Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.35 no.3 La Habana sep.-dic. 2013
COMUNICACIÓN CORTA
Anticuerpos a Mycoplasma synoviae en pollos de engorde en granjas de la provincia de Manabí, Ecuador
Antibodies to Mycoplasma synoviae in broiler chickens from farms in Manabí province, Ecuador
Laura de la CruzI, Evelyn LoboII, María Antonia AbeledoIII
IUniversidad Técnica de Manabí, Ecuador. Correo electrónico: laudelacvel@hotmail.com.
IIMYCOLAB (Laboratorio de Referencia de la OIE para diagnóstico de micoplasmas aviares). Departamento de Microbiología-Epidemiología, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de Las Lajas, Mayabeque, Cuba.Correo electrónico: elobo@censa.edu.cu.
IIIGrupo de Epidemiología, Departamento de Microbiología-Epidemiología, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de Las Lajas, Mayabeque, Cuba.
RESUMEN
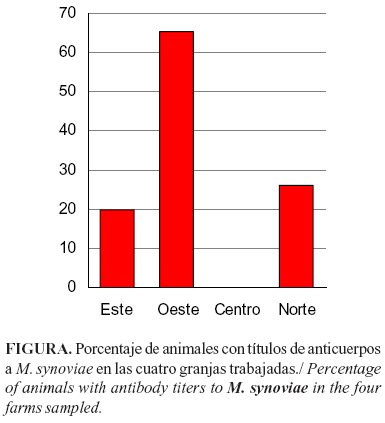
Con el objetivo de determinar la seroprevalencia de Mycoplasma synoviae en pollos de engorde en granjas de la provincia de Manabí, Ecuador, se realizó un muestreo en cuatro granjas con historia de padecer síndrome respiratorio crónico. Se seleccionaron al azar 15 aves de cada granja y el estudio serológico se realizó utilizando el Kit comercial ELISA-IDEXX para la detección de anticuerpos contra este microorganismo. Como resultado de este estudio en tres (O, E y N) de las cuatro granjas investigadas se detectaron animales seropositivos. La granja O mostró una seroprevalencia significativamente mayor que el resto de las granjas. Este trabajo constituye la primera evidencia de M. synoviae en la provincia Manabí, Ecuador. A partir de este resultado se recomienda continuar las investigaciones relacionadas con el papel de este agente en las patologías respiratorias de las aves en la provincia y confirmar este hallazgo con otro tipo de pruebas más sensibles y específicas como el PCR y el cultivo microbiológico con vistas a determinar la patogenicidad de las cepas circulantes.
Palabras clave: Mycoplasma synoviae, seroprevalencia, síndrome respiratorio crónico, diagnóstico.
ABSTRACT
The objective of this work was to determine the seroprevalence of Mycoplasma synoviae in broiler chickens from farms in Manabí province, Ecuador. For this work a sampling in four farms suffering from chronic respiratory syndrome was carried out. Fifteen birds were selected at random from each farm, and serological study was performed using a commercial Kit IDEXX ELISA for detecting antibodies against this microorganism. As a result of this study in three (O, E and N) of the four farms researched, seropositive animals were detected. In the case of farm O, there was a seroprevalence significantly higher than in the rest. This work constitutes the first evidence of M. synoviae in Manabí province. From this result, it is recommended to continue further researches regarding the role of this agent in poultry respiratory diseases in the province and to confirm this finding with other more sensitive and specific tests such as PCR and microbiological culture, in order to determine the pathogenicity of the circulating strains.
Key words: Mycoplasma synoviae, seroprevalence, chronic respiratory syndrome, diagnostic.
En la avicultura comercial, las enfermedades respiratorias y entéricas están consideradas entre las entidades que mayor impacto económico pueden ocasionar al productor, tanto en aves de engorde como en ponedoras (1). Dentro de las enfermedades respiratorias o Síndrome Respiratorio Crónico de las aves (SRC) se describen a virus, bacterias y micoplasmas como agentes etiológicos concomitantes de un mismo proceso (2,3). En el caso de los micoplasmas, Mycoplasma gallisepticum y Mycoplasma synoviae, se reconocen como los agentes predisponentes más importantes del SRC tanto en pollos de engorde como en ponedoras (4).
M. synoviae tiene como característica su tropismo por las mucosas y serosas del hospedero, causando infecciones crónicas o de larga duración, asociadas principalmente a cuadros de sinovitis, infecciones del aparato reproductor y tracto respiratorio superior de las aves (5,6). Como los signos y lesiones producidas por M. synoviae, no son patognomónicos, su diagnóstico sigue una conducta similar a M. gallisepticum, con la consideración de que requiere medios que contengan cisteína y Nicotinamida adenin dinucleótido (NAD), para su crecimiento (7,8). La base del monitoreo para su diagnóstico lo constituyen los estudios serológicos mediante la seroaglutinación rápida en placa (SAR), inhibición de la hemoaglutinación (HIA) y los ELISA (9).
El ELISA, procedimiento sensible, específico y que tiene ventajas sobre la SAR y la IH, ha comenzado a utilizarse más ampliamente durante las últimas décadas (9). Esto se debe a que ha eliminado la mayoría de las reacciones no específicas al utilizar antígenos recombinantes, por ejemplo, MS2/28 para M. synoviae, Mm14 para Mycoplasma meleagridis y pMGA1.2, para M. gallisepticum (10).
En Ecuador no se tiene evidencias de estudios relacionados con micoplasmas aviares en pollos de engorde; sin embargo, se presentan cuadros clínicos lesionales con sintomatologías compatibles a las producidas por estos microorganismo. El objetivo de este trabajo fue determinar la presencia de anticuerpos a M. synoviae en granjas de pollos de engordes en la provincia de Manabí, Ecuador.
El muestreo se realizó en cuatro granjas de pollos de engorde de la provincia Manabí, Ecuador con historia de aves que presentaron síndrome respiratorio crónico. Las granjas son representativas del Norte (N), Centro (C), Este (E) y Oeste (O) de la provincia y no han estado sometidas a programas de vacunación contra micoplasmas. Para mantener la confidencialidad de los productores, las granjas fueron identificadas como N, C, E y O en representación de la región geográfica muestreada. Se seleccionaron al azar 15 aves, de cada granja, entre 7 y 10 semanas de edad.
La sangre fue extraída por punción de la vena marginal del ala, recolectada en tubos estériles sin anticoagulante y una vez rotuladas se remitieron al laboratorio de AGROAVILAB S.A, Guayaquil, Ecuador para su análisis. En el estudio serológico se utilizó un kit comercial ELISA-IDEXX para la detección de anticuerpos contra M. synoviae siguiendo las especificaciones del productor. Para comparar los resultados de la seropositividad entre granjas se utilizó la comparación de proporciones.
Aunque se reconoce a M. synoviae como el agente etiológico fundamental de la sinovitis en pollos (4), en los últimos años, los brotes naturales reportados de esta entidad son escasos, lo que puede estar relacionado con el aumento del tropismo de este microorganismo por las vías respiratorias, que ha provocado la aparición de brotes de tipo respiratorio tanto en pollos de engorde como en ponedoras (11).
Una de las características más interesantes de los micoplasmas, es su capacidad de evadir la respuesta inmune (12). Esto se atribuye al mimetismo molecular, que consiste en que estos y las células hospederas comparten epítopes antigénicos que propician la evasión de los mecanismos de la respuesta inmune y/o la inducción de auto anticuerpos (13). Otra habilidad es la plasticidad fenotípica, que se refiere a la capacidad que tiene un genotipo de cambiar su composición antigénica produciendo más de una morfología, estado fisiológico o conducta en respuesta a las condiciones ambientales (14).
Por otra parte, el control de las infecciones por micoplasma en la avicultura es o debiera ser, en teoría, bastante simple y directo, especialmente porque los micoplasmas patógenos son de transmisión trans-ovárica y carecen de pared celular, lo que los hace muy susceptibles al medio ambiente (15). Sin embargo, este objetivo de control se ha complicado por varias razones, entre las que se encuentran la alta concentración de aves en pequeñas áreas, granjas multiedades, bioseguridad deficiente, carencia de información del impacto negativo en los índices productivos e imprecisión en el diagnóstico (7,15).
En tres (O, E y N) de las cuatro granjas investigadas se detectaron animales seropositivos (8/15 en O; 4/15 en N y 3/15 en E) (Figura). El hecho de no encontrar animales seropositivos en la granja C puede estar relacionado con las medidas de bioseguridad presentes en esta explotación avícola o al momento de la toma de muestra en relación con la infección, ya que es conocido que la respuesta inmune, tras la infección con M. synoviae, se inicia con la producción de IgM, las que pueden ser detectadas por SAR de 7 a 10 días después de la exposición al microorganismo (13) y no es hasta la segunda y tercera semana que se producen las inmunoglobulinas tipo G que pueden ser detectadas por HIA y ELISA (6). Este aspecto puede ser uno de los que haya influido en no encontrar seropositivos en la granja mediante el uso del ELISA.
Otro elemento a considerar, en este resultado, es el uso de antimicoplásmicos como tratamiento preventivo continuo con el objetivo de lograr un buen desarrollo de la parvada (7,16). En el caso de la granja C tiene dentro de su programa de control el uso de la tiamulina más clortetraciclina; el empleo de este tratamiento, con más de un 95% de efectividad, puede mantener sanos los epitelios, reducir reacciones complicadas, evitar la colonización de los micoplasmas y la instauración del proceso infeccioso (16,17), lo cual podría ser también una explicación a los resultados negativos obtenidos en esta granja
Por otra parte, se observaron elevados títulos de anticuerpos a M. synovie en las naves O, N y E (Tabla), lo que indica que los animales estuvieron en contacto con este agente.
Los resultados obtenidos son similares a resultados publicados por Nieves et al. (8), en Lima, Perú cuando estudiaron la seroprevalencia de M. synoviae en planteles de reproductores. De igual manera Gole et al. (18), reportan indicadores de un 69% donde la infección por este microorganismo continúa siendo prevalente en la mayoría de los lotes de ponedoras comerciales y en algunos planteles de reproductores pesados y pollos de carne.
La diferencia de animales positivos encontrados entre las granjas puede estar relacionado, en principio, con la relación instauración del proceso infeccioso-respuesta del sistema inmune -tiempo de la toma de muestra y como segundo elemento a considerar está la posible patogenicidad de la cepa circulante, pues en trabajos previos (8,19), se ha evidenciado que elevados porcentajes de seroprevalencia pueden estar asociados a la patogenicidad de las cepas de M. synoviae.
Este trabajo constituye la primera evidencia de la circulación de M. synoviae en la provincia Manabí, por lo que se recomienda continuar las investigaciones relacionadas con el papel de este agente en las patologías respiratorias de las aves en la provincia y confirmar este hallazgo con otro tipo de pruebas más sensibles y específicas como el PCR y el cultivo microbiológico, con vistas a determinar la patogenicidad de las cepas circulantes.
REFERENCIAS
1. Barrañón FJ, Fernández RJ, García HV. Control y prevención de la micoplasmosis en ponedoras comerciales. MERIAL, información al productor. 2011.
2. Barnes HJ. Pathological manifestation of colibacillosis in poultry. Proc 21st World's Poultry Congress, Montreal, Canadá.2000: 20-24.
3. Hossain KM, Takabbar H, Yamato I. Seroprevalence of Salmonella and Mycoplasma gallisepticum Infection in Chickens in Rajshahi and Surrounding Districts of Bangladesh. Int J of Biol. 2010;2(2):80-84.
4. McMullin Paul. Mycoplasma synoviae Infection, M.S. Infectious Synovitis. The Poultry Site. Com. 1 2007. http://www.thepoultrysite.com/diseaseinfo/99/mycoplasma-synoviae-infection-ms-infectious -synovitis.
5. Kleven SH. Mycoplasma synoviae infection, In: Calnek SW (Ed.), Diseases of Poultry. 10th ed. Iowa State University Press, Ames. 1997. p.220-225.
6. Nascimento ER, Pereira VLA, Nascimento MGF, Barreto ML. Avian mycoplasmosis. Brazilian Journal of Poultry Science. 2005;7(1):1-9.
7. Cardoso ALSP, Tessari ENC, Castro AGM, Kanashiro AMI, Stoppa GFZ. Monitoria sorológica da Micoplasmose em plantéis de aves reprodutoras no Brasil através do teste de soroaglutinação rápida. Arqs Inst Biológico, São Paulo. 2006;73(1):23-26.
8. Nieves MH, Icochea D, Gonzáles RV, Falcón NP. Seroprevalencia de Mycoplasma synoviae en pavos reproductores criados en la zona de Lima, Perú. Rev Investig Vet Perú. 2010;21(2):75-80.
9. Kleven SH, Ferguson-Noel AN, Raviv Z, Wooten R, Laibinis V. Role of Mycoplasma synoviae in Commercial Layer Escherichia coli Peritonitis Syndrome. Avian Dis. 2007;51:685-690.
10.Abdelmoumen B, Mardassi A, Be´jaoui A, Oussaeif L, Mlik B, Amouna FA. Recombinant Antigen-Based ELISA for the Simultaneous Differential Serodiagnosis of Mycoplasma gallisepticum, Mycoplasma synoviae, and Mycoplasma meleagridis Infections. Avian Dis. 2007;52:214-221.
11.Ley DH. Mycoplasma synoviae Infection in Poultry. The Merck Veterinary Manual. 2012. http://www.merckmanuals.com/vet/poultry/mycoplasmosis/mycoplasma -synoviae-infection-in-poultry.
12.Shlomo R. Interaction of Mycoplasmas with Host Cells. Physiol Rev. 2003;83: 417-432.
13.Sentíes-Cué G, Shivaprasad HL, Chin RP. Systemic Mycoplasma synoviae infection in broiler chickens. Avian Pathol. 2005;34(2):137-42.
14.Wren BW. Microbial genome analysis: insights into virulence, host adaptation and evolution. Nat Rev Genet. 2000;1:30-39.
15.Ruiz J. Micoplasmosis aviar e interacción con enfermedades bacterianas asociadas con problemas respiratorios en pollo de engorde. Vademécum Avícola. Información para el avicultor. 2005.
16.Arefin M, Begum JA, Parvin R, Rahman MM, Khan MAHNA, Chowdhury EH. Development of slide agglutination test for the rapid diagnosis of Mycoplasma infection in the chicken. Bangl Vet. 2011;28(2):80-84.
17.Ferguson-Noel N. Mycoplasma synoviae Lab Diagnosis - Problems and Solutions, 44th National Meeting on Poultry Health and Processing, Ocean City MD. 2009.
18.Gole VC, Chousalkar K, Lievaarj T, Roberts JR. Prevalence of Mycoplasma synoviae in eggs from laying hens using ELISA. Aust Poult Sci Symp. 2012.
19. Nascimento ER. Mycoplasma synoviae em avicultura, implicações econômicas: conviver ou erradicar? Anais Conferência Apinco de Ciências e Tecnologia Avícolas, Campinas, SP. 2001. p.31.
Recibido: 2-4-2013.
Aceptado: 5-8-2013.