My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Salud Animal
Print version ISSN 0253-570X
Rev Salud Anim. vol.36 no.2 La Habana May.-Aug. 2014
COMUNICACIÓN CORTA
Caracterización in vitro de bacterias ácido lácticas con potencial probiótico
In vitro characterization of acid lactic bacterias with probiotic potential
Lilian SánchezI, Jeannette TrompsII
ICentro Nacional de Sanidad Agropecuaria, Carretera de Tapaste y Autopista Nacional, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: lilian@censa.edu.cu.
IIUniversidad Central de Venezuela.
RESUMEN
Las propiedades beneficiosas de las bacterias ácido lácticas (BAL) posibilitan su uso como probióticas en animales y humanos. El objetivo del presente trabajo fue caracterizar, mediante pruebas in vitro, cepas BAL procedentes de fuente animal para considerar su posterior aplicación como probiótico en animales. Se evaluaron 72 cepas, identificadas hasta el nivel de género, de Lactobacillus spp., Leuconostoc spp., Lactococcus spp., Streptococcus spp. y Pediococcus spp. A todas las cepas se les determinó su estabilidad de crecimiento a diferentes pH, temperatura y tolerancia a altas concentraciones de cloruro de sodio. De ellas se seleccionaron 14 cepas que presentaron las mejores características como candidatos a probióticas por sus resultados a las pruebas de hidrofobicidad frente a solventes orgánicos (xileno y hexadecano), tiempo de autoagregación y la prueba de antagonismo microbiano; ante Bacillus cereus y Staphylococcus aureus el 63,6% de las cepas inhibieron el crecimiento, ante Salmonella typhimurium el 75,7% y frente a Pseudomonas aeruginosa el 72,7 %.
Palabras clave: bacterias ácido-láctica, probióticos, Bacillus cereus, Staphylococcus aureus, Salmonella spp., Pseudomonas aeruginosa.
ABSTRACT
The beneficial properties of the lactic-acid bacteria (LAB) in animals and humans make possible their use as probiotics. In order to characterize LAB from animal sources using in vitro tests to consider their subsequent application as a probiotic, 72 strains belonging to the genera Lactobacillus spp., Leuconostoc spp., Lactococcus spp., Streptococcus spp. and Pediococcus spp. were evaluated. Growth stability of all strains was determined at acid pH, different temperatures and tolerance to high concentration of sodium chloride. From them, there were 14 strains showing the best probiotic characteristics as candidates due to their scores on tests of hydrophobic versus organic solvents (xylene and hexadecane), autoaggregation time and microbial test. The 63,6% of the strains inhibited growth against Bacillus cereus and Staphylococcus aureus, the 75,7% against Salmonella typhimurium and the 72,7% against Pseudomonas aeruginosa.
Key words: lactics-acid bacteria, probiotics, Bacillus cereus, Staphylococcus aureus, Salmonella spp., Pseudomonas aeruginosa.
Las bacterias ácido lácticas (BAL), se definen como una clase funcional que designa un grupo heterogéneo de bacterias Gram positivas, no patógenas, no toxigénicas, fermentadoras, caracterizadas por producir ácido láctico a partir de carbohidratos, lo que las hace útiles como cultivos iniciadores para la fermentación de alimentos. Comparten otros rasgos comunes como ser aerotolerantes, no forman esporas, no reducen el nitrato y no producen pigmentos (1).
El grupo se subdivide en bacterias homo y heterofermentativas en función de los productos de su metabolismo. Las homofermentativas se caracterizan porque el único producto de la fermentación de los carbohidratos es el ácido láctico, mientras que las segundas pueden originar, además, dióxido de carbono, etanol o ácido acético (2). Dentro de las BAL, los géneros más utilizados para la obtención de alimentos y bebidas fermentadas son Lactococcus, Lactobacillus, Leuconostoc, Oenococcus y dentro del género Streptococcus la especie S. thermophilus (3).
Debido a que las BAL prevalecen en los alimentos fermentados, a su bajo nivel de infección y que son parte de la microbiota normal de las mucosas, se les atribuye su bajo potencial patogénico, por lo que se consideran como organismos GRAS (General Regarded As Safe) (4). Las investigaciones realizadas a las BAL demuestran una serie de beneficios potenciales a la salud, pero los efectos descritos solo pueden ser atribuidos a las cepas analizadas en cada estudio, y no se pueden generalizar a todas las especies, ni a todo el grupo u otras cepas probióticas (5).
El hecho de que los efectos son específicos para cada cepa, implica que se deben registrar los resultados sanitarios apoyados en las estudios in vitro e in vivo de cada una y que los mismos no pueden ser utilizados como prueba para avalar el uso de otras cepas que no sean incluidas en un estudio. En general, la evidencia clínica más fuerte a favor de las BAL está relacionada con su uso como probióticos para mejorar la función del intestino y estimular el estado inmunitario en los humanos y animales (6)
El objetivo del presente trabajo fue realizar la caracterización mediante pruebas in vitro a 72 cepas BAL aisladas de leche procedente de ubres de vacas criollas venezolanas y seleccionar aquellas que pueden ser empleadas como probióticas en la alimentación en humanos y en la dieta animal.
Las cepas aisladas fueron identificadas hasta género por las características culturales, morfología, tinción de Gram, pruebas de fermentación de carbohidratos, actividad catalasa, producción de esporas y motilidad, según lo descrito por Kozaki et al. (7). De acuerdo a los criterios del Manual Bergey (8) se identificaron 14 aislados como Lactobacillus spp., 13 cepas de Leuconostoc spp., 15 correspondieron a Lactococcus spp., 16 fueron Streptococcus spp. y 15 resultaron Pediococcus spp.
Para la caracterización fenotípica de las cepas identificadas se realizaron las pruebas de producción de gas, a partir de glucosa al 2 % en medio de cultivo líquido Mann Rogosa Sharp (MRS, Merck, Alemania) a 37oC durante 24-48 horas, sin agitación. Para el crecimiento en agar MRS se emplearon jarras de anaerobiosis con una atmósfera de CO2 de un 10% a 37oC por 48 horas. Se utilizaron además medios M17 y Elliker (Oxoid, UK) para el crecimiento de bacterias lácticas, las cuales fueron cultivadas bajo las mismas condiciones.
Se evaluó el crecimiento a temperaturas de 15, 30, 37 y 45°C con condiciones aerobias y microaerofilicas, a diferentes pH: 3, 4, 5 y 6; y se determinó la tolerancia a 6.5% de NaCl. Para estas pruebas se emplearon los medios MRS y M17. El crecimiento se observó visualmente en cada una de las variantes evaluadas.
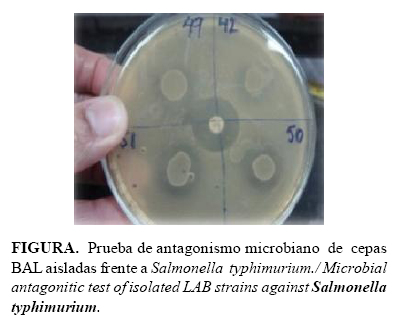
Para la determinar el antagonismo microbiano se utilizó la prueba de spot on the lawn descrita por Lewus et al. (9), que consiste en la inhibición del crecimiento de una cepa sensible, por una bacteria productora. En este estudio se verificó la producción de sustancias antagonistas por las cepas evaluadas, frente a microorganismos patógenos como Bacillus cereus ATCC 11778, Staphylococcus aureus ATCC 29213, Salmonella typhimurium ATCC 14028, Pseudomonas aeruginosa ATCC 25853, de la colección de cultivos procedentes de la Universidad Central de Venezuela.
A partir de cultivos de las BAL en caldo MRS y M17 de 18 horas de crecimiento, con una concentración de 108 UFC/ml, se inoculó un volumen de 0,01 ml en placa de MRS agar y se incubó en condiciones de microaerofilia durante 24 horas. Después de la formación de colonias visibles se le añadió agar semisólido del medio infusión cerebro corazón (BHI al 0,8 %) conteniendo 106 UFC/ml de las cepas patógenas indicadoras y se dejaron secar a 4oC durante 2 horas. Posteriormente se incubaron a 37oC durante 48 horas. La actividad antagónica positiva se verificó por la formación de zonas transparentes alrededor de las colonias con un diámetro mayor a 1 mm.
Se determinó la hidrofobicidad superficial de las cepas aisladas de Lactobacillus ssp. Leuconostoc spp., Lactococcus spp., Streptococcus spp. y Pediococcus spp. mediante la medición de la afinidad por el disolvente orgánico que presentan las células cultivadas en sistema de dos fases (agua- disolvente orgánico), como medida predictiva de su capacidad de adhesión a epitelios.
Para evaluar la hidrofobicidad en la superficie bacteriana se realizó un ensayo según las indicaciones reportados por Frizzo et al. (10) para determinar, a través de porcentajes de hidrofobicidad, la tendencia a la adhesión epitelial (mayor porcentaje de hidrofobicidad, mayor adherencia). Cada una de estas cepas crecidas de cultivo fresco en caldo MRS a 37ºC se lavaron con solución tampón de fosfato salino (PBS) y se ajustaron a una densidad óptica de 0,6-0,7 a 560 nm (DO560nm) y se mezclaron con la misma cantidad de n-hexadecano y xileno, a temperatura ambiente. Después de un tiempo de separación de 60 min, se midió la DO560nm de la fase acuosa. El porcentaje de hidrofobicidad se calculó utilizando la siguiente ecuación:
La actividad de hidrofobicidad de las cepas evaluadas se clasificó como alta (51-100%), media (30- 50%) y baja (0-29 %), según lo propuesto por Nader-Macías (11).
Posteriormente, a las cepas para las que los resultados de hidrofobicidad fueron positivos se les realizó el ensayo de agregación de acuerdo a la técnica utilizada por Reniero et al. (12).
Los cultivos de 18 h de incubación a 37°C en MRS se centrifugaron y se lavaron tres veces con agua destilada, se resuspendieron en el volumen inicial con una solución de PBS y se llevaron a una DO de 0,7. Los sobrenadantes de cada una de las cepas se filtraron y se agregaron a la suspensión a una concentración final del 10% (v/v); posteriormente, se incubaron a temperatura ambiente. La agregación se consideró positiva cuando las partículas visibles, similares a la arena y formadas por las células agregadas, se depositaron en el fondo del tubo dejando el sobrenadante limpio por un período máximo de 2 h a temperatura ambiente.
Los resultados obtenidos en cada uno de los experimentos se basaron en la media de tres experimentos.
En la Tabla 1 se pudo observar que la mayoría de las cepas evaluadas son homofermentativas obligadas, al no producir gas y crecer bajo diferentes condiciones, por lo que se describen como facultativas anaerobias. Dentro de los facultativos se distinguen aquellas que tienen la capacidad de alternar un metabolismo oxidativo aerobio con otro fermentativo, de aquellos otros que nunca pueden utilizar el O2 cómo aceptor final de electrones, pero que fermentan indistintamente en presencia y en ausencia de aire. Este último caso es el de las bacterias lácticas incluidas dentro del grupo de cocos Gram positivos facultativos. En cambio, los estafilococos son verdaderos facultativos, capaces de presentar dos fisiologías alternativas, como ocurre con la mayor parte de las levaduras. Algunos cocos y bacilos del grupo láctico crecen mal en condiciones estrictamente anaerobias, aunque nunca utilizan el O2; otros crecen bien sólo a bajas presiones parciales de oxígeno y por ello se les denomina microaerófilos; tal es el caso de las cepas evaluadas en el presente trabajo.
Se observó que todas las cepas evaluadas crecieron satisfactoriamente en los diferentes medios y en los pH de valores bajos evaluados, requisitos indispensables para que se puedan incluir como probióticos en la dieta humana y en la dieta animal. El crecimiento bacteriano fue exitoso en las condiciones de temperatura evaluadas; sin embargo, a la temperatura de 45oC de algunas cepas, en especial de lactobacilos, el 17,24% no crecieron. Lo mismo ocurrió con la concentración de NaCl evaluada. Estos resultados están acorde con los descritos por Sánchez et al. (13), quienes encontraron que un 16% de los lactocacilos de origen humano, no resistieron a estas condiciones hostiles.
De las 72 cepas evaluadas, se seleccionaron 42 que cumplieron estos requerimientos, pasando a realizar el estudio de antagonismo microbiano ante cuatro patógenos indicadores, como se observa en la Tabla 2 y Figura.
La mayoría de las cepas evaluadas exhibieron actividad antagónica contra la totalidad de los patógenos estudiados; el 63,6% de las cepas seleccionadas inhibieron a Bacillus cereus y Staphylococcus aureus, el 75,7% a Salmonella typhimurium y el 72,7% a Pseudomonas aeruginosa. Los halos de inhibición fueron variables en cada grupo de las bacterias evaluadas. En este estudio no se evaluó la naturaleza de las sustancias antagónicas que producen las cepas evaluadas. Se describe por varios autores que en esta actividad pueden estar presentes ácidos orgánicos (tales como ácido láctico), peróxido de hidrógeno, dióxido de carbono, diacetilo, acetaldehído y sustancias de naturaleza proteíca antimicrobiana, llamadas bacteriocinas, por lo que es necesario continuar estos estudios (14,15).
Las características físico-químicas de la pared celular bacteriana, y la naturaleza de la superficie a la que se adhiere, influyen sobre los fenómenos de autoagregación y adhesión. En la Tabla 3 se observan los ensayos de adhesión a xileno y hexadecano, ambos solventes no polares. Las cepas seleccionadas para este estudio demostraron que 14 de ellas presentaban porcentajes de adhesión superiores al 78%. Las restantes cepas evaluadas tienen actividad hidrofóbica moderada, teniendo en cuenta los valores hallados según lo reportado por diferentes autores (16,17). Estos resultados indican un fuerte carácter hidrofóbico de la superficie celular, factor que contribuye a la interacción de las BAL con las células del tracto gastrointestinal.
La capacidad de autoagregación de las cepas probióticas parece ser una exigencia necesaria para lograr la adhesión a las células epiteliales del intestino, ocupando lugares específicos para evitar la potencial colonización por microorganismos patógenos, por lo que es un importante criterio de selección de probióticos. El mecanismo de autoagregación fue previamente referido a los lactobacilos por varios autores (18) y se describe que las proteínas presentes en el sobrenadante del cultivo y las proteínas y lipoproteínas localizadas en la superficie de las células están involucradas en la agregación. Los tiempos hallados menores de 45 minutos en la autoagregación de las cepas evaluadas (Tabla 3) sugieren una relación directa con el carácter hidrofóbico de la superficie celular. Para las cepas de Pediococcus spp. no se determinó la capacidad de autoagregación, teniendo en cuenta los bajos resultados obtenidos en la prueba de hidrofobicidad (adhesión a solventes orgánicos).
Los resultados obtenidos en las pruebas in vitro realizadas demostraron que las cepas seleccionadas poseen características fisicoquímicas y biológicas compatibles con un potencial uso como probiótico: resistencia a pH ácido, actividad antimicrobiana, buenas propiedades hidrofóbicas y autoagregantes, relacionadas con su capacidad de adhesión al epitelio intestinal. Sin embargo, los presentes resultados muestran que existen variaciones entre las BAL evaluadas, con relación a la adhesión a superficies celulares por la técnica realizada, por lo que se debería complementar con estudios en cultivos celulares in vivo.
REFERENCIAS
1. Crittenden R. Incorporating probiotics into foods. En: Lee YK, Salminen S (eds) Handbook of probiotics and prebiotics, 2nd ed. 2009, NJ. p. 58-75.
2. Kandler O, Weiss N. Regular, Nonsporing Gram-Positive Rods. In: Bergey's Manual of Systematic Bacteriology. 9na Ed. The Williams and Wilkins C. Baltimore. 1994;1209-1234.
3. Ferreira CL. Grupos de bactérias lácticas e aplicação tecnológicas de bactérias probioticas. En Ferreira CL (ed). Prebioticos e probióticos Actualização e Proespecção. Rubio LTA, RJ. Brasil. 2012. p. 1-27.
4. Obed D. Eds Min-Tze Liong, Biology of prokaryotic in Probiotic Biology Genetics and healh aspects. Microbiology Monograph. 2011; Springer Heidelberg Dordrecht, New York. p. 1-10.
5. Gaggìa F, Mattarelli P, Biavati B. Probiotics and prebiotics in animal feeding for safe food production. Int J Food Microbiol. 2010;141:15-28.
6. Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JN, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012;307:1959-1969.
7. Kozaki M, Uchimura T, Okada S. Experimental manual of lactic acid bacteria. Tokyo, Japan: 1992. p. 34-37.
8. Noel R Krieg. Bergey's Manual of Systematic Bacteriology, The Williams and Wilkins Co., Baltimore, 1984. p. 964.
9. Lewus CB, Kaiser A, Montville TJ. Inhibition of food borne bacterial pathogens by bacteriocins from lactic acid bacteria isolated from meat. Appl Environ Microbiol. 1991;57:1683-1688.
10.Frizzo LS, Soto LP, Bertozz IE, Sequeira G, Marti LE, Rosmini MR. Evaluación in vitro de las capacidades probióticas microbianas orientadas al diseño de inóculos probióticos multiespecies para ser utilizados en la crianza de terneros. Revista FAVE-Ciencias Veterinarias. 2006;5:1-2.
11.Nader-Macias MEF. Advances in the design of probiotic products for the prevention of major diseases in dairy cattle. J Ind Microbiol Biot. 2008;35(11):1387-1395.
12.Reniero R, Cocconcelli P, Bottazzi V, Morelli L. High frequency or conjugation in Lactobacillus mediated by an aggregation-promoting factor. J Gen Microbiol. 1992;138:763-768.
13.Sánchez L, Vichi J, Llanes M, Castro E, Soler DM, Espinosa I, et al. Aislamiento y caracterización in vitro de cepas de Lactobacillus spp. como candidatos a prebióticas. Rev Salud Anim. 2011;33(3):154-160.
14.Ferreira Barbosa FH, Jardim de Lima Barbosa LP, Silva Bambirra LH, Figueira Aburjaile F. Produção de substâncias envolvidas no fenômeno de antagonismo bacteriano. Revista de Biologia e Ciências da Terra 2011;111-110. Disponible en: http://www.redalyc.org/articulo.oa?id=50021097001. (Consulta: 10 de octubre de 2013).
15.Ferreira CL, Salminen S, Grzeskowiak L, Brizuela MA, Sánchez L, Carneiro H, et al. Terminology concepts of probiotic and prebiotic and their role in human and animal health. Rev Salud Anim. 2011;33(3):137-139.
16.Frizzo LS, Soto LP, Zbrun MV, Signorini ML, Bertozzi E, Sequeira G, et al. Effect of lactic acid bacteria and lactose on growth performance and intestinal microbial balance of artificially reared calves. Livest Sci. 2011;140:246-252.
17.Hemaiswarya S, Raja R, Ravikumar R, Carvalho Isabel S. Mechanism of action of probiotics. Braz Arch Biol Techn. 2013;56(1):113-119.
18.Amorocho CM. Caracterización y potencial probiótico de bacterias lácticas aisladas de leche de oveja guirra. Tesis doctoral. 2011 Universitat politécnica de Valencia http://riunet.upv.es/bitstream/handle/10251/13830/tesisUPV3685.pdf?sequence=6. (Consulta: 10 de Octubre 2013).
Recibido: 11-10-2013.
Aceptado: 4-4-2014.