Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión On-line ISSN 2224-4700
Rev Salud Anim. vol.37 no.1 La Habana ene.-abr. 2015
ARTÍCULO RESEÑA
Antihelmínticos, resistencia y método FAMACHA. Experiencia cubana en ovinos
Anthelmintics, resistance and FAMACHA method. Cuban experience in sheep
Jesús G. Rodríguez DiegoI, Javier AreceII, Javier L. OlivaresIII, Yousmel AlemánIV, Yolanda Sánchez CastillejaIII
IUniversidad Autónoma Metropolitana, Unidad Xochimilco (UAM-X). Calzada del Hueso No. 1100. Col. Villa Quietud, Delegación Coyoacán, México. Correo electrónico: jesus122001mx@yahoo.es.
IIEstación Experimental de Pastos y Forrajes Indio Hatuey. Central España Republicana. CP. 44280. Matanzas, Cuba.
IIIDepartamento de Producción Agrícola y Animal. Universidad Autónoma Metropolitana, Unidad Xochimilco (UAM-X). Calzada del Hueso No. 1100. Col. Villa Quietud, Delegación Coyoacán, México.
IVCentro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba.
RESUMEN
Se realiza una revisión del uso, en los últimos años, de antihelmínticos en Cuba, así como de la adquisición de resistencia a los mismos y la aplicación y éxitos del método FAMACHA en la prevención de esta última. Del mismo modo, se recuentan las investigaciones sobre productos naturales con acción antihelmíntica realizadas en el país en los últimos años. Se aporta sobre la experiencia de los autores en el tema.
Palabras clave: antihelmínticos, resistencia antihelmíntica, FAMACHA.
ABSTRACT
The use of anthelmintics in Cuba in the last years, including the acquisition of resistance to them and the application and successes of the FAMACHA method to prevent it, is reviewed. Similarly, research on natural products with anthelmintic action carried out in the country in recent years is summarized. The experience of the authors in the field is provided.
Key words: anthelmintics, anthelmintic resistance, FAMACHA.
INTRODUCCIÓN
El parasitismo interno de los ovinos es una de las principales limitantes para el éxito de la ganadería de esa especie en el mundo. Elementos de diversa índole modulan la magnitud de la infestación parasitaria y, en la mayoría de las ocasiones, son el resultado de un grupo de factores indisolublemente unidos, tales como: la alimentación, la estacionalidad en la producción de los pastos y su efecto modulador en la reproducción (1, 2).
En el contexto actual cubano, la crianza ovina ha pasado de ser una vía de subsistencia familiar a ser un sistema de explotación ganadera, con el objetivo de satisfacer las demandas crecientes de la población. Este cambio de paradigma conlleva a la modificación de los perfiles investigativos de las instituciones de investigación-desarrollo de la rama, con la consecuente ruptura de esquemas rígidos de trabajo (1, 3).
Tradicionalmente, la medida de control parasitario que más se ha utilizado ha sido la aplicación de productos químicos con actividad antihelmíntica. El control parasitario en los rebaños ovinos se realiza de forma arbitraria y, en la mayoría de las situaciones, de manera indiscriminada, con la consecuente respuesta de los parásitos a estos errores: la aparición de la resistencia a los antiparasitarios (4).
El objetivo de este artículo es hacer un recuento y reflexión sobre el problema planteado, los éxitos alcanzados hasta el momento y la perspectiva del uso de productos naturales en el control de helmintos en Cuba.
USO DE ANTIHELMÍNTICOS
Entre los últimos estudios de evaluación de eficacia de antihelmínticos, contra helmintos de rumiantes en Cuba, se encuentran los trabajos de Arece et al. (2), quienes probaron el Levamisol inyectable, una mezcla de Levamisol y la Niclosamida, Ivermectina oral, Ivermectina inyectable, Albendazol oral y Albendazol sulfóxido en dos granjas de cría de ovinos, con la dosis recomendada por el fabricante. Los resultados obtenidos indicaron que el grupo imidazotiazole mostró un bajo nivel de resistencia antihelmíntica y alcanzó una eficacia cuestionable; en tanto, el resto de los productos resultaron ser eficaces contra el parasitismo gastrointestinal en ovejas. Esto constituyó la primera alerta, sobre bases prácticas, de la presencia de resistencia al antihelmíntico.
Con relación a la Ivermectina, que revolucionó desde 1981 todo lo relacionado con el control parasitario por la aparición de las endectocidas al mercado, mostró 33 meses después de su aparición, resistencia en Sudáfrica (3); esta se ha ido incrementando cada día más en diferentes países y especies de parásitos. La eficacia antihelmíntica de ese fármaco al 1% (Labiomec®, LABIOFAM, Cuba), en Cuba, fue estudiada recientemente en rebaños ovinos de la provincia de Camagüey (4). De los 15 rebaños investigados, sólo en uno se diagnosticó resistencia al producto, que mostró 36,3% de eficacia.
Con posterioridad a los primeros estudios con antihelmínticos, Arece et al. (3) realizaron otros ensayos de evaluación de la eficacia del Levamisol 10%®, LABIOMEC®, junto a Cydectin® y Virbamax® contra estrongílidos gastrointestinales. La eficacia en la reducción de la infestación parasitaria de Virbamax® y Cydetin® fue 100%; sin embargo, ya aparecía un nivel considerable de resistencia al Levamisol 10% ®y al LABIOMEC® (87 y 61% de Reducción del Conteo Fecal de Huevos) (RCFH) para cada producto, respectivamente. Se apreció resistencia de Haemonchus spp. al Levamisol 10% y resistencia multiespecífica de Haemonchus spp., Trichostrongylus colubriformis y Oesophagostomum columbianum al LABIOMEC®.
La eficacia del Closantil 5%® contra estrongílidos gastrointestinales de ovinos, también se evaluó en condiciones de producción. Se consideró que el medicamento fue eficaz, toda vez que la RCFH fuese superior a 95% y el intervalo de confianza superior a 90%. Se obtuvo la reducción del conteo fecal de huevos en los dos grupos tratados, tanto con el producto en cuestión como con el Levamisol. No obstante, en el grupo del Levamisol se observó que Haemonchus spp. no fue totalmente removido (0.01%), por lo que se infiere determinado nivel de tolerancia a este producto como resultado del uso continuado durante muchos años (5).
RESISTENCIA ANTIHELMÍNTICA
Según la FAO, durante las últimas cuatro décadas, si bien el desarrollo de acaricidas, insecticidas y antihelmínticos de gran eficacia y amplio espectro ha permitido al productor agropecuario disponer de una herramienta de control cada vez más práctica y adaptable a diferentes sistemas de producción, también ha creado un falso sentido de seguridad en ese sector, pues sustituyeron el diagnóstico y el asesoramiento profesional, por la casi exclusiva utilización de drogas (6).
Lamentablemente, el desarrollo paulatino de la resistencia parasitaria a antihelmínticos en el ámbito mundial, ha demostrado que los antiparasitarios son un recurso necesario, pero no renovable, en la medida que la resistencia sigue extendiéndose y persiste en las poblaciones parasitarias (7).
En la actualidad, la resistencia es un problema preocupante, que ha superado el interés académico para convertirse en un problema de vital importancia para la industria ganadera de muchas regiones del mundo y para la medicina veterinaria en general, pues se ha extendido de manera alarmante en la última década. La mayor prevalencia de resistencia en el mundo se presenta en las especies ovina y caprina y, aunque existe también en nematodos de bovinos, aún en estos no es severa (8).
En las poblaciones de nematodos gastrointestinales de rumiantes, muchas de las especies tienen características genéticas que favorecen el desarrollo de resistencia a estas sustancias químicas. Entre las más importantes, figura la rápida tasa de evolución de la secuencia de nucleótidos y el gran tamaño de las poblaciones de parásitos, lo que les confiere un alto nivel de diversidad genética (9).
La resistencia se ha definido como la disminución de la eficacia de un compuesto químico contra una población de parásitos que, por lo general, es sensible a esa droga y es de naturaleza genética (9). Muchos países trabajan en la detección de resistencia a antihelmínticos, con vistas a buscar solución a tan actual problema (8, 9, 10).
De esos estudios se conoce, recientemente, que existen varios fenotipos asociados a la resistencia de los estrongilidos gastrointestinales y que el recuento de huevos en heces sigue siendo el indicador tradicional usado más comúnmente para valorar el nivel de infestación parasitaria, sobre la base del número de huevos por gramo de heces. Ese parámetro pone de manifiesto la viabilidad de los nematodos adultos establecidos en el hospedero y la fecundidad media de las poblaciones parasitarias residentes (9). Otros indicadores del nivel de infestación parasitaria son el nivel plasmático de inmunoglobulina (IgA) y de pepsinógeno.
Estudios previos identificaron el Loci de Rasgos Cuantitativos (QTL) relacionado con la resistencia de los nematodos gastrointestinales de ovinos (10). El barrido genómico, basado en 181 marcadores microsatélites realizado en una población de ganado ovino lechero de raza Churra, en España (11), permitió identificar QTL con significación genómica en el cromosoma OAR6, y otros cuatro QTL a nivel cromosómico en OAR1, OAR10 y OAR14. Por su parte Gil et al. (10) más recientemente, realizaron un análisis de ligamiento para el carácter conteo fecal de huevos, en otra población ovina de raza Churra. El QTL identificado en los cromosomas 4 y 6 mostró interesante coincidencia con QTL informado anteriormente en el ganado ovino para los indicadores de resistencia a los nematodos gastrointestinales.
En Cuba, el control de las enfermedades parasitarias ha estado realizándose de forma arbitraria, sin tener en cuenta en la mayoría de los casos la información epidemiológica de las mismas. Esto ha provocado que los planes de control de parásitos no sean lo suficientemente eficaces y en las situaciones más críticas, los parásitos gastrointestinales han desarrollado resistencia a los antihelmínticos más utilizados (2), dando lugar a un ineficiente sistema de explotación del ovino, en la mayoría de los casos.
La resistencia a los antiparasitarios, en medicina veterinaria en Cuba, comienza a constituir uno de los problemas a considerar en el diseño de planes de control parasitario en ovinos. De este modo, se pueden trazar estrategias con el objetivo de reducir la presión de selección sobre la base del tratamiento dirigido con productos de conocida eficacia (3).
Hasta el año 2004, sólo se había detectado resistencia a los imidazotiazoles en los estrongílidos gastrointestinales (2, 3), como resultado del excesivo uso en condiciones de producción. Las condiciones existentes en la ganadería cubana en el siglo pasado propiciaron la aparición de este fenómeno, ya que no se contaba con diferentes grupos farmacológicos que permitiera una rotación racional de los medicamentos; además de su uso indiscriminado por no contar con un plan diseñado sobre la base de la epizootiología de la enfermedad o su agente etiológico. Del mismo modo, se detectaron indicios de resistencia a la Ivermectina (4).
Esta situación motivó, en Cuba, la búsqueda de alternativas para la disminución de la resistencia a antihelmínticos.
EL MÉTODO FAMACHA
El método FAMACHA © surge en Sudáfrica, hace algún tiempo, como una estrategia de control parasitario. El mismo se basa en el tratamiento selectivo de los animales en función de la coloración de la mucosa conjuntiva que está relacionada con diferentes grados de anemia (11).
El método se validó en Cuba, por vez primera por Arece et al. (12) y también se utiliza actualmente en muchos países (13, 14, 15, 16, 17, 18), tanto en ovinos como en cabras, con buenos resultados.
FAMACHA© comprende el tratamiento antihelmíntico selectivo y tratar el número mínimo de animales posible y con menos frecuencia, basado en el examen de la tinción de la conjuntiva ocular. Los diferentes tonos del color varían de rojo intenso hasta los niveles pálidos, 1-5 de acuerdo con la tarjeta FAMACHA© (18). Esta estrategia sólo funciona frente a infestaciones donde esté presente el género Haemonchus, por ser un nematodo hematófago por excelencia, que ocasiona anemia severa en los animales.
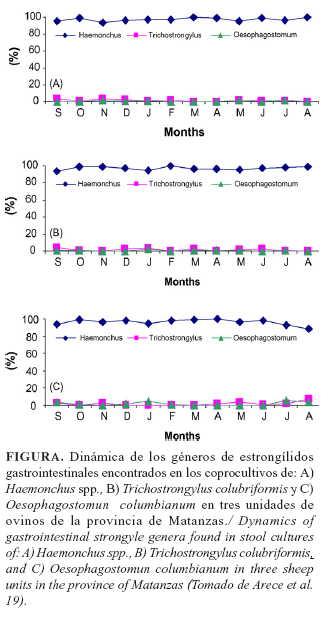
Un estudio epidemiológico sobre la prevalencia de estrongilidos en ovinos, en la provincia de Matanzas, realizado por Arece et al. (19), aportó elementos acerca de que Haemonchus posee un comportamiento anual, sin una tendencia estacional evidente. En todos los meses de estudio, superó el 90% del conteo fecal de huevos, lo cual se manifestó en la prevalencia de este nematodo en las diferentes épocas del año (Figura).
Sobre la base del estudio anterior, Arece et al. (12) iniciaron la aplicación de FAMACHA© en rebaños ovinos. Ellos correlacionaron la presencia del género Haemonchus con el color de la mucosa ocular (CMO) a través de la carta de colores del método, el hematocrito o volumen celular aglomerado (VCA) y el conteo fecal de huevos de estrongilidos (CFH). La correlación entre el CMO y el VCA fueron inversas (p<0,01). Según la técnica, se consideraron anémicos los animales con VCA = 19. La sensibilidad y la especificidad se mantuvieron altas (75 y 100%, respectivamente) para los valores de cuatro y cinco de la escala © FAMACHA©.
Los resultados obtenidos en el estudio anterior (12), coincidieron con resultados obtenidos previamente en Estados Unidos de América (20), en lo referente a que la relación entre CMO y VCA fue negativa (r=-0.38; p<0,01), mientras que se apreció una relación positiva, no significativa, entre el CMO y el CHF (r=0.036).
Posteriormente, el método se evaluó en cabras, en Cuba, por Aróstica et al. (21). Para ello se evaluaron los parámetros descritos para ovinos, durante dos meses. Los resultados obtenidos indicaron que la metodología FAMACHA© puede ser una herramienta en la detección de anemia en cabras en nuestras condiciones.
Estas experiencias cubanas sientan las bases para una estrategia de tratamientos, con vistas a reducir los casos de resistencia a antihelmínticos.
EL USO DE PRODUCTOS NATURALES CON ACCIÓN ANTIHELMÍNTICA EN CUBA
Por la condición de país cálido húmedo, Cuba posee una flora pródiga que brinda un número importante de alternativas terapéuticas para la Salud Pública y la Medicina Veterinaria. Desde épocas remotas el uso etnomédico de las plantas, basado en sus inicios, más en la sabiduría popular empírica que en la validación científica, contribuyó innegablemente a mitigar diferentes dolencias que aquejan al hombre y los animales (22).
Bromelia pinguin L. conocida también en nuestro medio como piña de cerca, es una planta común en toda la isla, que se emplea para formar cercas y setos vivos en las fincas y los patios de poblaciones rurales. Los frutos de la planta se utilizan de manera popular como remedio antiparasitario, sin que se hubiera corroborado este efecto (22). Marrero et al. (23) realizaron un estudio de comprobación de la eficacia del efecto antiparasitario atribuido a esta planta por generaciones, en este caso con fines veterinarios. Se estudió la actividad antihelmíntica de la pulpa de la planta B. pinguin en su estado natural y en extractos acuoso y alcohólico, frente a estrogílidos gastrointestinales de bovino. En la prueba de campo, la planta eliminó totalmente la carga parasitaria de Haemonchus y Cooperia spp., que se detectó por la reducción de la cantidad de huevos de los helmintos por gramo de heces fecales a nivel cero, a los dos días postratamiento; mientras que con la prueba controlada de la infestación de terneros con larvas infestivas de Haemonchus contortus se demostró su actividad antihelmíntica terapéutica. No se observó ningún efecto secundario tóxico con excepción de una ligera diarrea que pudiera estar relacionada con el propio mecanismo de acción del principio activo del producto.
Basados en estos estudios, posteriormente se realizaron ensayos en ovinos en México, también con resultados satisfactorios,contra Oesophagostomun columbianun (24).
La acción de seis extractos de Morus alba (Linn.) conocida en Cuba como morera, se evaluó sobre la viabilidad de larvas infestantes (L3) de Trichostrongylus spp. y Haemonchus spp. Los extractos obtenidos a partir de fraccionamiento fitoquímico, fueron extracto etanólico crudo (EEC), extracto etanólico fraccionado (EEF), extracto acuoso crudo (EAC), extracto acuoso fraccionado (EAF), extracto alcaloidal (EA) y el extracto clorofórmico (EC). Los mayores índices de mortalidad larvaria se correspondieron con los EAC y EAF, en los cuales la mortalidad fue superior al 80% durante la primera hora y llegó a ser de 96% al cabo de los 120 minutos. Los EEC y EEF causaron mortalidades inferiores (20-40% en todo el período de evaluación); mientras que los EA y EC no mostraron una actividad apreciable (0% a los 60 minutos y 0-20% a las 48 horas). La mortalidad causada por la adición de los extractos acuosos (EAs) presentó diferencias significativas favorables con relación a los extractos etanólicos (EEs), el EA y el EC. Los primeros signos de disminución de la vitalidad de las larvas comenzaron desde el mismo instante de haber sido agregados los EAs y EEs, debido a la presencia de compuestos polifenólicos mayoritarios, tales como los flavonoides (Quercetina y Rutina), las cumarinas (Umbeliferona) y los fenoles simples (Resveratrol). Esos resultados permitieron concluir que los metabolitos secundarios polifenólicos presentes en M. alba tienen una actividad antihelmíntica considerable en las larvas L3 de los mencionados helmintos (25).
Otras plantas se han evaluado con el objetivo de conocer su posible uso como antihelmínticos. Con estos estudios se determinó la actividad antihelmíntica in vitro de formulaciones de extractos de las plantas: Azadirachta indica (árbol del Neem), Momordica charantia y Chenopodium (Teloxys) ambrosioides, utilizando como modelo biológico la especie Eudrilus eugeniae (lombriz africana), en estadio adulto con un tamaño comprendido entre 7-8,5 cm de longitud. Todas las formulaciones mostraron actividad antihelmíntica y mayor efectividad el zumo de M. charantia y de C. ambrosioides, sin diferencias significativas entre éstas; en ambos casos no se evidenció parálisis previa a la muerte de las lombrices y la actividad intermedia fue significativa (p < 0,05) entre los controles negativos y positivos piperazina 1% y levamisol 10% (26). La planta A. indica también ha sido evaluada, recientemente, en Pakistán, tanto in vitro como in vivo, con muy buenos resultados (27).
Más recientemente se evaluó nuevamente en Cuba, la actividad antihelmíntica in vitro de extractos acuosos de hojas y semillas de A. indica, sobre la eclosión de huevecillos y el desarrollo larvario de estrongílidos gastrointestinales. El extracto resultó ser más efectivo, toda vez que con dosis de 500 mg/ml se logró reducir la eclosión de huevecillos en 99.1% y en 88.8% el desarrollo de las larvas hacia L3, sin diferencias significativas (p<0.01) con el Albendazol. Por su parte, el extracto de hojas inhibió más de un 80% la eclosión de huevos e interfirió en el desarrollo de las larvas en más de un 70%. Estos resultados indican que el árbol del Neem pudiera ser empleado como estrategia alternativa para el control parasitario, después de estudios in vivo y pruebas de toxicidad (28).
Del mismo modo, se evaluó la actividad in vitro de Rhizophora mangle L., sobre el desarrollo larvario exógeno de estrongílidos gastrointestinales de ovino. Se utilizaron tres extractos: dos de ellos procedentes del residual obtenido de lixiviación de la corteza como sub-producto en la producción de medicamentos registrados (acuoso y metanólico) y un extracto acuoso total de R. mangle (extracción directa de las cortezas). Cada extracto se evaluó en tres niveles de concentraciones: 5 mg/ml, 25 mg/ml, 50 mg/ml, sobre larvas de miembros de ese orden, donde primaba Trichostrongylus spp. Los resultados obtenidos demostraron que los tres extractos en concentraciones de 50 mg/ml, reducen significativamente (p<0.05) el desarrollo de la L3 al cuarto día de experimento (sexto día de vida larvaria); con una media de efectividad de 64.12 % (29).
Otros intentos han contemplado un estudio analítico y de pre formulación de un sólido pulverulento obtenido a partir de las semillas de Cucurbita moschata Duch. Los resultados obtenidos, unidos a otros descritos anteriormente (30), permitirán la posterior formulación de una nueva forma farmacéutica con acción antihelmíntica con requisitos tecnológicos establecidos, presentación estética adecuada y ensayos de control de calidad que lo hagan más fiable (30).
Los últimos estudios mencionados anteriormente precisan de validaciones de campo y de pruebas toxicológicas, toda vez que alguno podría constituirse en una alternativa nacional para la lucha contra la estrongiloidosis gastrointestinal de los rumiantes. Los estudios en este campo continúan en diferentes países, en la búsqueda de nuevos compuestos que sirvan para el control de helmintos (31).
REFERENCIAS
1. Arece J. La epizootiología como herramienta para el control parasitario en ovinos. Pastos y Forrajes. 2007;30, Número especial:35-43.
2. Arece J, Mahieu M, Archimède H, Aumont G, Fernández M, González E, et al. Comparative efficacy of six anthelmintics for the control of nematodes in sheep in Matanzas, Cuba. Small Rum Res. 2004;5(1-2):61-67.
3. Arece J, López Y, Aróstica N, Olivares J, Rodríguez-Diego JG, Torres-Hernández G. Evaluación de cuatro antiparasitarios frente a estrongílidos gastrointestinales de ovinos. Rev Salud Anim. 2008;30(3):180-183.
4. Mencho JD, Guerra Y, Padilla L, Rodríguez Diego JG, Beltrão M. Eficacia antihelmíntica de la Ivermectina 1% (Labiomec®) en rebaños ovinos de Camagüey, Cuba. Rev Salud Anim. 2013;35(2):134-136.
5. Arece J, Rodríguez-Diego JG, Olivares J. Eficacia del Closantil 5%® contra estrongílidos gastrointestinales de ovinos. Rev Salud Anim. 2008;30(1):59-62.
6. Nari A. Organización de las Naciones Unidas para la Agricultura y la Alimentación. Resistencia a los Antiparasitarios: Estado actual con énfasis en América Latina. Dirección de Producción y Sanidad Animal de la FAO. Roma, 2003:pp. 1.
7. Márquez D. Resistencia a los antihelmínticos en nematodos de rumiantes y estrategias para su control. Rev Corpoica. 2003;4(1):55-71.
8. Angulo F, Urdaneta M ,Chacín E, Ramírez R. Detection of anthelmintic resistance to 15% Albendazole of gastrointestinal nematodes in hair lambs of a Venezuelan flock. Rev Cient Fac C Vet. 2011;21(1):27-30.
9. Atlija M, Gutierrez-Gil B, Martínez Valladares M, de la Fuente LF, Arranz JJ. Barrido genómico con el SNP-CHIP ovino 50K para la detección de QTL con influencia sobre la resistencia a nematodos intestinales en el ganado ovino de raza churra: Análisis de ligamiento para el recuento de huevos en heces. XV Jornadas sobre Producción Animal, España 2013; Tomo II:pp. 532-534.
10.Gutiérrez-Gil B, Pérez J, Álvarez L, Martínez-Valladares M, de la Fuente L F, Bayón Y, et al. Quantitative trait loci for resistance to trichostrongylid infection in Spanish Churra sheep. Gen Sel Evol. 2009;28(41):46-52.
11.Van Wyk JA, Bath GF. The FAMACHA© system for managing haemonchosis in sheep and goats by clinically identifying individual animals for treatment. Vet Res. 2002;33:509-529.
12.Arece J, Rodríguez Diego J G, López Y. La Metodología FAMACHA ®: una estrategia para el control de estrongilidos gastrointestinales de ovinos. Estudios preliminares. Rev Salud Anim. 2007;29(2):91-94.
13.Coutinho AS, Soares J, Eduardo Silva Rebouças R, Araújo de Souza Fonseca ZA, et al. Perfil hematológico de ovinos avaliados pelo FAMACHA© no Rio Grande do Norte, Brasil. PUBVET. 2013;7(20): Ed. 243, Art. 1606.
14.Reynecke DP, Van Wyk JA, Gummow B, Dorny P, Boomker J. Validation of the FAMACHA© eye colour chart using sensitivity/specificity analysis on two South African sheep farms. Vet Parasitol. 2011;177(3-4):203-211.
15.Sotomaior C, Rosalinski-Moraes F, da Costa AR, Maia D, Monteiro AL, et al. Sensitivity and specificity of the FAMACHA(©) system in Suffolk sheep and crossbred Boer goats.false Vet Parasitol. 2012;190(1-2):114-119.
16.Idika IK, Iheagwam CN, Nwobi LG, Nwosu CO. Evaluation of anaemia in Nigerian goats using FAMACHA© eye colour chart: a preliminary study. Comp Clin Pathol. 2013;22(4):627-630.
17.Maia D, Rosalinski-Moraes F, van Wyk A, Weber S, Sotomaior C, et al. Assessment of a hands-on method for FAMACHA© system training. False. Vet Parasitol.2014;200(1-2):165-171.
18.Duarte GD, Zardin M, Gonçalves BP, Madruga LAM, Barbosa Silveira ID. 2011. Avaliação do estado nutricional-sanitario de borregas a través do escore de condição corporal e técnica do FAMACHA©. http://www.ufpel.edu.br/cic/2011/anais/pdf/CA/CA_00510.pdf. (revisado 19/03/2014).
19.Arece J, Rodríguez Diego JG, Torres G, Mahieu M, González E, González-Garduño R. The epizootiology of ovine gastrointestinal strongyles in the province of Matanzas, Cuba. Small Rum Res. 2007;72:119-126.
20.Kaplan RM, Burke JM, Terril TH, Miller JE, Getz WR, Mobini S, et al. Validation of the FAMACHA© eye color chart for detecting anemia in sheep and goats on farms in the southern United States. Vet Parasitol. 2004;123:105-120.
21.Aróstica N, Arece J, López Y, Rodríguez Diego JG. Evaluación de la carta de colores FAMACHA© en la detección de anemia en cabras en silvopastoreo. Estudios Preliminares. Rev Salud Anim. 2009;31(3):183-187.
22.Marrero E, Melchor G, Sánchez LM, Fernández O, Escobar A, et al. De la Etnomedicina al desarrollo de productos farmacéuticos naturales. V Coloquio Europeo de Etnofarmacología. Rev Fitoterapia. 2005;5(S1).
23.Marrero E, García T, Rodríguez Diego JG, Figueredo MA, Pérez R. Actividad antihelmíntica de Bromelia pinguin L (Bromeliaceae) en terneros. Rev Salud Anim. 1994;16(1-3):63-68.
24.Olivares J. Oesophagostomum columbianum: Puesta en evidencia, caracterización y control en ovinos de la región de Huichapán, Estado de Hidalgo, México (tesis doctoral). Universidad Agraria de la Habana. Mayabeque, Cuba. 2001.
25.García DE, Soca M, Medina MG. Acción antihelmíntica de seis extractos de morera en la viabilidad de larvas infestantes (L3) de nematodos gastrointestinales. Pastos y Forrajes. 2005;28(4):319-328.
26.Avello OE, Silveira Prado EA, Peña Rodríguez FI, Camacho Escandón MC, Arce González MA. Actividad antihelmíntica in vitro de extractos de Azadirachta indica A Juss, Momordica charantia L. y Chenopodium (Teloxys) ambrosioides L. REDVET. 2006;VII(11):1-10.
27.Dogar ZHM, Faiza A, Khalil-ur-Rahman, Shazia T, Abdul R, et al. In vivo and in vitro antihelmintic activity of gemmotherapeutically treated Azadirachta indica (neem) against gastrointestinal nematodes of sheep and earthworms. African J Pharm Pharmacol. 2012;6(46):3171-3179.
28.Barrabí M, Arece J. Actividad antihelmíntica in vitro de extracto acuoso de hojas y semillas de Neem (Azadirachta indica A. Juss). I. Inhibición de la eclosión de huevos y del desarrollo larvario. Rev Salud Anim. 2013;35(2):103-108.
29.Alemán Y, Sánchez LM, Pérez T, Rodríguez Y, Olivares JL, Rodríguez Diego JG. Actividad larvicida de extractos de Rhizophora mangle contra estrongílidos gastrointestinales de ovinos. Rev Salud Anim. 2011;33(2):111-115.
30.Rodríguez J, González HM. Un ingrediente activo con acción antihelmíntica, a partir de las semillas de Cucurbita moschata duch: estudios analíticos y de pre formulación. Ed Univ 2012, La Habana: pp. 136.
31.Maphosa V, Masika PJ. The potential of Elephantorrhiza elephantina as an anthelminthic in goats. Parasitol Res. 2012;111(2):881-888.
Recibido: 2-9-2014.
Aceptado: 17-12-2014.