Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570Xversión On-line ISSN 2224-4700
Rev Salud Anim. vol.37 no.3 La Habana sep.-dic. 2015
ARTÍCULO ORIGINAL
Evaluación en campo de un candidato vacunal por subunidad proteica E2 contra peste porcina clásica
Field evaluation of protein subunit2 vaccine candidate against classical swine fever
María Irian PercedoI, Osvaldo FonsecaI, Patricia Domínguez I, Sara Castell I, Marisela SuárezII, María Pilar RodríguezII, Carlos MonteroII, María Teresa FríasI
ICentro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: percedo@censa.edu.cu.
IICentro de Ingeniería Genética y Biotecnología (CIGB), La Habana, Cuba.
RESUMEN
Entre las enfermedades con alto potencial de diseminación transfronteriza y elevado impacto económico para los porcicultores de todos los sectores se encuentra la peste porcina clásica (PPC), también conocida como cólera porcino. No obstante los esfuerzos para su control, tras su reemergencia en 1993, el comportamiento endémico que se constata motivó el desarrollo de una vacuna por subunidad proteica E2 (VE2) del virus de la PPC (VPPC) para apoyar la erradicación de la enfermedad, al facilitar la diferenciación de cerdos infectados de vacunados. Luego de los resultados preclínicos satisfactorios, se evaluó la eficacia de la VE2 en un rebaño de ciclo completo con más de 5 000 cerdos, sujeto a vacunación sistemática con una vacuna viva atenuada lapinizada (Cepa China), pero con antecedentes de brotes esporádicos de enfermedad. Se realizó monitoreo de la respuesta serológica mediante ensayo de neutralización de la peroxidasa (NPLA), en diferentes etapas del ciclo productivo de tres grupos de animales (seroperfiles), desde cría hasta ceba, a intervalos de 12 semanas entre grupos, durante un año. Se constataron elevados porcentajes de animales con títulos considerados protectivos (³ 1:100), los que avalan una respuesta humoral satisfactoria a nivel poblacional. A su vez, las cebas positivas a Inmunoperoxidasa Directa (IPD) en tonsilas en el matadero disminuyeron durante el periodo. La evolución favorable del estado de salud del rebaño, tras la vacunación con la VE2, se revirtió en niveles productivos superiores. Los resultados preliminares obtenidos avalan favorablemente el desempeño de la vacuna E2 en condiciones de campo, pese al reto de la circulación viral que propicia el endemismo de la enfermedad y la presencia de otros patógenos.
Palabras clave: cerdos, peste porcina clásica, candidato vacunal, glicoproteína E2.
ABSTRACT
The Classical Swine Fever (CSF), also recognized as hog cholera, is among the diseases with high transboundary spreading potential and economic impact for swine breeders of all the sectors. Despite the efforts for its control since its re-emergence in 1993, the disease endemic behavior observed motivated development of a protein subunit E2 vaccine candidate (VE2) to support the disease eradication, in view of the easy differentiation of infected from vaccinated pigs. After successful preclinical assays, the VE2 efficacy was evaluated in a herd of complete productive cycle with more than 5 000 pigs under routine vaccination with a live attenuated vaccine (Chinese Strain), but with reports of sporadic outbreaks of the disease. Monitoring of the serological response was carried out by the neutralization peroxidase-linked assay (NPLA) in different phases of the productive cycle of three animal groups (serum profiles), from litter to fattener, at 12 weeks interval for one year. High percentages of positive animals with titters considered as protective (³ 1:100) were observed, supporting a satisfactory humoral response at population level. Likewise, the fatteners positive to the Direct Immunoperoxidase (DIP) in tonsils decreased at the slaughterhouse during the study period. The favorable evolution of herd health status after VE2 vaccination led to higher productive levels. The preliminary results obtained favorably support the VE2 performance in field conditions, despite the challenge of the virus circulation favored by the disease endemic condition and other pathogen presence.
Key words: pigs, Classical Swine Fever, vaccine candidate, E2 glycoprotein.
INTRODUCCIÓN
Entre las enfermedades que amenazan la rentabilidad de la producción porcina, independientemente del tipo de crianza, desde sistemas industriales hasta pequeños productores de traspatio, se encuentra la peste porcina clásica (PPC) o cólera porcino, lo que unido a su impacto en la seguridad alimentaria de los países afectados y el elevado potencial de diseminación transfronteriza, determinan la máxima prioridad que los organismos sanitarios internacionales le otorgan a su notificación obligatoria y a los planes para su control y erradicación (1,2).
La mayoría de los países que ostentan hoy la condición de libres de PPC han desarrollado sus programas de control apoyados en el uso de la vacuna atenuada de la Cepa China, que junto a otras cepas como la PAV, Thiverval, GPE (3) y LOM (4), entre otras, constituyen la primera opción ante una emergencia, por sus probadas bondades para inducir rápidamente una protección satisfactoria en los animales vacunados con vistas a frenar la diseminación de la enfermedad, aunque con el inconveniente de no poder diferenciar animales vacunados de infectados.
Sortear esta limitante fue la idea que impulsó el desarrollo de nuevas vacunas, entre ellas las de subunidad proteica con base en la glicoproteína E2 del virus de la PPC (VPPC), junto a los medios diagnósticos capaces de detectar, en exclusivo, la proteína ErNs, indicativa de la infección por un virus de campo (3, 5).
Para países afectados endémicamente por la PPC, puede resultar atractivo usar una vacuna marcadora en etapas avanzadas del control, pues en una primera fase sustituiría a la vacuna atenuada en uso hasta que disminuya a niveles mínimos la circulación viral y después, con menos riesgos y costos, proceder a la suspensión de la vacunación para llegar a la erradicación.
En Cuba, la PPC ha manifestado un comportamiento endémico tras su reemergencia en 1993 (6) y con la intención de erradicarla se obtuvo un candidato vacunal por subunidad proteica E2 (VE2), que una vez satisfechas las pruebas preclínicas establecidas (7,8,9,10,11,12), se requería de su evaluación en condiciones de campo.
El objetivo de este trabajo fue evaluar la eficacia de la vacuna por subunidad proteica E2 (VE2) frente a los desafíos del escenario endémico de la PPC en el país.
MATERIALES Y MÉTODOS
Para conocer la eficacia del candidato vacunal de la glicoproteína E2 del VPPC (VE2) se realizó un estudio prospectivo longitudinal durante un año para evaluar la dinámica de la respuesta humoral en los animales vacunados, así como la reducción de animales infectados en el rebaño, a través de la detección del virus de la PPC (VPPC) en las tonsilas de las cebas al término de su vida productiva.
El estudio se realizó en una granja de ciclo completo con más de 5 000 cerdos promedio (500 reproductoras), sujetos a vacunación sistemática con una vacuna viva atenuada lapinizada (Cepa China, LABIOFAM) y con antecedentes de brotes esporádicos de PPC.
· Vacuna y vacunación
El candidato vacunal VE2 se desarrolló en el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana. El principio activo se obtuvo por transducción del tejido mamario de cabras mediante un vector adenoviral y, a partir del acumulado en la leche del animal, se purificó posteriormente para disponer de una concentración de 25 mg/ml, adyuvada con Montanide 888. Las formulaciones se elaboraron a escala de desarrollo en la unidad de producción del CIGB.
La vacunación se realizó mediante la aplicación de dos dosis, de 2 ml cada una, a intervalo de 21 días, por vía intramuscular profunda en la zona lateral del cuello, alternando los lados izquierdo y derecho, en ese orden. El esquema vacunal se aplicó según la categoría zootécnica, como sigue:
- Reproductoras: Se vacunaron todas las cerdas entre los 21 y 63 días de gestación (Secciones tres a la nueve de Reproducción). No se vacunaron las cerdas con mayor tiempo de gestación para evitar su manipulación al momento de la revacunación, pero después del parto recibieron el mismo esquema de vacunación. Todas las reproductoras se volvieron a vacunar después de cada parto.
- Sementales: Se vacunaron al inicio y se reactivaron (una sola dosis) cada seis meses.
- Crías: Recibieron la primera dosis a los 24 (± 3) días de nacidas, en la quinta semana de Maternidad (M-5), y la segunda a los 46 (± 3) días de edad, en la semana dos de preceba (PC-2).
- Reemplazo de reproductores (cochinatas y cochinatos): Aunque se incorporaban a la granja después de haber recibido previamente la cepa China (LABIOFAM S.A) en sus granjas de procedencia (centros genéticos o multiplicadores), durante el periodo de cuarentena se les aplicó la vacunación bifásica con la VE2.
No se vacunaron los cerdos que se encontraban al inicio del estudio en las secciones de preceba y ceba, pues ya habían recibido previamente la vacuna cepa China (LABIOFAM S.A) a los 33 y 42 días de edad, según esquema bifásico vigente en la granja con anterioridad.
· Toma de muestras
Sangre: Se realizó extracción de sangre (2-5ml) por venopunción del seno venoso oftálmico. Las muestras de colectaron individualmente en tubos de vidrio sin anticoagulante.
Tonsilas: Se tomaron fragmentos de 2-3 cm2 luego del sacrificio de los animales en el matadero. Las muestras se colectaron individualmente en bolsas plásticas.
· Pruebas de laboratorio
- Detección de anticuerpos
El ensayo de neutralización de la peroxidasa (de sus siglas en inglés NPLA, neutralizing-peroxidase-linked-antibody-assay ) (1) para la detección de anticuerpos neutralizantes se realizó en el Laboratorio de Virología Animal del Centro Nacional de Sanidad Agropecuaria (CENSA).
La NPLA se realizó a partir de suero sanguíneo, en placas de microtitulación de fondo plano de 96 pocillos con células PK-15 y 100 DICT 50 (dosis infectivas del 50% en cultivo de tejidos) de la cepa Margarita (12). Se utilizaron diluciones seriadas en base dos. El título de anticuerpos neutralizantes se expresó como el logaritmo en base dos del recíproco de la última dilución de suero que neutralizó las 102 DICT50 de la cepa Margarita.
Debido a los altos títulos de anticuerpos neutralizantes evidenciados en los animales vacunados con la VE2 en las pruebas clínicas (8, 9, 10, 11), los animales se evaluaron a la dilución de 1:100, y solo a los que resultaron negativos se les repitió el ensayo a una dilución de 1:50.
Cuando no se pudo realizar la NPLA a la totalidad de los animales muestreados, se compensó la investigación mediante un ELISA (Ceditest).
- Detección de virus
Se realizó mediante Inmunoperoxidasa Directa (IPD) en cortes criostáticos de tonsilas en el Centro Nacional de Epidemiología, Diagnóstico e Investigación (CENEDI) del Instituto de Medicina Veterinaria (IMV).
· Evaluación de la respuesta humoral a la VE2
Para evaluar la dinámica de anticuerpos posvacunación, durante un año, se realizaron muestreos de sangre (seroperfiles) a tres grupos de los animales vacunados con la VE2, y a cada uno de estos grupos, en diferentes etapas de su ciclo productivo, hasta la ceba. El primer seroperfil se inició cuando las primeras crías vacunadas con VE2 cumplieron los 15 días de haber recibido la segunda dosis vacunal (Semana 5 de preceba, PC5). Los otros dos grupos de animales comenzaron a monitorearse, en lo adelante, a intervalos de 12 semanas.
Los muestreos para cada seroperfil se realizaron en los siguientes momentos:
- A los 24 ± 3 días de edad de las crías, al recibir la primera dosis de la VE2 (Semana 5 de Maternidad, MS5) (se incluyó a partir del seroperfil 2).
- A los 42 ± 3 días de edad, al aplicar la segunda dosis de la VE2 en la etapa de preceba (Semana 2 de preceba, PC2) (se incluyó a partir del seroperfil 3).
- A los 60 ± 3 días de edad, en la etapa de preceba (Semana 5 de preceba, PC5), pasados 15 días de cumplido el esquema vacunal bifásico.
- En la etapa de ceba hasta el final del ciclo tecnológico, a intervalos de 6 semanas (Semanas 2, 8 y 14 de ceba; C2, C8 y C14, respectivamente).
- En las cebas al momento del sacrificio en matadero.
En cada momento del seroperfil se muestreó el 20% de los animales existentes en los grupos que se estaban monitoreando hasta la ceba.
· Determinación de animales portadores del virus de la PPC en matadero
Durante todo el periodo de estudio se realizó el monitoreo mensual, mediante IPD en tonsilas, a grupos de 20-25 cebas al sacrificio en matadero. También fueron objeto de investigación, por IPD en matadero, las cebas de los grupos monitoreados serológicamente en diferentes momentos de su ciclo tecnológico (seroperfiles).
· Procesamiento estadístico
Para el procesamiento estadístico se utilizaron los programas Epidat (versión 3,1) y Microsoft Excel 2007. Se determinó la tendencia de la frecuencia de cebas positivas al VPPC mediante Inmunoperoxidasa Directa (IPD) en tonsilas en matadero durante el año estudiado. Mediante Chi-cuadrado de independencia, seguida de comparación de proporciones, se contrastó dicha variable entre los seroperfiles 1 (inicial) y 3 (final) de las cebas vacunadas con la VE2, y entre estas y las que habían recibido la Cepa China. Se determinó el Riesgo Relativo ante diferencias significativas para un intervalo de confianza (IC) del 95%.
RESULTADOS
En la Tabla 1 se refleja la cantidad de cerdos muestreada en cada sección tecnológica de los grupos monitoreados serológicamente mediante NPLA en el transcurso de su ciclo productivo hasta el sacrificio en matadero.
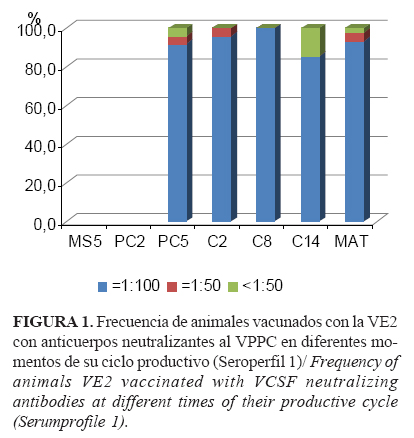
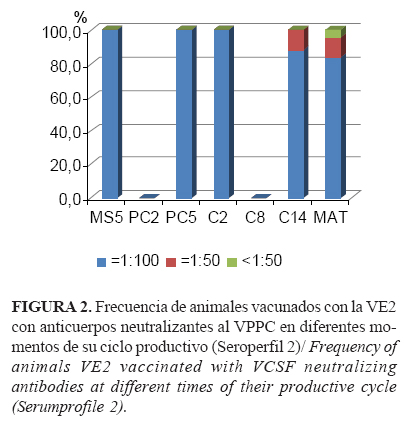
Se comprobó un elevado porcentaje general de animales con títulos de anticuerpos neutralizantes altos (NPLA ³1:100), durante todo el ciclo de producción de los cerdos hasta su sacrificio final como cebas, los que en general fueron del 93,35% (±5,25); 92,4% (±7,27) y 86,88% (±12,48) para los seroperfiles 1, 2 y 3, respectivamente (Figuras 1, 2 y 3). De igual manera, la respuesta humoral satisfactoria se pudo constatar en los casos en que se investigó mediante ELISA.
Se demostró la tendencia decreciente de cebas positivas a IPD en tonsilas en el matadero durante el transcurso de la prueba de campo (Figura 4). Es de notar que en algunos meses hubo dificultades para realizar los muestreos en matadero, en tanto en otros meses se realizaron varios. Particularmente en julio hubo varios muestreos, pues se investigaron las últimas cebas ya vacunadas con la Cepa China al inicio de la Prueba de Campo (Enero) y los primeros grupos de animales vacunados con la VE2.
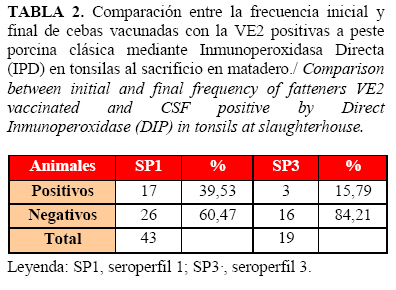
Se destaca que, para el caso de las cebas vacunadas con la VE2, no se constató diferencia significativa en la frecuencia de animales positivos al VPPC en tonsilas entre el primer y último seroperfiles (p<0,05) (Tabla 2).
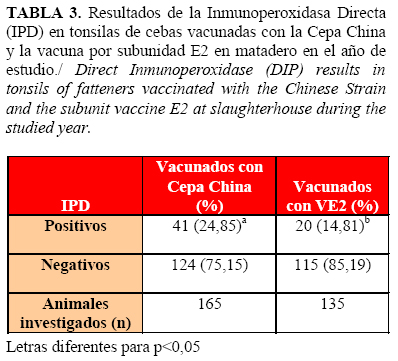
Por otra parte, la frecuencia de cebas positivas en tonsilas al VPPC en el matadero fue mayor en las vacunadas con la Cepa China respecto a las que recibieron la VE2. Además, se evidenció que las primeras tuvieron mayor riesgo de estar infectadas al término de su ciclo productivo (Riesgo Relativo 1,677, IC 95%; 1,03 - 2,72) (Tabla 3).
Se investigaron, igualmente, las tonsilas de ocho reproductores vacunados con la VE2, sacrificados en matadero como desecho por su deficiente desempeño reproductivo. Cuatro animales fueron positivos a IPD (50%), dos eran cerdas de primer parto que abortaron y dos sementales. Excepto una cerda que había resultado negativa a IPD y no se investigó por NPLA, los restantes animales mostraron títulos de ³1:100.
DISCUSIÓN
Para alcanzar la erradicación de la PPC, en países donde la enfermedad es endémica, es preciso avanzar en el control de la enfermedad hasta la no presentación de focos, pero también se requiere la disminución paulatina de la circulación viral antes de suspender la vacunación y eliminar las fuentes residuales del virus (2,13,14). Para ello, la transmisión debe ser reducida en tal medida que el virus no pueda mantenerse en la población y esto solo puede lograrse a través de medidas de control eficaces y la propia vacunación (15,16,17,18).
Dado el endemismo de la PPC en nuestro país, la vacunación sistemática de la población porcina de todos los sectores productivos constituye uno de los pilares fundamentales del programa de control vigente, y poder sustituir, en fases más avanzadas del control, la vacuna de la Cepa China por una vacuna marcadora como la VE2, brindaría la posibilidad de transitar hacia la erradicación con menos riesgos y a menor costo.
Disponer de vacunas marcadoras de subunidades, no replicativas tiene, además, la ventaja de no incurrir en los riesgos de recombinación del virus vacunal con virus de campo de PPC. Se ha señalado que por recombinación y cambios de aminoácidos que generan mutaciones puntuales se puede afectar la diversidad de las cepas y ocasionar el escape a la respuesta inmune (19, 20). Asimismo, se encontró que la vacunación con cepas atenuadas puede influir en la dinámica poblacional, la tasa evolutiva y la evolución adaptativa del virus de PPC (20).
La VE2 mostró su eficacia a través de los altos títulos de anticuerpos neutralizantes observados en los grupos de animales monitoreados, pues solo en el seroperfil 3 hubo un descenso en la frecuencia de animales positivos (70%), pero esta circunstancia al final de la vida productiva de la ceba no tiene mayores implicaciones epidemiológicas. De hecho, para el caso de los reproductores la revacunación anual estuvo prevista por la mayor duración de su vida productiva.
Como la inmunidad poblacional promedio alcanzada (81,82%) se puede considerar satisfactoria desde las crías hasta las cebas, de manera preliminar el esquema vacunal bifásico propuesto ha quedado en general validado para su uso. Otros estudios han demostrado protección, incluso en cerdos retados 13 meses después de recibir una sola dosis de vacuna por subunidad E2 (21).
En ensayos previos se observó que la VE2 era capaz de inducir una respuesta humoral activa en crías con altos niveles de anticuerpos maternos derivados de la inmunización de las madres, tanto con la vacuna viva atenuada de la cepa China (LABIOFAM) como con el propio candidato vacunal (9,11).
En el presente estudio las crías recibieron la primera dosis de la VE2 a los 24±3 días de nacidas y se revacunaron 21 días después con buenos resultados, a pesar de que en ambos momentos debieron existir altos títulos de anticuerpos maternales. Se había comprobado que la inmunidad pasiva en crías procedentes de madres vacunadas con este candidato vacunal se prolongaba hasta la sexta semana de vida (10).
Resultados similares se tuvieron también con la vacuna de subunidad E2 PorcilisPesti®, pues los anticuerpos maternos persistieron entre las 5 y 13 semanas de vida en cerdos procedentes de madres vacunadas (22).
Si bien la protección conferida a la descendencia mediante los anticuerpos de las madres vacunadas es de suma importancia, la elección del momento de la vacunación de las crías con vacunas vivas atenuadas es un punto crítico, ya que la interferencia con los anticuerpos maternos se considera como el factor que más afecta la inducción de inmunidad protectiva contra el VPPC en condiciones de campo (23, 24, 25, 26, 27). La vacunación de las crías antes de las seis semanas es la causa más probable de fallo vacunal en áreas endémicas (28).
Aun en áreas endémicas la exposición natural al VPPC en rebaños vacunados pudiera estar actuando como un refuerzo en cerdas vacunadas y, sin signo clínico alguno, ocasionarles un aumento significativo de anticuerpos neutralizantes y el consiguiente incremento de títulos de anticuerpos pasivos transferidos a la descendencia, lo que daría lugar a interferencias en la inducción de la respuesta inmune activa en los lechones después de la vacunación con vacunas vivas (29).
Previo a la introducción de la VE2 en la granja estudiada, las crías estaban recibiendo la primovacunación con la Cepa China aproximadamente a las cinco semanas de edad, al momento del destete, y una segunda dosis luego de 30 días. Con este esquema vacunal bifásico se trata de contrarrestar la neutralización de la primera dosis vacunal con los altos títulos de anticuerpos calostrales presentes. Los fallos por esquemas de vacunación inadecuados favorecen el mantenimiento de la circulación viral en el rebaño.
La respuesta favorable a la VE2 se demostró por el desarrollo y mantenimiento de una adecuada inmunidad poblacional hasta el final del ciclo productivo de las cebas (Figuras 1, 2 y 3), así como por la consiguiente reducción de la circulación viral potencial en la piara tras su aplicación (Figura 4), por lo que hubo menos probabilidad de infección con el VPPC en la granja después de introducir la VE2 (Tabla 3) (Riesgo Relativo 1,677, IC 95%; 1,03 - 2,72). Además, los animales vacunados con este producto que convivieron con los de mayor probabilidad de infección (seroperfil 1) no mostraron diferencias con aquellos cuyo ciclo de vida transcurrió mientras toda la granja ya estaba vacunada con la VE2 (seroperfil 3) (Tabla 2).
Se debe destacar que la elevada frecuencia de animales positivos en tonsilas, observada en los primeros cerdos vacunados con la VE2 y monitoreados hasta su sacrificio en matadero (SP1 en julio, Figura 4), se puede deber a un error inicial en el sitio de aplicación de la primera dosis de vacuna. Esta se aplicó por la vía intramuscular profunda en la cara interna del muslo, como por rutina se hace con la Cepa China, y en varios animales se constató una reacción inflamatoria significativa en el sitio de inoculación, con la formación en algunos casos de abscesos. Aunque estos no dejaron lesiones visibles en los músculos, como se verifió al momento del sacrificio, se pudo afectar la exposición del antígeno vacunal al sistema inmune y con ello interferir con el buen desarrollo de la respuesta en estos animales. Con esta observación se destaca la importancia de administrar adecuadamente la VE2 en el sitio establecido por el fabricante.
La introducción de la VE2 tuvo una influencia positiva en la inmunidad poblacional de la granja y, a medida que fue aumentando la proporción de animales vacunados con el nuevo candidato, se redujo paulatinamente la tasa de animales infectados en el rebaño desde edades tempranas y, con ello, la circulación viral en la piara. Una situación contraria pudo ocurrir antes en la granja con el esquema de la Cepa China en uso que diera lugar a la presentación de brotes esporádicos de PPC.
Se pudo comprobar, experimentalmente, que la vacuna por subunidad E2 redujo la transmisión de la infección a partir de los 10 días posvacunación, lo que demuestra el beneficio potencial de su uso ante un brote de PPC y la ventaja que adicionalmente tiene como vacuna marcadora (30).
De igual manera, la complejidad del escenario endémico de PPC existente en el rebaño se revela en los cuatro reproductores positivos en tonsilas al VPPC detectados en el matadero (50%). Las dos reproductoras positivas habían abortado, luego de gestarse por primera vez tras su incorporación a la granja como reemplazo y haber recibido las dos dosis de la VE2 durante la cuarentena. Además, habían sido vacunadas con la Cepa China en su rebaño de origen. Así, pese a estar vacunados con ambas vacunas, estos animales no resistieron la infección y las cepas, de moderada a baja virulencia, pudieron conducir a la transmisión vertical del virus y ser causa del aborto, lo que se corresponde con la condición endémica de la enfermedad en el rebaño.
En ese sentido, diversos experimentos realizados para comprobar la capacidad de las vacunas por subunidad para impedir la transmisión vertical del VPPC han mostrado resultados variables (3), por lo que es un aspecto a profundizar en investigaciones futuras con el nuevo candidato.
El avance en el control de la PPC en el rebaño, tras la vacunación con la VE2, se hizo notar, además, por su impacto productivo, al constatarse la recuperación de los indicadores bioproductivos en comparación con el periodo anterior, lo que también se consideró como un criterio de medida del éxito del nuevo candidato vacunal.
A su vez, se debe destacar que en el rebaño estudiado se confirmó la infección por Circovirus porcino Tipo 2 en animales con cuadro clínico típico de circovirosis porcina o síndrome del desgaste multisistémico, en los que se constató respuesta humoral satisfactoria al candidato vacunal E2 (31). Igualmente se presentaron casos esporádicos del síndrome de dermatitis y nefritis porcina, así como de salmonelosis por Salmonella suis Tipo 2. El diagnóstico diferencial con PPC con resultados negativos fue realizado en varios episodios de enfermedad, como parte del diagnóstico activo para evaluar el desempeño de la VE2 (datos no publicados).
Por la elevada frecuencia (73,9 %) con que se detecta la coinfección por el VPPC y el CVP2 en nuestros rebaños (32), es muy necesario profundizar en sus consecuencias, pues se conoce de fallas vacunales contra la PPC debido a la infección con CVP2 (33), así como con el virus de Aujesky (25) y del síndrome respiratorio y reproductivo porcino (34,35).
Constituyó un reto probar la eficacia de la VE2 en un escenario tan complejo, incluso por los antecedentes de brotes esporádicos de PPC. Los resultados preliminares obtenidos demuestran que el candidato puede ser muy útil en etapas avanzadas de la erradicación de la enfermedad en el país. Se recomienda continuar los estudios con el candidato vacunal en su nueva etapa de desarrollo y evaluar la posible inducción de inmunidad temprana, y la capacidad para impedir la transmisión transplacentaria del virus.
AGRADECIMIENTOS
A los Dres. Roberto González y María Reyes, así como otros técnicos, especialistas y directivos de la Empresa Agropecuaria Pinar del Río, Candelaria, Pinar del Río, por su colaboración en esta investigación.
REFERENCIAS
1. OIE. Classical Swine Fever (hog cholera). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Chapter 2.8.3. 2013. Disponible en: http://www.oie.int/fileadmin/Home/eng/Health_standards /tahm/2.08.03_CSF.pdf. Consultado: 12/10/2014.
2. FAO. Plan Continental para la Erradicación de la Peste Porcina Clásica en las Américas. Organización de las Naciones Unidas para la Agricultura y la Alimentación. Santiago de Chile, Octubre. 2000; 1-23.
3. Blome S, Meindl-Böhme A, Loeffen W, Thuer B, Moennig V. Assessment of classical swine fever diagnostics and vaccine performance. Rev Sci Tech OIE. 2006;25(3):1025-1038.
4. Song JY, Lim SI, Jeoung HY, Choi EJ, Hyun BH, Kim B, et al. Prevalence of Classical Swine Fever Virus in Domestic Pigs in South Korea: 1999-2001. Transboun Emerg Dis. 2013;(60):546-551.
5. Greiser-Wilke I, Moennig V. Vaccination against classical swine fever virus: limitations and new strategies. Anim Health Res Rev. 2004;(5):223-226.
6. Frías MT. Reemergence of Classical Swine Fever in Cuba 1993-1997. Rev Salud Anim. 2003;25(1)1-4.
7. Sánchez O, Barrera M, Rodríguez MP, Frías MT, Figuero NE, Naranjo P, et al. Classical swine fever virus E2 glycoprotein antigen produced in adenovirally transduced PK-15 cells confers complete protection in pigs upon viral challenge. Vaccine. 2008;26:988-997.
8. Barrera M, Sánchez O, Farnos O, Rodríguez MP, Domínguez P, Tait H, et al. Early onset and long lasting protection in pigs provided by a Classical Swine Fever E2-vaccine candidate produced in the milk of goats. Vet Immunol Immunopathol. 2010;133(1):25-32.
9. Vega E. Respuesta inmune humoral de un candidato vacunal de subunidad proteica (E2) contra el virus de la peste porcina clásica. Tesis en Opción al Grado Científico de Doctor en Ciencias Veterinarias. 2011. Centro Nacional de Sanidad Agropecuaria, Cuba.
10.Vega E, Barrera M, Abeledo MA, Rodríguez MP, Frías MT, Figueredo JM, et al. Capacidad protectora conferida a las crías por anticuerpos maternos inducidos por un candidato vacunal de subunidad proteica (E2). Rev Salud Anim. 2011;33(3):170-177.
11.Vega E, Barrera M, Abeledo MA, Rodríguez Moltó MP, et al. Anticuerpos maternos frente al virus de la peste porcina clásica en crías inmunizadas con candidato vacunal de subunidad proteica (E2). Rev Salud Anim. 2011;33(1):51-56.
12.Ganges L, Barrera M, Díaz de Arce H, Vega A, Núñez J, et al. Antigenic, biological and molecular characterization of the Cuban CSFV isolate Margarita. Rev Salud Anim. 2007;29(3):182-192.
13.FAO. Reunión del Programa Continental de Erradicación de la PPC en las Américas. Colombia, 2014.
14.OIE. Procedures for self declaration and for official recognition by the OIE. Chapter 1.6. 2014.
15.Moennig V. Introduction to Classical Swine Fever: virus, disease and control policy. Vet Microb. 2000;73(2-3):93-102.
16.Mangen M, Nielen M, Burrell A. Simulated epidemiological and economic effects of measures to reduce piglet supply during a classical swine fever epidemic in the Netherlands. Rev Sci Tech OIE. 2003;22(3):811-822.
17.Weesendorp E, Backer J, Stegeman A, Loeffen W. Effect of strain and inoculation dose of classical swine fever virus on within-pen transmission. Vet Res. 2009;40(6)59.
18.Weesendorp E, Backer J, Stegeman A, Loeffen W. Transmission of classical swine fever virus depends on the clinical course of infection which is associated with high and low levels of virus excretion. Vet Microb. 2011;147(3-4):262-273.
19.Pérez LJ, Díaz de Arce H, Perera CL, Rosell R, Frías MT, Percedo MI, et al. Positive selection pressure on the B/C domains of the E2-gene of classical swine fever virus in endemic areas under C-strain vaccination. Infection, Genetics and Evolution. 2012;12:1405-1412. Disponible en: http://dx.doi.org/10.1016/j.meegid.2012.04.030. Revisado: 23 de mayo de 2012.
20.Ji W, Niu DD, Si HL, Ding NZ, He CQ. Vaccination influences the evolution of classical swine fever virus. Infection, Genetics and Evolution. 2014;25:69-77. Disponible en: http://dx.doi.org/10.1016/j.meegid.2014.04.008 Revisado: 3 de mayo de 2014.
21.Smit AJ, Bouma A, de Kluijver EP, Terpstra C, Moormann RJM. Duration of the protection of an E2 subunit marker vaccine against classical swine fever after a single vaccination. Vet Microb. 2001;78(4):307-317.
22.Lipowsk A, Drexler C, Pejsak Z. Safety and efficacy of a classical swine fever subunit vaccine in pregnant sows and their offspring. Vet Microb. 2000;77(1-2):99-108.
23.Van Oirschot J. Vaccinology of classical swine fever: from lab to field. Vet Microb. 2003;96(4):367-384.
24.Wesley R, Lager K. Overcoming maternal antibody interference by vaccination with human adenovirus 5 recombinant viruses expressing the hemagglutinin and the nucleoprotein of swine influenza virus. Vet Microb. 2006;118(1-2):67-75.
25.Suradhat S, Damrongwatanapokin S, Thanawongnuwech R. Factors critical for successful vaccination against classical swine fever in endemic areas. Vet Microb. 2007;119(1):1-9.
26.Morilla GA, Carbajal VMA. La Fiebre Porcina Clásica endémica en México. Ciencias Veterinarias. 2003;166-190.
27.Vandeputte J, Too H, Ng F, Chen C, Chai K, Liao G. Adsorption of calostral antibodies against classical swine fever, persistence of maternal antibodies, and effect on response to vaccination in baby pigs. Am J Vet Res. 2001;62(11):1805-1811.
28.Morilla A. A decade of learning to control CSF in endemic areas. In: Proceed. 17th Int. Pig Vet Soc Cong. 2002; USA, 147.
29.Suradhat S, Damrongwatanapokin S. The influence of maternal immunity on the efficacy of a classical swine fever vaccine against classical swine fever virus, genogroup 2.2, infection. Vet Microb. 2003;92(1-2):187-194.
30.Bouma A, De Smit AJ, De Jong MCM, De Kluijver EP, Moormann RJM. Determination of the onset of the herd-immunity induced by the E2 sub-unit vaccine against classical swine fever virus. Vaccine. 2000;18:1374-1381.
31.Percedo MI, Domínguez P, Pérez LJ, Díaz de Arce H, Fonseca O, et al. Effective humoral response to Classical Swine Fever vaccine candidate in Porcine Circovirus type 2 naturally infected animals. En: Proceedings 6to Symp. Int. Emerging and Reemerging Swine Diseases, Barcelona, España. 12-15 June, 2011. Disponible en: http://www.emerging2011.com/. Revisado: 23 de noviembre de 2012.
32.Pérez LJ, Díaz de Arce H, Percedo MI, Domínguez P, Frías MT. First report of Porcine Circovirus Type 2 infections in Cuba. Res Vet Sci. 2009; Disponible en: http://dx.doi:10.1016/j.rvsc.2009.11.014.
33.Huang YL, Fei Pang V, Lin CM, Tsai Y, Chia MY, et al. Porcine circovirus type 2 (PCV2) infection decreases the efficacy of an attenuated classical swine fever virus (CSFV) vaccine. Vet Res. 2011;42:115. Disponible en: http://www.veterinaryresearch.org/content/42/1/115 Revisado: 3 de septiembre de 2013.
34.Li H, Yang H. Infection of porcine reproductive and respiratory syndrome virus suppresses the antibody response to classical swine fever virus vaccination. Vet Microbiol. 2003;95:295-301.
35.Suradhat S, Keddangsakonwut S, Sada W, Buranapraditkun S, Wongsawang S, Thanawongnuwech R. Negative impact of porcine reproductive and respiratory syndrome virus infection on the efficacy of classical swine fever vaccine. Vaccine. 2006;24:2634-2642.
Recibido: 16-3-2015.
Aceptado: 4-9-2015.