Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570Xversión On-line ISSN 2224-4700
Rev Salud Anim. vol.38 no.3 La Habana sep.-dic. 2016
ARTÍCULO ORIGINAL
Efecto de la quercetina, la L-ergotioneina y la pentoxifilina en el semen equino posdescongelado
Effect of quercetin, L-ergothioneine and pentoxifylline in post-thaw stallion semen
Giovanni Restrepo Betancur,I Juan Esteban Duque Cortés,II Benjamín Alberto Rojano,III
IUniversidad Nacional de Colombia, Facultad de Ciencias Agrarias, Departamento de Producción Animal, Calle 59A No 63-20, Medellín, Antioquia, Colombia.
IIPolitécnico Colombiano Jaime Isaza Cadavid: Carrera 48 Nº 7-151, Medellín, Antioquia, Colombia.
IIIUniversidad Nacional de Colombia, Facultad de Ciencias, Calle 59A No 63-20, Medellín, Antioquia, Colombia
RESUMEN
La criopreservación produce estrés oxidativo que altera la calidad del semen equino. Diferentes antioxidantes se han adicionado al semen refrigerado, congelado o posdescongelado; sin embargo, en muchos casos han tenido resultados limitados e incluso efectos deletéreos. En años recientes, se han reportado resultados prometedores de antioxidantes poco convencionales. Esta investigación tuvo como objetivo evaluar el efecto de la quercetina, la L-ergotioneina y la pentoxifilina en la conservación de la calidad posdescongelación del semen equino. Se criopreservó el semen de cinco caballos (Equus caballus) mediante un protocolo convencional de congelación. Se evaluó la posdescongelación, la producción e inhibición de especies reactivas de oxígeno (ERO) por el método H2DCFDA y se definieron las concentraciones de suplementación del semen para la L-ergotioneina de 150 µM, la quercetina de 150 µM y la pentoxifilina de 3,0 mM. A las 0, 6, 12 y 24 horas se evaluaron la movilidad y la cinética espermáticas por el sistema SCA®, la vitalidad y actividad mitocondrial mediante las sondas SYBR14/IP y JC-1, la integridad de membrana por la prueba hipoosmótica (HOS) y la peroxidación lipídica por la metodología TBARS. Se realizaron análisis de regresión y ajuste de modelos lineales generalizados (GLM). La máxima inhibición de ERO fue de73%, 20% y 37% para la quercetina, la L-ergotioneina y la pentoxifilina, respectivamente. La movilidad progresiva (MP), la velocidad curvilínea (VCL) y la velocidad media (VAP) fueron superiores a las seis horas para la L-ergotioneina y la quercetina; así como la VCL a las 12 horas para la L-ergotioneina (p<0,05). Se concluye que la L-ergotioneina y la quercetina tienen un efecto posdescongelación favorable sobre la MP, la VCL y la VAP del semen equino.
Palabras clave: antioxidantes, criopreservación, espermatozoides, fertilidad.
ABSTRACT
Cryopreservation produces an oxidative stress that alters the stallion semen quality. Different antioxidants have been added to cooled, frozen or post-thawed semen, but in many cases, they have had limited results and even deleterious effects. In recent years, promising results on conventional antioxidants have been reported. This research is aim at evaluating the effect of quercetin, L-ergothioneine and pentoxifylline in the post-thaw quality conservation of stallion semen. The semen from five horses (Equus caballus) was cryopreserved by a conventional freezing protocol. Post-thaw and reactive oxygen species (ROS) production and inhibition were assessed by H2DCFDA assay; and concentrations of semen supplementation were defined for L-ergothioneine 150 µM, quercetin 150 µM and pentoxifylline 3,0 mM. At 0, 6, 12 and 24 hours, sperm motility and kinetics were assessed by SCA® system; vitality and mitochondrial activity by SYBR14 / IP and JC-1 probes; membrane integrity by hypoosmotic swelling test (HOS) and lipid peroxidation by TBARS assay. The regression analysis and adjustment of the generalized linear models (GLM)were performed. ROS maximum inhibition was 73%, 20% and 37% for quercetin, L-ergothioneine and pentoxifylline, respectively. The progressive motility (PM), curvilinear velocity (VCL) and average path velocity (APV) were higher at 6 hours for L-ergothioneine and quercetin, as well as VCL at 12 hours for L-ergothioneine (p<0,05). It is concluded that L-ergothioneine and quercetin have a favorable post-thaw effect on PM, VCL and APV of stallion semen.
Key words: antioxidants, cryopreservation, spermatozoa, fertility.
INTRODUCCIÓN El almacenamiento a largo plazo de los espermatozoides es útil para llevar a cabo la inseminación artificial, cuando la ovulación se considera inminente (1). Sin embargo, en la criopreservación del semen las especies reactivas de oxígeno (ERO) pueden ser responsables de causar daño a las membranas de los espermatozoides y causar la fragmentación de su ADN, entre otros factores que influyen en su fertilidad (2). Con el fin de mejorar la tolerancia del semen equino a la congelación, se ha realizado la adición de plasma seminal, enzimas y moléculas con propiedades antioxidantes (3, 4,5). Sin embargo, la necesidad de conservar la viabilidad de los espermatozoides después de la descongelación, para su uso en reproducción asistida, ha llevado a la adición de antioxidantes también en esta etapa (6,7). Entre la amplia variedad de antioxidantes utilizados para la criopreservación de semen equino, la quercetina, la L-ergotioneina y la pentoxifilina podrían considerarse entre los antioxidantes no convencionales más promisorios. La quercetina reduce la peroxidación lipídica de los espermatozoides equinos durante la congelación y evita su capacitación prematura antes de la inseminación artificial (8). Se conoce que mejora la movilidad y la habilidad de unión a la zona pelúcida de los espermatozoides equinos congelados, además de ser útil para la reducción de la fragmentación del ADN en el semen sexado (9). La L-ergotioneina ha demostrado su capacidad antioxidante y citoprotectora contra una amplia gama de factores estresantes celulares (10). En semen de carnero, se ha reportado la capacidad de la L-ergotioneina para reducir la peroxidación lipídica e incrementar la capacidad antioxidante del semen (11,12); mientras, su adición en el diluyente de congelación para el semen equino ha permitido mejorar la calidad espermática posdescongelación (13). La pentoxifilina es un activador de la movilidad espermática por su efecto inhibidor de la fosfodiesterasa y en su función como antioxidante inhibe la generación de anión superóxido; sin embargo, puede causar bloqueo meiótico de los ovocitos (14). En una investigación reciente se encontró que la pentoxifilina mejora la movilidad y la longevidad del semen equino posdescongelado (6). Esta investigación tuvo como objetivos evaluar el efecto de la suplementación del diluyente de congelación con quercetina, L-ergotioneina y pentoxifilina sobre la movilidad, la cinética, la vitalidad, la actividad mitocondrial y la integridad de la membrana plasmática de espermatozoides equinos congelados-descongelados; así como determinar su efecto sobre el nivel de peroxidación lipídica posdescongelación del semen. MATERIALES Y MÉTODOS Colecta y evaluación de semen fresco Se usaron cinco caballos criollos colombianos (Equus caballus), ubicados en el Valle del Aburrá (Antioquia, Colombia), para la colecta de 15 eyaculados, mediante el método de la vagina artificial. Los animales tenían entre cuatro y ocho años de edad, todos en un régimen de mínimo una colecta semanal, con fertilidad comprobada por crías nacidas vivas y con una condición corporal de 6 a 7 (escala 1-9). El semen colectado se diluyó en proporción 1:1 en un diluyente (Equiplus®, Minitube, Alemania) a 37ºC y luego se transportó en un dispositivo de refrigeración (Equitainer®, Hamilton Research Inc., USA). Se evaluó la concentración espermática mediante espectrofotometría (Spermacue®, Minitube, Alemania) y la movilidad por microscopía de contraste de fase (Eclipse E200, Nikon Inc., Japón). Solo se procesaron los eyaculados con mínimo 100 x 106 espermatozoides/ml y 60% de movilidad total. Criopreservación de semen La criopreservación del semen se realizó mediante un protocolo modificado de congelación (15). El semen se centrifugó a 1200 g por 12 minutos (Mikro 220R, Hettich, Alemania) y el precipitado se resuspendió hasta una concentración final de 100 x 106 espermatozoides/mL, en diluyente EquiPlus®(Minitube, Alemania) suplementado con 5% de N,N-dimetilformamida (Sigma-Aldrich, USA) y 5% de yema de huevo centrifugada. La yema de huevo se preparó mediante la dilución en proporción de 3:1 en agua ultra pura y luego se centrifugó a 1600 gdurante 100 minutos (Mikro 220R, Hettich, Alemania) (16).El semen diluido se mantuvo en refrigeración a 5°C por 30 minutos y luego se empacó en pajillas para 0,5 mL (MRS1 Dual V2, IMV Technologies, Francia). Las pajillas se sometieron a vapores de nitrógeno líquido por 15 minutos y se almacenaron en un tanque para nitrógeno líquido. Suplementación antioxidante posdescongelación Con el fin de definir la concentración de cada antioxidante a ser suplementada en el semen descongelado, y considerando estudios previos (6, 9, 13), se evaluaron la cinética y la capacidad de inhibición de la producción total de ERO de diferentes concentraciones de L-ergotioneina (50, 100, 150, 200 y 250 µM), de quercetina (50, 100, 150, 200 y 250 µM) y de pentoxifilina (2,0, 2,5, 3,0, 3,5, y 4,0 mM) (Sigma-Aldrich, USA). La evaluación de la producción de ERO se realizó por la metodología de la 2,7-diclorodihidrofluoresceina diacetato (H2DCFDA) (17). Cada muestra se preparó con 30 μl de semen, 240 μl de solución tampón (pH 7,4) y 30 μl de una solución 40 mM de H2DCFDA (Intervet International BV, Holanda). Se emplearon condiciones controladas (37°C, pH 7,4) y como referencia el antioxidante Trolox® (Merck, Alemania). Las lecturas se realizaron por triplicado cada 60 segundos, durante 80 minutos, utilizando un espectrofluorímetro LS 55 (Perkin Elmer, USA). Se calcularon los porcentajes de inhibición de la producción total de ERO (%INH), de acuerdo a la expresión: %INH= (ms - mc / mc) x 100, donde ms es la pendiente de cada concentración y mc es la pendiente del control (sin antioxidante) (18). Posteriormente, grupos de ocho pajillas de semen (4,0 ml) se descongelaron en agua a 37°C por un minuto y se depositaron en un tubo graduado. El semen descongelado se dividió en cuatro alícuotas de 1,0 ml, de las cuales tres se suplementaron de forma separada con 150 µM de L-ergotioneina, 150 µM de quercetina o 3,0 mM de pentoxifilina (Sigma-Aldrich, USA). La cuarta alícuota no recibió suplementación antioxidante (tratamiento control). Para la evaluación seminal, las muestras se mantuvieron en un dispositivo de refrigeración a 5°C (Equitainer, Hamilton Research Inc., USA) a las 0, 6, 12 y 24 horas de almacenamiento. Evaluación del semen suplementado Movilidad y cinética espermática. Se evaluaron mediante el sistema Sperm Class Analizer (SCA®, Microptic S.L, España) (19). Se utilizó un microscopio de contraste de fase (Eclipse E200, Nikon, Inc, Japón) con cámara digital (Scout SCA780, Basler, USA). Se evaluaron los parámetros: movilidad total (MT), movilidad progresiva (MP), velocidad rectilínea (VSL), velocidad curvilínea (VCL) y velocidad media (VAP). Vitalidad espermática (VE). Se evaluó utilizando la sonda Live/Dead (Molecular Probes Inc, USA) (20). Se suspendieron 200 µl de la muestra espermática en solución Hanks Heppes (HH) con 1% de albúmina sérica bovina (BSA, Sigma-Aldrich, USA), para una concentración aproximada de 20 x 106 espermatozoides/ml. Luego, la mezcla se incubó a 37°C por ocho minutos, con 6,0 mM de SYBR14. Seguidamente, se incubó de la misma manera, con 0,48 mM de yoduro de propidio. Posterior a esto, y a partir de una muestra de 5,0 µl, se realizó el conteo de 200 espermatozoides, mediante un filtro UV-2A en un microscopio E200 con fluorescencia HBO (NikonInc, Japón). Integridad de la membrana plasmática (IM). Se evaluó mediante la prueba hipoosmótica (HOS) (21). Se tomaron 100 μl de semen y se adicionaron a un tubo con 500 μl de una solución hipoosmótica de sacarosa 5,4% (100 mOsmol/l). Esta mezcla se incubó a 38,5ºC por 30 minutos y luego se evaluó, mediante microscopia de contraste de fase (Eclipse E200, Nikon, Inc), la reacción de 200 espermatozoides. Potencial de membrana mitocondrial (PMM).Se realizó mediante la sonda JC-1 (Molecular Probes, USA) de acuerdo con un protocolo previamente descrito por Love et al. (22). El semen diluido a una concentración de 20x106 espermatozoides/ml se incubó con 2,0 mM de JC-1 en dimetilsulfóxido (DMSO), durante 8 minutos a 37°C. Las lecturas se realizaron mediante un microscopio E200 con fluorescencia HBO (Nikon Inc., Mellville, USA). A partir de 200 espermatozoides evaluados, se calculó la proporción de espermatozoides con patrones de fluorescencia roja, correspondientes a altos niveles de potencial de membrana mitocondrial. Peroxidación lipídica (PL). Se evaluó a las 0 y 24 horas posteriores a la suplementación antioxidante, por la metodología modificada de las sustancias reactivas al ácido tiobarbitúrico (TBARS) (23). Muestras de 50 µl de semen se incubaron por una hora a 37°C y luego se enfriaron en agua con hielo durante 10 minutos. Posteriormente, se adicionaron 40 μl de ácido tricloroacético (TCA, Sigma-Aldrich, USA) al 15% y 80 μl de ácido tiobarbitúrico al 0,67% (TBA, Sigma-Aldrich, USA). La mezcla se agitó e incubó por 20 minutos a 90°C y luego se enfrió en agua con hielo durante 10 minutos. Se adicionaron 300 μl de butanol (Sigma-Aldrich, USA) y luego se agitó cada muestra por inversión durante un minuto. Finalmente, se tomaron 300 μl de la capa superior de la muestra, los cuales se sirvieron en una placa multipozo. El complejo fluorescente formado se midió en un espectrofluorímetro LS 55 (Perkin Elmer, USA). Análisis estadístico Se realizó un diseño completamente al azar. Con el fin de evaluar el efecto de la concentración de cada antioxidante sobre la producción de ERO, se ajustó un modelo lineal generalizado (GLM) de medidas repetidas en el tiempo, donde se incluyó el efecto de la concentración y del tiempo de medición. Mediante un análisis de regresión lineal múltiple, se determinó la velocidad de producción de ERO (β1) para las diferentes concentraciones evaluadas de cada antioxidante. Para evaluar el efecto de los tratamientos sobre la calidad seminal se realizó el ajuste de modelos lineales generalizados (GLM) para cada variable. En cada modelo se incluyeron el efecto fijo del tratamiento y el efecto anidado del eyaculado dentro del equino. Se evaluó la normalidad de los datos por la prueba de Shapiro-Wilk. La comparación de las medias se realizó mediante la prueba de Tukey. Todos los análisis se realizaron mediante el programa SAS 9,2 (SAS Inst. Inc., USA). RESULTADOS Los modelos estadísticos para la evaluación de la producción de ERO del semen descongelado en presencia de los antioxidantes se explicaron en una alta proporción por los efectos incluidos (R2 > 0,80). Se encontraron coeficientes de variación para la producción de ERO de 27,4%, 10,1% y 11,5% para la quercetina, la L-ergotioneina y la pentoxifilina, respectivamente. En todos los modelos fueron significativos los efectos del tiempo y del tratamiento (p<0,05). Los resultados de la producción promedio de ERO del semen descongelado y suplementado con las diferentes concentraciones de antioxidantes se presentan en las Figuras 1, 2 y 3. Se hallaron valores máximos de inhibición de la producción total de ERO del 73% para quercetina (250 µM), del 20% para L-ergotioneina (150 µM) y del 37% para pentoxifilina (4 mM). Los resultados del análisis de regresión para la producción de ERO por antioxidante se presentan en la Tabla 1. La variabilidad encontrada en velocidad de producción de ERO (β1) para cada antioxidante y concentración evaluada fue baja (CV< 20%). Todos los modelos de regresión fueron explicados en una muy alta proporción por los efectos incluidos (R2> 0,90). Para la quercetina y la pentoxifilina se observó una tendencia de reducción de la velocidad de producción de ERO (β1), a medida que se incrementó la concentración utilizada. Para la L-ergotioneina se encontró un incremento en la velocidad de producción de ERO (β1), para las concentraciones superiores a 50 µM; en todos los casos resultaron inferiores respecto al semen no suplementado (0µM). Tomando en consideración los resultados de producción promedio de ERO, el porcentaje de inhibición de la producción total de ERO (%INH)(Figs. 1, 2, 3) y la velocidad de producción de ERO con cada antioxidante (Tabla 1), se definieron las concentraciones de suplementación antioxidante posdescongelación de la siguiente manera: L-ergotioneina 150 µM, quercetina 150 µM y pentoxifilina 3 mM. Los resultados de la evaluación de la movilidad y cinética espermática entre los tratamientos de suplementación antioxidante del semen, a las 0, 6, 12 y 24 horas posdescongelación, se presentan en la Tabla 2. Para las variables asociadas con la integridad y la funcionalidad de la membrana plasmática (VE e IM), así como con la actividad mitocondrial (PMM), no se encontraron diferencias estadísticas (p>0,05) entre el control y los tratamientos con antioxidantes en los tiempos de evaluación (0, 6, 12 y 24 horas) (Fig. 4). Se observó una tendencia de reducción de estos mismos parámetros con el avance del tiempo de refrigeración. De otro lado, tampoco se observaron diferencias estadísticas (p>0,05) en los niveles de peroxidación lipídica del semen suplementado con antioxidantes a las 0 y 24 horas de refrigeración; sin embargo, se observó un promedio de PL menor a las 24 horas para los tratamientos con antioxidantes respecto al control, así como mayores valores de PL a las 24 horas, respecto a las 0 horas, para todos los tratamientos (Fig. 5). DISCUSIÓN En las células espermáticas el estrés oxidativo promueve daños estructurales, cambios en la fluidez de la membrana y alteración de la actividad enzimática, lo cual se ve reflejado en la reducción de su movilidad, viabilidad y capacidad fecundante (11).En un esfuerzo por mitigar tales alteraciones, durante la criopreservación del semen equino se han evaluado diversos suplementos con propiedades antioxidantes (5, 24). Sin embargo, se conoce que la acumulación en el semen de subproductos metabólicos, como ERO y aldehídos lipídicos citotóxicos, comienza antes de la congelación (1) y se incrementa durante el periodo posdescongelación, a causa de la presencia de una mayor cantidad de células apoptóticas, las cuales son conocidas por su alta capacidad de generación de ERO (25, 26). De manera que los esfuerzos para la reducción del estrés oxidativo en el periodo posdescongelación cobran importancia, más aún cuando se requiere semen viable y funcional para la inseminación artificial con semen criopreservado, técnica que se ha establecido por su importante papel para el uso de sementales superiores en los programas de cría (27). En esta investigación se observó que la adición posdescongelación de quercetina, L-ergotioneina y pentoxifilina produjo en diferentes magnitudes, según la concentración empleada, una reducción de la producción de ERO en el semen equino. Lo cual corrobora la actividad antioxidante atribuida a estas moléculas y que se fundamenta para la quercetina en su capacidad para suprimir la formación de superóxido, quelatos de hierro e inhibir la formación de radicales peroxi-lípidos (28); así como para la L-ergotioneina, en su capacidad para neutralizar radicales hidroxilo y peroxilo (29, 30) y para la pentoxifilina, en su capacidad de inhibir la generación de anión superóxido (14). La quercetina y la pentoxifilina produjeron una reducción creciente de la producción de ERO, con el incremento de la concentración de antioxidante empleada (Tablas 1 y 2), con lo cual podría esperarse, incluso, una mayor reducción de ERO con el uso de concentraciones superiores a las evaluadas. Estos resultados son concordantes con lo observado por Yildiz et al. (12), quienes reportaron el incremento de la capacidad antioxidante del semen de carnero por efecto de la L-ergotioneina. De otro lado, la L-ergotioneina presentó una menor reducción de la producción ERO para las mayores concentraciones evaluadas. Sin embargo, en todos los casos se halló una reducción de la producción promedio de ERO y capacidad de inhibición de la producción total de ERO (%INH) respecto a las muestras no suplementadas (Fig. 1, 2 y 3), así como una reducción de la velocidad de producción de ERO (Tabla 1). De acuerdo con Irwin y Halliweil (10) y tal como se observó en este estudio, la L-ergotioneina ha demostrado tener una amplia capacidad antioxidante. La evaluación de los diferentes parámetros seminales posdescongelación mostró un descenso de la movilidad y cinética espermática en el tiempo (Tabla 2). Para la MT no se encontraron diferencias entre los tratamientos a las 0, 6 y 12 horas posdescongelación (p>0,05), mientras que a las 24 horas los resultados para la pentoxifilina fueron inferiores respecto a los demás tratamientos (p<0,05). Para la MP se encontraron mejores resultados por efecto de la L-ergotioneina respecto al control, a las 0 y 6 horas posdescongelación (p<0,05); sin embargo, la quercetina, bajo las mismas condiciones, presentó a las 6 horas una MP superior al control (p<0,05). Los resultados de otros investigadores han demostrado un efecto favorable de la L-ergotioneina y la quercetina sobre la movilidad del semen equino cuando se suplementa durante la congelación (9, 13). Para el caso de la L-ergotioneina, este efecto se ha atribuido a su capacidad de proteger los espermatozoides de sustancias químicas oxidadas y peroxidadas (31). Sin embargo, en periodos superiores de exposición (12 y 24 horas), no se observó un efecto benéfico de los antioxidantes empleados (p>0,05). A pesar que la pentoxifilina se ha descrito como un activador de la movilidad espermática, debido a su acción de inhibición de la fosfodiesterasa del grupo de las metilxantinas (14), en esta investigación no se observó dicho efecto, por el contrario, se encontró una MP inferior a las 24 horas posdescongelación (p<0,05). Es probable que, debido a los tiempos en que se evaluó la movilidad (0, 6, 12 y 24 horas), no se haya evidenciado un incremento en este parámetro por efecto de la pentoxifilina, pero sí el posible agotamiento temprano de las reservas energéticas necesarias para la movilidad espermática. Stephens et al. (6) observaron un efecto positivo sobre la movilidad total y progresiva por la adición posdescongelación de pentoxifilina, en semen equino previamente congelado. Sin embargo, en dicho estudio el periodo de evaluación, después de la adición de la molécula, comprendió los 0, 10, 20 y 30 minutos y cada 30 minutos hasta la reducción al 10% de la MT, lo cual sucedió a los 150 minutos aproximadamente. En la presente investigación, a las 6, 12 y 24 horas posdescongelación, el semen suplementado con la pentoxifilina aún alcanzaba valores de MT del 66,3%, 58,0% y 47,1%, respectivamente (Tabla 2). En el análisis de la cinética espermática se observó, para la L-ergotioneina, un valor de VAP superior a las 0 a 6 horas posdescongelación respecto al control (p<0,05); así como un efecto equivalente por la quercetinaa las 6 horas posdescongelación (Tabla 2). De igual forma, para la VCL se encontraron medias superiores para quercetina y L-ergotioneina, a las 6 horas y las 6 y 12 horas de posdescongelación, respectivamente (p<0,05). Coyan et al. (32) reportaron que la suplementación de los diluyentes para semen de carnero con diferentes concentraciones de L-ergotioneina produce un incremento en los valores de VSL, VCL y VAP. En la presente investigación, la suplementación con pentoxifilina produjo una reducción en la cinética espermática a las 24 horas posdescongelación (p<0,05) (Tabla 3). Para la integridad estructural (VE) y funcional (IM) de la membrana plasmática se observó una baja reducción después de las 24 horas de almacenamiento posdescongelación. De igual forma, el potencial de membrana mitocondrial sufrió una disminución máxima cercana al 10% en este mismo periodo (Figura 2). De acuerdo a lo anterior, podrían considerarse como menores los niveles de alteración espermática en el periodo de almacenamiento en refrigeración, razón por la cual los antioxidantes suplementados podrían haber carecido de un evidente efecto protector para los mencionados parámetros respecto al tratamiento control (p>0,05). Investigadores reportan que la mitocondria y la membrana plasmática se consideran como blancos potenciales de la crioinjuria (25, 26). De acuerdo con Moazamian et al. (33), una de las características clave de los espermatozoides oxidativamente estresados es la inducción de un proceso de peroxidación lipídica, que resulta en la formación de aldehídos potencialmente capaces de interrumpir la función de los espermatozoides. Acorde con lo anterior, en esta investigación se observó un incremento de la peroxidación lipídica después de las 24 horas posdescongelación (Figura 3), que coincidió con la reducción de la mayoría de los parámetros espermáticos. Esto podría atribuirse a la suma del estrés oxidativo producto de la congelación y el posterior almacenamiento en refrigeración de los espermatozoides. Sin embargo, en estos casos la adición de los antioxidantes no produjo diferencia estadística en los niveles de peroxidación lipídica respecto al control sin antioxidante a las 0 y 24 horas (p<0,05). Otros investigadores reportan la reducción en la peroxidación de semen equino por la adición de quercetina (8) que, para el caso de esta investigación, presentó los menores valores promedio de PL entre todos los tratamientos (Figura 3). Se ha reportado, en semen de carnero, la capacidad de la L-ergotioneina para reducir la peroxidación lipídica (11, 12). Se concluye que la L-ergotioneina y la quercetina tienen un efecto favorable sobre la movilidad progresiva, la velocidad curvilínea y la velocidad media del semen equino cuando ambas moléculas son suplementadas posdescongelación. Dicho efecto se extiende entre las 6 y 12 horas posdescongelación en condiciones de almacenamiento en refrigeración. Bajo estas mismas condiciones, la pentoxifilina produce una reducción en la movilidad progresiva y la cinética espermática después de 24 horas posdescongelación.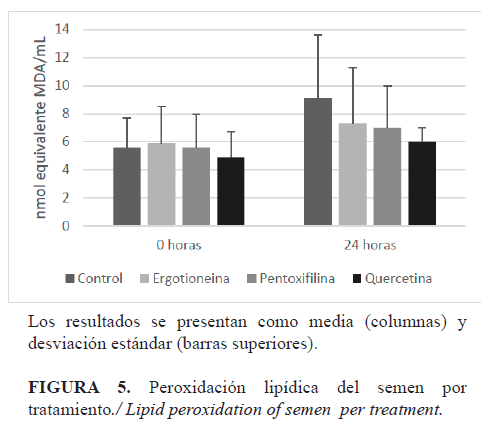
REFERENCIAS
1. Gibb Z, Aitken R. The impact of sperm metabolism during in vitro storage: The stallion as a model. Biomed Res Int. 2016;2016:1-8.
2. Lançoni R, Celeghini E, Bianchi-Alves M, Santos G, Florez-Rodriguez S, Leite T, et al. Use of melatonin and ferulic acid as promoters of cryopreserved equine sperm. Anim Reprod. 2015;12(3):559.
3. Barros L, Silva S, Almeida F, Silva E, Carneiro G, Guerra M. Effect of addition of acetyl-cysteine and glutathione peroxidase in freezing extender of stallion semen. J Equine Vet Sci. 2012;32:475-518.
4. Pizarro E, Restrepo G, Echeverry J, Rojano B. Efecto del plasma seminal sobre el estado redox del semen equino criopreservado. Rev MVZ Córdoba. 2013;18:3672-3680.
5. Martins H, Brito M, Sampaio I, Stahlberg R, Souza M, Penna C, et al. Effects of antioxidants lactoferrin and catalase on stallion frozen semen. Reprod Fert Develop. 2015;27(1):126-127.
6. Stephens T, Brooks R, Carrington J, Cheng L, Carrington A, PorrC,et al. Effects of pentoxifylline, caffeine, and taurine on post-thaw motility and longevity of equine frozen semen. J Equine Vet Sci. 2013;33(8):615-621.
7. Neuhauser S, Dörfel S, HandlerJ. Dose-dependent effects of homologous seminal plasma on motility and kinematic characteristics of post-thaw stallion epididymal spermatozoa. Andrology. 2015;3(3):536-543.
8. McNiven M, Richardson G. Effect of quercetin on capacitation status and lipid peroxidation of stallion spermatozoa. Cell Preserv Technol. 2006;4(3):169-177.
9. Gibb Z, Butler T, Morris L, Maxwell W, Grupen C. Quercetin improves the post thaw characteristics of cryopreserved sex-sorted and nonsorted stallion sperm. Theriogenology. 2013;79(6):1001-1009.
10. Irwin C, Halliweil B. Ergothioneine; antioxidant potential, physiological function and role in disease. BBA-Mol Basis Dis. 2012;1822(5):784-793.
11. Najafi A, Daghigh H, Mohammadi H, Najafi H, Zanganeh Z, Sharafi M, et al. Different concentrations of cysteamine and ergothioneine improve microscopic and oxidative parameters in ram semen frozen with a soybean lecithin extender. Cryobiology. 2014;69(1):68-73.
12. Yildiz S, Öztürkler Y, Ari U, Lehimcioğlu N, Atakişi E, Kulaksiz R. The effects of L-ergothioneine, N-acetylcystein and cystein on freezing of ram semen. Kafkas Univ Vet Fak Derg. 2015;21(1):81-86.
13. Metcalf E, Dideon B, Blehr R, Schlimgen T, Bertrand W, Varner D, et al. Effects of DMSO and L-Ergothioneine on post-thaw semen parameters in stallions: preliminary results. Anim Reprod Sci. 2008;107(1):332-333.
14. Blanes-Zamora R, Vaca-Sánchez R, González-Pérez J, Báez-Quintana D, Rodríguez-Díaz R, Bethencourt J. El uso de pentoxifilina mejora la movilidad espermática en los casos de microinyección espermática con biopsia testicular. Revista Internacional de Andrología. 2008;6(4):242-248.
15. Bustamante I, Pederzolli C, Sgaravatti A, Gregory R, Dutra C, et al. Skim milk-egg yolk based semen extender compensates for non-enzymatic antioxidant activity loss during equine semen cryopreservation. Anim Reprod. 2009;6(2):392-399.
16. Nouri H, Armin T, Zhandi M, Sadegui R. The effects of centrifuged egg yolk used with INRA plus soybean lecithin extender on semen quality to freeze miniature caspian horse semen. J Equine Vet Sci. 2013;33:1050-1053.
17. Aitken R, Smith T, Lord T, Kuczera L, Koppers A, Naumovski N, et al. On methods for the detection of reactive oxygen species generation by human spermatozoa: analysis of the cellular responses to catechol oestrogen, lipid aldehyde, menadioneandarachidonic acid. Andrology. 2013;1(2):192-205.
18. Rojano B, Gaviria C, Gil M, Saez J, Schinella G, Tournier H. Actividad antioxidante del isoespintanol en diferentes medios. Vitae. 2008;15(1):173-181.
19. Restrepo G, Ocampo D, Velásquez A. Evaluación de la movilidad del semen criopreservado de caballos criollos colombianos por un Sistema analizador de clase. Rev U.D.C.A. Act & Div Cient. 2013;16(2):445-450.
20. Gamboa S, Rodrigues A, Henriques L, Batista C, Ramalho-Santos J. Seasonal functional relevance of sperm characteristics in equine spermatozoa. Theriogenology. 2010;73(7):950-958.
21. Neild D, Chaves G, Flores M, Mora N, Beconi M, Agiiero A. Hypoosmotic test in equine spermatozoa. Theriogenology. 1999;51:721-727.
22. Love C, Thompson J, Brinsko S, Rigby S, Blanchard T, Lowry V.et al. Relationship between stallion sperm motility and viability as detected by two fluorescence staining techniques using flow cytometry. Theriogenology. 2003;60(6):1127-1138.
23. Morte M, Rodrigues A, Soares D, Rodrigues A, Gamboa S, Ramalho-Santos J. The quantification of lipid and protein oxidation in stallion spermatozoa and seminal plasma: Seasonal distinctions and correlations with DNA strand breaks, classical seminal parameters and stallion fertility. Anim Reprod Sci. 2008;106(1-2):36-47.
24. Cocchia N, Pasolinia M, Mancini R, Petrazzuolo O, Cristofaro I, Rospane I, et al. Effect of sod (superoxide dismutase) protein supplementation in semen extenders on motility, viability, acrosome status and ERK (extracellular signal-regulated kinase) protein phosphorylation of chilled stallion spermatozoa. Theriogenology. 2011;75:1201-1210.
25. Brum A, Sabeur K, Ball B. Apoptotic-like changes in equine spermatozoa separated by density-gradient centrifugation or after cryopreservation. Theriogenology. 2008;69(9):1041-1055.
26. Ortega-Ferrusola C, García B, Gallardo-Bolaños J, González-Fernández L, Rodríguez-Martínez H, Tapia J.et al. Apoptotic markers can be used to forecast the freeze ability of stallion spermatozoa. Anim Reprod Sci. 2009;114(4):393-403.
27. Ribeiro A, dos Santos R, Marques G, Gorzoni E, Aparecida L, Dell’Aqua J, et al. Fixed-time insemination with frozen semen in mares: is it suitable for poorly fertile stallions? Theriogenology. 2015;83:1389-1393.
28. Afanas’ev I, Dcrozhko A, Brodskii A, Kostyuk V, Potapovitch A. Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation. Biochem Pharmacol. 1989;38:1763-1769.
29. Akanmu D, Cecchini R, Aruoma O, Halliwell B. The antioxidant action of ergothioneine. Arch Biochem Biophys. 1991;288:10-16.
30. Asmus K, Bensasson R, Bernier J, Houssin R, Land E. One-electron oxidation of ergothioneine and analogues investigated by pulse radiolysis: redox reaction involving ergothioneine and vitamin C. Biochem J. 1996;315:625-629.
31. Mann T, Lutwak-Mann U. Male Reproductive Function and Semen. Berlin: Springer-Verlag; 1981.
32. Coyan K, Baspinar N, Numan M, Peker P. Effects of cysteine and ergothioneine on post-thawed Merino ram sperm and biochemical parameters. Cryobiology. 2011;63(1):1-6.
33. Moazamian R, Polhemus A, Connaughton H, Fraser B, Whiting S, Gharagozloo P, et al. Oxidative stress and human spermatozoa: diagnostic and functional significance of aldehydes generated as a result of lipid peroxidation. Mol Hum Reprod. 2015;21(6):512-515.
Recibido: 3/05/2016
Aceptado: 4/10/2016
Giovanni Restrepo Betancur, Universidad Nacional de Colombia. Email: grestre0@unal.edu.co














