Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión On-line ISSN 2224-4700
Rev Salud Anim. vol.39 no.3 La Habana set.-dic. 2017
ARTÍCULO ORIGINAL
Susceptibilidad antimicrobiana y formación de biopelícula en aislados de Escherichia coli procedentes de gallinas ponedoras
Antimicrobial susceptibility and biofilm formation in Escherichia coli isolates from laying hens
Rosa Elena Hernández-Fillor, Michel Báez-Arias, Pastor Alfonso-Zamora, Ivette Espinosa-Castaño*
Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba.
RESUMEN
Escherichia coli en la avicultura se asocia a procesos entéricos y respiratorios. Provoca importantes pérdidas debido a la disminución en la puesta y costos en medicamentos. Los genes que codifican para la resistencia en cepas de E. coli comensales o patógenas se pueden transferir a bacterias de importancia clínica en la salud humana a través de la cadena alimenticia. Además de la resistencia adquirida, la formación de biopelícula confiere a las cepas tolerancia a los antibióticos, lo cual contribuye a las recidivas de las infecciones. El presente trabajo tiene como objetivo determinar la susceptibilidad a los antibióticos de cepas de E. coli procedentes de gallinas ponedoras. Se colectaron 183 exudados cloacales de animales procedentes de cuatro unidades productivas en la provincia Mayabeque. Se identificaron 83 aislados como E. coli. Se determinó la susceptibilidad in vitro a diez antibióticos por el método de Difusión en Agar con discos y la capacidad de formar biopelícula por el método de adherencia en placa. Se determinó la Mínima Concentración Inhibitoria para el crecimiento planctónico (MCIP) y para la inhibición de la formación de biopelícula (MCIB). Los mayores porcentajes de resistencia por la prueba de difusión con discos fueron a Oxitetraciclina, Norfloxacina, Ticarcilina/Ácido Clavulánico, Cefoxitina y Ceftriazona; los menores porcentajes fueron a Gentamicina, Colistina y Nitrofurantoína. Del total de aislados de E. coli, solamente 14 % formaron biopelícula in vitro. La MCIB fue mayor que la MCIP, lo cual evidencia que la formación de biopelícula contribuye con la tolerancia a los antibióticos.
Palabras clave: biopelícula, Escherichia coli, gallinas ponedoras, resistencia antibiótica.
ABSTRACT
Escherichia coli is an important pathogen in poultry associated with enteric and respiratory processes, causing significant losses due to the decrease in the laying and costs in medicines. Plasmids and chemosomes encoding resistance mechanisms in E. coli commensal or pathogenic strains can be transferred to clinically important bacteria in human health through the food chain. In addition to the acquired resistance, the formation of biofilm gives the strains tolerance to antibiotics, which contributes to the recurrence of infections. The objective of this work is to determine the susceptibility to antibiotics of E. coli strains from laying hens. One hundred and eighty three sewage exudates were collected from four productive units in Mayabeque province. Eighty three isolates such as E. coli were identified. The susceptibility in vitro to ten antibiotics was determined by the Agar Diffusion Method and the ability to form biofilm by the Plate Adhesion Method. The Minimum Inhibitory Concentration for the planktonic growth (MICP) and for the inhibition of biofilm formation (MICB) was determined. The highest percentages of resistance by the disc diffusion test were to Oxytetracycline, Norfloxacin, Ticarcillin/Clavulanic Acid, Cefoxitin and Ceftriazone; and the lowest percentages to Gentamicin, Colistin and Nitrofurantoin. Of the total of E. coli isolates, only 14 % formed biofilm in vitro. MICB was higher than MICP, which shows that biofilm formation contributes to tolerance to antibiotics.
Key words: biofilm, Escherichia coli, laying hens, antibiotic resistance.
INTRODUCCIÓN
El amplio uso de compuestos antimicrobianos en la agricultura y en la salud humana, para tratar y prevenir enfermedades, ha traído como consecuencia la resistencia a múltiples familias de antibióticos en diversos géneros de bacterias, comúnmente aisladas de animales de consumo (1,2). Entre los mecanismos de resistencia a los antibióticos que presentan las bacterias, se encuentran la inactivación enzimática, las alteraciones en el sitio diana y las alteraciones de la permeabilidad (3). Otra expresión de resistencia en las bacterias es la capacidad de formar biopelícula, lo cual permite persistir en medios donde las condiciones son desfavorables para su crecimiento y resistir a la actividad de diferentes agentes, incluidos los antimicrobianos. Para algunas bacterias la estructura física de la biopelícula contribuye al fenotipo de resistencia y explica la cronicidad o recidiva de las infecciones (4,5), pues las bacterias en una biopelícula son más resistentes a los antibióticos y requieren concentraciones más altas de estos para inhibir su formación o erradicación (6).
Las pruebas convencionales para determinar la susceptibilidad antimicrobiana comprenden la Difusión en Agar sobre medios sólidos y la Mínima Concentración Inhibitoria (MCI) en cultivos líquidos, pero no tienen en cuenta el crecimiento en forma de biopelícula (7). En los últimos años se han descrito diferentes protocolos que simulan la formación de biopelícula in vitro y miden la actividad antimicrobiana en estas condiciones, y así es posible determinar la concentración óptima del antibiótico que actúa sobre esta forma de crecimiento bacteriano (8).
Escherichia coli es una de las especies predominantes de la microbiota normal del aparato digestivo de la mayor parte de los animales y del hombre (9). Las cepas patógenas de esta especie ocasionan graves pérdidas económicas a nivel mundial en la industria avícola (10) al provocar disminución en el peso en las aves, descenso en la producción de huevo, aumento en los índices de conversión, aumento de la mortalidad y elevados costos de los tratamientos (11). La presencia de cepas de E. coli, aisladas de aves, con fenotipos de resistencia a diferentes familias de fármacos se informa con frecuencia (12,13), así como la capacidad de formar biopelícula in vitro bajo determinadas condiciones (14). En Cuba, la enterobacteriosis se reporta como la segunda causa de focos y pérdidas en la avicultura (15).
En las últimas décadas constituye una prioridad a nivel mundial realizar estudios de resistencia antibiótica, tanto en cepas patógenas como comensales de esta especie, debido al peligro que pueden constituir para la salud humana (16), ya que estas son una fuente potencial de genes de resistencia que pueden transmitirse a los miembros de la microbiota intestinal del humano (1) a través de la cadena alimenticia (17). La Organización Mundial de la Salud (OMS) recomienda conocer los mecanismos de resistencia implicados, lo cual permitirá optimizar la vigilancia de la resistencia y las políticas de control y uso de antibióticos en cada país (18). Estos reportes temporales se deben comunicar a las autoridades pertinentes de salud veterinaria y humana con el fin de aplicar políticas adecuadas para el uso de los antimicrobianos, y así asegurar el enfoque de una sola salud.
El presente trabajo tiene como objetivo determinar los patrones de resistencia y la capacidad para la formación de biopelícula en aislados de E. coli procedentes de gallinas ponedoras en granjas de la provincia Mayabeque, Cuba.
MATERIALES Y MÉTODOS
Tamaño de la muestra
Para la toma de la muestra se siguieron las orientaciones establecidas en el Código Sanitario para los Animales Terrestres (19). Se seleccionó un tamaño de muestra de 96 animales, significativo para un nivel de confianza de 95 %, una precisión de 10 % y una prevalencia esperada de 50 %, según la fórmula:
![]()
Aislamiento de E. coli
Se colectaron 183 exudados cloacales en gallinas ponedoras con diarrea en cuatro unidades de crianza ubicadas en la provincia Mayabeque, durante los periodos abril-julio de 2013 y marzo de 2014.
Los exudados se sembraron en caldo Triptona Soya (BIOCEN) y se incubaron por dos horas a temperatura ambiente. Posteriormente se sembraron por agotamiento en Agar Mac Conkey (BIOCEN). Después de 24 horas de incubación se procedió a la selección de las colonias con características compatibles a E. coli: presencia de colonias rosadas en Mac Conkey y cocobacilos negativos en la tinción de Gram.
Identificación molecular de los aislados de E. coli
Para la extracción de ADN se partió de una colonia de los cultivos de 24 horas, la cual se colocó en 50 μL de agua libre de nucleasas (Promega), se hirvió a 100ºC por cinco minutos y se incubó inmediatamente a -20ºC durante 10 minutos para su lisis. A continuación, se centrifugó a 5000 g por 5 min; el sobrenadante se transfirió a un tubo y se conservó a -20 ºC. Se realizó la confirmación de especie por la Reacción en Cadena de la Polimerasa (PCR de sus siglas en inglés, Polymerase chain reacction). Los cebadores utilizados para la amplificación de un fragmento del ARNr 16S de E. coli fueron 5´-GCTTGACACTGAACATTGAG -3´ y 5´-GCACTTATCTCTTCCGCATT -3´ (20).
La mezcla de PCR se realizó en un volumen final de 25 μL: 1X de Green Master Mix (Promega), 0.8 µM de cada uno de los cebadores y 2 µL de ADN. Las condiciones de reacción fueron las siguientes: 40 ciclos: 94ºC por 30 segundos, 60ºC por 30 segundos y 72ºC por 60 segundos. Los ensayos se realizaron en un termociclador (Mastercycler). La visualización de los productos de PCR se efectuó en geles de agarosa (2 % en TBE 0.5X) con Bromuro de Etidium (1 mg/mL), en un transiluminador de luz ultravioleta (Pharmacia LKB). En cada visualización realizadas y se incluyeron dos réplicas del producto amplificado, se utilizó un marcador de peso molecular de 1 Kb (Promega) y se incluyó un control negativo.
Determinación de la capacidad de formación de biopelícula en aislados de E. coli
Se utilizó la metodología propuesta por Naves et al. (21) con modificaciones. Las cepas se cultivaron en placas de Agar Triptona Soya (BIOCEN), suplementado con 5 % de sangre de cordero, a 37ºC durante 24 horas. A partir de estos cultivos se inocularon cinco colonias en tubos con 5 mL de medio Luria Bertani (BIOLIFE) y se incubaron a 37ºC durante 24 horas. La concentración de los cultivos se ajustó a 1x108 UFC/mL (según datos de DO 620nm y conteo de UFC en placas). Los cultivos se realizaron en pocillos de placas de poliestireno de fondo plano (Falcon) no tratadas para cultivo celular, en medio Mínimo M63 suplementado con 8 g/L de glucosa y se incubaron en condiciones estáticas a 36ºC durante 24 horas. Pasado ese tiempo, se lavaron los pocillos con 150 µL de agua destilada y se secaron a 60ºC durante 30 minutos en el horno (Hotpack). La tinción de los pocillos se realizó con 130 µL de Cristal Violeta (Sigma) al 1 % durante 5 min y se retiró el colorante. Se lavaron los pocillos cuatro veces con 150 μL de agua destilada y se secaron una hora a temperatura ambiente. A continuación, se les añadió 130 µL de ácido acético (FLUKA) al 33 % y se midió la densidad óptica a una longitud de onda de 492 nm en lector de placas (SUMA, PR-621, Cuba). Como control negativo se utilizaron pocillos con medio M63. La clasificación de las cepas de E. coli, atendiendo a su capacidad de formación de biopelícula, se realizó según el criterio propuesto por Christensen et al. (22).
Determinación de la susceptibilidad in vitro a los antimicrobianos evaluados por el Método de Difusión en Agar con Discos
La evaluación de la susceptibilidad microbiana se realizó por el Método de Difusión en Agar con Discos, siguiendo las recomendaciones del Instituto de Estándares Clínicos y de Laboratorios (23), utilizando los siguientes discos de antibióticos (Oxoid): Norfloxacina (10 μg); Gentamicina (10 μg); Oxitetraciclina (30 μg); Cloranfenicol (30 μg); Colistina (10 μg); Neomicina (30 μg); Ceftriazon a (30 μg); Ticarcilina/Ácido clavulánico (85 μg); Cefoxitina (30 μg); Nitrofurantoína (100 μg). Para la clasificación de los aislados se utilizaron los valores de corte establecidos por el Comité Europeo para Pruebas de Susceptibilidad Antimicrobiana (24) para los antibióticos Oxitetraciclina, Colistina y Neomicina, mientras que para Ticarcilina/Ácido clavulánico, Cefoxitina, Gentamicina, Norfloxacina, Cloranfenicol, Ceftriazona y Nitrofurantoína se usaron criterios del Instituto de Estándares Clínicos y de Laboratorios (23). Se utilizó la cepa E. coli ATCC 25922 como control de la calidad de los discos con antibióticos.
Determinación de la Mínima Concentración Inhibitoria del crecimiento planctónico (MCIP) y del crecimiento en biopelícula (MCIB) a Ceftazidima
La Mínima Concentración Inhibitoria (MCI) necesaria para erradicar el 50 % del crecimiento planctónico y del crecimiento en biopelícula se determinó por el método de microdilución en caldo, según lo descrito por el Instituto de Estándares Clínicos y de Laboratorios (23). Se seleccionaron dos aislados fuertes formadores de biopelícula (EC25 y EC35). Se realizaron diluciones dobles de Ceftazidima (2 µg/mL– 64 µg/mL) en medio Mueller Hinton (BIOCEN) para determinar la MCIP y en medio M63 para determinar la MCIB de la formación de biopelícula. Cada pocillo se inoculó con 2,6 µL (equivalente a 1x105 UFC) de cultivo, para un volumen final de 130 µL. Como control positivo se utilizaron pocillos inoculados con células de cada aislado de E. coli en ausencia de Ceftazidima y, como control negativo, pocillos con Ceftazidima no inoculados. Las placas se incubaron a 37ºC por 24 horas y se determinó el crecimiento planctónico mediante la lectura a 620 nm; a continuación se realizó la tinción para determinar la formación de biopelícula como se describe anteriormente y se realizó la lectura a 492 nm en lector de placas (SUMA, PR-621, Cuba). Cada experimento se realizó en duplicado y se repitió dos veces independientemente. El porcentaje de inhibición del crecimiento y de la formación de biopelícula se determinó según la fórmula:
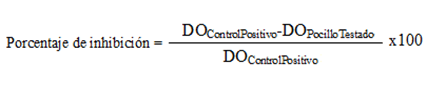
Análisis estadístico
Los experimentos para determinar la MCIP y MCIB de ceftazidima se realizaron por duplicado, para los cuales se calcularon los estadígrafos simples. Los porcentajes de inhibición se compararon mediante análisis de varianza simple y las medias se contrastaron según prueba LSD de Fisher con 95 % de confianza, para lo cual se empleó el paquete estadístico InfoStat (25).
RESULTADOS Y DISCUSIÓN
Del total de muestras analizadas, se identificaron 45,9 % como colonias presuntivas de E. coli, debido a sus características culturales y por la tinción de Gram. El 100 % de estos aislados formaron colonias rosadas en Agar Mac Conkey y la tinción de Gram reveló cocobacilos cortos Gram negativos. La amplificación de un fragmento de 662 pb como producto del PCR, correspondiente a la región 16S del ADNr en todos los aislados de E. coli, confirmó la identificación de esta especie (Figura 1).
Según Blanco et al. (26), E. coli se asocia a diarreas en las aves, signo clínico producido en la colibacilosis entérica. La diarrea es uno de los signos clínicos menos frecuentes en aves; sin embargo, cuando se presenta junto a lesiones en el intestino, se observa de forma severa acompañada de mucosidad (27). En esta especie la colibacilosis se considera extraintestinal, pues algunas cepas afectan el tracto respiratorio (28) y se ha propuesto para las mismas un origen fecal (29).
Evaluación de la susceptibilidad a los antibióticos por el Método de Difusión en Agar con Discos
No se encontró 100 % de sensibilidad a los antimicrobianos en estudio; sin embargo, todos los aislados fueron resistentes a Oxitetraciclina. La frecuencia de resistencia varió de 2 a 100 % frente a los antimicrobianos (Figura 2A).
Además de la Oxitetraciclina, los mayores porcentajes de resistencia encontrados entre las cepas de E. coli testadas fueron a los antibióticos Ticarcilina/Ácido clavulánico y Ceftriazona; mientras que los menores porcentajes de resistencia estuvieron asociados a Colistina y Nitrofurantoína (Figura 2). Del total de aislados analizados en este ensayo 93,33 % mostraron multirresistencia a los antimicrobianos evaluados.
El uso de antimicrobianos es irreemplazable en la terapéutica de las enfermedades bacterianas (30). Sin embargo, el uso excesivo y con frecuencia empírico de los antimicrobianos para el tratamiento de diferentes situaciones clínicas provoca la emergencia de microorganismos resistentes a estos compuestos (31,32,33). En el presente estudio los datos de la susceptibilidad microbiana mostraron alta resistencia a varios de los antimicrobianos comúnmente usados en Medicina Veterinaria y Humana (Figura 3). Estos datos coinciden con lo anteriormente reportado por autores que plantean una alta proporción de cepas de E. coli resistentes, tanto en aves como en humanos (34,35).
Para el caso de las tetraciclinas, específicamente la Oxitetraciclina, todas las cepas de E. coli evaluadas mostraron 100 % de resistencia, lo cual coincide con las altas frecuencias de resistencia encontradas por Alcaine et al. (36) y Rugumisa et al. (37). Las Tetraciclinas y Tylosina han sido los antibióticos más usados como promotores del crecimiento y terapéuticos en la producción animal a nivel mundial (38). De manera similar ha ocurrido en la industria avícola de Cuba, según el Instituto de Medicina Veterinaria (15). Estos datos alertan sobre la posibilidad de fracaso terapéutico de la Oxtetraciclina, cuya efectividad se debe estimar con anterioridad a su aplicación para garantizar una mayor eficacia del tratamiento y minimizar la presión selectiva sobre las bacterias.
El 51,1 % de los aislados de E. coli estudiados mostró resistencia frente a Norfloxacina, otro de los antimicrobianos de uso frecuente como terapéutico en la avicultura en Cuba (15). Yang et al. (39) encontraron porcentajes superiores de resistencias (entre 64 % y 95 %), mientras que Wang et al. (40) hallaron porcentajes de resistencia bajos, entre 9 % y 11 %. Rodriguez-Martinez et al. (41) plantean que, en las bacterias Gram negativas, la resistencia a quinolonas se produce, predominantemente, por mutaciones en genes cromosómicos que codifican para la enzima girasa, que garantiza la topología del ADN o debido a la disminución de la permeabilidad al compuesto. Sin embargo, desde 1998 se reportó la emergencia del plásmido MQR; sus productos proteicos protegen a las enzimas toposisomerasas de la acción del fármaco y provocan la extrusión del compuesto (42). La presencia de MQR podría indicar la emergencia y diseminación de este mecanismo de resistencia a quinolonas entre cepas de importancia clínica, por lo que la resistencia a este medicamento se debe continuar monitoreando.
La Gentamicina es un aminoglucósido que presenta gran actividad frente a bacterias Gram negativas. La resistencia encontrada a este antimicrobiano fue de 16 %; resultados similares a los obtenidos por Alcaine et al. (36), quienes encontraron bajos niveles de resistencia a Gentamicina (12 %) en pollos en mataderos de Albania; sin embargo, Wang et al. (40) reportaron altos niveles de resistencia, superiores a 53 %, en aislados de E. coli de casos de colibacilosis en pollos de engorde en China. Los resultados de este trabajo fueron superiores a los reportados por Abreu et al. (43) (6,8 %) en aislados de pollos de granjas avícolas en Tenerife.
En el estudio se incluyó también el Cloranfenicol, droga que posee actividad frente a microorganismos Gram negativos. Los bajos porcentajes encontrados pudieran sugerir su uso con buena eficacia. Sin embargo, su utilización ha disminuido a nivel mundial y está limitada a pollos de engorde y no en gallinas ponedoras, debido a su efecto residual en los huevos y a los daños adversos como mielosupresión en humanos (44).
La frecuencia de resistencia encontrada a la Colistina y la Nitrofurantoína fue baja. En 2009 la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) reconoció a la colistina como el único agente antimicrobiano autorizado en avicultura de puesta frente a E. coli (45), por ser el único antimicrobiano que presenta un periodo de retirada cero en huevos. Durante varios años los reportes de resistencia fueron muy bajos; Amaral et al. (46) encontraron solamente 0,4 % de resistencia a este fármaco, mientras Geornaras et al. (47) demostraron que el 100 % de los aislados clínicos estudiados presentaron perfiles de sensibilidad a la Colistina. Estos datos señalan la factibilidad del uso de este fármaco para el tratamiento de E. coli en aves. Sin embargo, recientemente se ha detectado el gen mcr-1 (Mobile Colistin Resistance) que confiere resistencia a Colistina/Polimixina y que se encuentra localizado en elementos genéticos móviles (plásmidos) (48), por lo que por primera vez las bacterias han adquirido la capacidad de compartir la resistencia a las polimixinas, extendiendo así la resistencia a otras cepas (49). El consumo intensivo de polimixinas en la crianza de animales para la producción de alimentos puede haber favorecido la aparición de este plásmido de resistencia a la Colistina (50). La Organización Panamericana de la Salud llamó a limitar el uso de Colistina en este ámbito al tratamiento de animales afectados clínicamente (49).
La Nitrofurantoína se utiliza específicamente para el tratamiento de las infecciones urinarias en humanos producidas por bacterias Gram negativas y por algunas Gram positivas. E. coli es de reconocida sensibilidad a este fármaco, y aunque se conoce su utilización en la avicultura en muchos países, en Cuba no se emplea en la avicultura (51).
La alta frecuencia encontrada de aislados resistentes a algunos antimicrobianos de uso en humanos, como Ticarcilina/Ácido Clavulánico y Ceftriazona, constituye una alerta, pues evidencian la necesidad de la vigilancia de este comportamiento y de profundizar en la identificación de la naturaleza de la resistencia. A partir de estas cepas podría ocurrir la transmisión de genes de resistencia, si estos estuviesen asociados a elementos transferibles, como pueden ser los plásmidos (52).
El huevo es el principal producto de consumo humano de la crianza avícola en Cuba a partir de aves. El mismo puede sufrir contaminación externa durante su paso por la cloaca, aunque las buenas prácticas de manejo de este alimento reducen el riesgo de toxiinfección alimentaria, si se lavan antes de romper la cáscara para cocerlos.
Ensayos para determinar la capacidad de formación de biopelícula
En las condiciones evaluadas, solamente 14,46 % de los aislados de E. coli resultó positivos para la formación de biopelícula in vitro. De ellos, según las categorías establecidas para la clasificación cuantitativa de formación de biopelícula, 2 (16,67 %) resultaron fuertes formadores y 10 (83,33 %) mostraron moderada formación de biopelícula.
Los resultados difieren con lo reportado por Reisner et al. (53), donde más del 75 % de los aislados de E. coli, tanto patógenos como comensales de origen fecal en aves, mostraron capacidad de formar biopelícula in vitro. Estos resultados confirman que la capacidad de formar biopelícula en E. coli es una característica intrínseca a cada cepa y en ensayos estáticos depende de la metodología empleada, en especial de las condiciones de cultivo (21), a las que responden los aislados de manera diferencial de acuerdo a sus características (54). Existen autores que describen gran capacidad de formar biopelícula para algunas cepas de E. coli en los medios ricos, como LB, pero no en medios mínimos sin ácidos y con glucosa o glicerol como fuente de carbono (54).
Efecto de la Ceftazidima sobre el crecimiento planctónico y sobre la formación de biopelícula
La MCIP de Ceftazidima requerida para lograr la inhibición del crecimiento planctónico en el 50 %, para dos cepas formadoras de biopelícula (EC25 y EC35), resultó menor a 2 µg/mL; mientras que la MICB de Ceftazidima, para inhibir la formación de biopelícula en 50 % para estas cepas, fue 16 µg/mL (Figura 3). Se encontraron diferencias estadísticamente significativas entre la MCIP y MICB para 95 % de confianza.
En cuanto a la MCI de Ceftazidima, para los aislados formadores de biopelícula se encontró que la misma fue mayor para inhibir el crecimiento en biopelícula (MCIB) que la concentración requerida para inhibir el crecimiento planctónico MCIP, asociando el modo de vida sésil al incremento en la resistencia antibiótica. Estos resultados coinciden con los reportados por Yonezawa et al. (55) para Helicobacter pylori. Según Costerton et al. (56), las células de la biopelícula pueden resultar entre 10 y 1000 veces más resistentes que las células planctónicas correspondientes a un gran número de antibióticos de amplio espectro (Ampicilina, Estreptomicina, Tetraciclina y Gentamicina). El aumento en la resistencia pudiera deberse a que en la biopelícula la penetración del antibiótico es restringida, debido a la matriz de exopolisacáridos y la emergencia de células persistentes (8,57).
A partir de estos resultados, se sugiere incorporar el crecimiento en biopelícula en los posteriores estudios para determinar la MCI de los antibióticos, si se tiene en cuenta que el 99 % de todas las células bacterianas existen en calidad de biopelícula, y tan solo 1 % vive en estado planctónico (58).
Las infecciones por E. coli y las manifestaciones clínicas provocadas por cepas virulentas son de considerable importancia en la avicultura y en la salud humana, atendiendo al potencial zoonótico de esta bacteria. Estos resultados demandan el estudio de alternativas terapéuticas y de prevención; además, sugieren cambios en la estrategia actual de tratamiento de E. coli, consistente con empleo de los antimicrobianos para los cuales se reveló baja frecuencia de resistencia, fundamentalmente la Gentamicina.
Un aspecto de gran interés sería dilucidar los mecanismos que soportan la resistencia encontrada. Estos eventos pueden ocurrir por mutaciones inducidas en presencia del fármaco o a través de vehículos genéticos móviles, como transposones o plásmidos, que pueden ser transferidos entre diferentes grupos de bacterias y constituyen el principal peligro de difusión (59). La evaluación de la susceptibilidad antimicrobiana no es un aspecto concluido, sino que requiere una vigilancia constante para la actualización de los datos. En estudios futuros sería conveniente incrementar el número de aislados de E. coli procedentes también de animales sanos, así como en otros niveles de la cadena avícola, como los mataderos, para comprender la magnitud del riesgo.
- Szmolka A, Nagy B. Multidrug resistant commensal Escherichia coli in animals and its impact for public health. Front Microbiol. 2013;4(258):1-13. doi: 10.3389/fmicb.2013.00258
- Chattopadhyay MK. Use of antibiotics as feed additives: a burning question. Front Microbiol. 2014;5(334):1-3. doi: 10.3389/fmicb.2014.00334
- Munita J, Arias C. Mechanisms of Antibiotic Resistance. En: Kudva I, Cornick N, Plummer P, et al. (Ed). Virulence Mechanisms of Bacterial Pathogens, 5ta Ed. Washington DC: ASM Press. 2016. 481-511. doi: 10.1128/microbiolspec.VMBF-0016-2015.
- Klinger-Strobel M, Lautenschläger C, Fischer D, Mainz JG, Bruns T, Tuchscherr L, et al. Aspects of pulmonary drug delivery strategies for infections in cystic fibrosis where do we stand? Expert Opin Drug Deliv. 2015;12:1351-1374.
- Li J, Xie S, Ahmed S, Wang F, Gu Y, Zhang C, et al. Antimicrobial Activity and Resistance: Influencing Factors. Front Pharmacol. 2017;8(364):1-11. doi: 10.3389/fphar.2017.00364
- Hall CW, Mah T-F. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria. FEMS Microbiol Rev. 2017;41(3):276-301.
- Balouiri M, Sadiki M, Ibnsouda SK. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 2016;6(2):71-79.
- Ciofu O, Rojo-Molinero E, Macià MD, Oliver A. Antibiotic treatment of biofilm infections. APMIS. 2017;125(4):304-319.
- Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, et al. Diversity of the human intestinal microbial flora. Science. 2005;308:1635–1638.
- Landman W, van Eck J. The incidence and economic impact of the Escherichia coli peritonitis syndrome in Dutch poultry farming. Avian Pathol. 2015;44(5):370-378.
- Tamayo M. La colibacilosis aviar y su repercusión en la avicultura. XXII Congreso Centroamericano y del Caribe en Avicultura en Panamá. 2012. [citado en Junio 2014]. Disponible en Internet: http://www.elsitioavicola.com
- Smet A, Martel A, Persoons D, Dewulf J, Heyndrickx M, Catry B, et al. Diversity of extended spectrum beta-lactamases and class C beta-lactamases among cloacal Escherichia coli isolates in Belgian broiler farms. Antimicrob Agents Chemother. 2008;52:1238-1243.
- Harisberger M, Gobeli S, Hoop R, Dewulf J, Perreten V, Regula G. Antimicrobial Resistance in Swiss Laying Hens, Prevalence and Risk Factors. Zoonoses Public Health. 2011;58(6):377-387.
- Olson ME, Ceri H, Morck DW, Buret AG, Read RR. Biofilm bacteria: formation and comparative susceptibility to antibiotics. Can J Vet Res. 2002;66:86-92.
- Instituto de Medicina Veterinaria. Listado Oficial de Productos Veterinarios Registrados. Cuarentena e inocuidad de los alimentos. Grupo de registro de productos de uso veterinario. 2014:1-123.
- Van Hoorebeke S, Van Immerseel F, Berge AC, Persoons D, Schulz J, Hartung J, et al. Antimicrobial resistance of Escherichia coli and Enterococcus faecalis in housed laying-hen flocks in Europe. Epidemiol Infect. 2010;139(10):1610-1620.
- Mihaiu L, Lapusan A, Tanasuica R, Sobolu R, Mihaiu R, Oniga O, et al.First report on the prevalence and antimicrobial susceptibility of Salmonella spp. isolates in retail meat products in Romania. J Infect Dev Ctries. 2014;8:50-58.
- Mosquito S, Ruiz J, Bauer JL, Ochoa TJ. Mecanismos moleculares de resistencia antibiótica en Escherichia coli asociadas a diarrea. Rev Peru Med Exp Salud Publica. 2011;28(4):648-656.
- Código Sanitario para los Animales Terrestres. Capítulo 6.7. -OIE Armonización de los programas nacionales de vigilancia y seguimiento de la resistencia a los agentes antimicrobianos. 2013. Disponible en Internet en: http://www.oie.int/doc/ged/D12823.PDF
- Chotar M, Vidova B, Godany A. Development of specific and rapid detection of bacterial pathogens in dairy products by PCR. Folia Microbiol. 2006;51: 639-646.
- Naves P, del Prado G, Huelves L, Gracia M, Ruiz V, Blanco J, et al.Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. J Appl Microbiol. 2008;105:585-590.
- Christensen GD, Simpson WA, Younger JA, Baddour LM, Barrett FF, Melton DM, et al. Adherence of cogulase negative Staphylococci to plastic tissue cultures: a quantitative model for the adherence of staphylococci to medical devices. J Clin Microbiol. 1985;22(6):996-1006.
- Instituto de Estándares Clínicos y de Laboratorios. Performance standards for antimicrobial susceptibility testing: 23th informational supplement, M100-S23. CLSI, Wayne, PA. 2013.
- Comité Europeo para Pruebas de Susceptibilidad Antimicrobiana. Breakpoint tables for interpretation of MICs and zone diameters. Version 4.0. 2014 [citado Junio 2014].
- Di Rienzo JA, Casanoves F, Balzarini MG, Gonzalez L, Tablada M, Robledo CW. InfoStat versión 2014. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
- Blanco J, Blanco M, Blanco JE, Mora A, Alonso MP, González EA, et al. Enterobacterias: características generales. Género Escherichia. En: Vadillo S, Piriz S, Mateos E. (Ed). Manual de Microbiología Veterinaria. España:McGraw-Hill Interamericana. 2002:301-325.
- Vandekerchove D, Herdt PD, Laevens H, Butaye P, Meulemans G, Pasmans F. Significance of interactions between Escherichia coli and respiratory pathogens inlayer hen flocks suffering from colibacillosis-associated mortality. Avian Pathol. 2004;33(3):298-302.
- Stordeura P, Marlier D, Blanco J, Oswald E, Biet F, Dho-Moulin M, et al. Examination of Escherichia coli from poultry for selected adhesin genes important in disease caused by mammalian pathogenic E. coli. Vet Microbiol. 2002;84:231-241.
- Barnes H, Nolan L, Vaillancourt JP. Colibacillosis. En: Saif Y. (Ed). Diseases of poultry. 12ª Ed. Iowa: Blackwell Publishing. 2008:691-732.
- Cheng G, Dai M, Ahmed S, Hao H, Wang X, Yuan Z. Antimicrobial drugs in fighting against antimicrobial resistance. Front Microbiol. 2016;7(470):1-11. doi: 10.3389/fmicb.2016.00470
- Wright GD. Antibiotic resistance in the environment: a link to the clinic? Curr Opin Microbiol. 2010;13:589–594.
- Yap PS, Yiap BC, Ping C, Lim SH. Essential oils, a new horizon in combating bacterial antibiotic resistance. Open Microbiol J. 2014;8:6-14.
- Mihaiu L, Lapusan A, Tanasuica R, Sobolu R, Mihaiu R, Oniga O, et al.First report on the prevalence and antimicrobial susceptibility of Salmonella spp. isolates in retail meat products in Romania. J Infect Dev Ctries. 2014;8:50-58.
- Torres C, Zarazaga M. BLEE en animales y su importancia en la transmisión a humanos. Enferm Infecc Microbiol Clin. 2007;25:29-37
- Johnson TJ, Logue CM, Johnson JR, Kuskowski MA, Sherwood JS, Barnes HJ, et al. Associations between multidrug resistance, plasmid content, and virulence potential among extraintestinal pathogenic and commensal Escherichia coli from humans and poultry. Foodborne Pathog Dis. 2012;9:37-46.
- Alcaine S, Molla L, Nugen S, Kruse H. Results of a pilot antibiotic resistance survey of Albanian poultry farms. J Glob Antimicrob Resist. 2016;4:60-64.
- Rugumisa BT, Call DR, Mwanyika GO, Mrutu RI, Luanda CM, Lyimo BM, et al. Prevalence of Antibiotic-Resistant Fecal Escherichia coli Isolates from Penned Broiler and Scavenging Local Chickens in Arusha, Tanzania. J Food Prot. 2016;79(8):1424-1429.
- Eager H, Swan G, van Vuuren M. A survey of antimicrobial usage in animals in South Africa with specific reference to food animals. J S Afr Vet Assoc. 2015;83: 16.
- Wang Y, Yi L, Wang Y, Wang Y, Cai Y, Zhao W, et al. Isolation, phylogenetic group, drug resistance, biofilm formation, and adherence genes of Escherichia coli from poultry in central China. Poult Sci. 2016;95(12):2895-2901.
- Rodríguez-Martínez JM, Cano ME, Calvo J, Hernández P, Martinez A, Martinez L. Plasmid-mediated quinolone resistance. En: Krcmery V. (Ed.). Resistance. London: Future Medicine Ltd; 2013.107-121.
- Hopkins KL, Davies, RH, Threlfall EJ. Mechanisms of quinolone resistance in Escherichia coli and Salmonella: recent developments. Int J Antimicrob Agents. 2005;25(5):358-373.
- Abreu R, Castro-Hernández B, Madueño A, Espigares-Rodríguez E, Moreno-Roldán E, Moreno P. Cepas de E. coli productoras de betalactamasas (BLEE) aisladas en pollos en Tenerife (España). Hig Sanid Ambient. 2013;13(4):1091-1096.
- Li XS, Wang GQ, Du XD, Cui BA, Zhang SM, Shen JZ. Antimicrobial susceptibility and molecular detection of chloramphenicol and florfenicol resistance among Escherichia coli isolates from diseased chickens. J Vet Sci. 2007;8(3):243-247.
- Gilbert M. Detección y caracterización de aislados de Escherichia coli de origen clínico y fecal en gallinas ponedoras [tesis]. Madrid: Universidad Complutense de Madrid. 2009. Disponible en Internet en: http://eprints.ucm.es/10514/
- Amaral A, Zakia Z, Bouzoubaa K. Antibioresistance of Escherichia coli strains isolated in Morocco from chickens with colibacilosis. Vet Microbiol. 1995;43:325-330.
- Geornaras L, Hastings JW, von Holy A. Genotypic analysis of Escherichia coli from strains poultry carcasses and their susceptibilities to antimicrobial agents. Appl Envirom Microbiol. 2001;67(4):1940-1944.
- Liu YY, Wang Y, Walsh TR, Yi LX, Zhang R, Spencer J, et al. Emergence of plasmid -mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis. 2016;16(2):161-168. doi: 10.1016/S1473-3099(15)00424-7
- Organización Panamericana de la Salud (OPS/OMS). Alerta epidemiológica: Enterobacterias con resistencia transferible a colistina. Implicaciones para la salud pública en las Américas. 2016. [citado 7 de diciembre 2016]. Disponible en internet en:http://antimicrobianos.com.ar/ATB/wp-content/uploads/2016/06/Enterobacterias-con-resistencia-transferible-a-colistina.pdf
- Agencia Europea de Medicamentos. Use of colistin-containing products within the European Union: development of resistance in animals and possible impact on human and animal health. 2013. [citado 7 de diciembre 2016]. Disponible en internet en:http://www.ema.europa.eu/docs/en_GB/document_library/Report/2013/07/WC500146813.pdf
- Gupta K, Hooton TM, Roberts PL, Stamm WE. Short-course nitrofurantoin for the treatment of acute uncomplicated cystitis in women. Arch Intern Med. 2007;167(20):2207-2212.
- Alonso CA, Zarazaga M, Ben Sallem R, Jouini A, Ben Slama K, Torres C. Antibiotic resistance in Escherichia coli in husbandry animals: the African perspective. Lett Appl Microbiol. 2017;64(5):318-334.
- Reisner A, Krogfelt KA, Klein BM, Zechner EL, Molin S. In vivo biofilm formation of commensal and pathogenic Escherichia coli strains: Impact of environmental and genetic factors. J Bacteriol. 2006;188:3572-3581.
- Pratt LA, Kolter R. Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type I pili. Mol Microbiol. 1998;30(2):285-293.
- Yonezawa H, Osaki T, Kamiya S. Biofilm formation by Helicobacter pylori and its involvement for antibiotic resistance. Biomed Res Int. 2015;2015:914791:1-9. doi: 10.1155/2015/914791
- Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science. 1999;284:318–322.
- Penesyan A, Gillings M, Paulsen IT. Antibiotic discovery: combatting bacterial resistance in cells and in biofilm communities. Molecules. 2015;20:5286–5298.
- Ramadan HH. Chronic rhinosinusitis and bacterial biofilms. Curr Opin Otolaryngol Head Neck Surg. 2006;14(3):183-186.
- Soto SM. Role of efflux pumps in the antibiotic resistance of bacteria embedded in a biofilm. Virulence. 2013;4(3):223-229.
Recibido: 20/8/2017
Aceptado: 1/11/2017
* Autor para correspondencia: Ivette Espinosa-Castaño. E-mail: espinosa@censa.edu.cu














