INTRODUCCIÓN
El desarrollo de la microbiota gastrointestinal es un proceso que empieza después del nacimiento de los seres vivos (1). En los animales terrestres, la fuente inicial de la colonización bacteriana es la microbiota materna, mientras que, en los animales acuáticos, está determinada por el entorno al contacto con el agua circundante; se considera autóctona o nativa cuando los microorganismos son capaces de colonizar la superficie epitelial del intestino del hospedero, y alóctona o transitoria cuando los microorganismos presentes en el medio circundante no logran permanecer dentro del intestino (2).
Inicialmente, el intestino de los peces es colonizado por bacterias anaerobias facultativas que van a predominar y, posteriormente, la variación poblacional dependerá del tipo de dieta ingerida, la secreción hormonal, la absorción de nutrientes, la acción y aparición de proteínas, la presencia de enzimas digestivas, la edad, la ubicación geográfica, los medicamentos utilizados y el estado general del organismo cultivado, razón por la cual es importante el conocimiento y la composición de esta (3).
Con respecto a los peces dulces acuícolas, su tracto gastrointestinal se caracteriza por ser un nicho ecológico que favorece el desarrollo de grandes comunidades microbianas, tanto poblaciones de microorganismos benéficos como de patógenos; las que más abundan son las que habitan en el medio que los rodea (4). Sin embargo, las variaciones de las comunidades que están en el medio ambiente influyen de manera determinante en los géneros y en las especies que se puedan encontrar en la microbiota intestinal.
Las principales bacterias colonizadoras son anaerobias, aerobias y anaerobias facultativas obligadas (5,6); albergan una estimación aproximada de 107 a 1011 bacterias/g de contenido intestinal (7) que comprenden los Phylum Proteobacteria, Fusobacteria, Firmicutes, Bacteroidetes, Actinobacteria, Clostridia, y Verrucomicrobia (5), de los cuales Proteobacteria, Firmicutes y Bacteroidetes representan hasta 90 % de la microbiota intestinal (7,8). Existen estudios microbiológicos del tracto gastrointestinal (TGI) de los peces que han evidenciado una gran variedad y diversidad de poblaciones bacterianas (4). En los peces de agua dulce los géneros dominantes corresponden a Aeromonas, Pseudomonas, Plesiomonas, Micrococcus, Acinetobacter, Clostridium y algunos géneros de la familia Enterobacteriaceae (5).
Esta microbiota juega un papel importante e influye de manera directa sobre la salud, la digestión, la nutrición, el crecimiento, la reproducción, la dinámica poblacional y la vulnerabilidad sobre las enfermedades de los peces (4,5), aspectos que influyen en gran medida en los organismos acuáticos cultivados bajo condiciones controladas. Por esta razón, se hace necesario realizar investigaciones que permitan comprender el comportamiento de esta microbiota en el sector acuícola.
En Colombia, el sector acuícola está representado por el cultivo de peces dulce acuícolas, como la tilapia, la trucha arco iris y las cachamas. La cachama blanca (Piaractus brachypomus) es una especie nativa de las cuencas de los ríos Orinoco y Amazonas (9), perteneciente a la familia Characidae, que se caracteriza por presentar aletas rojas, color plateado, es omnívoro, con un tamaño aproximado de 88 cm de longitud y 20 kg de peso, no presenta exigencias nutricionales, resiste bajas concentraciones de oxígeno, prolifera en aguas con temperaturas entre 23 y 27°C, con crecimiento rápido, es poco susceptible a adquirir enfermedades y su carne tiene buena aceptación (10); está ampliamente distribuida en América del Sur, en los países de Brasil, Argentina, Bolivia, Perú, Venezuela y Colombia (9). Es considerada la segunda especie de mayor potencial productivo y comercial en la piscicultura extensiva, semiintensiva e intensiva de aguas cálidas continentales de América tropical, debido a su resistencia en cautiverio y facilidad de cultivo en medios rústicos, se comporta dócil y se adapta a las condiciones limnológicas desfavorables por periodos no prolongados (11). El presente trabajo tuvo como objetivo caracterizar parte de la microbiota intestinal de la cachama blanca (Piaractus brachypomus).
MATERIALES Y MÉTODOS
Se tomaron 50 cachamas sin importar el sexo: 30 en la etapa juvenil, 10 adultos y 10 de engorde, provenientes del estanque de tierra de la piscícola La Palmera, ubicada en el municipio San Carlos, Antioquia, Colombia.
Se sacrificaron los peces, según el protocolo propuesto por Sherwin et al. (12); se extrajo el intestino completamente, se lavó con solución salina varias veces y luego se maceró y se homogeneizó toda la muestra para realizar los análisis microbiológicos.
Aislamiento y caracterización de las cepas
Se tomó 1 g de la muestra del intestino, se mezcló con 9 mL de agua peptonada al 0,1 % p/v en un tubo de ensayo y se realizaron diluciones hasta 103; de cada dilución se tomó 0,1 mL y se inocularon en los medios de cultivos selectivos y diferenciales: Agar Man Rogosa y SharpeMRS (Merck, 110660) más azul de anilina al 1 % p/v para Lactobacillus spp., agar M17 (Merck, 115108) para Lactococcus spp., agar MacConkey (Merck, 105465) para los géneros de la familia Enterobacteriacea y otros ,y en agar PlateCount PC (Merck, 105463) para bacilos esporulados, por el método de agotamiento en superficie. Para el aislamiento de los bacilos esporulados se procedió a calentar a 80°C por 10 minutos las respectivas diluciones, con el fin de destruir las células vegetativas y asegurar únicamente la presencia de estructuras de resistencia como las esporas. Todos los procedimientos se realizaron por duplicado.
Cada uno de los cultivos se incubaron de acuerdo a los requerimientos de cada microorganismo; en el caso de los géneros Lactobacillus y Lactococcus, en los medios de cultivo agar MRS y M17 a 37°C por 72 horas bajo condiciones de anaerobiosis generada mediante una cámara de anaerobiosis; para los miembros de la familia Enterobacteriaceae y los bacilos esporulados en los medios de cultivo MacConkey y agar PlateCount, respectivamente, a 37°C durante 24-48 horas en aerobiosis.
Se realizó el recuento de Unidades Formadoras de Colonias por gramo (UFC/g); se escogieron las diluciones donde se pudieron contar entre 30 y 300 colonias; estos datos se tabularon y promediaron para realizar el recuento de la microbiota intestinal para cada una de las etapas de desarrollo de la cachama blanca. Luego se caracterizaron morfológicamente las colonias y los microorganismos; a las colonias se les describió su textura, pigmentación, borde, elevación, tamaño y forma; los microorganismos se caracterizaron de acuerdo a su apariencia microscópica mediante la coloración de Gram. Se realizó la purificación de las colonias y se conservaron en caldo BHI más glicerol al 85 % v/v y se almacenaron a -80°C y a -20°C para futuros trabajos.
Los aislados provenientes del agar MacConkey se caracterizaron bioquímicamente en los siguientes medios de cultivos: Agar Hierro Triple Azúcar TSI (Merck, 103915), Agar Hierro Lisina LIA (Merck, 111640), Citrato (Merck, 102501), Urea (Merck, 108492) y Sulfuro-Indol-Movilidad SIM (Merck, 105470) y se identificaron por el sistema comercial API 20 E Biomeriux, Francia.
Análisis estadístico
La comparación del nivel mediano de microorganismos, entre cada uno de los tres grupos (juveniles, adultos y engorde), se realizó mediante un análisis de varianza no paramétrico de una vía (prueba de Kruskal-Wallis). Seguidamente, se realizaron comparaciones por pares entre las medianas de los diferentes grupos, mediante la prueba de Dunn.
Se realizó un análisis de escalamiento multidimensional o coordenadas principales para observar las similitudes y la agrupación de la microbiota intestinal de la cachama blanca en sus diferentes estadios de desarrollo. Se empleó el software estadístico R Studio (Vienna, Austria, https://www.R-project.org/.
RESULTADOS Y DISCUSIÓN
A partir de las muestras analizadas, se obtuvieron diferentes recuentos que variaron, principalmente, según la etapa de desarrollo de la cachama y del medio de cultivo utilizado. En la Figura 1 se muestran los resultados obtenidos a partir de los 50 especímenes del intestino de la cachama blanca. El recuento se grafica en Log UFC/g de cada uno de los grupos de microorganismos aislados.
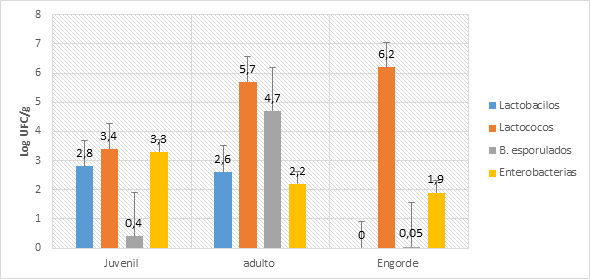
FIGURA 1 Recuento en logaritmo (UFC/g) de la microbiota intestinal de la cachama blanca durante sus estadios de desarrollo. / Count in logarithm (CFU/g) of the intestinal microbiota of the white cachama during its stages of development.
En la etapa juvenil se observaron los recuentos de lactococos con valores de 3,4; lactobacilos 2,8; bacilos esporulados 0,4 y Enterobacteriaceae 3,3. En la etapa adulta valores de 5,7 para lactococos; 2,6 lactobacilos; 4,7 bacilos esporulados; 2,2 para especies de la familia Enterobacteriaceae y, finalmente, en la etapa de engorde los recuentos fueron: 6,2 lactococos; 0 lactobacilos; 0,05 bacilos esporulados y 1,9 Enterobacteriaceae.
La Fig. 1 muestra que los valores de la concentración de las bacterias presentes en el intestino de la cachama blanca fluctúan en cada una de las etapas de desarrollo e indican que la mayor carga bacteriana de la microbiota intestinal se encontró en la etapa adulta con los mayores recuentos de cada uno de los grupos de microorganismos estudiados.
Es de resaltar que a nivel de cada grupo de microorganismos existen diferencias significativas (p<0,05) en cuanto al recuento por estadio. El grupo de lactococos presentaron diferencias significativas a nivel de juveniles-adultos y juveniles-engorde (Tabla 1), además de que estuvieron presentes en todas las etapas de desarrollo del pez con los mayores recuentos; mientras que los grupos de lactobacilos presentaron diferencias a nivel de adultos-engorde y juveniles-engorde y estuvieron ausentes en una etapa de desarrollo (Tabla 2). Los bacilos esporulados estuvieron ausentes en al menos una etapa del desarrollo, como se pudo observar en la etapa de engorde, y presentaron diferencias significativas en cuanto a adultos-engorde y juveniles-adultos (Tabla 3). Las Enterobacteriaceae estuvieron presentes en cada una de las etapas de desarrollo de forma estable y no presentaron diferencias significativas (p>0,05) a nivel de cada estadio (Tabla 4). Estas variaciones se pueden atribuir a que la presencia de bacterias en el intestino de los peces está dada por las condiciones presentes en el ambiente, la temperatura, el número de bacterias que haya en el agua, entre otras variables, como son las condiciones intrínsecas del pez (la dieta, el estado del desarrollo, la madurez, entre otras) (13).
Sin embargo, no se puede estipular qué factores determinaron la población microbiana presente en el intestino de la cachama, ya que la microbiota intestinal en los organismos acuáticos está dada por factores internos como la genética, el estadio del desarrollo, así como por factores externos como la temperatura y calidad del agua, además de las condiciones de manejo en los centros de cultivo. Todos estos y muchos más factores influyen de manera importante en la microbiota de los peces. Asimismo, se debe resaltar que en esta investigación no se realizó un análisis microbiológico del agua ni la selección del sexo de los animales, que son factores que también podrían ayudar a determinar el establecimiento de esta microbiota en la cachama.
TABLA 1 Resultados del ANOVA para lactococos. / ANOVA results for lactococcus.
| Kruskal-Wallis | ||
|---|---|---|
| p-value | 0,0005738 | |
| Estadios (Medianas) | Adultos | Engorde |
| Engorde | 2,000 | |
| Juveniles | 0,0114 * | 0,004* |
TABLA 2 Resultados del ANOVA para lactobacilos. / ANOVA results for lactobacilli
| Kruskal-Wallis | ||
|---|---|---|
| p-value | 0,003627 | |
| Estadios (Medianas) | Adultos | Engorde |
| Engorde | 0,0376* | |
| Juveniles | 2,000 | 0,003* |
TABLA 3 Resultados del ANOVA para bacilos esporulados. / ANOVA results for sporulated bacilli.
| Kruskal-Wallis | ||
|---|---|---|
| p-value | 3,44e-06 | |
| Estadios (Medianas) | Adultos | Engorde |
| Engorde | 0,000* | |
| Juveniles | 0,000 * | 1,979 |
TABLA 4 Resultados del ANOVA para Enterobacteriaceae / ANOVA results for Enterobacteriaceae.
| Kruskal-Wallis | ||
|---|---|---|
| p-value | 0,3822 | |
| Estadios (Medianas) | Adultos | Engorde |
| Engorde | 1,955 | |
| Juveniles | 0,5738 | 1,3124 |
En el intestino de la cachama blanca los recuentos bacterianos arrojaron resultados similares a los expuestos por diferentes autores (5,7,14), quienes reportaron que, en la microbiota intestinal de los peces, los Phylum más frecuentes son Firmicutes y Proteobacterias (hasta 90 % de esta), lo que confirma lo encontrado en la presente investigación, donde estos Phylum están presentes en mayor proporción en, al menos, una etapa de la vida del pez y muestra que los firmicutes (lactococos, lactobacilos y bacilos esporulados) abundan y las Proteobacteria (Enterobacteriaceae) se encuentran presentes en forma estable en cada uno de las etapas de desarrollo.
En la Fig. 2 se observa que, en cada etapa, hay cierta disimilitud y no existe una agrupación como tal, lo que quiere decir que las comunidades microbianas no comparten características semejantes entre sí (son diferentes) por la relación directa de la microbiota con la etapa de vida del pez; sin embargo, a nivel de juveniles y de engorde existe cierto grado de agrupación, lo que se puede atribuir a que los microorganismos comparten ciertas semejanzas o son los mismos, es decir, que se pueden encontrar en ambas etapas.
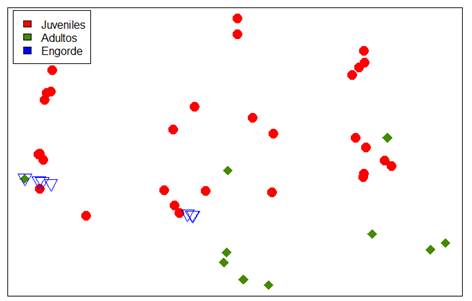
FIGURA 2 Matriz de coordenadas principales para el recuento de la microbiota intestinal de la cachama blanca en cada uno de sus estadios del desarrollo./ Matrix of the main coordinates for the count of the intestinal microbiota of the white cachama in each of its stages of development.
Aislamiento y caracterización de las cepas
Se obtuvieron 204 aislados bacterianos: 90 tenían una apariencia similar a cocos y a bacilos Gram positivos, provenientes de los medios de cultivo agar M17 y MRS, respectivamente; 60 fueron bacilos Gram positivos con presencia de esporas, aislados de agar PC, y 54 fueron bacilos o cocobacilos Gram negativos en el medio de cultivo agar MacConkey.
En la Figura 3 se observa que las colonias provenientes del medio de cultivo M17 tenían borde entero, eran lisas, convexas, con forma esférica u ovoide, estaban bien definidas y con tamaños variables y el comportamiento del microorganismo al microscopio: redondos con tendencia a agruparse en pares o en cadenas, Gram positivos. La Figura 4 hace referencia a las colonias y a los microorganismos aislados del medio de cultivo agar MRS. Las colonias se caracterizaron por ser de tamaño pequeño, con bordes definidos, forma redonda con ligera elevación convexa y una textura cremosa; los microorganismos en forma bacilar algunos de tamaño largo y otros más pequeños, aunque pudo observarse, con frecuencia, bacilos cortos o coco-bacilos, Gram positivos. En la Figura 5, las colonias correspondientes al medio de cultivo PC tenían un tamaño variado, de color blanquecinas, con bordes definidos e irregulares, convexas y planas; al microscopio eran de forma bacilar, formadores de esporas y Gram positivos.
En el medio de cultivo MacConkey, las colonias fueron circulares, convexas y elevadas, bordes enteros y lobulares, superficies y texturas planas y rugosas, consistencia cremosa, de aspecto uniforme; los microorganismos en forma de bastón, Gram negativos (Fig. 6).
A cada una de las colonias diferentes se les determinaron las características metabólicas en los medios de cultivo, agar TSI, LIA, SIM, Urea y Citrato. A partir de estas pruebas se obtuvieron ocho perfiles diferentes, los cuales se muestran en la Tabla 5.
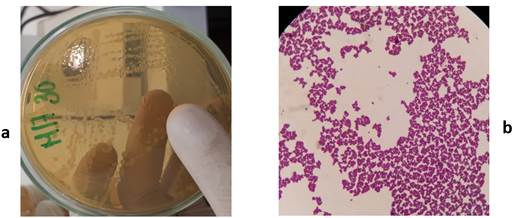
FIGURA 3 Características morfológicas de la colonia y tinción de Gram de las células microbianas correspondientes en el medio de cultivo M17. (a) colonia, (b) células microbianas. / Morphological characteristics of the colony and Gram staining of the corresponding microbial cells in the M17 culture medium. (a) colony, (b) microbial cells.

FIGURA 4 Características morfológicas de la colonia y tinción de Gram de las células microbianas correspondientes en el medio de cultivo MRS. (a) colonia, (b) células microbianas. / Morphological characteristics of the colony and Gram staining of the corresponding microbial cells in the MRS culture medium. (a) colony, (b) microbial cells.
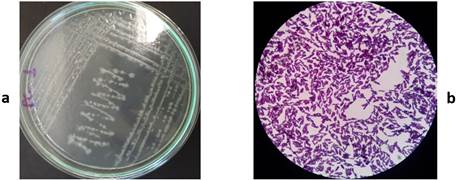
FIGURA 5 Características morfológicas de la colonia y tinción de Gram de las células microbianas correspondientes en el medio de cultivo PlateCount. (a) colonia, (b) microorganismo. / Morphological characteristics of the colony and Gram staining of the corresponding microbial cells in the PlateCount culture medium. (a) colony, (b) microorganism.
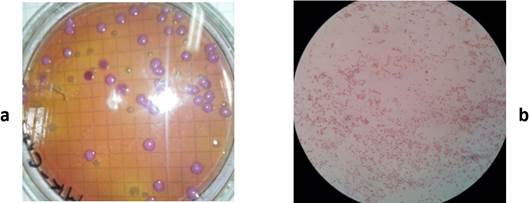
FIGURA 6 Características morfológicas de la colonia y del microorganismo en el medio de cultivo MacConkey. (a) colonia, (b) microorganismo. / Morphological characteristics of the colony and the microorganism in the MacConkey culture medium. (a) colony, (b) microorganism.
TABLA 5 Resultados de las pruebas bioquímicas de las colonias aisladas del agar MacConkey. / Results of the biochemical tests of the colonies isolated from MacConkey agar.
| Perfil | Citrato | Urea | TSI | SIM | LIA | ||
|---|---|---|---|---|---|---|---|
| Móvil. | Indol. | SH2 | |||||
| 1 | - | Débil | A/A | + | - | - | K/A |
| 2 | - | - | A/K | + | - | - | K/K + Ácido |
| 3 | + | + | A/A | + | - | - | K/K |
| 4 | + | - | K/K + Ácido + Gas | - | - | + | K/K + Ácido |
| 5 | - | + | K/K | + | - | - | K/K |
| 6 | + | + | K/A + Ácido + Gas | - | - | + | K/K + Ácido |
| 7 | + | + | K/K | + | - | - | K/K |
| 8 | + | - | K/K + Gas | + | - | - | K/K |
*A= Ácido *K= Alcalino
La Tabla 6 hace referencia a las características morfológicas de la colonia y de los microorganismos y su comportamiento en la tinción de Gram, de cada uno de los aislados que provenían del medio de cultivo agar MacConkey. Los aislados se nombraron de acuerdo con el medio de cultivo y con números consecutivos.
TABLA 6 Caracterización morfológica de las colonias y los microorganismos del medio de cultivo MacConkey. / Morphological characterization of colonies and microorganisms of the MacConkey culture medium.
| N° | Morfología | Gram | Elevación | Textura | Borde | Forma | Tamaño |
|---|---|---|---|---|---|---|---|
| MkJ3 | Bacilos | - | Convexa | Lisa | Irregular | Redonda | Mediana |
| MkJ4 | Bacilos | - | Elevada | Lisa | Definido | Redonda | Mediana |
| MkJ6 | Bacilos | - | Convexa | Lisa | Definido | Redonda | Pequeña |
| MkJ8 | Bacilos | - | Elevada | Lisa | Indefinido | Redonda | Pequeña |
| Mk28 | Bacilos | - | Convexa | Lisa | Definido | Redonda | Mediana |
| Mk32 | Bacilos | - | Convexa | Lisa | Definido | Redonda | Pequeña |
| MkW | Bacilos | - | Convexa | Mamelonada | Definido | Redonda | Mediana |
| Mk K | Bacilos | - | Convexa | Lisa | Definido | Redonda | Grande |
La identificación mediante el sistema API 20E (Biomeriux) comprobó que cuatro cepas correspondieron a las siguientes especies: Citrobacter brakii, Citrobacter youngae, Plesiomonas shigelloides y Enterobacter cloacae de la familia Enterobacteriaceae y cuatro a las especies Aeromonas hydrophila, Pseudomonas fluorescens, Pseudomona spp. y Acinetobacter baumanni, pertenecientes a las familias Aeromonadaceae, Pseudomonadaceae y Moraxellaceae, respectivamente.
Los resultados observados en los aislados de los medios de cultivo MRS y M17 concuerdan con lo descrito en el manual de Bergeys (15) para este tipo de microorganismo, que se caracterizan por ser bacilos o cocos Gram positivos, de color blanco cremoso, de forma redonda, puntiformes, con borde entero y superficie convexa.
Con relación al comportamiento de los bacilos esporulados, estos resultados concuerdan con lo reportado por otros autores (16,17) que observaron bacilos de tamaño variado, Gram positivos, aerobios estrictos o anaerobios facultativos, móviles por la presencia de flagelos laterales, catalasa positiva, con presencia de endosporas; características que concuerdan con el género Bacillus. Estos microorganismos producen, por lo general, colonias blanquecinas, grandes, extendidas e irregulares; están ampliamente distribuidos en la naturaleza, aunque algunos forman parte de la microbiota normal del intestino de los animales monogástricos, como los peces (15,17).
En el agar MacConkey, los resultados concuerdan con las características de los miembros de la familia Enterobacteriaceae, reportados por el manual de Bergeys (15), que describe bacilos Gram negativos, no formadores de esporas, fermentadores de glucosa, con capacidad de reducción de nitratos a nitritos y las especies móviles lo hacen por medio de flagelos peritricos, de igual manera, concuerdan con los expuestos por Madigan (18), sobre la caracterización de los géneros pertenecientes a las familias Enterobacteriaceae, Aeromonadaceae, Pseudomonadaceae y Moraxellaceae, que son microorganismos Gram negativos y forman parte de la microbiota intestinal de los animales acuáticos. Además, la caracterización metabólica mediante las pruebas bioquímicas, definen las propiedades que permiten afirmar que una cepa pertenece al grupo de las Enterobacteriaceae, porque todos los miembros fermentan la glucosa a ácido pirúvico por la vía Embden-Meyerhoff (glicolisis), fermentan la D-glucosa con producción de gas, reducen los nitritos a nitratos, tienen la capacidad de utilizar el citrato como única fuente de carbono, presentan las enzimas descarboxilasa y desaminasas y producen hidrógeno sulfurado.
Los resultados sobre la identificación de los miembros de la familia Enterobacteriaceae y otros géneros se corroboran con los expuestos por otros autores (19), quienes aislaron microorganismos anaerobios obligados y facultativos, aerobios estrictos del contenido intestinal de la trucha arco iris, del ayú, de la carpa común, la tilapia nilótica y la carpa dorada.
Igualmente, Sakata et al. (20) encontraron que en los peces de agua dulce, como la tilapia nilótica cultivada, la microbiota intestinal dominante eran los géneros Pseudomonas, Aeromonas y algunos especies de la familia Enterobacteraceae. Por otra parte, Belman (21) analizó la microbiota intestinal de la tilapia y encontró que las bacterias dominantes eran aerobias y anaerobias facultativas, de las familias Vibronacea y de Enterobacteriaceae (21). Igualmente, Lara-Flórez et al. (22) caracterizaron la microbiota intestinal de la tilapia cultivada en tanques de concreto y encontraron que los géneros más abundantes eran Pseudomonas, seguido de Vibrio y Citrobacter.
Cabe resaltar que estos microorganismos son considerados patógenos de peces y pueden ser un verdadero problema de salud pública, pues llegan a afectar también a los seres humanos. Dentro de este contexto, el género Aeromonas produce cuantiosas pérdidas económicas en los cultivos de los peces al provocar, principalmente, enfermedades septicémicas y ulcerativas.
La composición de la microbiota intestinal de los peces es más simple que la de los animales homeotermos (23), porque en los peces la microbiota intestinal no existe como una entidad propia, sino que es cambiante y está influenciada por el ambiente natural en el que se encuentran, a diferencia de lo que ocurre en el ser humano y otros animales terrestres (5,24). Esta variación de la microbiota intestinal de los peces, que están en sistemas de cría intensivos, se debe, principalmente, a la presencia de ambientes naturales y puede afectarse por varios factores como son los nutrientes, las técnicas de crianza y desinfección, así como el uso de antibióticos (25). Otro factor a tener en cuenta es que la composición de la microbiota nativa de las mucosas y de los epitelios intestinales de los peces depende de factores genéticos (26) y de las características fisicoquímicas del ecosistema donde viven (7).
Diferentes investigaciones en los peces (27,28) demuestran que las bacterias Gram negativas son las principales constituyentes de la microbiota intestinal (5,7,27,29) como en las levaduras (29,30). Algunas bacterias aerobias y anaerobias facultativas, como los géneros Acinetobacter, Alteromonas, Aeromonas, Flavobacterium, Micrococcus, Moraxella, Pseudomonas y Vibrio aisladas de la piel, de las branquias y del intestino, constituyen la microbiota endógena de una variedad de peces marinos (31), y su distribución depende básicamente de la salinidad del hábitat y de la carga microbiana del agua. La microbiota intestinal de peces de agua dulce está dominada, principalmente, por miembros de los géneros Aeromonas, Acinetobacter, Pseudomonas, Flavobacterium y representantes de la familia Enterobacteriaceae y anaerobios obligados de los géneros Bacteroides, Clostridium, Fusobacterium y Photobacterium (32). Los microorganismos que pueden multiplicarse en el intestino de los peces podrán mantenerse como colonizadores, mientras que el resto actuará o solo será parte de la microbiota transitoria.
Los resultados del aislamiento, la caracterización y la identificación de los aislados bacterianos de la cachama blanca, consignados en este estudio, constituyen el primer reporte de la microbiota intestinal de este pez en un sistema de cultivo.
CONCLUSIONES
Los resultados de esta investigación evidencian que en el intestino de la cachama blanca existen comunidades microbianas, pertenecientes a los Phylum Firmicutes en mayor proporción que de los Proteobacteria, además predominan los microorganismos patógenos u oportunistas de los peces como Pseudomonas y Aeromonas que podrían causar enfermedades. La cachama blanca tiene una microbiota que, como en la mayoría de los animales acuáticos, puede estar sujeta tanto a factores internos como externos.














