INTRODUCCIÓN
Tradicionalmente, en la coagulación enzimática de la leche para la elaboración de quesos se ha utilizado cuajo animal. Este cuajo está constituido, principalmente, por la quimosina, una enzima proteolítica que se extrae del cuarto estómago de los rumiantes jóvenes. La escasez de los abomasos de los rumiantes jóvenes y el aumento de los precios de las preparaciones enzimáticas permitieron el desarrollo de otras enzimas coagulantes (1).
Entre las enzimas más estudiadas se encuentran las de origen animal (pepsinas bovinas y porcinas), microbiano (proteasas fúngicas) y vegetal (proteasas de flores de Cynara cardunculus) (1). Estas enzimas son proteinasas ácidas y las secuencias de aminoácidos y las estructuras tridimensionales presentan una elevada homología estructural con la quimosina y se les denominan coagulantes lácteos (2).
Para la extracción enzimática en coagulantes de origen animal, la calidad microbiológica puede verse afectada, debido a la carga microbiana inicial de los estómagos. Para disminuir la presencia de microorganismos y garantizar la inocuidad del producto final, se deshidratan los estómagos con adición de sal y diferentes métodos de secado (3,4).
En Cuba, los productores de quesos frescos artesanales elaboran su coagulante por vía enzimática de manera artesanal. Una desventaja de los cuajos que elaboran los productores es la calidad microbiológica, esta afecta la inocuidad de los quesos que se elaboran (5). Con la obtención de una metodología para producir un coagulante lácteo a partir de estómago porcino, se tendría una materia prima para la elaboración de quesos artesanales con mejor calidad, por lo que el objetivo de esta investigación fue evaluar los parámetros físico-químicos y microbiológicos del coagulante lácteo obtenido a partir de estómagos de cerdos.
Para la extracción de enzimas se utilizaron estómagos de cerdos sanos de ambos sexos y de aproximadamente 25 kg de masa corporal, de la categoría preceba, de la raza Yorkland y sus cruces, y de 9 a 10 semanas de edad. El sistema de crianza empleado fue en Flat-Deck. Se procedió al lavado con abundante agua, se les retiró la grasa presente y se salaron por ambos lados con sal común (6,7). El secado se realizó bajo condiciones naturales, al sol (HR = 76±2 %; T = 30±3°C) y a la sombra (HR = 82±11 %; T = 22±4°C) (4,6).
El contenido de humedad de los estómagos de cerdos se determinó por el método descrito en la norma cubana (8), en días alternos hasta que los mismos presentaron un porcentaje de humedad por debajo de 25 %, equivalente a 0,33 g de agua/g materia seca. Los estómagos de cerdos deshidratados se cortaron en tiras y se rehidrataron en solución salina. Se realizaron tres extracciones de 48 h cada una y se reguló el pH a 4,5 con ácido acético (Merck) al 8 %. Se obtuvieron 15 mezclas enzimáticas, que se filtraron al vacío con bomba de agua y papel de filtro Sartorious (AG 37037) para obtener los coagulantes lácteos (9).
A los coagulantes se les determinó el pH por método potenciométrico (10) y la fuerza de cuajo se cuantificó mediante la adición de 1 mL del coagulante en 100 mL de leche (11). La fórmula empleada para el cálculo fue la propuesta por Spreer et al. (12):
Para los análisis microbiológicos se tomó 1 mL del coagulante lácteo obtenido, a los cuales se le adicionó 9 mL de solución salina peptonada y se homogenizaron en Stomacher Seward®. Las diluciones decimales seriadas (1:10) se utilizaron para los recuentos de microorganismos a 30°C en agar para conteo en placa (BIOCEN), acorde a la norma ISO 4833: 2011 (13); coliformes totales en agar violeta rojo bilis (BIOCEN) según ISO 4832: 2006 (14); Escherichia coli en agar TBX (Biolife Italiana) en correspondencia con ISO 16649: 2001 (15); Enterobacterias en agar violeta rojo bilis glucosa según ISO 21528-2: 2017 (Biolife Italiana) (16); Staphylococcus coagulasa positivo en agar Baird Parker acorde a ISO 6888-2: 2003 (Biolife Italiana) (17); hongos y levaduras en agar extracto de levadura dextrosa cloranfenicol acorde a ISO 21527-2: 2013 (18).
Para el análisis de los resultados se realizó un análisis de varianza simple (SC tipo III) y una dócima de comparación de rangos múltiples de Duncan (InfoStat, versión 2.0) (19).
Se observó que el contenido de agua por gramos de materia seca disminuyó en función del tiempo, para el secado de los estómagos de cerdos al sol y a la sombra (Figura 1).
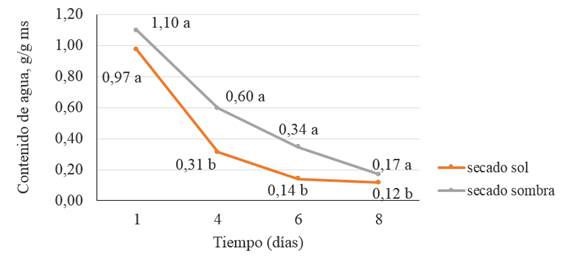 Letras diferentes indican diferencias significativasLeyenda: ms (materia seca)
Letras diferentes indican diferencias significativasLeyenda: ms (materia seca)Figura 1 Curva de secado natural para los estómagos de cerdos / Natural drying curve for pig stomachs
En el primer día, el contenido de agua de los estómagos para el secado al sol y a la sombra no presentaron diferencias significativas (p>0,05); sin embargo, para el caso de los días cuatro, seis y ocho, los valores del contenido de agua de los estómagos fueron estadísticamente diferentes (p<0,05) entre las variantes de secado. Entre los valores de humedad correspondientes al día seis y al día ocho de la variante al sol no existieron diferencias, por lo que el secado ocurre en seis días. No obstante, según criterio de Coronel et al. (4), con el valor medio de contenido de agua por gramos de materia seca obtenido en el día cuatro, los estómagos podían considerarse como secos. Para el caso de la variante a la sombra, siguiendo el mismo criterio, el tiempo de secado fue de ocho días. Estos resultados sugieren que la velocidad de secado para la variante al sol es mayor que la variante a la sombra.
El cloruro de sodio produjo un efecto deshidratador en los estómagos, lo cual evitó el deterioro del producto y previno la proliferación de los microorganismos (4,6). Por otra parte, Sheehan (20) y Cruz et al. (21) determinaron que la adición de sal incrementa la presión osmótica en la fase acuosa de los alimentos y causa la deshidratación de las bacterias. La deshidratación de los estómagos en este estudio contribuyó a disminuir la carga microbiana inicial. La introducción del método de secado de los estómagos de cerdo para la obtención del coagulante lácteo es una forma de garantizar su calidad e inocuidad.
En la Tabla 1 se muestran los resultados del pH y la fuerza de cuajo de las 15 corridas.
Tabla 1 Valores de pH y fuerza de cuajo de las 15 corridas del coagulante lácteo de estómago de cerdo/ Values of pH and rennet strength of the 15 runs of the rennet from pig
| Corridas | pH | Fuerza cuajo |
|---|---|---|
| 1 | 4,87 | 1: 4000 |
| 2 | 4,57 | 1: 4200 |
| 3 | 4,82 | 1: 4706 |
| 4 | 4,55 | 1: 840 |
| 5 | 4,44 | 1: 1388 |
| 6 | 4,79 | 1: 3250 |
| 7 | 4,80 | 1: 1600 |
| 8 | 4,51 | 1: 4210 |
| 9 | 4,73 | 1: 4389 |
| 10 | 4,53 | 1: 3200 |
| 11 | 4,49 | 1: 3200 |
| 12 | 4,53 | 1: 3200 |
| 13 | 4,59 | 1: 1860 |
| 14 | 4,61 | 1: 4250 |
| 15 | 4,90 | 1: 4137 |
Los valores obtenidos de pH se presentaron en el intervalo de 4,44 a 4,90. Estos resultados coinciden con el rango (4,5-5,5) establecido para los cuajos líquidos por Gorreta (22). Dobler et al. (23) reportaron que los estómagos de conejo contienen enzimas coagulantes que se pueden extraer con soluciones que contengan de 1 a 5 % de cloruro de sodio y pH 4.
Según Mahler y Cordes (24), la pepsina se desnaturaliza a valores de pH superiores a 5,0 y parte de la fuerza de coagulación se pierde. Los resultados obtenidos de pH evitan que ocurra la desnaturalización ácida de esta enzima e impiden la interacción electrostática que produce desnaturalización y provoca que las enzimas coagulantes pierdan su fuerza de coagulación (25).
La fuerza de cuajo se encontró en el intervalo de 1:840 a 1:4706 para las 15 corridas (Tabla 1). El valor máximo de fuerza de cuajo obtenido fue superior a lo reportado por Córdova y Paitan (26) y por Coronel et al. (4), quienes utilizaron estómagos de animales adultos. Este resultado puede atribuirse a que en esta investigación se emplearon estómagos de animales jóvenes. La fuerza de cuajo se ve afectada por la edad del animal, tipo de alimentación, métodos de extracción, manipulación y forma de conservación de los estómagos (25).
La media del conteo de microorganismos a 30°C de las 15 corridas fue de 2,05 ± 0,76 log ufc/mL (Figura 2). Se puede observar que para cada una de las corridas los resultados de este indicador fueron inferiores a 3,3 log ufc/mL. Palladino et al. (27), informaron recuentos superiores a 7,65 ± 0,34 log ufc/mL, en la elaboración de diferentes sueros coagulantes a partir de estómagos de cabra, cordero, oveja, chivito y chivo.
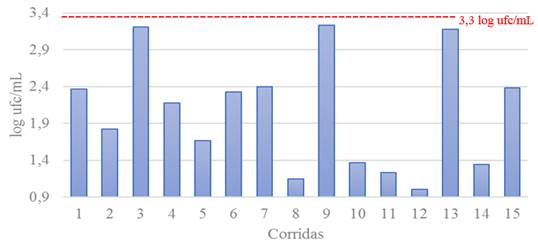
Figura 2 Conteo de microorganismos a 30°C posterior a la extracción final de enzimas por cada corrida/ Counting of microorganisms at 30 ° C after the final extraction of enzymes for each run.
Los conteos de coliformes totales, enterobacterias, hongos y levaduras fueron inferiores a 10 ufc/mL. No se detectó la presencia de Staphylococcus coagulasa positivo ni de Escherichia coli. Estos valores fueron inferiores a los obtenidos por Bonafede et al. (6) quienes, al emplear estómagos de cabritos deshidratados con sal para elaborar coagulante con solución salina, obtuvieron conteos de coliformes, enterobacterias y hongos y levaduras con valores de 4,8 log ufc/mL, 2,3 log ufc/mL y 4,2 log ufc/mL, respectivamente, resultados que fueron superiores a los obtenidos en este estudio.
El conteo de microorganismos a 30°C y coliformes totales obtenidos en este estudio está en correspondencia con lo que reportan varios autores para los coagulantes líquidos. Gorreta (22) refiere que el conteo de microorganismos aerobios mesófilos viables debe ser de 2x103 ufc/mL, mientras que el de coliformes totales debe estar ausente o como máximo en 102 ufc/mL.
Un estudio similar, realizado en el Instituto Nacional de Tecnología Industrial (INTI-Lácteos) de Argentina, reportó el recuento de microorganismos a 30°C con valores medios de 3,0 log ufc/mL, de enterobacterias, coliformes totales y Escherichia coli inferiores a 1 log ufc/mL así como de Staphylococcus coagulasa positivos, hongos y levaduras menores a 2 log ufc/mL (6). El conteo de los microorganismos indicadores de la calidad higiénico-sanitaria del coagulante obtenido en esta investigación fue inferior a los descritos por el Instituto Nacional de Tecnología Industrial.
La obtención de un coagulante lácteo a partir de estómago de cerdo brinda una alternativa para la mejora del proceso de producción de queso fresco artesanal, al comprobarse que los parámetros físico-químicos y microbiológicos se encuentran en correspondencia con lo establecido para coagulantes lácteos líquidos.














