INTRODUCCIÓN
Las plantas arvenses constituyen un grupo de plantas que pueden crecer y desarrollar asociadas a los cultivos y que afectan el rendimiento de los mismos. Estas plantas se consideran indeseables y se eliminan de las áreas de cultivo inmediatamente que los agricultores las detectan; sin embargo, tienen funciones ecológicas importantes dentro del agroecosistema, como servir de alimento y refugio a diversos polinizadores e insectos controladores de plagas. Varias de estas especies como el romerillo (Bidens pilosa L.), la celestina azul (Ageratum conyzoides L.), la lechosa (Euphorbia heterophylla L.) y el cundeamor (Momordica charantia L.), presentan diferentes usos etnobotánicos e históricamente se utilizan en el tratamiento de numerosas patologías (Espinosa-Moreno et al., 2016).
Estudios recientes avalan las propiedades antimicrobianas de estas especies frente a microorganismos patógenos como Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa y Candida albicans, que afectan a humanos y a animales de interés zootécnico (Cervantes et al., 2017). Numerosas investigaciones se enfocan en la búsqueda de nuevos fármacos de origen botánico con actividad antibacteriana, ya que la resistencia de microorganismos patógenos a antibióticos convencionales, constituye una de las problemáticas más importantes que enfrenta la humanidad (Stefani et al., 2020).
En otros estudios científicos se les atribuyen propiedades plaguicidas a estas especies arvenses, ya que presentan potencialidades para el desarrollo de productos botánicos que controlan plagas de diferentes cultivos agrícolas como Phytophthora infestans (Mont.) (León et al., 2013), Leucoptera coffeella (Lyonetiidae), Macrosiphum rosae (Aphididae) y Solenopsis invicta (Hymenoptera) (Silva et al., 2014). Estas actividades biológicas se relacionan con la presencia de metabolitos secundarios como los flavonoides, los taninos, las saponinas y los terpenoides, los cuales se consideran sustancias con diversas propiedades como antioxidantes, antimicrobianas, anticancerígenas, entre otras (Ojezele et al., 2016; Yi et al., 2016).
El perfil fitoquímico de las plantas depende de varios factores como el genotipo, el órgano, la edad fisiológica, el momento de colecta, diversos factores ambientales y la interacción genotipo-ambiente (Cervantes et al., 2017). Por estas razones, es importante el estudio de la flora local para la búsqueda de fuentes de compuestos bioactivos con propiedades biológicas, que permitan el desarrollo de la industria biofarmacéutica y del sector agropecuario. El objetivo del presente trabajo fue determinar las características fitoquímicas y antibacterianas de extractos de hojas de cinco especies arvenses, presentes en la flora matancera.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas de E. heterophylla, M. charantia, Bidens pilosa L., A. conyzoides y Blechum brownei Jess., presentes en la finca “Mery” perteneciente a la localidad de Coliseo, municipio Jovellanos, provincia de Matanzas, Cuba. La identificación taxonómica de las especies se realizó por especialistas del Jardín Botánico de Matanzas, a partir del análisis de los caracteres morfológicos in situ y la comparación con muestras presentes en el herbario de dicha entidad. La colecta se realizó en marzo de 2018 entre 7:00 y 9:00 am. Se seleccionaron plantas adultas que no presentaban síntomas de enfermedades o el ataque de plagas. Los ejemplares de E. heterophylla, B. pilosa y A. conyzoides, se encontraban en la etapa reproductiva; mientras que M. charantia y B. brownei estaban en la fase vegetativa en el momento de la colecta.
Preparación de los extractos
Las hojas colectadas se lavaron con agua destilada para eliminar el polvo y posteriormente se procedió al secado en una estufa (Boxun) a 45 °C por 96 h. Las hojas secas se trituraron en un molino eléctrico hasta obtener un polvo con partículas inferiores a 0,2 mm (Niranjan et al., 2013).
Se realizaron extractos etanólicos y acuosos por separado. Para cada extracto se mezclaron 100 g de polvo de las hojas secas con 1 L de cada solvente (etanol 90 % v/v o agua) en frascos ámbar, y se colocaron en agitación sobre una zaranda orbital (HDL® Apparattus) a 160 rpm por 24 h. Transcurrido este tiempo las muestras se filtraron con tres capas de papel de filtro (Whatmann No. 1) y se colectaron los extractos. Se volvió a adicionar 1 L de ambos solventes a la fracción sólida y se procedió de manera similar a la extracción y filtración de los extractos. Posteriormente se eliminaron los solventes de los extractos con ayuda de un rotovaporador y se secaron a temperatura ambiente. Las muestras se conservaron a 4 °C para los ensayos fitoquímicos y microbiológicos.
Tamizaje fitoquímico
Se determinó la presencia de flavonoides, terpenoides, antocianinas, taninos, antraquinonas, glucósidos cardiotónicos, flobataninos, esteroides y cumarinas según la metodología descrita por Chigodi et al. (2013). La abundancia relativa de los tipos de metabolitos se determinó de manera cualitativa a través del sistema no paramétrico de cruces (MINSAP, 1997). Presencia: abundante (+++), moderado (++), bajo (++) y ausencia (-).
Cuantificación de azúcares reductores
El contenido de azúcares reductores se determinó por el método del ácido dinitrosalisílico y se empleó la D-glucosa (Sigma) como azúcar patrón (0,1-1,0 mg mL-1). La absorbancia de las muestras se midió en un espectrofotómetro Ultrospect 2000 (Pharmacia Biotech, Suecia) a una longitud de onda de 456 nm.
Cuantificación de carbohidratos solubles totales
El contenido de carbohidratos en las muestras se determinó colorimétricamente mediante el método del fenol-sulfúrico (Dubois et al., 1956), con el empleo de D-glucosa (0,01-0,08 mg mL-1) como azúcar patrón. Las muestras se leyeron a una longitud de onda de 490 nm, con el uso de un espectrofotómetro Ultrospect 2000 (Pharmacia Biotech, Suecia).
Contenido de proteínas solubles totales
El contenido proteico se determinó colorimétricamente mediante el método descrito por Lowry et al. (1951) con el uso de albúmina de suero bovino como sustancia patrón (0,1-0,7 mg mL-1). Los valores de absorbancia se obtuvieron en un espectrofotómetro a una longitud de onda de 750 nm y las concentraciones (mg mL-1) se determinaron mediante la curva patrón.
Determinación de polifenoles totales
La cuantificación de polifenoles se realizó en espectrofotómetro según procedimiento de Friend (1992), con el uso del reactivo de Folin-Ciocalteu. Las absorbancias se midieron a una longitud de onda de 725 nm y el contenido de compuestos fenólicos se expresó en mg de fenoles por g de masa seca (mg g-1 de MS), referidos a una curva patrón de ácido clorogénico.
Actividad antibacteriana
Se evaluó la actividad antibacteriana “in vitro” de los extractos etanólicos frente a la bacteria Gram positiva Staphylococcus aureus ATCC 25923 y las bacterias Gram negativas Escherichia coli ATCC 25922 y Proteus sp. El ensayo se realizó con el uso del método de difusión en pocillos.
Las cepas bacterianas se cultivaron previamente sobre medio agar cerebro corazón a 37 °C. A partir de estos cultivos se realizaron diluciones celulares con una turbidez ajustada al tubo 0,5 de la escala Mc Farland, las cuales se sembraron con hisopos estériles en placas con medio agar Mueller- Hinton. Los pocillos se conformaron con la ayuda de un horadador estéril de 8 mm de diámetro y en cada uno se adicionaron 100 µL (200 mg mL-1) de cada extracto. Las placas se incubaron toda la noche a 37 °C.
Se emplearon como control negativo la disolución hidroalcohólica y como controles positivos se utilizaron discos con los antibióticos amikacina (30 μg) para las bacterias Gram negativas y cefalexina (30 μg) para la cepa Gram positiva. La actividad antibacteriana se evaluó a partir de la medición del diámetro del halo de inhibición con regla milimetrada. Se realizaron tres réplicas por cada tratamiento.
Diseño experimental y análisis estadístico
Los ensayos para la evaluación de la actividad antibacteriana se desarrollaron mediante un diseño completamente aleatorizado con tres réplicas por tratamiento. La determinación cualitativa de los tipos de metabolitos secundarios y las lecturas de absorbancia para las cuantificaciones bioquímicas se realizaron por triplicado.
Los datos correspondientes a los análisis bioquímicos cuantitativos y a la actividad antibacteriana se procesaron con el paquete SPSS versión 15.0 para Windows. Se determinó el ajuste de los datos a una Distribución Normal mediante la prueba de Bondad de Ajuste Kolmogorov-Smirnov y la Homogeneidad de Varianza mediante las Pruebas de Bartlett. Los datos se procesaron mediante ANOVA de clasificación simple y se realizó la Prueba de Rangos Múltiples de Tukey para la comparación entre las medias.
RESULTADOS Y DISCUSIÓN
Análisis fitoquímico
El estudio fitoquímico (Tabla 1) mostró la presencia de flavonoides, terpenos, saponinas, taninos, cumarinas y glucósidos cardiotónicos en las diferentes especies vegetales. Los metabolitos mejor representados fueron los flavonoides y los terpenos, aunque también se observaron de manera moderada o abundante las cumarinas y los glucósidos cardiotónicos en extractos de E. heterophylla y M. charantia; mientras que no se observó la presencia de antocianinas, antraquinonas o flobataninos. De manera general, el etanol resultó ser un mejor solvente que el agua para la extracción de la mayoría de los metabolitos, lo cual pudiera relacionarse con la diferencia de polaridad que existe entre ambas sustancias.
Tabla 1 Presencia de metabolitos secundarios en extractos de hojas de especies arvenses
| Especies - extractos | Metabolitos secundarios | |||||||
|---|---|---|---|---|---|---|---|---|
| Fv | Te | An | Sa | Ta | Es | Cu | GC | |
| B. brownei | ||||||||
| Acuoso | + | ++ | - | - | - | - | + | + |
| Etanólico | ++ | ++ | + | + | + | + | - | + |
| E. heterophylla | ||||||||
| Acuoso | + | ++ | - | - | + | - | ++ | ++ |
| Etanólico | ++ | ++ | - | ++ | + | + | ++ | ++ |
| B. pilosa | ||||||||
| Acuoso | ++ | +++ | - | - | + | - | + | - |
| Etanólico | +++ | ++ | - | + | + | + | - | - |
| conyzoides | ||||||||
| Acuoso | + | +++ | - | - | + | - | + | + |
| Etanólico | + | +++ | - | + | + | - | - | ++ |
| M. charantia | ||||||||
| Acuoso | ++ | +++ | - | - | + | - | ++ | ++ |
| Etanólico | +++ | +++ | - | + | + | + | + | +++ |
Flavonoides (Fv), terpenos (Te), antocianinas (An), saponinas (Sa), taninos (Ta), esteroides (Es), cumarinas (Cu), antraquinonas (At), glucósidos cardiotónicos (GC) y flobataninos (Fb)
Contenido: +++ = abundante, ++ = moderado, + = bajo, - = ausencia
Los resultados coinciden con otros autores quienes refirieron la presencia de varios de estos metabolitos en B. pilosa (Yi et al., 2016) y M. charantia (Cervantes et al., 2017). Sin embargo, otros autores detectaron la presencia de flobataninos en extractos de Momordica charantia, lo cual puede relacionarse con la interacción genotipo-ambiente y los métodos de extracción y detección de dichos compuestos, entre otros (Cervantes et al., 2017).
La presencia de flavonoides en hojas de B. pilosa sugiere un uso potencial de los extractos de esta especie en patologías humanas y animales asociadas con el estrés oxidativo, como el cáncer y procesos inflamatorios, ya que estos compuestos mostraron una fuerte actividad antioxidante (Yi et al., 2016). De manera similar, los taninos, las saponinas y las cumarinas detectadas en los extractos evaluados, también pueden indicar un uso potencial de estas plantas en el tratamiento de trastornos intestinales como las diarreas y la disentería, debido a las propiedades que tienen estos compuestos de inhibir el crecimiento de bacterias patógenas.
La figura muestra el contenido de polifenoles totales en las distintas especies estudiadas. Los valores más elevados se observaron en B. pilosa (35,32 mg g-1) y E. heterophylla (33,44 mg g-1). Los resultados obtenidos están en correspondencia con los observados por Mesa-Vanegas et al. (2015) quienes refirieron valores similares de polifenoles en hojas de A. conyzoides (24,79 mg g-1). Sin embargo, difieren de los valores observados en extractos de hoja de B. pilosa (72 mg g-1) por Singh et al. (2017), de E. heterophylla (8,24 mg g-1) por Keerthana et al. (2014) y en M. charantia (14,28 mg g-1) por Chahar y Sharma (2017). Estas diferencias pueden estar relacionas con varios factores como el genotipo y las condiciones edafoclimáticas, entre otras.
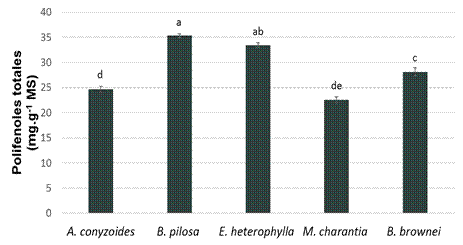
Letras diferentes indican diferencias significativas entre extractos según Prueba de Rangos Múltiples de Tukey (p<0,05)
Figura 1 Contenido de polifenoles totales de hojas de B. brownei, E. heterophylla, B. pilosa, A. conyzoides y M. charantia
La presencia de estos compuestos polifenólicos en las especies evaluadas indica que estas plantas se pueden utilizar en el tratamiento de patologías asociadas al estrés oxidativo en humanos y animales, ya que, en estudios previos, estos compuestos mostraron una fuerte correlación con la actividad antioxidante de extractos de B. pilosa (Singh et al., 2017); E. heterophylla (Keerthana et al., 2014); A. conyzoides (Mesa-Vanegas et al., 2015). Los compuestos polifenólicos tienen funciones importantes en la reducción de las especies reactivas del oxígeno (Chahar y Sharma, 2017). Se conoce que estos radicales atacan y modifican un rango amplio de macromoléculas que tienen funciones vitales a nivel celular como las enzimas, los ácidos nucleicos y los lípidos de membrana; lo cual provoca cambios en las propiedades biológicas de estas macromoléculas y un mal funcionamiento a nivel celular. El exceso de estos radicales libres puede iniciar o exacerbar el desarrollo de patologías humanas como el cáncer, las enfermedades neurodegenerativas, los procesos inflamatorios, las enfermedades cardiovasculares y el envejecimiento, entre otros (Mohammed y Abbas, 2016).
La naturaleza antioxidante de los compuestos fenólicos también sugiere el uso potencial de B. pilosa como fuente de sustancias útiles, para su utilización como aditivos en productos de la industria alimentaria. Las propiedades reductoras de los fenoles permiten inhibir la formación de radicales libres y/o interrumpir los procesos de autooxidación que ocurren en las carnes almacenadas.
Contenido de metabolitos primarios
En la Tabla 2 se muestra el contenido de carbohidratos solubles totales, azúcares reductores y proteínas solubles totales en extractos acuosos y etanólicos de hojas de las diferentes especies vegetales analizadas. Los mayores contenidos de carbohidratos solubles totales se obtuvieron en los extractos acuosos de E. heterophylla, seguido de B. pilosa (extracto acuoso), B. brownie (extracto acuoso) y M. charantia (extracto etanólico).
Tabla 2 Contenido de carbohidratos solubles totales, azúcares reductores y proteínas solubles totales en extractos acuosos y etanólicos de hojas de especies arvenses
| Especie / extracto | Metabolitos primarios | |||||
|---|---|---|---|---|---|---|
| CST | AR | PST | ||||
| mg mL-1 | EE | mg mL-1 | EE | mg mL-1 | EE | |
| brownie (ac) | 13,30 bc | 0,34 | 5,47 cd | 0,12 | 6,57 d | 0,26 |
| brownie (et) | 10,58 d | 0,26 | 6,40 c | 0,10 | 2,50 g | 0,08 |
| M. charantia (ac) | 7,08 e | 0,82 | 5,61 cd | 0,43 | 15,76 b | 0,02 |
| M. charantia (et) | 13,04 bc | 1,44 | 8,08 b | 0,30 | 9,34 c | 0,11 |
| E. heterophylla (ac) | 22,99 a | 1,08 | 12,45 a | 0,56 | 20,16 a | 0,30 |
| E. heterophylla (et) | 10,19 d | 0,93 | 5,85 cd | 0,22 | 9,66 c | 0,80 |
| pilosa (ac) | 13,75 b | 0,23 | 5,24 cd | 0,05 | 6,10 de | 0,17 |
| pilosa (et) | 10,53 d | 0,87 | 4,72 d | 0,23 | 3,69 f | 0,16 |
| conyzoides (ac) | 10,37 d | 1,02 | 6,36 c | 0,36 | 9,84 c | 0,10 |
| conyzoides (et) | 12,46 c | 1,38 | 6,50 c | 0,56 | 5,20 e | 0,04 |
Letras diferentes indican diferencias estadísticas entre extractos para un mismo metabolito primario, según Prueba de Rangos Múltiples de Tukey (P<0,05), EE: error estándar
CST: carbohidratos solubles totales, AR: azúcares reductores y PST: proteínas solubles totales, ac: extractos acuosos, et: extractos etanólicos
Con relación a los azúcares reductores, el extracto acuoso de E. heterophylla también mostró los valores más altos, seguido del extracto etanólico de M. charantia, los cuales son superiores a los observados en el resto de los extractos. Las concentraciones más altas de proteínas solubles totales se observaron en el extracto acuoso de E. heterophylla, seguido del extracto acuoso de M. charantia y de los extractos de A. conyzoides (acuoso), E. heterophylla (etanólico) y M. charantia (etanólico), sin diferencias entre estos últimos. En la extracción de las proteínas totales, el agua resultó mejor solvente que el etanol para todas las especies; sin embargo, en la extracción de los carbohidratos solubles totales y los azúcares reductores en algunos casos fue el etanol el mejor solvente, en otras especies fue el agua y en plantas como B. brownie, B. pilosa y A. conyzoides, no hubo diferencias en el contenido de azúcares reductores entre ambos extractos.
Los resultados coinciden con algunos estudios realizados por varios investigadores quienes refirieron la presencia de carbohidratos y proteínas en extractos de E. heterophylla (Keerthana et al., 2014) y M. charantia (Vijayanand y Sanjana, 2017). La cuantificación de azúcares reductores en los extractos estudiados es importante, ya que estas sustancias interfieren en la extracción de saponinas, las cuales son de gran interés comercial para la industria farmacéutica.
Las concentraciones notables de proteínas solubles totales en el extracto acuoso de E. heterophylla tiene valor zootécnico, ya que esta planta se utiliza tradicionalmente para la alimentación de algunas especies de interés zootécnico como el conejo y el cerdo. De forma general, los valores obtenidos para los diferentes metabolitos primarios analizados, además de contribuir a la caracterización bioquímica de estas especies, tiene una importancia adicional, ya que plantas como B. pilosa se ingieren en forma de jugos o de infusión para el tratamiento de afecciones, los cuales contienen estos metabolitos que tienen una función fundamental en el metabolismo celular.
Actividad antibacteriana
Los resultados de la actividad antibacteriana de los extractos etanólicos se muestran en la Tabla 3. De manera general, los mejores resultados se obtuvieron frente a Proteus sp. y S. aureus. En el caso de E. coli solo se observó una actividad baja en los extractos de H. heterophylla y B. brownie. Frente a la bacteria Gram positiva S. aureus el efecto inhibitorio más elevado se obtuvo con el antibiótico, seguido por los extractos de E. heterophylla, M. charantia y B. brownei, entre los cuales no hubo diferencias; sin embargo, la actividad antibacteriana de E. heterophylla fue superior a los extractos de B. pilosa y A. conyzoides. Frente a Proteus sp. el control positivo y los extractos de A. conyzoides y B. pilosa mostraron valores similares, mientras que los valores más bajos se obtuvieron con M. charantia y E. heterophylla.
Tabla 3 Actividad antibacteriana de extractos etanólicos de hojas diferentes especies arvenses frente a Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 y Proteus sp.
| Controles / extractos | S. aureus | Proteus sp. | E. coli | |||
|---|---|---|---|---|---|---|
| DZI (mm) | EE | DZI (mm) | EE | DZI (mm) | EE | |
| Cefalexina (Gram +) | 23,10 a | 0,58 | - | - | - | - |
| Amikacina (Gram -) | - | - | 14,67 a | 1,45 | 13,4 a | 0,87 |
| Disolución hidroalcohólica | 1,00 d | 0,33 | 0,00 | 0,00 | 0,00 | 0,00 |
| Blechum brownei Juss. | 9,67 bc | 0,36 | 9,33 cd | 1,05 | 2,67 b | 0,57 |
| Momordica charantia L. | 10,33 bc | 0,57 | 7,67 d | 1,80 | 0,00 | 0,00 |
| Euphorbia heterophylla L. | 11,33 b | 0,88 | 6,00 e | 1,73 | 4,00 b | 0,33 |
| Bidens pilosa L. | 8,66 c | 0,33 | 12,00 abc | 1,15 | 0,00 | 0,00 |
| Agerantum conyzoides L. | 8,30 c | 0,66 | 14,33 ab | 1,20 | 0,00 | 0,00 |
DZI: diámetro de la zona de inhibición. Los datos representan medias de tres réplicas
Letras distintas indican diferencias entre extractos frente a un mismo microorganismo patógeno, según Prueba de Rangos Múltiples de Tukey (p<0,05)
Los resultados obtenidos concuerdan con otros autores quienes refirieron una actividad antibacteriana de extractos de B. pilosa frente a S. aureus y/o E. coli (Singh et al., 2017). La acción antibacteriana se relacionó con la presencia de varios metabolitos secundarios como flavonoides, taninos, terpenoides y saponinas, los cuales también se observaron en la presente investigación.
La actividad antibacteriana observada con el extracto de A. conyzoides es congruente con los resultados obtenidos por Ezeonwumelu et al. (2017), quienes indicaron propiedades antibacterianas del extracto etanólico de esta especie, frente a S. aureus, E. coli y Proteus mirabilis, entre otros patógenos. A diferencia de estos autores, no se evidenció un efecto frente a E. coli, lo cual puede estar relacionado con diferencias genéticas y morfofisiológicas de las cepas utilizadas, así como de la composición fitoquímica de los extractos.
El efecto antibacteriano del extracto de E. heterophylla frente a P. mirabilis y E. coli se refirió previamente por Fred-Jaiyesimi y Abo (2010); sin embargo, el extracto no mostró actividad frente a S. aureus. En este trabajo el efecto tóxico frente a los patógenos fue menor al evaluado en la presente investigación, lo cual puede estar asociado a la dosis inferior que utilizaron (90 mg mL-1), así como otros factores como las diferencias genotípicas en el material vegetal, el momento de la cosecha y el estado fenológico de la planta, entre otros. El efecto tóxico frente a estas bacterias Gram negativas se relacionó con la detección de taninos, saponinas y glucósidos cardiotónicos en el extracto, los cuales se observaron también en el presente estudio.
Los resultados obtenidos con el extracto de cundeamor también son congruentes con los referidos por Cervantes et al. (2017), quienes observaron una actividad antibacteriana con extractos etanólicos de esta planta frente a S. aureus y otros patógenos como S. epidermidis, Klebsiella pneumoniae y P. aeruginosa. Estos autores asociaron el efecto antibacteriano con la presencia abundante de flavonoides y terpenoides en el extracto, lo que coincide con los resultados del estudio fitoquímico en la presente investigación, ya que estos compuestos, junto a los glucósidos, se observaron en mayores proporciones con relación al resto de los metabolitos secundarios en esta planta.
El efecto antibacteriano del extracto de B. brownei, para nuestro conocimiento, constituye el primer reporte de su tipo para esta especie. En estudios similares con B. orientale, varios investigadores indicaron una actividad antibacteriana de extractos de hojas y/o rizomas de esta planta frente a diferentes patógenos como S. aureus y S. epidermidis (How-Yee, et al., 2017), lo que evidencia las potencialidades del género como fuente de compuestos bioactivos con actividad antibacteriana.
Los metabolitos observados en los extractos evaluados, pueden inhibir el crecimiento bacteriano a través de diferentes mecanismos como cambios en las propiedades físico-químicas de la membrana celular y la interferencia con procesos metabólicos esenciales en los microorganismos patógenos. Los flavonoides afectan el crecimiento microbiano por la inhibición de la biosíntesis de ácidos nucleicos y otros procesos metabólicos; mientras que las sustancias de naturaleza terpenoide pueden interferir en la síntesis de los componentes de las membranas biológicas (Nayak et al., 2010).
Las saponinas, debido a su naturaleza surfactante, pueden interactuar con las membranas biológicas y alterar la solubilidad y semi-permeabilidad de la misma, lo que provoca la salida de componentes celulares. Los taninos y los compuestos fenólicos pueden inhibir el crecimiento bacteriano, debido a la capacidad que tienen estas sustancias de formar complejos con proteínas solubles extracelulares y con la pared celular de las bacterias, lo que provoca la muerte de los microorganismos. Los taninos también pueden disminuir la actividad de enzimas bacterianas, mediante la quelatación de iones imprescindibles para la función catalítica de estas proteínas (Ojezele et al., 2016).
La actividad antibacteriana observada en los extractos analizados, unido al contenido de compuestos de naturaleza antioxidante como los polifenoles y en particular los flavonoides; también indican las potencialidades de estas especies para el tratamiento de patologías asociadas al estrés oxidativo, como procesos inflamatorios en humanos y animales.
CONCLUSIONES
Los extractos etanólicos y acuosos de E. heterophylla, M. charantia, B. pilosa, A. conyzoides y B. brownei poseen numerosos metabolitos secundarios como flavonoides, terpenos, taninos, saponinas, cumarinas y glucósidos cardiotónicos, los cuales constituyen compuestos bioactivos que justifican el uso de algunas de estas especies en la medicina tradicional. Los extractos mostraron actividad antibacteriana frente a S. aureus y Proteus sp., lo cual sugiere el uso potencial de estos extractos para el tratamiento de enfermedades infecciosas en humanos y animales















