Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop v.29 n.4 La Habana oct.-dic. 2008
Reseña
Comunidad microbiana asociada a los Hongos Micorrizógenos Arbusculares (HMA)
Ms.C. Lorelí de los A. MirabalI, Dr.C. E. OrtegaII
I Investigador Agregado del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, email: loreli@inca.edu.cu
II Investigador Titular de la facultad de Biología de la Universidad de La Habana, Cuba.
Abstract
The optimal crop development demands a higher application of mineral fertilizers and pesticides. The use of such chemicals involves not only high cost and energy requirements, but their indiscriminate contribution could cause salinity troubles and ground water pollution. Plant development can also be improved by using biological elements that co-ordinately act in the soil-root interface; among them and as an essential factor are arbuscular mycorrhizal fungi, which are capable of colonizing 95 % land plants. A recent study on the microbial community associated to arbuscular mycorrhizal fungi (AMF) has provided a fungal knowledge; bacteria, filamentous fungi and yeast associated to AMF structures have been observed. This paper is aimed to analyze the evident tripartite interaction between AMF, plants and other microorganisms, and to release the main scientific contributions associated to this phenomenon.
Key words: fungi, arbuscular mycorrhizae, microorganisms, bacteria, symbiosis
Resumen
El desarrollo óptimo de los cultivos demanda una elevada aplicación de fertilizantes minerales y pesticidas. El uso de dichos insumos químicos implica no solo costo y requerimientos energéticos elevados, sino que su aporte indiscriminado pudiera provocar problemas de salinización y contaminación del manto freático. El desarrollo vegetal también puede incrementarse por la utilización de elementos biológicos, que actúan de forma coordinada en la interfase suelo-raíz; entre estos y como factor imprescindible se encuentran los hongos formadores de micorrizas arbusculares, capaces de colonizar el 95 % de las plantas terrestres. El estudio reciente de la comunidad microbiana asociada a los hongos micorrizógenos arbusculares (HMA) ha contribuido al conocimiento de ellos; se han observado bacterias, hongos filamentosos y levaduras asociadas a las estructuras del HMA. El presente trabajo tiene como objetivo analizar la interacción tripartita que se pone de manifiesto entre los HMA, las plantas y otros microorganismos y dar a conocer los principales aportes científicos relacionados con este fenómeno.
Palabras clave: hongos, micorrizas arbusculares, microorganismos, bacterias, simbiosis
Los hongos micorrizógenos arbusculares
Generalidades
El vocablo micorriza lo utilizó por primera vez el botánico de origen alemán Albert Bernard Frank (1), para designar “la asociación de hifas a los órganos subterráneos de las plantas superiores”. Etimológicamente, la palabra se ha formado del término griego “mykos” (hongo) y del vocablo latino “rhiza” (raíz) (2).
El término micorrizas describe un fenómeno de ocurrencia generalizada, resultante de la unión orgánica entre las raíces y el micelio de hongos del suelo. Es un órgano morfológicamente independiente con dependencia íntima y recíproca, seguido por el crecimiento de ambas partes y con funciones fisiológicas muy estrechas (3).
La inmensa mayoría de las plantas que crecen sobre la corteza terrestre viven asociadas, en forma de simbiosis mutualista, con los HMA. Mas del 80 % de las plantas, entre ellas las de interés agronómico (incluida orto-fruticultura), así como las especies arbustivas, sub-arbustivas y herbáceas propias de los ecosistemas forestales ibéricos, forman las llamadas “micorrizas arbusculares” (MA). El hongo MA, microscópico, coloniza biotróficamente la corteza de la raíz, sin causar daño a la planta, llegando a ser fisiológica y morfológicamente parte integrante de dicho órgano. El hongo también desarrolla un micelio externo que, a modo de sistema radical complementario y altamente efectivo, coloniza el suelo que rodea la raíz y ayuda a la planta a adquirir nutrientes minerales y agua. Recientemente se ha comprobado que las hifas del hongo en conjunto con otros microorganismos del suelo, contribuyen a la formación de agregados estables necesarios para mantener la estructura y, por tanto, la calidad del suelo (4).
Las micorrizas arbusculares constituyen la simbiosis planta-microorganismo más extendida sobre el planeta, tanto por el número de hospederos vegetales que la conforman como por su distribución, ya que más del 97 % de las especies vegetales forman micorrizas de forma nativa y, a su vez, en un 95 % de los casos son del tipo arbuscular (5).
La distribución geográfica de las asociaciones micorrízicas es muy amplia, encontrándose desde los polos hasta los trópicos (6, 7). Estos endófitos fúngicos tienen la capacidad de colonizar diversos ambientes y su éxito ecológico refleja un alto grado de diversidad en las capacidades genéticas y fisiológicas. No puede sorprender, entonces, hallar especies vegetales formando este tipo de asociación en la mayoría de los ecosistemas terrestres, siendo quizás las excepciones algunas plantas de zonas pantanosas y acuáticas (8).
Aunque la micorrización aporta un beneficio mutuo para ambos organismos, hay que tener en cuenta el criterio de Palma (9), quien plantea que la asociación micorrízica resulta de la unión íntima entre huésped y hospedero, en la que intervienen factores como la virulencia del huésped y la reacción de defensa de la planta, mucho menos severa y de carácter temporal en relación con los microorganismos patógenos típicos.
A las asociaciones micorrízicas se le han atribuido múltiples funciones, entre las que se destacan el mejoramiento de la superficie absorbente del sistema radicular a través de un aumento significativo de ella, aumento de la tolerancia a las toxinas, resistencia a condiciones adversas (sequía, salinidad, entre otras), cierta protección contra los patógenos radicales, y como relevante el hongo formador de micorriza arbuscular capacita y faculta a la planta asociada para incrementar la captación de iones, principalmente fosfatos, la cual puede ser seis veces superior a la que conseguirían en su ausencia.
Tomando en consideración la distribución geográfica de los simbiontes, su morfo-anatomía y ultra-estructura, los hongos formadores de micorrizas se clasifican en: ectomicorrizas, endomicorrizas y ectendomicorrizas (10).
Las ectomicorrizas se pueden visualizar macroscópicamente, pues el hongo rodea a la raíz y forma una capa o manto fúngico. A partir de esta estructura, las hifas se introducen entre las células de la corteza, sin lograr penetrarla, y forman de esta manera la red de Harting, que provoca cambios anatómicos evidentes y el consecuente crecimiento dicotómico fragmentado de las raíces (11, 12).
Las endomicorrizas son difícilmente apreciables a simple vista, no forman capas fúngicas externas y se propagan a través de las raíces, alcanzando el interior de las células corticales, pero sin franquear la endodermis. Finalmente, como un nivel o paso intermedio, aparecen las ectendomicorrizas, que presentan características de los dos tipos de simbiosis anteriores (11, 12).
Evolución
Datos de fósiles y moleculares han demostrado que los HMA son muy antiguos, datan de alrededor de 350 a 400 millones de años (13, 14).
Existen varias hipótesis que defienden distintas teorías acerca del origen del hongo. Pirozynski y Malloch (15) sugirieron que fuese un alga semiacuática. Por otra parte, Morton (16) no aceptó este ancestro y sugirió un hongo zygomicetes saprobiótico con hábitat más terrestre. Recientemente la hipótesis de Morton ha sido corroborada, hoy se conoce que es un hongo zygomicetes llamado Geosiphon pyriformis (Kuts & Wettstein) (16), que no se asocia con plantas superiores pero tiene gran similitud morfológica y molecular con la línea Glomus en Glomales.
Otros trabajos demostraron que en Geosiphon pyriformis existen secuencias de nucleótidos (18S ARNr), que tienen gran similitud con hongos pertenecientes al orden Glomales, que con hongos fuera de este orden (17) y sus esporas guardan cierta semejanza con especies típicas del género Glomus (18).
Debido a la actividad fisiológica del hongo, se conoce que es capaz de vivir en autotrofía de carbono y nitrógeno (17); quizás la asimilación de carbono por el micobionte en la fotosíntesis esté estrechamente ligada con indicadores de parentesco con hongos del orden Glomales, lo cual sugiere que ha existido una estrecha y obligada relación con procariontes autotróficos.
De gran relevancia para la presente investigación fue conocer que en Geosiphon pyriformis se hubiesen detectado microorganismos asociados; se plantea la observación de especies filamentosas de Nostoc (usualmente N. puntiforme) (19). Sin embargo, Geosiphon junto al endosimbionte han sido considerados como un raro sistema endocitobiótico primitivo, porque los procariontes encontrados en su interior pueden ser experimentalmente separados y unificados (20), poniéndose en evidencia no solo el origen de estos HMA, sino también que en el hongo reconocido como más antiguo se ha detectado la presencia de microorganismos endógenos.
Relación entre los HMA y otros microorganismos
En adición a la bien conocida interacción entre plantas y hongos, las micorrizas ofrecen un excelente nicho ecológico para otros microorganismos (21). Los hongos frecuentemente hospedan microorganismos del suelo, los cuales pueden influir de manera beneficiosa en la fisiología y el desarrollo de ellos (22, 23, 24). Los microorganismos pueden ser derivados de la tierra circundante o ser transportados por esporas de hongos. Desde el punto de vista ecológico, muchos estudios muestran que numerosos microorganismos del suelo interactúan con los hongos, promoviendo actividad antagónica, sinérgica o de competencia (25).
1. Interacción de los HMA y las bacterias rizosféricas
Artursson y Jansson (26) confirmaron la importancia de las bacterias asociadas a las micorrizas, las que años anteriores Garbaye (27) había identificado como bacterias que ayudan a la micorrización y las denominó mycorrhization helper bacteria (MHB) y propuso cinco mecanismos que explican el comportamiento de las MHB:
cambios beneficiosos en el suelo rizosférico
mejoramiento del reconocimiento entre la raíz y el hongo
incremento de la susceptibilidad de las plantas a la colonización micorrízica
mejoramiento del estado nutricional del hongo
estimulación de la germinación de los propágulos del hongo.
Estas poblaciones microbianas tienen un efecto beneficioso en el crecimiento del HMA, no solo porque mejoran la colonización radical y estimulan el crecimiento de la hifa extrarradical, sino porque facilitan la germinación de la esporas del HMA (28). Este efecto ha sido visualizado con Actinomycetes, Pseudomonas Corynebacterium y Bacillus (29) spp.
Después de varias investigaciones, Garbaye y Bowen (30) señalaron que existían verdaderas bacterias que ayudaban al hongo a adaptarse a vivir en simbiosis, localizándose en la vecindad del hongo en el suelo; con mucha frecuencia observaron Pseudomonas fluorescens, que en un 80 % traían consigo un efecto positivo sobre la formación de las micorrizas y en un 20 % exhibían un halo inhibitorio, revelando entonces que en la relación bacterias y su efecto sobre la formación de las micorrizas, no se debe ser totalmente absoluto.
También fueron encontradas bacterias formando parte de la simbiosis entre el hongo y la planta, en diversas condiciones del sitio a muestrear y en diferentes combinaciones hongo-planta.
Estas bacterias rizosféricas en gran medida son las responsables de los cambios beneficiosos en la rizosfera, como por ejemplo la transformación de las propiedades físico-químicas del suelo, con el objetivo de facilitar la colonización micorrízica.
2. Antecedentes de bacterias asociadas a HMA
Como es ya conocido, existe una estrecha relación entre los hongos HMA y las plantas; ahora se abre una nueva posibilidad con el estudio de bacterias y otros microorganismos que viven asociados con el hongo, y constituye una de las nuevas promesas para entender la compleja simbiosis.
Además de la conocida pregunta de si los hongos emiten señales que sean reconocidas por receptores potenciales en la planta, hoy se abre una nueva incógnita:
l ¿La extensa cantidad de bacterias en el interior o específicamente asociadas con el hongo sugiere que muchas de las simbiosis entre este y la planta sean asociaciones tripartitas?
Existen numerosas evidencias que demuestran la relación existente entre los HMA y otros microorganismos; en algunas ocasiones la literatura refiere términos como: microorganismos endógenos, bacterias que ayudan a la micorrización, endófitos y en otras ocasiones se hace referencia a microorganismos asociados.
l ¿Qué evidencias existen de microorganismos asociados a las esporas de HMA?
En 1970, Mosse (31) planteó algunas hipótesis sobre la posible presencia de organismos parecidos a bacterias en el citoplasma de Endogonaceae, actual Orden Glomales. Este autor observó que las bacterias eran capaces de suplir con productos metabólicos a las esporas de los glomales en períodos de rápida multiplicación. No obstante, citó que otros habían demostrado que los microorganismos podían estimular, inhibir o matar las esporas en procesos de germinación.
Mac Donald y Chandler (32) informaron la presencia de organismos parecidos a bacterias embebidos en las paredes de las esporas de HMA Glomus caledonium (Nicol. & Gerd., Trappe & Gerd); estas bacterias localizadas en las paredes se protegen físicamente de soluciones esterilizantes y afirmaron que el crecimiento eventual de bacterias embebidas puede ser la causa de contaminaciones aparentes y espontáneas de las esporas de HMA en cultivos axénicos.
A partir de muestras de suelos rizosféricos de caña de azúcar fueron obtenidas esporas vivas y muertas de la familia Endogonaceae, principalmente de Glomus sp. y Acaulospora sp. y observaron bacterias que crecían en medio LGI. Al realizar pruebas bioquímicas (catalasa, oxidasa, producción de H2S, utilización de azúcares, hidrólisis de almidón y gelatina, tinción de Gram) a los aislados, encontraron que los siete crecían en medio LGI, que por sus características concluyeron que eran cepas de A. diazotrophicus y que las esporas podían constituir un reservorio natural de esta bacteria fijadora de nitrógeno.
En el mencionado trabajo la desinfección solo se realizó con estreptomicina (no se especifica la concentración) y agua destilada, sin que se haya comprobado que hubo una verdadera desinfección externa de las esporas. Este trabajo tiene el mérito de haber sido pionero en la idea de bacterias asociadas a las esporas de estos hongos en Cuba, pero las evidencias presentadas no constituyen una verdadera prueba de que las cepas aisladas fueran Acetobacter diazotrophicus y mucho menos que los resultados probaran la presencia de bacterias provenientes del interior de las esporas de hongos micorrizógenos (33).
No se explica cómo analizaron que los microorganismos podían haber estado albergados en el interior de las esporas. No se considera que se hizo una buena desinfección de ellas, porque no se dan datos de la concentración del antibiótico usado y no se menciona el uso de agentes clorados, desinfectantes biológicos, reactivos estos empleados para un trabajo de desinfección total de esporas de HMA.
Para una identificación de los aislados y concluir que son cepas de A. diazotrophicus, es necesario en primer lugar realizar pruebas moleculares, por ejemplo 16 SARN y secuenciar el fragmento para compararlo con el Blast (una lista de microorganismos y su fragmento conservado secuenciado, que sirve de comparación), prueba de identificación API e incluso el perfil de los ácidos grasos. Las pruebas bioquímicas realizadas dan la probabilidad de que las cepas obtenidas sean Acetobacter diazotrophicus, pero no constituye un resultado concluyente.
Años más tarde, otros observaron al microscopio electrónico de transmisión en esporas de Glomus clarum NT4 (Nicol. & Schenck) estructuras semejantes a bacterias; aun cuando no confirmaron que estas fueran verdaderas bacterias, atribuyeron la presencia de tales estructuras a posibles fallos en la descontaminación de las esporas (34).
De forma semejante, Bianciotto y colaboradores con el uso de técnicas morfológicas y moleculares demostraron que el citoplasma de HMA Gigaspora margarita (Becker & Hall) sirve de albergue a verdaderas bacterias, las cuales fueron detectadas ultraestructuralmente en esporas y micelios simbióticos. Y con el uso de microscopía confocal fluorescente, estimaron aproximadamente 250 000 organismos parecidos a bacterias en el interior de esporas de Gigaspora margarita. Utilizando microscopía electrónica, otros han detectado organismos semejantes a bacterias en HMA Glomus caledonium y Acaulospora laevis (Gerdemann & Trappe) (13).
En el HMA Gigaspora margarita se realizó una comparación entre los genes representativos de eubacterias y la secuencia de los genes de la subunidad menor de ARNr de bacterias endosimbióticas, concluyendo que los genes del ARNr de las endosimbióticas pertenecían al género Burkholderia. Los análisis filogenéticos hechos al ADNr 16S demostraron la presencia de esta bacteria en todas las fases del ciclo de vida del HMA Gigaspora margarita (14).
Numerosos estudios aportaron ideas e hipótesis suficientes, a través de las cuales varios científicos (13, 14, 21, 35) llegaron a la conclusión que los sistemas micorrízicos debían incluir otros microorganismos, además de las raíces y el hongo que era lo estudiado.
Según Bianciotto y colaboradores (13, 14), la identificación taxonómica ha estado muy limitada, por lo difícil e infructuoso que ha constituido el aislamiento y crecimiento de bacterias endosimbiontes de esporas de HMA en medios de cultivo axénicos. Solamente se menciona el género Burkholderia (13) y un nuevo taxón bacteriano ‘Candidatus Glomeribacter gigasporanum’ (36), el que solo fue detectado en el citoplasma de esporas dormantes y micelios de HMA Gigaspora margarita, Scutellospora persica (Koske & Walker Walker & Sanders) y Scutellospora castanea (Walker).
Análisis electroforéticos revelan que la comunidad bacteriana asociada con las esporas depende más del hongo micorrízico arbuscular que de la identidad de la planta hospedera (37).
Bacterias asociadas con esporas HMA colonizan principalmente la pared celular externa de las esporas y raras veces penetran en el interior de la pared más interna (34). Aunque se han observado algunas bacterias en el citoplasma de esporas de HMA (14, 32), el papel de estas bacterias aún no se ha esclarecido, ellas pueden estimular la germinación de las esporas por erosión en las paredes (38), por la producción de compuestos estimuladores, por ejemplo el CO2 y otros compuestos volátiles, o por influencia en la adquisición de fósforo por los HMA (39).
En estudios previos de microorganismos asociados a las esporas, las bacterias fueron aisladas de los cultivos in vitro del HMA. No obstante, estas bacterias no cultivables en medios de cultivo no selectivos podían representar una parte significativa de la comunidad bacteriana asociada a las esporas. Solo una pequeña fracción (de 1 al 10 %) del total de la comunidad bacteriana es cultivable (40).
3. Hongos filamentosos en HMA
Los Actinomicetes se han encontrado en esporas y ascocarpos de HMA (38), y representan un componente normal de su microflora. Estos microorganismos incrementan la germinación de las esporas, debido a la producción de compuestos volátiles como por ejemplo 2-methylisoborneol (41).
Por su parte, otros han detectado hongos filamentosos en esporas de HMA. Ellos plantean que los HMA podían ser habitados por numerosos microorganismos y aislaron dos hongos Ascomicetos con fenotipos diferentes, de esporas vivas y muertas del HMA Scutellospora castanea con secuencias muy parecidas o semejantes a ascomycetes (ascomycete-like) (42). Estas secuencias pueden haber sido aisladas de hongos contaminantes que podían estar habitando la superficie de las esporas de HMA; otra posibilidad es que las secuencias fueran de hongos ascomicetos que viven en el interior de las esporas de HMA y la tercera situación es que podía ser que las secuencias sean originadas desde el genoma de la espora (42).
Investigaciones futuras podrían revelar si la presencia de tales hongos juega un papel importante en el funcionamiento de los HMA o su interacción con las plantas.
4. Levaduras en HMA
En los HMA también se han detectado levaduras, que fueron observadas asociadas a esporas de Glomus mosseae (cepa INCAM-2, cepario del INCA) después de un proceso de desinfección total denominado CCfT. Dos levaduras fueron caracterizadas (EndoGm1 y EndoGm11), ambos aislados fueron capaces de solubilizar fuentes de fósforo poco solubles (fosfato de hierro y calcio) y acumular polifosfatos. Los resultados del análisis del 18S ADNr revelaron que dichas levaduras pertenecían a los géneros Rhodotorula o Rhodosporidium (EndoGm1) y Cryptococcus (EndoGm11). Los resultados de los experimentos de inoculación revelaron que existe un efecto de las levaduras asociadas a las esporas sobre el crecimiento radical de plántulas de arroz, lo cual pudiera indicar una posible interacción tripartita entre las levaduras asociadas a las esporas, los HMA y las plantas (43).
Hipótesis del establecimiento de la simbiosis entre HMA y bacterias endosimbióticas
La simbiosis intracelular trajo consigo cuestiones fascinantes acerca de la adquisición, transmisión de los endosimbiontes y la evolución de adaptaciones recíprocas.
Margulis y Chapman (44) propusieron que en los miembros de la familia Gigasporaceae (Morton & Benny), se observan claramente dos posibles y opuestos tipos de simbiosis. En un estudio realizado en distintas áreas geográficas, se obtuvieron once aislamientos fúngicos, pertenecientes a seis especies diferentes de la familia Gigasporaceae: se apreció que Gigaspora margarita es capaz de albergar gran cantidad de endobacterias, Gigaspora roseae (Nicol. & Schenck) no alberga ninguna y en Gigaspora gigantea (Nicol. & Gerd.) se observan bacterias endosimbióticas, pero con características diferentes a las encontradas en otras especies de Gigaspora, debido a la presencia de bacterias con formas redondeadas o cocoides.
La compleja situación observada en la familia Gigasporaceae, puede deberse a la temporal pero interesante asociación de los HMA seleccionados por los simbiontes bacterianos (bacterias del suelo de vida libre) desde el ambiente (simbiosis cíclica). Aunque la existencia de endocitosis y adquisición de la bacteria es un evento muy raro en hongos, debido a la pared que rodea las hifas, algunos Zygomicetes pueden representar un caso especial entre los hongos, solo se conoce que estos tienen la posibilidad de establecer relaciones cíclicas con cianobacterias (14).
La simbiosis permanente es el resultado de la adquisición de bacterias durante la evolución, mostrada solo por transmisión vertical, durante las generaciones de los endosimbiontes. La reproducción asexual típica de los HMA y la naturaleza cenocítica del micelio en los Zygomicetes, son factores que pueden facilitar este tipo de transmisión.
La simbiosis permanente ha sido muy discutida y es la que cuenta con un mayor número de votos a su favor. En el 2000 se demostró, con el uso de análisis celulares y moleculares, que las bacterias se mueven de una generación fúngica a la siguiente, por lo que bacterias presentes en el interior de HMA pueden llevar millones de años en sus estructuras, teniendo en cuenta que estos hongos datan de alrededor de millones de años (14).
Aislamiento de microorganismos asociados y metodologías de desinfección de esporas utilizadas
La desinfección total de las esporas ha sido intentada con diferentes objetivos, entre estos para lograr cultivos in vitro de los HMA; pero si se desean aislar bacterias del interior de las esporas, esto es imprescindible. La descontaminación de la superficie es requerida para evitar la proliferación de microorganismos contaminantes y asegurar que estos no influyan en los resultados experimentales, siendo las esporas frescas más sensibles al proceso de descontaminación que las esporas maduras (34).
Las esporas antes del proceso de desinfección presentan una coloración oscura a su alrededor debido a los contaminantes. Cuando las esporas son desinfectadas e incubadas en medio de cultivo Agar agua, la germinación de las esporas es limitada; niveles de germinación del 28 % fueron obtenidos después de una exposición en Cloramina T al 5 % por 120 minutos, porque la Cloramina T inhibe la germinación (34).
Existe mucha contradicción en cuanto a la eficiencia o no del método de Mosse. El planteó que con el uso de una solución de Cloramina T al 2 %, 200 µg.mL-1 de estreptomicina y trazas de detergente biológico se logra un 90 % de esporas descontaminadas (43); sin embargo, informaron que con dicho método solo se conseguía del 32-64 % de esporas axénicas (45).
En la literatura se citan otros métodos para la desinfección de las paredes de las esporas en dependencia del objetivo que se persigue, por ejemplo:
Inmersión en hipoclorito de sodio al 0.5 % por 20 minutos, seguido de tres lavados con agua destilada estéril e inmersión en una solución de sulfato de estreptomicina 100 mg.L-1 por 30 minutos y nuevamente tres lavados con agua destilada estéril (46).
Inmersión por diez minutos en hipoclorito de sodio al 0.5 %, seguido de dos lavados con agua destilada estéril e inmersión en una solución de sulfato de estreptomicina 100 mg.L-1 por 10 minutos y nuevamente tres lavados con agua estéril (46, 47).
Lavado con alcohol 70 %, seguido de dos lavados con agua estéril e inmersión en solución de Cloramina T al 1 % por 10 minutos, seguido de tres lavados con agua estéril (47, 48).
Inmersión en Cloramina T 2 % durante un tiempo entre 10 y 120 minutos (34).
Inmersión en solución 1:1 de Cloramina T 2 %, sulfato de estreptomicina 200 mg.L-1 por 30 minutos, seguido de tres lavados con agua estéril durante 30 minutos (47, 49).
Inmersión en solución de Cloramina T 2 % durante cinco minutos, seguido de tres lavados en agua destilada estéril por el mismo tiempo (47).
Inmersión en solución de Cloramina T 4 %, 300 ppm de estreptomicina por 30 minutos y lavar cinco veces por una hora con agua filtrada y destilada estéril (13, 50).
Otros utilizaron la metodología anterior con una variante; en lugar de estreptomicina 300 ppm, usaron estreptomicina al 0.04 % (14).
Los métodos de desinfección superficial no son capaces de eliminar el 100 % de los microorganismos asociados, debido a la cantidad de microorganismos que pudiera estar localizada en el lumen de las esporas, así como incrustadas en las paredes de las hifas (47).
En la literatura se encuentran publicados un gran número de métodos rutinarios, con el objetivo final de proveer la superficie desinfectada de las esporas. El éxito en el uso de estas metodologías de desinfección es altamente dependiente de cómo son manipuladas las técnicas y sobre qué material se aplican.
Sin embargo, se ha propuesto una metodología de desinfección eficiente por un colectivo (51) del Instituto Nacional de Ciencias Agrícolas (INCA) y la Universidad de La Habana (UH), en un trabajo conjunto que se realizó con esporas frescas del HMA Glomus mosseae, las que fueron completamente desinfectadas y la limpieza de sus paredes puede ser apreciada en la Figura 1. Esta desinfección puede contribuir al estudio de la ultraestructura del esporangio, sus núcleos, sus sistemas de membranas, sus diferentes paredes celulares y, por supuesto, el objetivo principal para la que fue concebida, el estudio de microorganismos estrechamente asociados a las esporas de HMA Glomus mosseae (49).
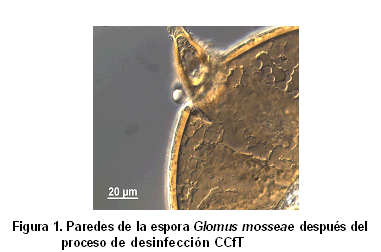
Dicha metodología se denominó CCfT y en ella se emplean diferentes combinaciones de Cloramina T, Tween y Cefalexina. El no crecimiento microbiano fue verificado durante siete días en tres medios de cultivos diferentes LGI-P (libre de nitrógeno, 10 % de sacarosa y pH 5,5) (52), AN (Agar nutriente) (53) y SYP (extracto de levadura, sacarosa y sales, pH 6,2) (54), en los cuales se habían inoculado esporas desinfectadas e intactas; lo inverso ocurrió cuando se inocularon en placas de cultivo esporas desinfectadas y maceradas (51), lo cual evidenció que las paredes estaban completamente desinfectadas y que en el macerado existen microorganismos que pudieran haber estado adheridos muy estrechamente en las paredes e introducidos en poros de estas o que simplemente vivían en el interior de las esporas.
Conclusiones
El concepto endosimbiosis da la posibilidad de estudiar e investigar la relación entre células y genomas. Este informe resalta que las micorrizas tienen un interés particular en un contexto evolutivo, porque ofrecen un selecto ejemplo de interacciones entre las plantas, los hongos y las bacterias u otros microorganismos.
Referencias
1. Bernard, A. F. Uber die auf wurzel - symbiose berunhende ernährung gewisser baüme durch unterirdische pilze. Ber. Dtsch. Bot. Ges., 1881, vol. 3, p. 128-145.
2. Plenchette, C. H. Les Endomicorrhiziens a vesicules et arbuscule (va): Un potentiel a exploitier en agriculture. Phytoprotection, 1982, vol. 63, p. 86-108.
3. Dommergues, F. y Mangenot, F. Les associations mycorrhiziennes. En: Ecologie Microbienne du sol. Ed Masson et Cie. Paris, 1970, p. 656-675.
4. Alarcón, A. Actualización de la taxonomía de los Glomales. Terra Latinoamericana, 2001, vol. 19, no. 001, p. 103-104.
5. Barea, J. M. Morfología, anatomía y citología de las micorrizas va. En: Fijación y movilización de Nutrientes. Madrid. 1991, t2, p. 150-173.
6. Mosse, B. Advances in the study of va micorrhiza. Ann. Rev. Phytopath, 1973, vol. 11, p. 171-196.
7. Perry, D. A. Species migration and ecosystem stability during climate change; the belowground connection. Conservation Biology, 1990, vol. 4, p. 266-274.
8. Solaiman, M. Z e Hirata, H. Effects of indigenous arbuscular mycorrizal fungi on rice growth and N,P,K nutrition under different water regimes. Soil Sci. Plant Nutr., 1995, vol. 41, no. 3, p. 505-514.
9. Palma, J. M. Superoxide dismutase in vesicular- arbuscular mycorrhizal red clover plants. Physiologia Plantarum, 1993, vol. 87, no. 1, p. 77-83.
10. Azcón, R. Papel de la simbiosis micorrízica y su interacción con otros microorganismos rizosféricos en el crecimiento vegetal y sostenibilidad agrícola. Ecología Fisiología y Biotecnología de la Micorriza Arbuscular. Mundi Prensa. México, 2000, p. 1-15.
11. Garrido, N. L. Mykorrhizen in den Nothofagus-Waldern Mittelchiles. Bibliotheca Mycologica, 1988, vol. 120, p. 1-258.
12. Strullu, D. G. Les mycorrhizes des abres et plantes cultivees. Technique et Documentation. Lavoisier. Paris, 1991.
13. Bianciotto, V.; Bandi, C.; Minerdi, D.; Sironi, M.; Tichy Hans, V. y Bonfante, P. An obligately endosymbiotic mycorrhizal fungus itself harbors obligately intracellular bacteria. Applied and Environmental Microbiology, 1996, vol. 62, no. 8, p. 3005-3010.
14. Bianciotto, V.; Lumini, E.; Lanfranco, L.; Minerdi, D.; Bonfante, P. y Perotto, S. Detection and identification of bacterial endosymbionts in arbuscular mycorrizal fungi belonging to the Family Gigasporaceae. Applied and Environmental Microbiology, 2000, vol. 66, no. 10, p. 4503-4509.
15. Pirozynski, K. A. y Malloch, D. W. The origin of land plants: a matter of mycotropism. BioSystems, 1975, vol. 6, p. 153-164.
16. Morton, J. Species and clones of arbuscular mycorrhizal fungi (Glomales, Zigomycetes): their role in macro- and microevolutionary processes. Mycotaxon, 1990, vol. 37, p. 493-515.
17. Gehrig, H.; Schussler, A. y Kluge, M. Geosiphon pyriforme, a fungus forming endocytobiosis with Nostoc (cyanobacteria) is an ancestral member of the Glomales: evidence by SSU rRNA analysis. Journal of Molecular Evolution, 1996, vol. 43, p. 71-81.
18. Schussler, A.; Mollenhauer, D.; Schnepf, E. y Kluge, M. Geosiphon pyriforme, an endosymbiotic association of fungus and cyanobacteria: the spore structure resembles that of arbuscular mycorrhizal (AM) fungi. Botanica Acta, 1994, vol. 107, p. 36-45.
19. Kluge, M.; Mollenhauer, D. y Mollenhauer, R. Photosynthetic carbon assimilation in Geosiphon pyriforme (Kützing) F. v. Wettstein, an endosymbiotic assocation of fungus and cyanobacterium. Planta, 1991, vol. 185, p. 311-315.
20. Kluge, M.; Gehrig, H.; Mollenhauer, D.; Molenhauer, R.; Schnepf, E. y SchüBler, A. News on Geosiphon pyriforme, an endosymbiotic consortium of a fungus with a cyanobacterium. En: Eukaryotism and Symbiosis. Springler-Verlag, 1997, p. 469-476.
21. Bonfante, P. Plants, mycorrhizal fungi and endobacteria: dialog among cells and genomes. Biol. Bull, 2003, vol. 204, p. 215-220.
22. Artursson, V.; Finlay, R. D. y Jansson, J. K. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Appl. Environ. Microbiol., 2006, vol. 8, p. 1-10.
23. Lumini, E.; Ghignone, S.; Bianciotto, V. y Bonfante, P. Endobacetria or bacteria endosymbionts? To be or not to be. New Phytol., 2006, vol. 170, p. 199-201.
24. Javier, L. J. C. y Germida, J. Bacteria associated with Glomus clarum spores influence mycorrhizal activity. Soil Bio Biochem., 2003, vol. 35, p. 471-478.
25. Buzzini, P.; Gasparetti, C.; Turchetti, B.; Cramarossa, M. R.; Matini, V. A.; Martini, A.; Pagnoni, U. M. y Forti, L. Production of volatile organic compounds (VOCs) by yeasts isolated from the ascocarps of black (Tuber melanosporum Vitt.) and white (Tuber magnatum Pico) truffles. Arch microbial., 2005, vol. 184, p. 187-193.
26. Artursson, V. y Jansson, J. K. Use of Bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae. Applied and Environmental Microbiology, 2003, p. 6208-6215.
27. Garbaye, J. Tansley Review No.76. Helper Bacteria: A new dimension to the mycorrhizal simbiosis. New Phytologist, 1994, vol. 128, no. 2, p. 197-210.
28. Gryndler, M.; Hrselova, H. y Striteska, D. Effect of soil bacteria on hyphal growth of the arbuscular mycorrhizal fungus Glomus claroideum. Folia Microbiol., 2000, vol. 45, p. 545-551.
29. Xavier, L. J. C. y Germida, J. J. Bacteria associated with Glomus clarum spores influence mycorrhizal activity. Soil Biol. Biochem., 2003, vol. 35, p. 471-478.
30. Garbaye, J. y Bowen, G. D. Stimulation of mycorrhizal infection of Pinus radiata by some microorganisms associated with the mantle of ectomycorrhizas. New Phytologist, 1989, vol. 112, p. 383-388.
31. Moose, B. Honey-coloured sessile Endogone spores. II. Changes in fine structure during spore development. Arch. Mikrobiol., 1970, vol. 74, p. 146-159.
32. Mac Donald, R. M. y Chandler, M. R. Bacterium-like organelles in the vesicular arbuscular mycorrhizal fungus Gigaspora margarita. Mol. Ecol., 1981, vol. 8, p. 37-45.
33. Velazco, A.; Fernández, F.; Furrazola, E. y Herrera, R. Presencia de Acetobacter diazotrophicus en esporas de la familia Endogonaceas. Cultivos Tropicales, 1993, vol. 14, no. 1, p. 25-27.
34. Walley, F. y Germida, J. Failure to decontaminate Glomus clarum NT4 spores is due to spore wall-associated bacteria. Mycorrhiza, 1996, vol. 6, p. 43-49.
35. Bianciotto, V. y Bonfante, P. Arbuscular mycorrhizal fungi: a specialised niche for rhizospheric and endocellular bacteria. Antonie van Leuwenhoek, 2002, vol. 81, p. 365-371.
36. Bianciotto, V.; Lumini, E.; Bonfante, P. y Vandamme, P. ‘Candidatus Glomeribacter gigasporanum’ gen. Nov., sp. Nov., an endosymbiotic of arbuscular mycorrhizal fungi. Int J Syst Evol Microbiol., 2003, p. 53. 121.
37. Roesti, D.; Ineichen, K.; Braissant, O.; Redecker, D.; Wiemken, A. y Aragno, M. Bacteria associated with spores of the arbuscualr micorrhizal fungi Glomus geosporum and Glomus constrictum. Applied and Environmental Microbiology, 2005, p. 6673-6679.
38. Filippi, C.; Bagnoli, G.; Citernesi, A. S. y Giovannetti, M. Ultrastructural spatial distribution of bacteria associated with sporocarps of Glomus mosseae. Symbiosis, 1998, vol. 24, p. 1-12.
39. Ruiz-Lozano, J. M. y Bonfante, P. Intracellular Burkholderia of the arbuscular mycorrhizal fungus Gigaspora margarita possesses the vacB gene, which is involved in host cell colonization by bacteria. Microb. Ecol., 2000, vol. 39, p. 137-144.
40. Amann, R. I.; Ludwig, W. y Schleifer, K. H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiol. Rev., 1995, vol. 59, p. 143-169.
41. Carpenter-Boggs, L.; Loynachan, T. E. y Stahl, P. Spore germination of Gigaspora margarita stimulated by volatiles of soil-isolated actinomycetes. Soil Biol., 1995, vol. 27, p. 1445-1451.
42. Hijri, M.; Redecker, D.; MacDonald-Comber Petetot, J. A.; Voigt, K.; Wo¨stemeyer, J. y Sanders Ian, R. Identification and isolation of two ascomycete fungi from spores of the arbuscular mycorrhizal fungus Scutellospora castanea. Applied and Environmental Microbiology, 2002, vol. 68, no. 9, p. 4567-4573.
43. Mirabal, L.; Diethelm, K. y Ortega, E. Spores of the mycorrhizal fungus Glomus mosseae host yeasts that solubiliza phosphate and acumúlate polyphosphates. Mycorrhiza, 2008, vol. 18, p. 197-204.
44. Margulis, L. y Chapman, M. J. Endosymbioses: cyclical and permanent in evolution. Trends Microbiol., 1998, vol. 6, p. 342-345.
45. Mosse, B. The establishment of vesicular-arbuscular mycorrhizal under aseptic conditions. J. Gen. Microbiol., 1962, vol. 27, p. 509-520.
46. Mertz, S. M.; Heithaus, J. J. y Bush, R. L. Mass production of axenic spores of the endomycorrhizal fungus Gigaspora margarita. Trans Br Mycol Soc., 1979, vol. 72, p. 167-169.
47. Colozzi-Filho, A. Desinfestacão superficial de esporos de fungos micorrízicos vesículo-arbusculares. Lavras: ESAL. Tese de Mestrado, 1988. 80 p.
48. Reis, V. M.; Paula, M. A. y Döbereiner, J. Ocorrência de micorrizas arbusculares e da bacteria diazotrófica Acetobacter diazotrophicus em cana-de-açúcar. Pesq. Agropec., 1999, vol. 34, p. 1931-1941.
49. Tilak, K. V. B. R.; Li, C. H. y H. O. I. Occurrence of nitrogen fixing Azospirillum in a vesicular-arbuscular mycorrhizal fungi. Plant and Soil, 1989, vol. 116, p. 286-288.
50. Nair, M. G.; Safir, G. R. y Siqueira, J. O. Isolation and identification of vesicular arbuscular mycorrhiza-stimulatory compounds from clover (Trifolium repens) roots. Applied and Environmental Microbiology, 1991, vol. 57, p. 434-439.
51. Mirabal, L.; Ortega, E.; Rodés, R. y Fernández, F. Método efectivo para la desinfección de esporas de hongos micorrizógenos arbusculares (HMA): aislamiento y caracterización de bacterias endospóricas en Glomus clarum. Cultivos Tropicales, 2002, vol. 23, no. 1, p. 21-24.
52. Döbereiner, J.; Reis, V. M.; Paula, M. A. y Olivares, F. Endophitic diazotrophs in sugar cane, cereals and tuber plants. En: New Horizons in Nitrogen Fixation. Netherland:Kluwer Academic Publisher. 1993, p. 671-676.
53. Romão, L. Microbiología. Agar nutriente. Consultado [5-4-2008]. Disponible en: <http:www.midavid. hpg.ig.com.br/ microbiologia. html>.
54. Caballero-Mellado, J. y Martínez-Romero, E. Limited genetic diversity in the endophytic sugarcane bacetrium Acetobacter diazotrophicus. Applied and Environmental Microbiology, 1994, p. 1532-1537.
Recibido: 20 de noviembre de 2007
Aceptado: 22 de octubre de 2008













