Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop v.30 n.1 La Habana ene.-mar. 2009
Establecimiento de una metodología para el conteo de cromosomas en el clavel español (Dianthus caryophyllus L.)
Yanelis CastillaI y Dra.C. María E. GonzálezII, Dra.C. Xonia XiquésIII
I Reserva Científica, email: yanelis@inca.edu.cu
II Investigadora Auxiliar del departamento de Genética y Mejoramiento Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, CP 32 700
III Profesora Auxiliar de la Facultad de Biología, Universidad de La Habana (UH) y Ms.C. Ania Pinares, Reserva Científica del Jardín Botánico Nacional, Calabazar, Ciudad de La Habana, Cuba.
ABSTRACT
The cytogenetic characterisation of a plant species involves a high value, from the taxonomic point of view, and it is very important for breeding as well as to detect the genetic variability of in vitro culture. However, it is impossible to perform a cytogenetic analysis without previously establishing a procedure to distinguish and count the chromosomes from a species; thus, the present study is aimed at determining a method, which allows the adequate visualisation and counting of chromosomes in Spanish carnation (Dianthus caryophyllus L. var. Chabaud Red). 20 roots were randomly taken from pregerminated plants in a moist chamber and submitted to several pre-treatments, different hydrolysis times on HCl-1N and staining times on haematoxylin. The chromosomes from 20 cells were counted per each preparation, by using a Motic optic microscope connected to a computer. It was possible to determine a method for visualizing and counting chromosomes of Spanish carnation, and to prove the chromosomal number of this species.
Key words: cytogenetics, chromosomes, Dianthus
RESUMEN
La caracterización citogenética de una especie vegetal encierra un valor alto, desde el punto de vista taxonómico, así como una gran importancia para el mejoramiento genético y la detección de variabilidad genética en el cultivo in vitro. Pero resulta imposible realizar un análisis citogenético, si previamente no ha sido establecido un procedimiento que permita distinguir y contar los cromosomas de una especie, por lo que el presente trabajo tiene como objetivo determinar un método, que permita la adecuada visualización y el conteo de los cromosomas de claveles españoles (Dianthus caryophyllus L. var. Chabaud Red). Se tomaron al azar 20 raíces de plantas germinadas en cámara húmeda y se sometieron a distintos pretratamientos, diferentes tiempos de hidrólisis en HCl 1N y de coloración en hematoxilina. Se contaron los cromosomas de 20 células por cada preparación, con el empleo de un microscopio óptico Motic conectado a una computadora. Fue posible determinar un método de visualización y conteo de cromosomas para los claveles españoles, así como comprobar el número cromosómico de esta especie.
Palabras clave: citogenética, cromosomas, Dianthus
INTRODUCCIÓN
Una de las plantas más estimadas como flor de corte es el clavel español (Dianthus caryophyllus L.), planta herbácea perenne perteneciente a la familia Caryophyllaceae (1, 2). Los claveles representan aproximadamente el 12 % de la exportación mundial de flores, por lo que constituyen una de las más cotizadas en el mercado internacional, debido a su belleza y diversidad de colores, duración después de cortados y resistencia al embalaje y transporte (3, 4).
Conocer el número de cromosomas de una especie no solo encierra un gran valor desde el punto de vista taxonómico y evolutivo (5, 6), sino que además permite la verificación de la estabilidad genética en plantas propagadas mediante el cultivo de tejidos in vitro, que puede ocasionar alteraciones del material hereditario, como microlesiones y macrolesiones (7, 8).
Los estudios citogenéticos permiten detectar algunas de estas alteraciones (9, 10), siendo más ventajosos que los morfoagronómicos, ya que no están sujetos a una marcada influencia ambiental (11), por lo que su aplicación es de gran importancia (12, 13). Estos comprenden la determinación del número de cromosomas, el conocimiento de su forma, la estructura y el análisis de la ploidía (14, 15), pero resulta imposible realizar un estudio citogenético completo, si primeramente no se determina un método que permita una adecuada observación y conteo de los cromosomas.
En el caso de especies ornamentales como el clavel español (Dianthus caryophyllus L.), aunque en la literatura ha sido informado su número básico de cromosomas (2n=2x=30), no se ha descrito un método rápido y práctico que permita observarlos y contarlos, por lo que el objetivo del presente trabajo fue determinar un método efectivo, que permita la adecuada visualización y el conteo de los cromosomas de clavel español, con vistas a su futura utilización en la verificación de la estabilidad genética de plantas provenientes del cultivo in vitro.
MATERIALES Y MÉTODOS
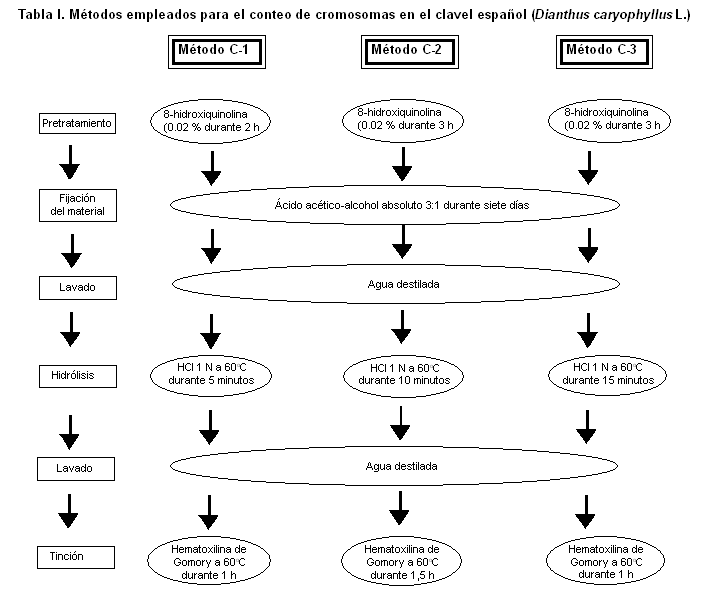
Las plantas de clavel español (Dianthus caryophyllus L. var. Chabaud Red) se obtuvieron a partir de la germinación de semillas, que fueron colocadas sobre una placa Petri con papel de filtro humedecido y sometidas a condiciones de temperatura ambiente y luz artificial de 1000 lux durante ocho horas diarias. Al emerger las raíces, cuando contaban con una longitud de 1 cm, se tomaron 20 de ellas al azar y se sometieron a tres métodos diferentes de conteo de cromosomas: C1, C2 y C3 (Tabla I), para seleccionar el que permitiera la mejor visualización y el conteo de los cromosomas.
Para la observación, el conteo y fotografiado, se analizaron 20 células por cada preparación, con el empleo de un microscopio óptico Motic con aumento máximo de 100 X, acoplado a una cámara fotográfica con visualización en la computadora mediante el programa Motic Imagen.
RESULTADOS Y DISCUSIÓN
Al efectuar la etapa de pretratamiento del material vegetal durante dos horas en 8-hidroxiquinolina, se observaron dificultades para realizar el conteo de los cromosomas, lo que pudo deberse a que la dispersión y contracción de los cromosomas no eran suficientes para lograr una buena observación de estos, lo cual se logró al incrementar el tiempo de pretratamiento a tres horas, apreciándose una mayor proporción de células en divisiones metafásicas. Al realizar este tipo de estudio en otras especies ornamentales como la rosa (Rosa sp), otros no alcanzaron resultados satisfactorios, ya que no obtuvieron una máxima dispersión y contracción de los cromosomas, debido a que hubo pocas células en divisiones metafásicas y, en cambio, las células en profase resultaron más abundantes (16).
En el presente estudio la mayor dificultad para la observación de los cromosomas de los claveles estuvo determinada por el tiempo de hidrólisis, ya que a los cinco minutos el tejido permaneció duro, e igual comportamiento se observó al aumentar el tiempo de hidrólisis a 10 minutos. Sin embargo, a los 15 minutos se obtuvo una consistencia adecuada de las células y fue posible observar los cromosomas de forma satisfactoria.
Algunos plantean que para los cromosomas de rosas (Rosa sp), los mejores resultados con este tipo de procedimiento se obtienen al realizar la hidrólisis en un rango comprendido desde 15 y hasta 20 minutos, ya que un tiempo superior a este es capaz de ocasionar la degradación de los cromosomas (5), al igual que las concentraciones de HCl superiores a 1N (16, 17). En cambio, en un estudio sobre la diversidad citogenética de Physalis peruviana L., otros plantean que resulta factible realizar una hidrólisis de doble digestión: primero una digestión ácida con HCl 1N durante 20 min a 60°C y luego una digestión enzimática compuesta por un ´coctel´ de varias enzimas, ya que la consistencia de la pared celular depende de la especie y del tipo de explante que se analice (18).
Otro aspecto a destacar es la influencia del tiempo de tinción, observándose que al realizarse durante una hora y una hora y media (métodos C1 y C2), se obtuvo una tinción pobre y no se tiñeron todas las células de manera homogénea, a diferencia del método C3, en el cual con dos horas en hematoxilina se logró una tinción apropiada, lo que pudiera atribuirse al hecho de que en los métodos C1 y C2 el tejido permaneció duro y no se propició la penetración adecuada del colorante. Resultados similares se han obtenido con células de anteras inmaduras de rosa, al realizar la tinción con acetocarmín (19).
Al analizar los resultados en conjunto, se determinó que el método que permitió una mejor visualización y conteo de los cromosomas fue el C3.
Se observó que todas las muestras analizadas presentaron un número cromosómico de 2n=2x=30 (Figura 1), lo cual coincide con otros informes (20), al estudiar cuatro especies del género Dianthus, que también plantea la posibilidad de encontrar casos de poliploidía para la especie Dianthus caryophyllus L., apareciendo un número cromosómico de 2n=6x=90, lo cual no observamos en los estudios realizados.
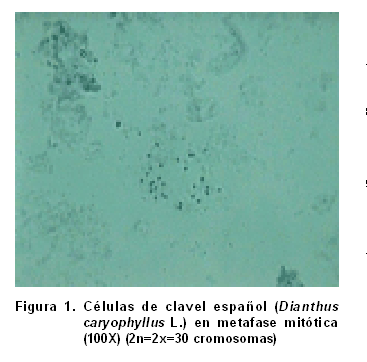
La importancia de estos resultados consiste en que facilitan los estudios del número cromosómico en la especie Dianthus caryophyllus L., aspectos de gran significación para su caracterización y como método para evaluar el comportamiento de la estabilidad y variabilidad genética en cuanto al número cromosómico en plantas de esta especie regeneradas por vías tradicionales y biotecnológicas.
CONCLUSIONES
Se determinó el método más eficiente de visualización y conteo de los cromosomas en los claveles españoles.
Se comprobó que el número cromosómico de los claveles españoles es 2n=2x=30 cromosomas.
REFERENCIAS
1. Judd, W. S.; Campbell, C. S.; Kellog, E. A.; Stevens, P. F. y Donoghue, M. J. Plant Systematics: A Phylogenetic Approach. Ed. Palgrave-Freeman, 2007. 565 p.
2. Curir, P.; Dolci, M. y Galeotti, A. A phytoalexin-like flavonol involved in the carnation (Dianthus caryophyllus L.)- Fusarium oxysporum f.sp. dianthi patosystem. Plant Pathology, 2005, vol. 153, p. 65-67.
3. Fundación Chile. Análisis del mercado mundial de flores. [Consultado el: 3 enero de 2004]. Disponible en: <www.fundacionchile.cl/fc/flores/analisis.cfm>.
4. Ardila, H. D. e Higuera, B. Inducción diferencial de polifenol oxidasa y -1,3 glucanasa en clavel (Dianthus caryophyllus L.) durante la infección por Fusarium oxysporum f.sp. dianthi raza 2. Acta Biológica Colombiana, 2005, vol. 10, p. 65-78.
5. Martínez, P.; Sánchez, R.; Vaknin, Y.; Dicenta, F. y Gradziel, T. M. Improved technique for counting chromosomes in almond. Scientia Horticulturae, 2005, vol. 105, p. 139-143.
6. Martínez, P.; Majourhat, K.; Zeinalabedini, M.; Erogul, D.; Khayam-Nekoui, M.; Grigorian, V.; Hafidi, A.; Piqueras, A. y Gradziel, T. Use of biotechnology for preserving rare fruit germplasm. Bioremediation, Biodiversity and Bioavailability, 2007, vol. 1, no. 1, p. 31-40.
7. Hughes, K. Ornamental species. En: Cloning agricultural plants via in vitro techniques. B.V. Conger. CRC Press. 1980.
8. Orellana, P. Propagación vía organogénesis. En: Propagación y Mejora Genética de Plantas por Biotecnología. Pérez Ponce, J. N. (Ed). Santa Clara, Cuba. Instituto de Biotecnología de las Plantas. 1998. 400 p.
9. Portieles, R.; Rodríguez, R.; Hernández, I.; Canales, E. y Cornide, M. T. Determinación del número cromosómico de un grupo de clones silvestres de origen desconocido y clones de fundación del complejo Saccharum. Cultivos Tropicales, 2002, vol. 23, no. 2, p. 69-72.
10. Román, M. I.; Xiqués, X.; González, C.; Dueñas, F.; Alonso, M.; Hernández, M.; González, L.; Ramírez, T.; Valdés, M. y Rojas, A. Caracterización citogenética en materiales obtenidos por diferentes métodos de propagación en bananos y plátanos. En: Programa y resúmenes del Congreso Científico del INCA (15:2006 noviembre 7-10:San José de las Lajas), 2006.
11. Dueñas, F.; Román, M. I.; González, C.; Xiqués, X. y Valdés, M. Empleo de marcadores en la detección de la variabilidad genética en somaclones de Musa spp. En: Programa y resúmenes del Congreso Científico del INCA (14: 2004 noviembre 9-12, San José de las Lajas), 2004.
12. Coto, O.; Rodríguez, M.; Portieles, R.; Rodríguez, R.; Cornide, M. T.; Hernández, I.; Canales, E.; Oliva, O.; Prada, F. de y Pérez, G. Marcadores moleculares y citogenéticos para la identificación y caracterización de una colección de trabajo de clones del complejo Saccharum para la nobilización. En: Memorias de la Convención Trópico (2004 abril 4-9 La Habana), 2004.
13. Román, M. I.; González, C.; Xiqués, X.; Valdés, M.; Alonso, M.; Dueñas, F.; Ramírez, T. y González, L. Diversidad genética de los bananos (Musa spp) en Cuba. Memorias de la Convención Trópico (2004 abril 4-9 La Habana), 2004.
14. Lacadena, J. R. Citogenética. Ed. Complutense, 1996.
15. Beovides, Y. Detección de variabilidad genética en clones de yuca (Manihot esculenta Crantz) obtenidos por diferentes métodos de propagación. [Tesis de Maestría]. Universidad de La Habana, 2001.
16. Ma, Y.; Nurul, M.; Crane, C. F.; Stella, D.; James, H. y Byrne, D. A new procedure to prepare slides of metaphase chromosomes of roses. HortScience, vol. 31, no. 5, p. 855-857.
17. Majourhat, K.; Jabbar, Y.; Araneda, L.; Zeinalabedini, M.; Hafidi, A. y Martínez, P. Karyotype characterization of Argania spinosa (L.) Skeel (Sapotaceae). South African Journal of Botany, 2007, vol. 73, p. 661-663.
18. Rodríguez, N. C. y Bueno, M. L. Estudio de la diversidad citogenética de Physalis peruviana L. (Solanaceae). Revista Acta Biológica Colombiana, 2006, vol. 11, no. 1, p. 19-34.
19. Fernández, M. D.; Torres, A. M.; Millán, T.; Cubero, J. I. y Cabrera, A. Physical mapping of ribosomal DNA on several species of the subgenus Rosa. Theoretical and Applied Genetics, 2001, vol. 103, p. 835-838.
20. Ramírez, L. Micropropagación de variedades de clavel (Dianthus caryophyllus L. y Dianthus plumarius L.) saneado mediante cultivo in vitro de meristemos. [Tesis de Diploma]; Universidad de La Habana, 1995.
Recibido: 29 de octubre de 2007
Aceptado: 28 de noviembre de 2008













