Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop v.30 n.3 La Habana jul.-sep. 2009
Biodegradabilidad de mezclas de caliza fosfatada con abonos orgánicos en un suelo ácido
B. CaleroI, email: bcalero@minag.cu; mejoramiento@minag.cu, Mirelys RodríguezII, Ms.C. Amalia MoralesIII, F. MartínezIV, Dr.C. L. MorejónV
I Investigador Titular
II Reserva Científica
III Investigadora Agregada
IV Investigador Auxiliar
V Investigador del Instituto de Suelos, autopista Costa-Costa km. 8½., Apdo. 8022, CP 10 800, Capdevila, Boyeros, ciudad de La Habana, Cuba
ABSTRACT
The effect of calcareous phosphate mixtures with different organic substrates as vermicompost (HL), cattle manure (EV) and pig slurry (EP) on soil biological indicators was studied, with the aim of measuring its biodegradability and fertility influence, mainly related to mineral nitrogen availability. The dynamics of NO3- formation was determined, whereas NH4+ and NO3- contents were extracted and quantified in total soil matter. Data were processed through an ANOVA for a random trifactorial arrangement. Duncan’s Multiple Range test was used as a criterion of differences between treatment means for all variants analyzed. Results showed that calcareous phosphate mixtures with HL, EV and EP stimulate soil microbiological activity and support those microbiological processes associated to organic nitrogen mineralization. Mixture biodegradability depended more on the calcareous phosphate proportion than on substrate quantity. Independently that the mixtures made up with EV and EP caused a greater effect on microbiological processes, the mixture with HL had a similar decomposition pattern to the control soil, which means that it does not cause marked microflora changes; therefore, it provokes a smaller soil biological balance disorder.
Key words: organic manures, calcareous phosphate, organomineral fertilizers
RESUMEN
Se estudió el efecto de las mezclas de caliza fosfatada con los sustratos orgánicos humus de lombriz (HL), estiércol vacuno (EV) y estiércol porcino (EP) sobre los indicadores biológicos del suelo, como medida de su biodegradabilidad e incidencia en la fertilidad, principalmente la vinculada con la disponibilidad de nitrógeno mineral. Se determinó la dinámica de formación de NO3- y se realizó la extracción y cuantificación de NH4+ y NO3- contenidos en la masa total del suelo. Los datos obtenidos se procesaron mediante un ANOVA para un arreglo trifactorial aleatorio. Se utilizó la prueba de Rangos Múltiples de Duncan, como criterio de las diferencias entre las medias de los tratamientos para las distintas variantes analizadas. Los resultados mostraron que las mezclas de caliza fosfatada con HL, EV y EP estimulan la actividad microbiológica del suelo y favorecen los procesos microbiológicos asociados a la mineralización del nitrógeno orgánico. La biodegradabilidad de las mezclas dependió más de la proporción de caliza fosfatada que de la cantidad de sustrato presente. Independientemente de que las mezclas elaboradas con EV y EP provocaron un mayor efecto sobre los procesos microbiológicos, la mezcla con HL presentó un patrón de descomposición similar al suelo control, lo cual indica que no genera cambios bruscos en la microflora; por tanto, provoca una menor alteración del equilibrio biológico del suelo.
Palabras clave: abonos orgánicos, caliza fosfatada, abonos órganominerales
INTRODUCCIÓN
Para desarrollar una agricultura sostenible, es necesario hacer el uso y manejo correctos de los suelos, mediante la integración de medidas que permitan el control de su degradación, así como el mantenimiento y la recuperación de su fertilidad (1). Entre las acciones que deben considerarse para evitar el proceso de degradación y la pérdida de calidad en las reservas orgánicas, ocupan un lugar de importancia en la actualidad la disminución de la fertilización química y combinación de esta con la orgánica (2, 3).
Los abonos orgánicos son portadores de nutrientes de baja concentración, por lo que para satisfacer los requerimientos nutricionales de las plantas, se necesitan grandes cantidades que, en ocasiones, se hacen insostenibles desde el punto de vista práctico y económico; esto puede atenuarse utilizando combinaciones de abonos orgánicos con minerales industriales, también conocidos como naturales, alternativos o técnicos, entre los que se encuentran las calizas fosfatadas (4, 5). Estas pueden incrementar la concentración de algunos nutrientes, lográndose el beneficio de un área mayor con la misma cantidad de fuente orgánica, así como la corrección de los excesos de acidez en los suelos (6).
Es por ello que es necesario encontrar alternativas que garanticen rendimientos aceptables, sin incrementos importantes de la actividad microbiológica en los suelos, logrando un mayor aprovechamiento de los nutrientes y una disminución considerable de su pérdida (7). La capacidad y velocidad con que los microorganismos del suelo mineralizan las sustancias orgánicas define, en gran medida, el poder fertilizante de estas.
El empleo de fertilizantes órganominerales puede ser una alternativa eficaz para incrementar el rendimiento agrícola y proteger los recursos edáficos de los agroecosistemas. Es importante señalar que la relación C/N es una de las características más importantes de un abono órganomineral. De su valor depende su velocidad de descomposición cuando se aplica al suelo, la mineralización de nitrógeno y la competencia entre los microorganismos del suelo y las plantas por ese elemento, así como el aprovechamiento del carbono de la materia orgánica (8, 9).
El presente trabajo estudió el efecto de diferentes mezclas de caliza fosfatada con los sustratos orgánicos: humus de lombriz (HL), estiércol vacuno (EV) y estiércol porcino (EP), sobre la formación de amonio y nitrato en el suelo, como medida de su biodegradabilidad e incidencia en la fertilidad del suelo, principalmente la vinculada a la disponibilidad de nitrógeno mineral.
MATERIALES Y MéTODOS
Se utilizó un suelo Ferralítico Amarillento Lixiviado (10) del sureste de la provincia de Pinar de Rio, tomado a la profundidad de 0 a 20 cm con un pH (H2O)= 5.2, 1.12 % de MO, 1.24 mg.kg-1 Ca, 0.15 mg.kg-1 Mg y 0.12 mg.kg-1 K. Primeramente, el suelo se secó al aire y se tamizó por una malla de 5 mm. Se empleó la caliza fosfatada del yacimiento de Loma Candela de la provincia La Habana. Las características fundamentales que se determinaron fueron: 23.6 % Ca, 6.23 % Mg, 0.07 % K, 5.5 % P y 63.81 % CaCO3. Se ensayaron 18 combinaciones, que se explican en la Tabla I.

Se realizó la caracterización química de los sustratos orgánicos y las mezclas (11). Para el estudio de la dinámica de formación del NO3-, la mezcla en la proporción y dosis establecida (Tabla I) se combinó íntimamente con 50 g de suelo y se colocó en potes plásticos. Se añadió agua hasta alcanzar una humedad equivalente al 70 % de la capacidad máxima de retención de humedad del suelo, la cual se mantuvo por diferencia de peso durante todo el período de incubación; posteriormente, estos se colocaron en incubadora a una temperatura de 28-30oC. Se preparó una cantidad suficiente de potes de la mezcla del suelo con cada combinación y el control (S), para hacer muestreos destructivos de tres réplicas a los 0, 15, 30, 45, 60, 75 y 90 días de la incubación. Se realizó la extracción de NH4+ y NO3- contenido en la masa total de suelo usando K2SO4 al 2 %. La cuantificación del NH4+ y NO3- se realizó colorimétricamente utilizando Nessler y ácido disulfofenólico respectivamente (12, 13).
Los datos obtenidos se procesaron con el paquete estadístico Microsta, mediante un ANOVA para un arreglo trifactorial aleatorio considerando cuatro niveles para el factor A (S, S+(CF-HL), S+(CF-EV) y S+(CF-EP); dos niveles para el factor B (2 proporciones de CF + sustrato orgánico para cada mezcla) y tres niveles para el factor C (4, 12 y 20 t.ha-1). Se utilizó la prueba de rangos múltiples de Duncan, como criterio de diferencias entre las medias de los tratamientos para las diferentes variantes analizadas.
RESULTADOS Y DISCUSIóN
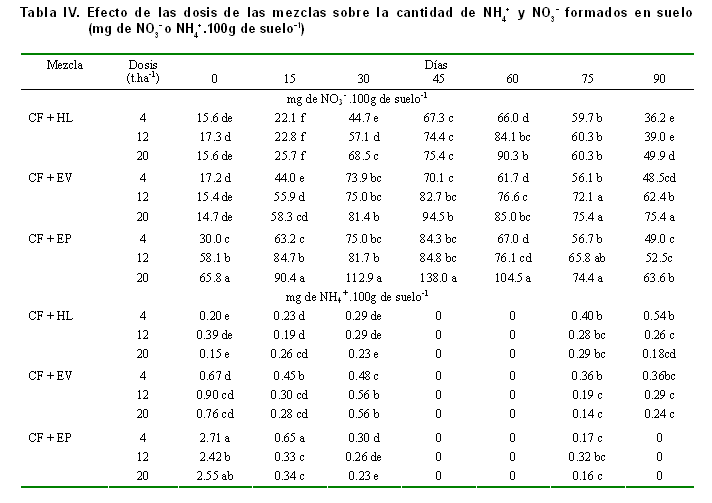
En la Tabla II se presentan los valores de la caracterización química de los sustratos orgánicos y las mezclas estudiadas.
El proceso de nitrificación en el suelo garantiza la formación del N-NO3-, a partir de la oxidación biológica del N-NH4+ existente o del que se forma como consecuencia de la mineralización de las formas orgánicas de nitrógeno existentes o añadidas al suelo, mediante el proceso conocido por amonificación (14, 15).
Lo anterior refiere que en un suelo incubado y sometido a condiciones óptimas de humedad y temperatura, donde no hay extracción de nitratos por el cultivo y las condiciones no sean favorables para su reducción, este elemento se irá formando y acumulando en función de las reservas mineralizables presentes en el suelo y la actividad de la microflora nitrificante (16, 17).
Los patrones de formación de nitratos (Figura 1), tanto en el suelo control (sin adición de fuentes orgánicas) como en los tratados con las mezclas, siguen un comportamiento típico para los suelos incubados, donde la formación de nitratos ocurre hasta que disminuyen las reservas orgánicas presentes y los productos metabólicos que son formados durante el proceso de mineralización se convierten en freno de este proceso (18, 19).

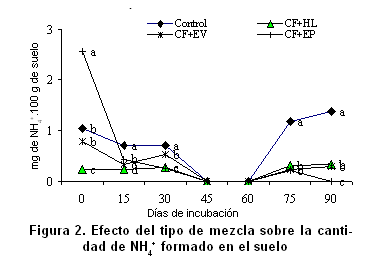
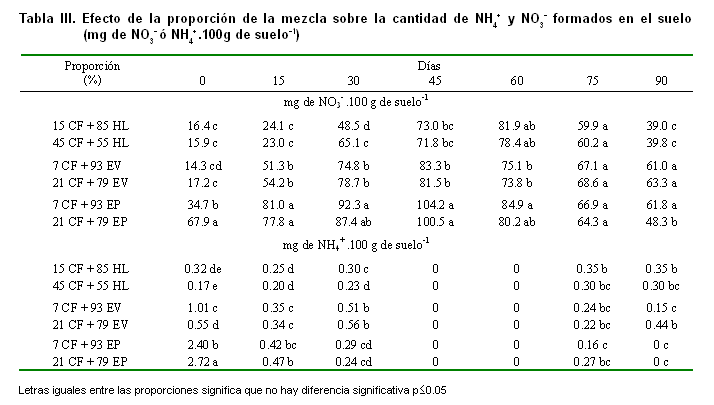
El contenido de N-NO3- y N-NH4+ en el suelo, para todas las variantes estudiadas durante los diferentes tiempos de determinación, evidencia que con todas las mezclas en estudio ocurre la mineralización del nitrógeno hasta la formación de nitratos. Comparando la cantidad de nitratos con la de amonio formado en el suelo (Figuras 1 y 2, Tablas III y IV), se aprecia que no existe acumulación de amonio y que este, en los momentos de mayor nitrificación, se hace cero, lo cual indica condiciones favorables para la microflora nitrificante.
De lo anterior se desprende que la composición orgánica de las mezclas estudiadas favorece la liberación de formas asimilables de nitrógeno para los cultivos, lo cual se asocia en gran medida a que la relación C/N (Tabla II) en las mezclas utilizadas es favorable a la mineralización y no a la inmovilización microbiana de nitrógeno (20).
Como regla general, no se encontraron diferencias significativas entre la cantidad de NH4+ y NO3- en el suelo, al comparar el efecto de las proporciones en las mezclas estudiadas para cada abono orgánico; sin embargo, se aprecia que las mezclas formadas con EV y EP favorecen la formación de nitratos en el suelo y particularmente en la mezcla donde el porcentaje de CF y la dosis de la mezcla son mayores (Tablas III y IV), lo cual puede deberse a que el aumento de la concentración de caliza fosfatada es lo que determina una mayor eficiencia en la transformación del material orgánico.
La cantidad de nitratos formados fue mayor en los tratamientos con la mezcla conformada con EP, seguida de la del EV y, por último, la del HL; sin embargo, la tasa diaria de formación de nitratos para los intervalos estudiados refleja que las mayores entregas ocurren, para el caso de las mezclas elaboradas con EP y EV, en el período de 0-15 días de la incubación, mientras que para el caso de la que contiene el HL y el control ocurre entre los 15-30 y 30-45 días respectivamente (Figura 3). En todos los casos, a partir de los 45 días se presenta una disminución en la tasa de formación de nitratos, hasta hacerse negativa para todos los tratamientos después de los 60 días, coincidiendo con una desaparición del nitrato formado (Figura 1); este hecho, al igual que la reaparición de amonio después de los 60 días, puede estar motivado por los fenómenos de inmovilización y mineralización secundaria que ocurren en ambientes cerrados, es decir, sobre fracciones más complejas de la materia orgánica, lo que sugiere que para el uso de estas mezclas debe considerarse el momento de aplicación, de forma que se garantice un mayor aprovechamiento del nitrógeno mineralizado (20).
Es importante señalar que la mezcla conformada por el HL presentó un patrón de mineralización muy similar al del suelo control (Figura 3), lo que indica que no hay cambios bruscos en la microflora y, por tanto, provoca una menor alteración del equilibrio biológico del suelo; desde el punto de vista orgánico, el HL se ratifica como un sustrato de mineralización lenta (20).
CONCLUSIONES
Las mezclas de caliza fosfatada con humus de lombriz, estiércol vacuno y estiércol porcino, en las proporciones y dosis estudiadas, estimulan la actividad microbiológica del suelo y favorecen los procesos microbiológicos asociados a la mineralización del nitrógeno orgánico.
La biodegradabilidad de las mezclas se relacionó con las características del sustrato orgánico y fue más dependiente de la proporción de caliza fosfatada que de la cantidad de sustrato orgánico presente.
Independientemente de que las mezclas elaboradas con estiércol vacuno y porcino provocaron un mayor efecto sobre los procesos microbiológicos estudiados, la mezcla con humus de lombriz presentó un patrón de descomposición similar al suelo control, lo cual indica que esta no genera cambios bruscos en la microflora y, por tanto, provoca una menor alteración del equilibrio biológico del suelo.
REFERENCIAS
1. Alfonso, C. A. y Monedero, M. Uso, manejo y conservación de los suelos. ACTAF. 2004. 68 p.
2. Brechelt, A. Manejo ecológico del suelo. Fundación Agricultura y Medio Ambiente. Red de acción de Plaguicidas y sus alternativas para América Latina. 2004. 28 p. (Consultado: 7 de abril de 2008). Disponible en: < clusterorgan/codom.org.dol…manejo_ecologico_ del_suelo.pdf>.
3. Martin, G. y Rivera, R. Mineralización del nitrógeno de la Canavalía Ensiformis en un suelo Ferralítico Rojo de La Habana. Cult. Trop., 2004, vol. 35, no 3., p. 83-88.
4. Colás, A.; Díaz-Martín, B.; Cairo, P. y Machado de Armas, J. Efecto de la aplicación de dosis mínimas de abonos orgánicos y minerales naturales sobre el estado estructural del suelo pardo con carbonatos medianamente lavado (Inceptisol). Centro Agrícola, 2004, vol. 31, no. 3-4.
5. Cairo, P.; Carvajal, M.; Machado de Armas, J. y Díaz, B. Efecto de diferentes métodos de mejoramiento sobre la fertilidad de los suelos degradados dedicados al cultivo de la caña de azúcar. Centro Azúcar, 2001, vol. 2.
6. Morejón, L.; Milera, A. y Esquijarosa, H. Uso de una roca fosfatada cubana como fuente alternativa de fósforo para suelos ácidos. Memorias XXV Congreso Nacional de la Sociedad Mexicana de la Ciencia de Suelos. México. 1992. p. 36-40.
7. Font, L. Estimación de la calidad del suelo: Criterios físicos, químicos y biológicos. (Tesis presentada en opción al Grado Científico de Doctor en Ciencias Agrícolas). La Habana: Instituto Nacional de Ciencias Agrícolas, 2008. p. 105.
8. Vantour, A.; Fraser, M. y Mansfarrol, V. Informe final de proyecto “Tecnología para producir y manejar los fertilizantes organomineral en los agroecosistemas de viandas, granos y hortalizas”. Programa Ramal Científico- Técnico. Protección del Suelo por Métodos Sostenibles. Ministerio de la Agricultura: Instituto de Suelos, 2005. p. 75.
9. Tejada, M.; Benítez, C. y González, J. L. Effects of application of two organomineral fertilizers on nutrient leaching losses and wheat crop. Agron. J., 2005, vol. 97, p. 960-967.
10. Hernández, A.; Pérez, J. M.; Bosch, D. y Rivero, L. Nueva versión de clasificación genética de los suelos de Cuba. AGRINFOR, La Habana. 1999. p. 64.
11. Martínez, F.; Valdés, M. y Bahamonde, A. Manual de técnicas de análisis químico para el humus de Lombriz. Ministerio de la Agricultura. Instituto de Suelos, 2004. p. 38.
12. Makarov, B. N. y Geraschenko, L. B. Determination of the content of mineral forms of nitrogen in a single soil extract. Soviet Soil Sci., 1976, vol. 8, no. 1, p. 109-112.
13. Margesin, R. y Schinner, F. Manual of Soil Analysis. Monitoring and Assessing Soil Bioremediation. Heidelberg: Springer, 2005. 370p. ISBN: 10-3-540-25346-7.
14. Cariman, S. y Hermosilla, M. Seminario No 1. El ciclo del nitrógeno: mineralización del nitrógeno. Escuela Superior de Salud y Ambiente. Universidad Nacional de Comahue. 2006. p. 5.
15. Videla, C.; Pazos, A. y Trivelin, P. C. Mineralización bruta de nitrógeno bajo labranza convencional, siembra directa y pastura. Ciencia del Suelo, 2005, vol. 23, no. 2, p. 1850-2067.
16. Forster, J. Soil Nitrogen. En: Alef, K., Nannipieri, P (eds) Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. 1995. p. 79-87.
17. Martín, J.; Miralles de Imperial, R. y Beltrán, E. Mineralización del nitrógeno contenido en un lodo de depuradora secado térmicamente. Revista Internacional de Contaminación Ambiental, 2006, vol. 33, no. 3, p. 125-133.
18. Bargett, R. The biology of soil. A community and ecosystem approach. Oxford: University Press, 2005. 254 p. ISBN: 0-19-852502-8.
19. Alef, K. y Nannipieri, P. Methods in applied soil microbiology and biochemistry. San Diego: Ed. Academic Press, 1995. p. 575.
20. Martínez, F.; Calero, B. J.; Nogales, R. y Rovesti, L. Lombricultura. Manual práctico. La Habana: Instituto de Suelos, 2003, 98 p.
Recibido: 15 de mayo de 2008
Aceptado: 16 de abril de 2009