Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.3 La Habana jul.-set. 2010
CARACTERIZACIÓN DEL COMPORTAMIENTO MICORRÍZICO EN Brachiaria decumbens INOCULADA CON Glomus hoi-like
BEHAVIORAL CHARACTERIZATION Brachiaria decumbens mycorrhiza with Glomus hoi INOCULATED-like
Ms.C. Bannie VázquezI. E-mail: bannie@inca.edu.cu, Dr.C. R. RiveraII, Ms.C. Kalyanne FernándezIII y Ms.C. Yakelín RodríguezIII,
I Especialista
II Investigador Titular
III Investigadoras Agregadas del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana, Cuba, CP 32700.
RESUMEN
El experimento se realizó en el Instituto Nacional de Ciencias Agrícolas (INCA), con el objetivo de caracterizar el funcionamiento micorrízico de Brachiaria decumbens inoculada con Glomus hoi-like sobre un sueloFerralítico Amarillento estéril en dos canteros de 15 m de largo x 1 m de ancho a una altura de 20 cm. Para la toma de muestras se subdividieron los canteros en tres cuadrantes de 5 m y se realizaron muestreos a los 30, 60, 90 y 120 días después de la siembra. En los distintos cuadrantes se extrajeron plantas de un área de 25 cm x 25 cm, para evaluar la masa seca aérea y de las raíces correspondientes a dos profundidades (0-10 y 10–20 cm), así como la colonización fúngica y densidad visual. Asimismo, se determinó el número de esporas del HMA, tomándose dos muestras compuestas por tres y cinco submuestras en cada cuadrante en las dos profundidades estudiadas. No se encontraron diferencias estadísticas en los porcentajes de colonización micorrízica y densidad visual entre las dos profundidades, ambas variables se incrementaron en el tiempo y los mayores valores de colonización micorrízica se mostraron a los 90 días. La producción de esporas se fue incrementando en el tiempo y no se encontraron diferencias significativas entre la toma de tres y cinco submuestras por muestra compuesta a los 30 y 60 días; sin embargo, a los 90 y 120 días se encontraron diferencias estadísticas, mostrando la muestra compuesta por cinco submuestras los mayores valores de número de esporas en ambos casos. El número de esporas se correlacionó significativamente con la colonización micorrízica; no obstante, estas dos variables no se correlacionaron con la masa seca radical.
Palabras clave: Brachiaria decumbens, profundidades de muestreo, Glomus hoi-like.
ABSTRACT
The experiment was carried out at the National Institute of Agricultural Sciences (INCA), with the aim of characterizing the mycorhizal functioning of Brachiaria decumbens inoculated with Glomus hoi-like on a sterile Yellowish Ferralitic soil in two 15-m-long x 1-m-wide seedbeds at 20 cm high. To take samples, seedbeds were subdivided into three 5-m quadrants and samplings were performed at 30, 60, 90 and 120 days after seeding. Within those quadrants, plants were extracted from a 25-cm x 25-cm area to evaluate root and aerial dry weights in two depths (0-10 and 10-20 cm), as well as fungal colonization and visual density. Also, the number of AMF spores was determined by taking two samples made up of three and five sub-samples in each quadrant in both depths studied. No statistical differences were recorded in the mycorhizal colonization and visual density percentages between the two depths, both variables increased in time and the highest mycorhizal colonization values were observed at 90 days. Spore production started to increase with time and there were not any significant differences between taking three and five sub-samples per compound sample at 30 and 60 days; however, at 90 and 120 days, there were statistical differences, since the sample composed by five sub-samples showed the highest spore numbers in both cases. The spore number was significantly correlated with mycorhizal colonization; nevertheless, these two variables were not correlated with root dry weight.
Key words: Brachiaria decumbens, sampling depths, Glomus hoi-like.
INTRODUCCIÓN
Los hongos micorrízicos arbusculares (HMA) son microorganismos simbiontes y ubicuos pertenecientes al phylum Glomeromycota (1), queforman asociaciones mutualistas con las raícesde la mayoría de las plantas superiores,entre las que se encuentran los principales cultivos de interés comercial.
Brachiaria decumbens es una especie con una dependencia micorrízica de aproximadamente un 80 % (2), que se utiliza como alimento para el ganado vacuno, bien sea con pastizales o en áreas de forraje permanente para ensilar (3).
Los beneficios de los HMA en los agroecosistemas de pastizales están estrechamente ligados al aumento de la absorción de elementos minerales, agua y otros compuestos, a través de una red de hifas interconectadas, que incrementan el volumen de suelo, exploran las raíces, facilitan el acceso de las plantas a los nutrientes menos asimilables y a la vez mejoran la estructura del suelo (4).
Se ha trabajado exitosamente la inoculación micorrízica de Brachiaria decumbens en el momento de la siembra, logrando pastizales con una micorrización efectiva y altas producciones de masa seca.ha-1 al inocular cepas eficientes según el tipo de suelo, además de ahorros importantes de fertilizantes minerales (5, 6).
Precisamente por la alta respuesta del cultivo a la inoculación micorrízica, es fundamental poder caracterizar la dinámica del funcionamiento del hongo a través de diferentes indicadores, como el porcentaje de colonización micorrízica, la densidad visual y producción de esporas; siendo esta última variable un factor decisivo en el mantenimiento de la micorrización en el pastizal. Por tanto, el objetivo de este trabajo ha sido contribuir a la caracterización del funcionamiento micorrízico en Brachiaria decumbens y al establecimiento de un método de toma de muestras, que permita evaluar las variables analizadas con mayor precisión.
MATERIALES Y MÉTODOS
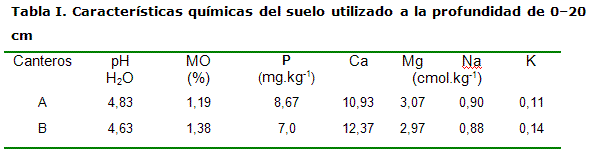
El experimento se realizó en el Instituto Nacional de Ciencias Agrícolas (INCA), en octubre del 2007; para ello se utilizaron dos canteros de 15 m de largo x 1 m de ancho, a una altura de 20 cm., conteniendo un suelo Ferralítico Amarillento (7), el cual se esterilizó inicialmente con una solución de formol al 1 % aplicada a razón de 5 L.m-2 (Tabla I).
Para la caracterización química del suelo se utilizaron los siguientes métodos analíticos:
- el pH en H2O se determinó por potenciometría, utilizando una relación suelo:disolución 1:2,5
- el contenido de materia orgánica (% MO) se determinó siguiendo la metodología descrita por Walkley y Black y el fósforo (P2O5) por Oniani
- los cationes intercambiables se determinaron por una extracción con NH4AC 1 mol.L-1 a pH 7; calcio (Ca) y magnesio (Mg) por complexometría y potasio (K) por fotometría de llama (8).
Las semillas de Brachiaria decumbens sesembraron a una densidad de 13 g.m-2. Se utilizó un inoculante micorrízico certificado a base de Glomus hoi-like, con un título de 68 esporas.g-1, el cual se aplicó mediante la tecnología de recubrimiento (9).
En el momento de la siembra se aplicaron 150 g de N, P, K en la fórmula completa (9–13–17) y con posterioridad a los 30 días se aplicaron 75 g de urea (46–0–0), ambas se aplicaron por canteros de 15 m de largo. Los canteros se desyerbaron tres veces en la fase del cultivo y se regaron cada vez que la humedad del suelo reflejaba entre 75-80 % de su capacidad de campo.
Para la toma de muestras, se subdividieron los canteros en tres cuadrantes de 5 m y se realizaron muestreos a los 30, 60, 90 y 120 días después de la siembra. En todos los cuadrantes, se extrajeron plantas de un área de 25 cm x 25 cm., para evaluar la masa seca aérea y de las raíces correspondientes a dos profundidades (0-10 y 10–20 cm). La masa seca se determinó colocando las muestras en estufa a una temperatura de 65ºC hasta obtener masa constante. En las raíces extraídas a ambas profundidades también se evaluaron los porcentajes de colonización micorrízica y densidad visual (10, 11).
El número de esporas de HMA se evaluó tomándose en cada cuadrante y profundidad dos muestras de suelo compuestas por tres y cinco submuestras respectivamente, para lo cual se utilizó una barrena de 6 cm de diámetro. Las esporas se aislaron por el método de tamizado húmedo y decantado (12) y se contaron con ayuda de una placa de conteo de nematodos en un microscopio estéreo modelo Stemi 2000-C (40x).
Análisis estadístico. El comportamiento de los momentos de muestreo sobre la masa seca aérea y radical en las dos profundidades se determinó mediante un análisis de varianza de clasificación simple (ANOVA), siendo las medias con diferencias significativas comparadas según la prueba de Rangos Múltiples de Duncan para p£0.05.
Los datos del porcentaje de colonización micorrízica (%C) fueron transformados por la función 2arcsen√x. La influencia de la profundidad de muestreo (0-10 y 10-20 cm) sobre el porcentaje de colonización micorrízica y número de esporas de HMA se determinó mediante la comparación de las medias con sus intervalos de confianza al 95 %. De forma similar, se procedió con la influencia del número de submuestras tomadas en las muestras compuestas (tres y cinco) sobre el número de esporas en todos los momentos de muestreo.
Se analizó la influencia del porcentaje de colonización y la masa seca radical sobre la producción de esporas mediante una correlación, donde se utilizaron los datos del porcentaje de colonización micorrízica en la profundidad de 0-10 cm, las muestras compuestas por cinco submuestras en la producción de esporas y la masa seca radical a los 90 días en la profundidad de 0-10 cm.
En todos los casos, los análisis se realizaron utilizando el programa estadístico SPSS 11.5 para Windows con (p£0.05 %).
RESULTADOS Y DISCUSIÓN
En la Figura 1 se muestra la producción de masa seca aérea y radical en las dos profundidades del cantero durante el ciclo del cultivo de Brachiaria decumbens. La masa seca aérea (Figura 1A) mostró un comportamiento característico de un crecimiento, que se incrementa en el tiempo alcanzando valores máximos de 0.96 kg.m-2 a los 120 días.
En la masa seca radical 0-10 cm (Figura 1B) hasta los 90 días, se observó un crecimiento paulatino de la variable y, con posterioridad, en el intervalo enmarcado entre los 90 y 120 días, un incremento exponencial que alcanzó valores máximos de 0.84 kg.m-2, que fueron significativamente superiores a los encontrados en el resto de los momentos de muestreo. En la profundidad de 10-20 cm, no se encontraron diferencias significativas en los distintos momentos de muestreo, mostrando valores máximos de 0.11 kg.m-2. Estos resultados indican que el volumen de raíces de Brachiaria decumbens en la profundidad de 10-20 cm fue mucho menor que en la de 0-10 cm.
Otros afirman que más del 80 % de las raíces se encuentran en las capas superficiales, especialmente en los primeros 10 cm de profundidad (13, 14), lo cual fue corroborado con estos resultados.
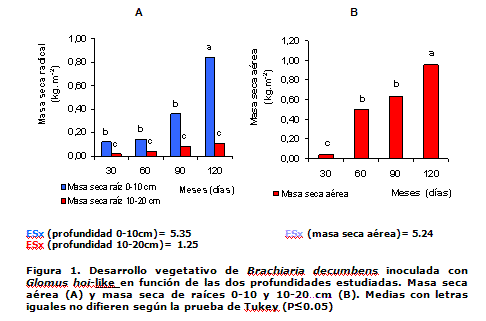
En la Figura 2 aparece la dinámica de los porcentajes de colonización micorrízica en las dos profundidades estudiadas. Se mostró a partir de los 60 días un incremento sostenido del porcentaje de colonización micorrízica hasta los 90 días de establecido el cultivo, con valores máximos de 60 %.
Resultados similares se observaron en condiciones de campo con plantaciones de Brachiaria inoculada con cepas eficientes en dos tipos de suelo (15).
A los 120 días comenzó a decrecer el porcentaje de colonización micorrízica (Figura 2), posiblemente asociado al manejo del riego que se provocó en estos canteros a partir de los 105 días, para estimular la esporulación de los HMA, al provocar el cese de los procesos de absorción y, por ende, la traslocación de fotosintatos al sistema radical.
Teniendo en cuenta los intervalos de confianza, no se encontraron diferencias significativas entre los porcentajes de colonización micorrízica en las dos profundidades en todos los momentos de muestreos (Figura 2), lo que se corrobora con trabajos realizadosen raíces de cafeto evaluadas a las mismas profundidades (16).
Estudios realizados en trigo (Triticum aestivum) y Brachiaria decumbens tampoco mostraron daños de la colonización micorrízica por la profundidad de muestreo, hasta los 20 cm de profundidad en ambos casos (17, 18).
Según estos resultados, las raíces de las plantas micorrizadas mantienen una colonización relativamente uniforme en su sistema radical, hasta los 20 cm de profundidad. Por tanto, se infiere que no es imprescindible muestrear las dos profundidades del sistema radical, para alcanzar una buena estimación de la colonización micorrizíca en el cultivo.
Los resultados corroboran los estudios realizados en pastos, donde se encontraron que la mayoría de las esporas y la colonización micorrízica arbuscular se presentan en los primeros 20 cm del suelo, disminuyendo de forma exponencial con la profundidad (19).
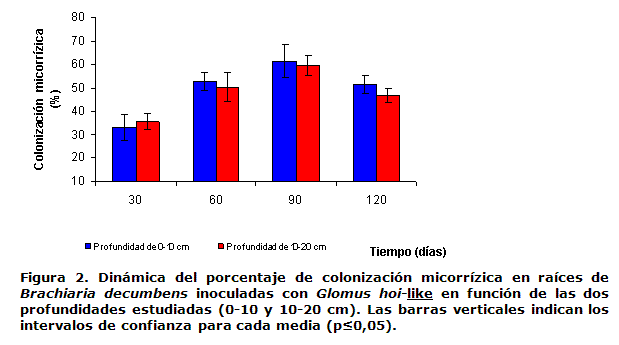
La Figura 3 muestra la dinámica del porcentaje de densidad visual en las dos profundidades, la cual refleja la intensidad con que la cepa inoculada colonizó el interior del sistema radical. Esta manifestó un comportamiento similar en ambas profundidades, con valores máximos a los 90 días de 3.07 %.
Trabajos realizados en campo abierto con Brachiaria decumbens inoculada con cepas eficientes de HMA, obtuvieron valores de densidad visual de 3.28 % (20), que fueron similares a los obtenidos en el presente trabajo.
Sin embargo, a los 120 días (Figura 3), se detectó una disminución del porcentaje de densidad visual en las dos profundidades, comportamiento que se corresponde con la dinámica del porcentaje de colonización micorrizíca (Figura 2) explicado en el manejo de riego ya referido.
No existieron diferencias significativas entre los porcentajes de densidad visual en las dos profundidades estudiadas, reflejándose una homogeneidad de la micorrización en todo el sistema radical; esta es la respuesta de la planta a la inoculación con HMA, que se expresa en todo el sistema radical con la misma intensidad.
La Figura 4 muestra el número de esporas de Glomus hoi-like en las dos profundidades analizadas y en función del número de submuestras (tres y cinco) tomadas por muestra. En todos los casos, el número de esporas en el suelo se incrementó notablemente en el tiempo durante todo el período estudiado, lo cual indica que el proceso de producción de nuevas esporas de HMA en el sistema estudiado es continuo, posiblemente derivado del propio desarrollo de la simbiosis en el sistema radical del cultivo y de la masa fúngica externa. Este comportamiento es típico del propio desarrollo de la asociación micorrizíca y el ciclo de vida del hongo (21).
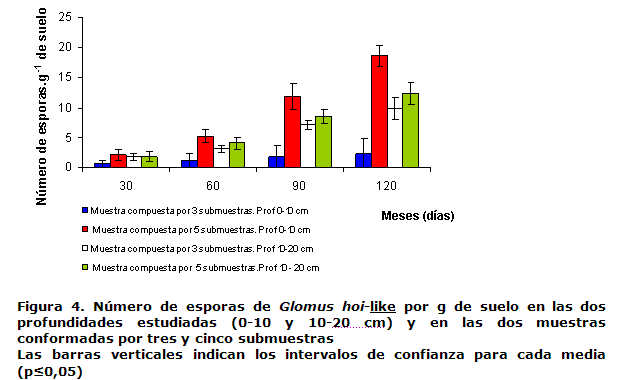
No se observaron diferencias significativas en el número de esporas en el suelo (Figura 4) entre las muestras compuestas por tres y cinco submuestras a los 30 y 60 días en las dos profundidades (0-10 y 10-20 cm). Teniendo en cuenta los intervalos de confianza a los 90 y 120 días, se mostraron diferencias significativas entre las muestras compuestas por tres y cinco submuestras en las dos profundidades, siendo mayor el número de esporas de HMA en la muestra compuesta por cinco submuestras en la profundidad de 0-10 cm.
En trabajos realizados, se ha encontrado que las principales fuentes de inóculo de HMA están amplia y uniformemente distribuidas en los 10 cm superficiales del suelo (22, 23, 24).
Por otra parte, se ha detectado que con la profundidad disminuye la cantidad de propágulos de HMA en el suelo y los resultados indicaron que para la estimación de las esporas, es necesario tener en cuenta las profundidades de muestreo (25).
Según los resultados de este trabajo, para estimar el número de esporas se recomienda tomar muestras compuestas por cinco submuestras, lo cual garantiza que el muestreo sea más representativo del área. En la Tabla II se muestra una correlación significativa entre el número de esporas de Glomus hoi-like y el porcentaje de colonización micorrízica en la profundidad de 0-10 cm, aunque existen contradicciones al relacionar estos factores, observándose que el número de esporas de HMA del suelo no necesariamente refleja la capacidad de colonización de estos hongos (26).
No mostraron correlación las variables mencionadas anteriormente con la masa seca radical, sobre esto puede estar influyendo que la masa seca de la raíz en la profundidad de 0-10 cm incluye el peso de varias raíces gruesas, que no están involucradas directamente en el proceso simbiótico y, por tanto, tampoco en la formación de esporas ni en el porcentaje de colonización micorrízica. El comportamiento de las cepas de HMA está determinado por la morfología y la tasa de crecimiento del sistema radical de la planta hospedera, la tasa de absorción de nutrientes y el flujo de carbohidratos en la interfase simbiótica (27).
REFERENCIAS
- Schüßler, A.; Schwarzott, D. y Walker, C. A new fungal phylum, the Glomeromycota plylogeny and evolution. Mycological Research, 2001, vol. 105, p. 1413-1421.
- Howeler, R. H.; Sieverding, E. y Saif, S. R. Practical aspects of mycorrhizal technology in some tropical crops and pastures. Plant and Soil, 1987, vol. 10, p. 77-81.
- Posada, A. R.; Franco, L. A.; Cuellar, A. P.; Sánchez, W. Inóculo de hongos de micorriza arbuscular en pasturas de Brachiaria decumbens (Poaceae) en zonas de loma y vega.Acta Biol. Colomb., 2007, vol. 12, no. 1, p. 113–120.
- Johnson, N. C.; Rowland, D. L.; Corkidi, L.; Egerton, L. M. y Allen, E. B. Nitrogen enrichment alters mycorrhizal allocation at five mesic to semi-arid grasslands. Ecol., 2003, vol. 84, p. 1895.
- González, P. J.; Plana, R.; Igarza, E.; Ramírez, J. Efectos del antecedente cultural en la respuesta de P. maximum, cv. Likoni a la inoculación de hongos micorrizógenos arbusculares. XV Congreso Científico del INCA. Programa y Resúmenes. 2006, p. 117.
- González, P. J.; Plana, R.; Rivera, R.; Fernández, F y Arbola, J. Efectos de la inoculación de hongos micorrízicos arbusculares en pastos del género Brachiaria, cultivados en suelo Pardo Mullido. Revista Cubana de Ciencia Agrícola, 2008, vol. 42, no. 1, p. 101.
- Hernández, A.; Pérez, J. M.; Bosch, D. y Rivero, L. Nueva versión de clasificación genética de los suelos de Cuba. Instituto de Suelos. Agrinfor, La Habana. 1999, p.64.
- Cuba. NRAG. 892-88. Suelos. Análisis químico. Reglas generales. C. de la Habana. MINAG. Cuba. 1988.
- Fernández, F. y Rodríguez, E. Estudios básicos de la tecnología de recubrimiento de semillas con inoculantes micorrizógenos VA. En: Programa y Resúmenes X Sem. Cient. Inst. Nac. Cienc. Agríc. La Habana. 1996, p. 87-88.
- Phillips, J. M. y Hayman, D. E. Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br Mycol. Soc., 1970, vol. 55, p. 158-161.
- Herrera, R. A.; Ferrer, R. L.; Furrazola, E. Estrategia de funcionamiento de las micorrizas VA en un bosque tropical. Biodiversidad en Iberoamérica: Ecosistemas, evolución y procesos sociales (Eds. Maximina Monasterio). Programa Iberoamericano de Ciencia y tecnología para el desarrollo. Subprograma XII, Diversidad Biológica, Mérida (12).1995.
- Gerdemann, J. W. y Nicholson, T. H. Spore of mycorrhizae endogone species extracted from soil by wet sieving and decanting. Trans Br. Mycol. Soc., 1963, vol. 46, p. 235-244.
- Ramírez, B. L.; Ramírez, H. F. y Suárez, J. C. Captura de carbono y desarrollo radicular de sistemas de uso del suelo en la Amazonia Colombiana. LivestockResearch for Rural Development, 2009, vol. 21, no. 91. Consultado en Junio 30, http://www.lrrd.org/lrrd21/6/rami21091.htm.2009.
- Paneque, V. M.; Calaña, J. M.; Rivera, R.; Castellanos, E.; Calvo, J. D.; Hernández, R. y Mederos, J. D. Estudio de la distribución de las raíces de Brachiaria decumbens en el perfil del cantero, cuando se utiliza como planta hospedera para la producción de EcoMic® y su relación con su contenido de esporas. 2006.
- González, P. J.; Vieito, E.; Ramírez, J. F. y Cruz, M. Influencia de la fertilización orgánica en la producción de forraje y semillas de Canavalia ensiformis. Ecosistemas Ganaderos, 2007, vol. 1, p. 33.
- Montilla, M.; Herrera, R. y Monasterio, M. Influencia de los períodos de descanso sobre la distribución vertical de raíces, micorrizas arbusculares y pelos radicales en páramos andinos venezolanos. Sociedad Venezolana de Ecología. Ecotrópicos, 2002, vol. 15, no. 1, p. 85-98.
- Covacevich, F.; Fernández-Palma, H.; Sainz-Rozas, P. y Barbieri, H. Crecimiento y micorrización de trigo en siembra directa bajo distintas formas de colocación de fósforo. Ciencia del Suelo Unidad Integrada. INTA-FCA Balcarce. 2006.
- Mederos, J. D. Evaluación de sustratos naturales y la efectividad de la cepa de HMA Glomus hoi-like para la producción de un inoculante micorrizógeno comercial. Tesis presentada en opción al Título Académico de Maestro en Ciencias en Nutrición de las Plantas y Biofertilizantes. Instituto Nacional de Ciencias Agrícolas. 2009, p. 74.
- Peña-Venegas, C.; Cardona, G.; Arguelles, J. H. y Arcos, A. L. Micorrizas arbusculares del sur de la Amazonía Colombiana y su relación con algunos factores fisicoquímicos y biológicos del suelo. Acta Amazónica, 2007, vol. 37, no. 3, p. 327–336.
- González, P.J.; Plana, R.; Rivera, R.; Fernández, F. y Arzola, J. Efectos de la inoculación de hongos micorrízicos arbusculares en pastos del género Brachiaria, cultivados en suelo Pardo Mullido. Revista Cubana de Ciencia Agrícola, 2008, vol. 42, no. 1, p. 101.
- Fernández, F.; Dell Amico, J. M., Fernández, K.; Providencia, I. de la, Rodríguez, Y. Funcionamiento de un inoculante líquido a base del hongo micorrízico arbuscular de Glomus sp. (INCAM-4) en arroz (Oryza sativa var. J-104) en suelo salino. Cultivos Tropicales, 2006, vol. 27, no. 2, p. 27-33.
- Pattinsb, G. S.; Sutton, B. G.; McGEE, P. A. Simulated fire reduces the density of AMF at the soil surface. Mycol. Res., 1990, vol. 103, p. 491-496.
- Seguel, A.; Rubio, R.; Carrillo, R. Niveles de glomalina y su relación con características químicas y biológicas del suelo (andisol) en un relicto de bosque nativo del sur de Chile. Bosque, 2008, vol. 29, no. 1, p. 11-22.
- Lovera, M. y Cuenca, G. Diversidad de hongos micorrízicos arbusculares (HMA) y potencial micorrízico del suelo de una sabana natural y una sabana perturbada de la gran sabana, Venezuela. INCI, 2007, vol. 32, no. 2, p. 108-114.
- Castillo, C. G.; Rubio, R.; Rouanet, J. L.; Borie, F. Arbuscular mycorrhizal fungal propagules as affected by tillage and crop rotation in an Ultisol of southern Chile. Biol. Fert. Soils, 2006.
- Hayman, D. S. y Stovold, G. E. Spore populations and infectivity of vesicular arbuscular mycorrhizal fungi in New South Wales. Aust. J. Bot., 1979, vol. 27, p. 227-233.
- Fernández, F. La simbiosis micorrízica arbuscular. En: R. Rivera /et al./.El manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso. El Caribe. 2003, p.13-40.
Recibido: 6 de Julio de 2009
Aceptado: 13 de Mayo de 2010