Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.3 La Habana jul.-set. 2010
Determinación de la estabilidad genética en cuatro especies del banco de germoplasma de papa en Cuba conservadas In Vitro
Determination of genetic stability in four species of potato germplasm maintained in vitro in Cuba
Dr.C. J. G. CastilloI y Ms.C. Dania VargasI; Dra.C. Ana EstévezII y Dra.C. María M. HernándezII, Ms.C. J. L. SalomónIII, Aymara PérezIV, Dr.C. O. Borrás-HidalgoV y Dr.C. Y. LópezV y Dr.C. A. D. ArencibiaVI
I Investigadores Agregados. E-mail: juanc@inca.edu.cu
II Investigadoras Titulares
III Investigador Auxiliar
IV Especialista del departamento de Genética y Mejoramiento Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana, CP 32700
V Investigadores del Centro de Ingeniería Genética y Biotecnología (CIGB)
VI Investigador del Instituto Nacional de Investigaciones de la Caña de Azúcar (INICA), La Habana, Cuba
RESUMEN
Se estudiaron cuatro especies de papa conservadas in vitro durante diez años, con el objetivo de determinar si mantenían su estabilidad genética al compararlas con las de la colección base mantenida en campo. Se realizó una descripción morfoagronómica de las especies de ambas procedencias y se emplearon métodos isoenzimáticos y moleculares, para saber si se producían cambios en los patrones de bandas de las especies conservadas in vitro. Se utilizaron los sistemas isoenzimáticos peroxidasas, esterasas, polifenol oxidasas y anhidrasa carbónica, y el polimorfismo de longitud de fragmentos amplificados (AFLP) como marcador molecular. Las cuatro especies conservadas fueron: Solanum schruteri Buk, Solanum dolichostigma Buk, Solanum jamesii Jorry Solanum tuberosum L. Las plántulas se conservaron en un medio de retardamiento del crecimiento y fueron sub-cultivadas dos veces al año. Se evaluaron los caracteres cualitativos, del rendimiento y sus componentes, para determinar la existencia de cambios fenotípicos en las especies estudiadas. En el análisis de AFLP se emplearon cinco combinaciones de cebadores. Se realizó una prueba t de comparación de medias al rendimiento y sus componentes, para calcular la existencia de diferencias entre las accesiones. No se encontraron cambios fenotípicos notables para los caracteres cualitativos, el rendimiento y sus componentes. Los sistemas isoenzimáticos no detectaron cambios en los patrones de bandas, mientras que en el análisis de AFLP, los patrones de bandas de las plantas conservadas in vitro mostraron diferencias marcadas en cuanto al número de bandas, por lo que se concluye que no se mantiene la estabilidad genética de las accesiones estudiadas en el tiempo de conservación evaluado.
Palabras clave: papa, germoplasma, estabilidad genética, marcadores moleculares.
ABSTRACT
Four in vitro-preserved potato species were studied for ten years, with the aim of determining if they kept their genetic stability when compared to those from the base collection remaining in the field. Species of both origins were morphologically described; isozymatic and molecular methods were used to evaluate if changes took place in the band patterns of in vitro-preserved species. The isozymatic systems, peroxidases, esterases, polyphenol oxidases and carbon anhydrase, and the AFLP molecular marker were employed. The four preserved species used were: Solanum schruteri Buk, Solanum dolichostigma Buk, Solanum jamesii Jorr and Solanum tuberosum L. Seedlings were preserved in a slow growth medium and sub-cultivated twice a year. The qualitative characters, yield and its components were evaluated, to determine if there were phenotypical changes among the species studied. Five primer combinations were used in the AFLP analysis. A t test of media comparison was made to yield and its components, to calculate if there were differences among accessions. There were not any remarkable phenotypical changes for the qualitative characters, yield and its components. Isozymatic systems did not detect changes in the band patterns, while AFLP analysis showed notable differences concerning band number; thus, it is concluded that genetic stability is not maintained in the different species studied during the preservation period evaluated.
Keys words: potato, germplasm, genetic stability, molecular markers.
INTRODUCCIÓN
Hoy en día existe una mayor necesidad de conservar los bancos de germoplasma fuera de su hábitat natural para su utilización y explotación. Esto puede realizarse a través de las colecciones in vitro (1), las cuales tienen la ventaja sobre el método de conservación tradicional, de reducir el riesgo de la erosión genética debido a desastres naturales, plagas y enfermedades.
El cultivo de la papa se lleva a cabo mediante la propagación vegetativa, por lo cual se ve afectado seriamente por el ataque de patógenos externos. El establecimiento, el mantenimiento y la conservación de los bancos de germoplasma en este cultivo es de gran importancia, para los trabajos de mejoramiento genético, pues son el punto de partida para la obtención de nuevas variedades mejoradas, aunque durante este proceso pueden producirse variaciones genéticas en los materiales genéticos conservados (2).
Estas variaciones pueden estudiarse mediante el uso de marcadores morfoagronómicos, isoenzimáticos y moleculares. Los primeros corresponden a los caracteres morfológicos, que son importantes en la utilización de diferentes genotipos (3). Los isoenzimáticos posibilitan el estudio de la variación genética y las similitudes o diferencias entre organismos al nivel de su composición isoenzimática o proteica, independientemente del efecto que puede ejercer el medio ambiente (4), y los moleculares, como el polimorfismo de longitud de fragmentos amplificados (AFLP), han permitido detectar un polimorfismo elevado entre diferentes especies de plantas, lo que los hace adecuados para los estudios de biodiversidad (5), análisis de colecciones de germoplasma (6) y la determinación de la estabilidad genética de plantas regeneradas (7), entre otras.
Las muestras conservadas in vitro en la colección de germoplasma de papa del INCA cuenta con 120 accesiones, las cuales se encuentran en medio de conservación desde hace más de una década. El mantenimiento de esta colección es esencial, como resguardo de la colección de campo, pues permite la regeneración de las muestras en caso de pérdidas o afectaciones sustanciales en la colección de campo (8). Por tal motivo, es importante conocer si durante el tiempo de conservación se mantiene la estabilidad genética en los materiales conservados, de forma tal que se garantice la integridad genética de las accesiones.
Es por ello que este trabajo estuvo encaminado a evaluar la estabilidad genética en accesiones, regeneradas a partir de la conservación in vitro del banco de papa en Cuba,mediante elempleo de marcadores morfoagronómicos, isoenzimáticos y moleculares.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en las instalaciones del Instituto Nacional de Ciencias Agrícolas (INCA) y el Centro de Ingeniería Genética y Biotecnología (CIGB).
Se estudiaron cuatro especies de papa conservadas in vitro por más de diez años, en medio de crecimiento mínimo, realizándole dos subcultivos cada año. Se tomaron cuatro vitroplántulas por accesiones, que fueron adaptadas previamente y plantadas posteriormente en invernadero. Los tubérculos obtenidos se conservaron en cámaras refrigeradas, conjuntamente con los tubérculos originales de la colección base, los que se plantaron en macetas de 0,30x0,30 m en el invernadero de la sede central del INCA y en macetas de 0,20x0,20 m en el CIGB durante dos años. Las atenciones culturales se realizaron de forma manual y el riego de forma localizada. Las macetas contenían una mezcla de suelo y materia orgánica en proporción 2:1.
Las especies de papa conservadas in vitro(MS+manitol) y cultivadas en el campo fueron las siguientes: Solanum schruteri Buk, Solanum dolichostigma Buk, Solanum jamesii Jorr y Solanum tuberosum L. (var. 3-92-85).
Evaluación morfoagronómica de las accesiones evaluadas. Durante dos campañas, 2003-2004 y 2004-2005, se realizó una descripción morfoagronómica detallada, para comprobar cambios visibles del fenotipo de las accesiones según la procedencia, utilizando los descriptores propuestos por Huamán y Gómez (9).
Análisis isoenzimáticos. Estos se realizaron mediante los sistemas peroxidasas, esterasas, anhidrasa carbónica y polifenol oxidasas, para los que se tomaron muestras de 1,5-3,0 g de tejido foliar fresco de las hojas terminales a los 25 días de plantadas las accesiones en macetas en el área central del INCA. Se hicieron las tinciones fotoquímicas para las enzimas peroxidasas, esterasas y polifenol oxidasas (10) y, en el caso de la anhidrasa carbónica, se utilizó la metodología propuesta por González (11).
Análisis molecular. Se realizó mediante el AFLP, para el cual se tomaron muestras de 3 g de hojas jóvenes de plantas de las accesiones estudiadas, a los 25 días de plantadas en los invernaderos del CIGB. Las muestras se liofilizaron en N líquido y conservaron a -20oC. El ADN genómico total de cada accesión se aisló por el método de CTAB (12) y su calidad se comprobó por chequeo electroforético en geles de agarosa 0,8 %.
El análisis de AFLP siguió la metodología de Vos (13). Los oligonucleótidos se confeccionaron por el sintetizador de ADN Milligen Expedite 8909 (Millipore Corp. Bedford, MA, EE.UU.) en el CIGB. Se utilizaron cinco combinaciones de cebadores MseI+act-PstI+gcc, MseI+cga-PstI+aac, MseI+agc-PstI+aac, MseI+cgg-PstI+cct y MseI+gac-PstI+agc.
Análisis estadísticos. Para el rendimiento y sus componentes se realizó una prueba t de comparación de valores relacionados mediante el paquete estadístico SPSS versión 11.5 para Windows, con el fin de determinar si existían diferencias significativas entre las muestras según su procedencia.
Para los análisis isoenzimáticos y moleculares se evaluaron las bandas de forma binaria, considerando el valor 0 como ausencia y 1 como presencia de la banda. A partir de las matrices de los datos originales, se calculó la similitud genética (Genetic Similarity, GSij) entre cada par de accesiones, utilizando solo las bandas polimórficas mediante el paquete estadístico Ntsys-pc 2.02i. Los agrupamientos se efectuaron con el algoritmo SAHN (Sequential Agglomerative Hierarchical and Nested) utilizando el índice de similitud (IS) de Jaccard. El método de agrupamiento empleado fue el de la media aritmética no ponderada (UPGMA-Unweighted pair-group method arithmetic average). Las matrices de valor cofenético se obtuvieron mediante el algoritmo COPH del paquete estadístico Ntsys-pc y comparadas con las matrices originales que se utilizaron en los agrupamientos, de acuerdo con la prueba de correspondencia de Mantel y empleando el algoritmo de comparación Mxcomp.
RESULTADOS Y DISCUSIÓN
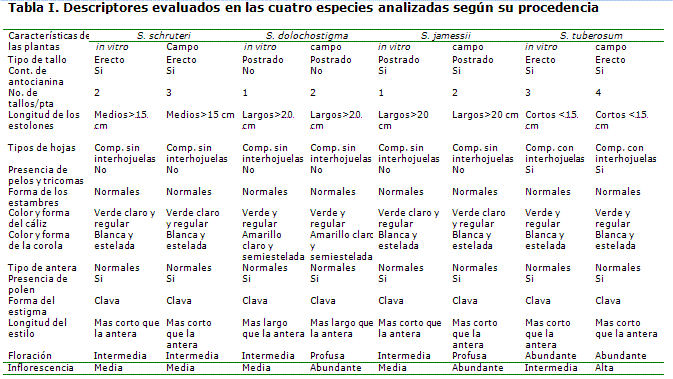
Evaluación morfoagronómica de las accesiones estudiadas. En la Tabla I se aprecia que no existieron cambios significativos en cuanto al fenotipo. Los caracteres cualitativos se mantuvieron inalterables y solo sufrió cambios el carácter número de tallos por planta, que fue ligeramente superior en todos los casos, cuando la especie provenía de la colección base con respecto a las in vitro. Otro cambio notable fue el que se manifestó en la intensidad de la floración, que a excepción de la especie Solanum schruteri, fue mayor cuando las plantas provenían de la colección base.
Es importante tener en cuenta la estabilidad genética de los caracteres morfoagronómicos, pues en cualquier programa de mejoramiento puede ser útil, cuando se quieren mantener inalterables caracteres de importancia económica (14) y se necesita mejorar un carácter determinado (15). En trabajos con híbridos somáticos de papa entre las especies S. tuberosum L. (48x) y S. brevidens (24x) ha sido difícil mantener la estabilidad de los caracteres morfoagronómicos, debido posiblemente a pérdidas de cromosomas en los procesos de regeneración (16).
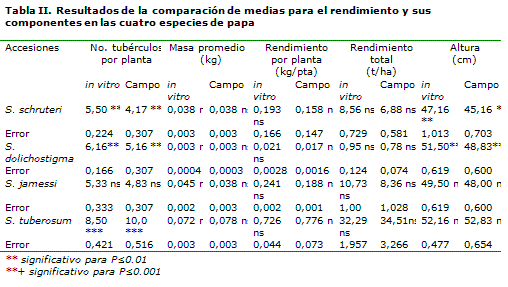
En la Tabla II se presentan los resultados de la prueba t de comparación de medias, efectuada para el rendimiento y sus componentes en las cuatro especies estudiadas. Se observa, en la mayoría de las especies, un ligero incremento de los valores de los caracteres evaluados, cuando las especies provenían de la conservación in vitro, en relación con las provenientes del campo, excepto para la especie Solanum tuberosum. La Solanum jamessi no presentó diferencias significativas para ninguno de los caracteres evaluados, mientras que la Solanum dolichostigma y Solanum schruteri mostraron diferencias significativas para el número de tubérculos y la altura de la planta.
La especie Solanum tuberosum presentó diferencias altamente significativas, para el número de tubérculos por planta, no así para el resto de los caracteres. Se ha podido constatar la estabilidad fenotípica, del rendimiento y sus componentes en el cultivo de la papa, al estudiar 12 clones en condiciones de campo (17). En este mismo sentido, no se han encontrado cambios fenotípicos notables en los componentes del rendimiento en plantas de soja crioconservadas y no crioconservadas (18).
Análisis isoenzimático. En la Figura 1 se presentan los patrones isoenzimáticos evaluados para el análisis del comportamiento de la estabilidad genética de las cuatro especies estudiadas. Como se aprecia en ella, se mantuvieron los patrones de bandas idénticos para cada par de muestras de cada accesión. Los sistemas peroxidasas y esterasas fueron los de mayor número de bandas para ambas procedencias. Estos sistemas fueron, además, los más polimórficos y los que presentaron los mayores niveles de tinción y grosor de las bandas; no obstante, la intensidad de tinción y el grosor de las bandas no es un indicador exacto de equivalencia genética (19), pues ello depende, en gran medida, del tipo de material vegetal (20) y la concentración de las muestras (21).
El alto polimorfismo de los sistemas esterasas y peroxidasas se ha manifestado al estudiar las progenies provenientes de cuatro cruces intraespecífcos de papa en el programa de mejoramiento cubano (22). En este mismo sentido, se ha encontrado también un elevado polimorfismo genético de estos dos sistemas isoenzimáticos, al estudiar la estabilidad genética de callos de papa conservados in vitro (2).
La anhidrasa carbónica, por su parte, manifestó un bajo polimorfismo, ya que presentó el mayor número de bandas comunes y no reflejó diferencias entre los patrones de bandas de las plantas de ambas procedencias. Resultados similares ya han sido informados por otros que encontraron para este sistema un marcado monomorfismo en callos de papa, utilizando diferentes concentraciones de Pectimorf (22). El sistema polifenol oxidasas, por su parte, reflejó el menor número de bandas y, por tanto, el menor polimorfismo. Este sistema ha sido empleado con éxito en los estudios de tolerancia al calor en tomate (23).
En la Figura 2 se observa el dendrograma formado a partir de las bandas polimórficas en los cuatro sistemas isoenzimáticos realizados. Se obtuvieron coeficientes de similitud del 100 % para las accesiones de ambas procedencias, lo que demuestra que los sistemas isoenzimáticos utilizados no detectaron cambios en los patrones de bandas en las accesiones conservadas. En la colección de yuca del CIAT, no se encontraron variaciones detectables en los patrones de bandas de plantas procedentes in vitro y de la colección base durante diez años de estudio; utilizando diferentes sistemas isoenzimáticos (24). Ya se han utilizado las técnicas isoenzimáticas, para detectar estabilidad en los materiales conservados in vitro con resultados exitosos (2, 25). Sin embargo, es importante aplicar técnicas más novedosas y avanzadas que complementen estos resultados.
Las diferencias observadas en los patrones de bandas de las muestras evaluadas pudieran deberse a que las plántulas se conservaron en un medio de crecimiento mínimo, que contenía sustancias retardadoras del crecimiento (manitol), como parte de los componentes del medio de cultivo, en el cual permanecieron durante largo tiempo. Se ha comprobado que el uso de retardadores del crecimiento puede producir cambios morfológicos, provocar la formación de callos, vitrificación o generar mutaciones en las plantas conservadas, lo cual atenta contra su estabilidad genética (26). Se ha informado, además, la utilización de un nuevo producto retardador del crecimiento con resultados alentadores y que no produce, hasta el momento, variaciones genéticas detectables en los materiales in vitro, aunque el tiempo evaluado fue de 16 meses y utilizaron para el estudio marcadores RAPD (27).
En el germoplasma de papa de Filipinas, en un monitoreo realizado en el banco de conservación in vitro, durante un período entre dos y 10 años, se encontraron unas 311 variedades de papa, 13 de ellas con variaciones genéticas detectables por métodos isoenzimáticos y moleculares (28). También se ha detectado variación genética, al analizar la estabilidad de 22 variedades de caña de azúcar conservadas in vitro, donde una de ellas resultó diferente en cuanto a la resistencia a la roya de la caña (29). Sin embargo, no se ha detectado variación genética en variedades de boniato conservadas en campo e in vitro durante diez años, utilizando AFLP y microsatélites, aunque se sugiere que la no detección de variabilidad genética en los materiales conservados in vitro no asegura que los genotipos analizados sean genéticamente estables; pues los cambios a nivel molecular pueden tener efectos deletéreos no detectables (30).
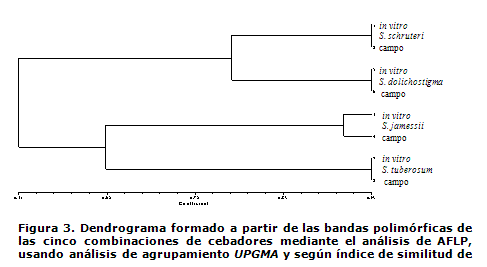
Al analizar el dendrograma formado a partir de las bandas polimórficas obtenidas mediante los marcadores AFLP en las cinco combinaciones de cebadores (Figura 3), utilizando el índice de Jaccard (z= 0,78), se observó que tanto las especies provenientes del cultivo in vitro como las de la colección base poseen índices de similitud cercanos entre ellos, pero no es de 1 (100 %). Los IS entre los patrones de banda de cada accesión fueron altos, llegando a ser de un 93 % para las especies S. schruteri, S. dolichostigma y S. tuberosum, mientras que para la especie S. schruteri, el índice de similitud fue de alrededor del 90 %.
La técnica de AFLP logró detectar los cambios que se produjeron a nivel de ADN y que no fueron detectados a nivel isoenzimático. Estudios recientes confirman la eficiencia de esta técnica y otras de marcadores moleculares, en la determinación de la estabilidad genética en plantas de papa derivadas de cultivo in vitro (31, 32), así como en otros cultivos (33, 34).
Los resultados permitieron determinar que no se mantiene la estabilidad genética de las accesiones estudiadas; por tanto, se sugiere la utilización de nuevos retardadores del crecimiento, como el sorbitol y acimidol, que se han empleado con éxito en la conservación a mediano plazo del germoplasma de papa a nivel mundial.
REFERENCIAS
- Gepts, P. Plant genetic resources conservation and utilization: The accomplishments and future of a societal insurance policy. Crop Sci., 2006, vol. 46, p. 2278–2292.
- Lara, R. M.; Florido, M.; Plana, D.; Moré, O.; González, M. E.; Álvarez, M. y Hernández M. M. Isoenzymatic analisys for detecting in vitro variability and/or stability of economically important crops. Cultivos Tropicales, 2003, vol. 24, no. 3, p. 39-47.
- Franco, T. L. e Hidalgo, R. (eds.). Análisis estadístico de datos de caracterización morfológica de recursos fitogenéticos. Boletín técnico no. 8, Instituto Internacional de Recursos Fitogenéticos (IPGRI), Cali, Colombia. 2003, 89 p.
- Iglesias, L. Estudio de la variabilidad morfoagronómica y bioquímica en soya (Glycine max L. Merrill). Tesis de Grado (Dr. en Ciencias Agronómicas). INCA. La Habana. 1986, 232 p.
- Veteläinen, M.; Gammelgard, E. y Valkonen, J. P. T. Diversity of nordic landrace potatoes (Solanum tuberosum L.) revealed by AFLPs and morphological characters. Genetic Resources and Crop Evolution, 2005, vol. 52, no. 8, p. 1072-1077.
- Negi, M. S. V.; Sabharwal, S. R. y Lakshmikumaran, M. Utility of AFLP markers for the assessment of genetic diversity within Brassica nigra germplasm. Plant Breeding, 2004, vol. 123, no. 1, p. 13-19. Sharma, S. K.; Glenn, J. B.; Mark, O. W. y Millam, S. Stability of potato (Solanum tuberosum L.) plants regenerated via somatic embryos, axillary bud-proliferated shoots, microtubers and true potato seeds: a comparative phenotypic, cytogenetic and molecular assessment. Revista Planta. Article On line, 2005.
- Estévez, A.; González, M. E.; Castillo, J.; Salomón, J. L.; Cordero, M.; Ortíz, U. y Hernández, M. Informe final proyecto PNCT Evaluación y caracterización morfobotánica y bioquímica del germoplasma cubano de papa. Cod. 015-00023. INCA. 2003, 92 p.
- Huamán, Z. y Gómez, R. Descriptores de papa para la caracterización básica de colecciones nacionales. Edición actualizada. Centro Internacional de la Papa (CIP), Lima. 1994, 10 p.
- Iglesias, L. Utilización de marcadores bioquímicos y moleculares en el mejoramiento genético de la papa. Cultivos Tropicales, 1994, vol. 15, no. 2, p. 106-121.
- González, C. Comportamiento genético bioquimicos de la lima persa SRA-58 (Citrus latifolia) sobre diferentes patrones en Cuba. (Tesis de Doctorado). UH. 1989.
- Dellaporta, S. L.; Wood, J. y Hichs, J. B. A plant molecular DNA minipreparation, versión II. Plant Mol. Biol. Rep., 1993, vol. 1, p. 19-21.
- Vos, P.; Hogers, R.; Bleeker, M.; Reijans, M.; Lee, T. van de; Hornes, M.; Fritjers, A.; Pot, J.; Kuiper, M. y Zabeau, M. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research, 1995, vol. 23, no. 21, p. 4407-4414.
- Ortiz, R. y Golmirzaie, A. M. Genetic parameters for agronomic characteristics. I. Early and intermediate breeding populations of true potato seed. Hereditas, 2003, vol. 139, no. 2, p. 212–216.
- Liu, J., Liu, L., Hou, N., Zhang, A. y Liu, C. Genetic diversity of wheat gene pool of recurrent selection assessed by microsatellite markers and morphological traits. Euphytica, 2007, vol. 155, no. 1-2, p. 249-258.
- Preiszner, J.; Fehér, A.; Veisz, O.; Sutka, J. y Dudits, D. Characterization of morphological variation and cold resistance in interspecific somatic hybrids between potato (Solanum tuberosum L.) and S. brevidens. Euphytica, 1991, vol. 57, no. 1, p. 137-49.
- González, M. E.; Estévez, A.; Castillo, J.; Salomón, J. L.; Varela, M.; Ortiz, U. y Ortiz, E. Utilización del método biplot en los análisis de estabilidad genotípica en el cultivo de la papa. Cultivos Tropicales, 2003, vol. 24, no. 1, p. 81-84.
- Ortíz, R.; Fe, C. de la; Cornide, M. T. y Rodríguez, A. Estabilidad varietal de la caña de azúcar procedente de meristemos crioconservados. Cultivos Tropicales, 2000, vol. 21, no. 2, p. 17-19.
- Barta, J.; Curn, V. y Divis, J. Study of biochemical variability of potato cultivar by soluble proteins, isoesterase and isoperoxidase electrophoretic patterns. Plant Soil Environment, 2003, vol. 49, no. 5, p. 230-236.
- Nezih, M. The peroxidase enzyme activity of some vegetables and its resistance to heat. Journal of the Science of Food and Agriculture, 2006, vol. 36, no. 9, p. 877-880.
- Lara-Cabrera, S. y Spooner, D. M. Taxonomy of North and Central American diploid wild potato (Solanum sect. Petota, Solanaceae) species: AFLP data. Amer. Jour. of Pot. Research, 2004, vol. 81, no. 1, p. 71-76.
- Castillo, J. G. Estimación de la variabilidad genética en poblaciones híbridas de papa (Solanum tuberosum L.). Tesis de Maestría. INCA. La Habana, Cuba. 2000, 72 p.
- Thipyapong, P., Melkonian, J., Wolfe, D. W. y Steffensa, J. C. Suppression of polyphenol oxidases increases stress tolerance in tomato. Plant Science, 2004, vol. 67, no. 4, p. 693-703.
- Reed, B. M.; Engelmann, F.; Dulloo, M. E. y Engels, J. M. M. Technical guidelines for the management of field and in vitro germplasm collections. IPGRI, Roma Italia. 2004, 106 p.
- Kaneko, Y.; Yano, H.; Bang, S. W. y Matsuzawa, Y. Genetic stability and maintenance of Raphanus sativus lines with an added Brassica rapa chromosome. Plant Breeding, 2003, vol. 122, no. 3, p. 239-245.
- Golmirzaie, A. y Toledo, J. Non-cryogenic long-term germplasm storage. En: Hall, R. (Ed.). Methods in Molecular Biology. Vol. 111. Plant Cell Culture Protocols. Humana Press. Netherlands, 1998, p. 95-101.Sarkar, D.; Swarup, K.; Chakrabarti, S. y Naik, P. Low-growth conservation of potato microplants: efficacy of ancymidol for long-term storage in vitro. Euphytica, 20 01, vol. 117, no. 2, p. 133-142.
- Zamora, A. B. y Paet, C. N. In vitro gene bank activities at the institute of plant breeding. College of Agriculture, University of the Philippines at Los Baños. En: Management of field and in vitro germplasm collections. F. Engelman ed. 15-20 January, IPGRI, Roma Italia. 1999, p. 76-84.
- Victoria, J. L y Guzmán, M. L. Sugar cane in vitro culture in Colombia. En: Management of field and in vitro germplasm collections. F. Engelman ed. 15-20 January, 1996, IPGRI, Roma Italia. 1999, p. 88-89.
- Jarret, L. J. y Towill, L. E. Maintenance of sweet potato germplasm in the S-9 germplasm collection in Griffin, Georia, USA. En: Management of field and in vitro germplasm collections. F. Engelman ed. 104-109 January, IPGRI, Roma Italia. 1999, p. 76-84.
- Mandolina, G.; De Marco, S.; Faeti, V.; Bagatta, M.; Carboni, A. y Ranalli, P. Stability of fingerprints of Solanum tuberosum plants derived from conventional tubers and vitrotubers. Plant Breeding, 2007, vol. 115, no. 6, p. 439–444.
- Chimot, V. P., Swarup, K. C, Pattanayak, D. Molecular analysis of cytoplasm type in Indian potato varieties. Euphytica, 2007, vol. 162, no. 1, p. 69-80.
- Legesse, B. W.; Myburg, A. A.; Pixley, K. V.; Twumasi-Afriyie, S. y Botha, A. M. Relationship between hybrid performance and AFLP based genetic distance in highland maize inbred lines. Euphytica, 2007, vol. 162, no. 3, p. 313-323.
- Sorkheh, K.; Shiran, B.; Gradziel, T. M.; Epperson, B. K.; Martínez-Gómez, P. y Asadi, E. AFLP as a tool for molecular characterization of almond germplasm: genetic diversity among cultivated genotypes and related wild species of almond, and its relationships with agronomic traits. Euphytica, 2007, vol. 156, no. 3, p. 327-344.
Recibido: 9 de julio de 2009
Aceptado: 19 de mayo de 2010