Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.3 La Habana jul.-set. 2010
AISLAMIENTO E IDENTIFICACIÓN DE HONGOS MICORRÍZICOS ARBUSCULARES NATIVOS DE LA ZONA DE LAS CAOBAS, HOLGUÍN
ISOLATION AND IDENTIFICATION OF NATIVE arbuscular mycorrhizal fungi AREA OF MAHOGANY, HOLGUÍN
Ms.C. Laura R. MedinaI. E-mail: laura@inca.edu.cu y Ms.C. Yakelín RodríguezII, Y. TorresIII, y Dr.C. R. HerreraIV
I Especialista
II Investigadora Agregada del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana
III Investigador
IV Investigador Titular del Instituto de Ecología y Sistemática (IES), Ciudad de La Habana, Cuba.
RESUMEN
Con el objetivo de caracterizar el potencial micorrízico de la zona Las Caobas en la provincia de Holguín, se aislaron, identificaron y multiplicaron hongos nativos y conglomerados de estos, provenientes de suelos afectados por la salinidad. Por sus características morfológicas, se identificaron 28 morfotipos de hongos micorrízicos arbusculares (HMA), agrupados según su homogeneidad respecto a la forma, el color, la apariencia de la pared externa, el tamaño de las esporas y la presencia, forma y coloración de la conexión hifal. A partir del análisis morfológico de las esporas aisladas, se encontraron cuatro de los géneros conocidos (Glomus, Acaulospora, Gigaspora y Scutellospora), siendo Glomus el más común; además, se consideró el 35 % de las especies como nuevas, al no estar descritas en la literatura.
Palabras clave: hongos micorrízicos arbusculares, salinidad, caracterización morfológica.
ABSTRACT
Indigenous fungi and their clusters, coming from saline soils, were isolated, identified and multiplied, with the aim of characterizing the mycorrhizal potential of Las Caobas area in Holguín province. Regarding their morphological traits, 28 morphotypes of arbuscular mycorrhizal fungi (AMF) were identified and grouped according to their homogeneity on shape, colour, outer wall appearance, spore size and the hyphal connection presence, shape and coloration. From the morphological analysis of isolated spores, four of the known genera (Glomus, Acaulospor, Gigaspora and Scutellospora) were found, Glomus being the most common; besides, 35 % of the species were considered as new ones, since they had not been described in literature.
Key words: arbuscular mycorrhizal fungi, salinity, morphological characterization.
INTRODUCCIÓN
Uno de los problemas agrícolas más extendidos en el mundo es la acumulación de sales en la superficie del suelo. La salinidad afecta completamente un tercio de las tierras bajo riego en áreas con escasez de agua, altas temperaturas, alta evapotranspiración o cuando se practica un manejo de riego deficiente por parte de los agricultores (1). Además, con la disminución de las fuentes de agua disponibles, usar aguas salinas para el riego es casi inevitable (2).
En general, la salinidad inhibe el crecimiento de las plantas y su productividad. La alta salinidad induce desequilibrios en las relaciones osmóticas entre el suelo y la planta y en su metabolismo. Existe un grupo de factores que aumentan la tolerancia de las plantas a la salinidad, la incorporación o aplicación de estos puede facilitar a las plantas una mejor resistencia al estrés salino y también ayudar a mejorar la productividad de los cultivos en estas condiciones (2, 3).
La tolerancia al estrés en las plantas es un fenómeno complejo, que involucra muchos cambios a nivel bioquímico y fisiológico. Sin embargo, los mecanismos detrás de la tolerancia al estrés parecen estar bajo la influencia de la colonización por los hongos micorrízicos arbusculares (HMA).
La simbiosis micorrízica arbuscular es el resultado visible de la interacción entre las raíces de las plantas y un hongo, y un excelente ejemplo de las extensas alteraciones morfológicas que dichas raíces experimentan, con el fin de acomodarse a la presencia de un simbionte (4). Los HMA reciben fotosintatos de la planta, mientras que esta mejora su habilidad para la toma de nutrientes y agua, así como la tolerancia tanto al estrés abiótico como biótico (5, 6).
Por las posibilidades que brindan los HMA en la agricultura desarrollada en áreas afectadas por la salinidad, resulta importante conocer y aislar las especies nativas de estos suelos. Tradicionalmente, los estudios taxonómicos de estos hongos se han basado en la morfología y apariencia de las esporas (6, 7, 8) y, a pesar de que hoy en día se aplican técnicas moleculares con estos fines (9, 10, 11), no se puede obviar el incuestionable valor de los métodos morfológicos en la identificación y caracterización de nuevos géneros y especies (12, 13, 14).
Teniendo en cuenta estos aspectos y la necesidad de contar con un cepario de especies de HMA adaptadas a condiciones salinas, que pudieran ser utilizadas con fines prácticos, el objetivo del presente trabajo fue aislar, identificar y multiplicar los HMA nativos y sus conglomerados, provenientes de suelo salino de la zona Las Caobas en la provincia de Holguín.
MATERIALES Y MÉTODOS
Caracterización de la zona seleccionada para el aislamiento de HMA. El área escogida fue la zona Las Caobas, municipio de Gibara, provincia de Holguín, que cuenta con una superficie agrícola de 409.2 ha; de ellas, 118.8 son cultivables y 68.64 se encuentran bajo riego.
El agua de riego se obtiene de 20 pozos, es salobre y, en ocasiones, tiene altos niveles de salinidad; el clima se caracteriza por temperaturas promedio de 30.3 oC y las precipitaciones de 1 008 mm como valores medio anuales.
Al momento del muestreo, la zona se encontraba cultivada de tomate (Solanum lycopersicum L.) y no se le había aplicado con anterioridad ningún producto a partir de HMA.
Análisis del suelo. El suelo de la zona se encuentra dentro del agrupamiento Húmico sialítico, tipo Rendzina y subtipo rojo (15, 16), que se correlaciona con un Nitisol ferrálico (éutrico, ródico) del Word Reference Base (17). La Tabla I muestra los análisis realizados al suelo.Tabla I. Algunas características químicas del suelo seleccionado para el aislamiento de los HMA nativos en Holguín

Las determinaciones se realizaron en el laboratorio de Análisis Químico del INCA, mediante los siguientes métodos: para los cationes calcio (Ca2+), potasio (K+), sodio (Na+) y magnesio (Mg2+) –Maslova; fósforo (P) –Oniani; materia orgánica (MO) -Walkley y Black; pH (H2O) -por la conductividad mediante el electrodo de vidrio con dilución 1:2.5.
Extracción y cuantificación de esporas de HMA nativos. Se tomaron 13 muestras compuestas por tres submuestras de suelo de 200 g de la zona de la rizosfera de las plantas presentes, de 0 a 40 cm de profundidad, que se guardaron en bolsas plásticas a 4oC hasta el momento de su uso.
Las muestras de los sitios seleccionados se llevaron al laboratorio de Micología del IES. Las esporas de HMA provenientes de las muestras se extrajeron del suelo, empleando el método de decantado húmedo y tamizado modificado por Herrera (18), del protocolo descrito por Gerdemann y Nicholson (19), a través de dos tamices de 400 y 40 μm respectivamente y centrifugado con solución de sacarosa 2 M–Tween 80, decantándose luego la fracción líquida con los componentes fúngicos. Se realizó un conteo de las esporas en estereomicroscopio (Stemi-200C), utilizando placas de conteo de nematodos, para conocer la cantidad de material micorrízico con que se contaba.
Propagación de esporas de las muestras representativas de suelos salinos. Para la propagación de esporas, se utilizaron 50 g de cada una de las muestras de suelos que contenían las esporas. Estas se propagaron en macetas de 5 L de capacidad, conteniendo suelo Ferralítico Rojo lixiviado (15) como sustrato, el cual se esterilizó para la destrucción de los microorganismos en activo crecimiento y sus estructuras de resistencia, tales como las esporas, con una solución de formaldehído al 5 % por cinco días, al cabo de los cuales el sustrato fue removido y lavado con agua hasta la eliminación del producto.
Se utilizó sorgo como cultivo trampa, debido a que los HMA son simbiontes obligados y necesitan una planta para poder completar su ciclo de vida, siendo el sorgo muy utilizado por los altos niveles de colonización micorrízica que desarrolla. A las semillas se les dio un tratamiento de esterilización, empleando una solución de hipoclorito de sodio al 10 % por 10 minutos. Una vez que se decantó la solución, estas se lavaron varias veces con abundante agua destilada.
Cuando germinaron las semillas, se aplicó el riego a base de solución nutritiva modificada a partir de Hewitt (20) cada 10 días. El cultivo trampa se mantuvo por un período de tres meses. Después de este tiempo, se extrajeron las esporas por el método anteriormente mencionado y se trabajó con esporas sanas, para la identificación morfológica.
Identificación de los HMA nativos aislados de los suelos salinos. Para ello, las esporas se separaron en grupos, de acuerdo con su color y tamaño, preparándose portaobjetos con las esporas extraídas, utilizando alcohol polivinílico y ácido láctico glicerol (PVLG) y PVLG con reactivo Melzer (1:1 v/v), como líquidos de montaje, aplicándose una ligera presión sobre cada uno de los cubreobjetos, para romper levemente las esporas y secando cada preparación a la temperatura ambiente durante 72 horas. Después de este tiempo, se procedió a analizar las preparaciones con ayuda del sistema AxioVision de Carl Zeiss y se clasificaron de acuerdo con sus características morfológicas: forma, color, contenido, unión hifal y tipos de paredes o grupos de paredes, considerando además el tipo y la distribución de las ornamentaciones, según los morfotipos descritos en la literatura (21, 22). El color de las esporas se obtuvo con ayuda de la carta de color del INVAM (23). Para la identificación de las especies, se empleó el manual de Schenck y Pérez (24), la colección fotográfica del departamento de Biofertilizantes del IES de esporas de hongos Glomales, así como la página Web del INVAM (23) y las descripciones originales de las especies publicadas en la literatura especializada, mediante el método propuesto por Herrera (25, 26). Se tomaron imágenes de los distintos tipos de esporas aisladas con el sistema AxioVision de Carl Zeiss.
RESULTADOS Y DISCUSIÓN
Caracterización del potencial micorrízico de la zona Las Caobas. Los conteos totales de esporas correspondientes a 1 g de suelo, para cada una de las muestras tomadas, indican que el número se encuentra entre 8 y 17 esporas.g-1 de suelo. El número de esporas encontradas no es bajo para las condiciones nativas, según los datos informados (27) que encontraron entre 0 y 49 esporas en 25 g de suelo en un experimento, en el que se evaluaron poblaciones de HMA asociadas con cultivos de maíz y soya de cinco años. Además, Howeler (28) registró conteos de esporas nativas asociadas a Brachiaria decumbens, que no superan las 10 esporas.g-1 de suelo seco. Igualmente, Douds (29) encontró entre 1 y 43 esporas en 50 cm3 (aproximadamente 50 g) de suelo en cultivos de maíz, soya y trigo, en sistemas con labranza convencional y mínima, y Serralde y Ramírez (30) informaron de 4 a 16 esporas.g-1 de suelo seco en poblaciones de HMA nativas asociadas al cultivo del maíz.
Identificación de morfotipos de HMA aislados. A partir del análisis morfológico de las esporas aisladas, se encontraron cuatro de los 19 géneros conocidos (Glomus, Acaulospora, Gigaspora y Scutellospora), el más común fue Glomus, al cual pertenecen 21 morfotipos, seguido por Acaulospora, al que pertenecen cinco de los morfotipos encontrados. Por el contrario, los géneros menos frecuentes fueron Gigaspora y Scutellospora, en los que solo se identificó un morfotipo en cada uno. Estos resultados se corresponden con los encontrados por Blaszkowski (31), Oehl (32) y Castillo (33), lo que ubica a Glomus como género dominante en la mayoría de las poblaciones nativas y es posible que se encuentre en simbiosis activa en mayor proporción que los demás, lo que refleja su capacidad de adaptación a las condiciones edáficas y ofrece un alto potencial para su uso como biofertilizante.
Es conocido que especies como Gigaspora o Scutellospora necesitan una prolongada fase de colonización radical, para llegar a la fase de esporulación; en contraste con esto, no se requiere la esporulación para la colonización de nuevas raíces en la mayoría de las especies de Glomu, siendo la colonización por estas especies mucho más abundante e iniciada por hifas, micelios o fragmentos de raíces en el suelo, lo que pudiera explicar su éxito ecológico (14).



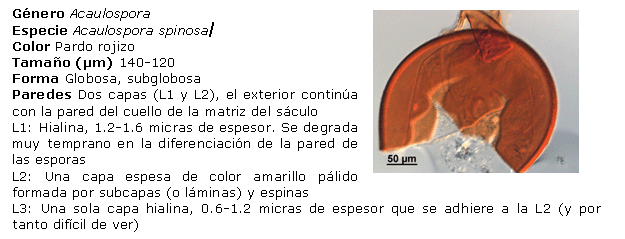



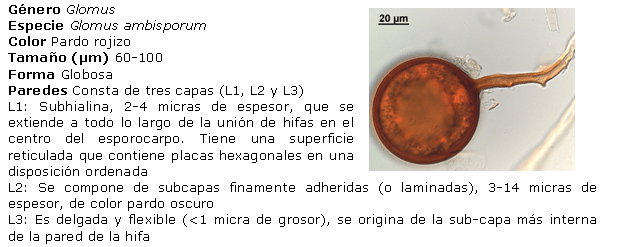





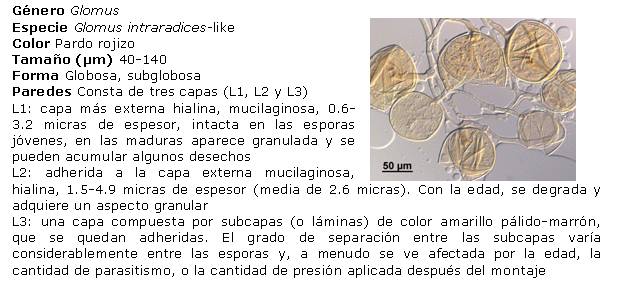


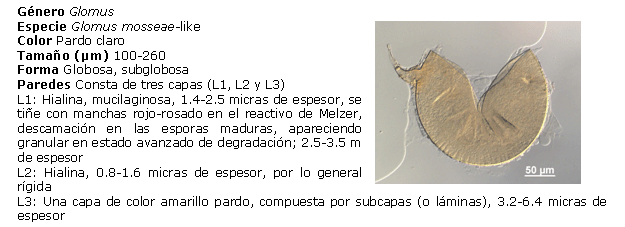
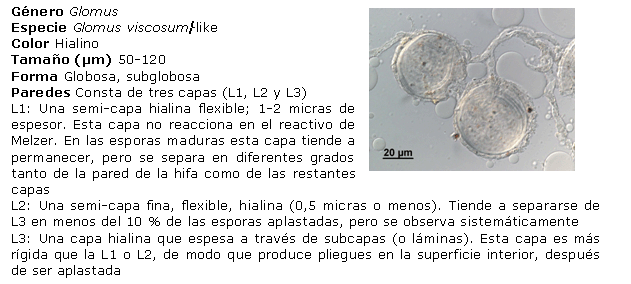



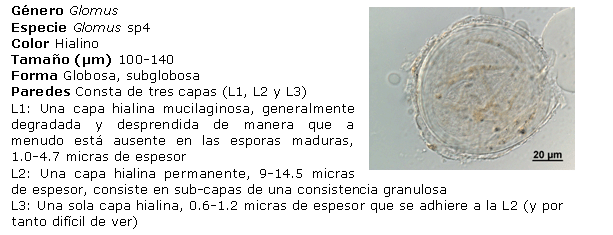




Diversos autores han encontrado entre tres y 15 especies nativas de HMA para condiciones de cultivos en campo (30). Sin embargo, es interesante observar que el total de morfotipos detectados aquí indica un buen establecimiento de las poblaciones de HMA en condiciones nativas para estos suelos (27).
El 35 % de los morfotipos encontrados aparentemente presentaron características que no se ajustan a las descripciones publicadas en la literatura, por lo que se consideraron como posibles especies nuevas y se requiere de mayor investigación para su identificación.
Es válido aclarar que la identificación, basada únicamente en la morfología de las esporas, requiere de personal altamente calificado así como largos años de experiencia visual, por lo que en la actualidad se complementa este criterio, realizando técnicas moleculares (12, 13), las cuales constituyen una herramienta valiosa y viable para estos fines.
Oehl (34) detectó un total de 45 especies de HMA en ocho agroecosistemas de Europa Central, donde un 20 % correspondía a especies no descritas en la literatura. De forma similar, Castillo (33) informó que de 39 especies encontradas en una prospección al sur de Chile, el 23 % se consideraron especies nuevas.
Al comparar estos resultados con los obtenidos en este estudio, se observa un elevado porcentaje de especies nuevas aisladas de los suelos salinos (34), lo cual pudiera atribuirse, en parte, al hecho de que no se pudo corroborar por métodos moleculares la identificación morfológica de las especies nativas encontradas.
La aplicación de estas técnicas novedosas ha contribuido de manera importante al esclarecimiento de la identidad de las especies de HMA (35, 36, 37).
REFERENCIAS
- Cano, E. A.; Perez-Alfocea, F.; Moreno, V.; Caro, M. y Bolarín, M. C. Evaluation of salt tolerance in cultivated and wild tomato species through in vitro shoot apex culture. Plant Cell Tissue Org Cult., 1998, vol. 53, p. 19–26.
- Chinnusamy, V., Jagendorf, A., y Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci., 2005, vol. 45, p. 437-448.
- Alrahman, A.; Shibli, N. M.; Ereifej, R. A. y Hindiyeh, K. I. Influence of salinity on growth and physiology of in vitro grown cucumber (Cucumis sativus L.). Jordan Agric. Sci., 2005, vol. 1, p. 93–106.
- Mohammadi, E., Rezaee, D., Prasad, R., y Varma, A. Mycorrhizal fungi: What we know and what should we know?, En: Mycorrhiza: state of the art, genetics and molecular biology. A. Varma. Editor, Springer-Verlag Berlin Heidelberg. 2008.
- Ashraf, M. y Foolad, M. R. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environ. Exptl. Bot., 2006, vol. 59, p. 206-216.
- Choa, K., Tolera, H., Leeb, J., Ownleyc, B., Stutzd, J. C., Moorea, J. L. y Auge, R. M. Mycorrhizal symbiosis and response of sorghum plants to combined drought and salinity stresses. Journal of Plant Physiology, 2006, vol. 163, p. 517—528.
- Al-Karaki, G. N. Response of wheat and barley during germination to seed osmopriming at different water potential (p. 229-235). Published Online: Apr 22, 2008, 12:00 am. DOI: 10.1111/j.1439-037X.1998.tb00422.x.
- Aroca, R., Porcel, R., y Ruiz-Lozano, J. How does arbuscular mycorrhizal symbiosis regulate root hydraulic properties and plasma membrane aquaporins in Phaseolus vulgaris under drought, cold or salinity stresses?. New Phytologist, 2007, vol. 173, p. 808–816.
- Ruíz-Lozano, J. M.; Azcón, R. y Gómez, M. Alleviation of salt stress by arbuscular-mycorrhizal Glomus species in Lactuca sativa plants. Physiologia plantarum, 1996, vol. 98, p. 767-772.
- Rabie, G. H. y Almadini, A. M. Role of bioinoculants in development of salt-tolerance of Vicia faba plants under salinity stress. Afr J Biotech., 2005, vol. 4, p. 210–22.
- Walker, C. Taxonomic concepts in the Endogonaceae: spore wall characteristics in species descriptions. Mycotaxon, 1983, vol. 18, p. 443–455.
- DeBellis, T. y Widden, P. Diversity of the small subunit ribosomal RNA gene of the arbuscular mycorrhizal fungi colonizing Clintonia borealis from a mixed-wood boreal forest. FEMS Microbiol. Ecol., 2006, vol. 58, p. 225–235.
- Lee, J.; Lee, S. y Young, P. W. J. Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi. FEMS Microbiol. Ecol., 2008, vol. 65, p. 339–349.
- Öpik, M.; Moora, M.; Zobel, M.; Saks, Ü.; Wheatley, R.; Wright, F. y Daniel, T. High diversity of arbuscular mycorrhizal fungi in a boreal herb-rich coniferous forest. New Phytologist,2008, vol. 179, p. 867–876.
- Hernández, A., Pérez, J. M., Bosch, D., y Rivero, L. Nueva versión de clasificación genética de los suelos de Cuba. La Habana: AGRINFOR, 2006, 64 p.
- Hernández, A.; Ascanio, M.; Morales, M. y Bojorquez, I. El suelo: Fundamentos sobre su formación, los cambios globales y su manejo. Editado en Universidad de Nayarit, México. 2006, 255 p.
- IUSS Working Group WRB. World Reference Base for Soil resources 2006. Rome: FAO, 2006, 128 p.
- Herrera, R. A. Estrategia de funcionamiento de las micorrizas VA en un bosque tropical. Biodiversidad en Iberoamérica: Ecosistemas, evolución y procesos sociales (Eds. Maximina Monasterio). Programa iberoamericano de ciencia y tecnología para el desarrollo. Subprograma XII, diversidad biológica, Mérida, 1995.
- Gerdemann, J. W. y Nicholson, T. H. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Trans Br Mycol Soc., 1963, vol. 46, p. 235–244.
- Hewitt, E. J. Sand and water culture methods used in the studies of plant nutrition. En: Tech Comm 22. London: comm. Agri Bur. 1966, p. 430-434.
- Sieverding, E. y Ole, F. Revision of Entrophospora and description of Kuklospora and Intraspora, two new genera in the arbuscular mycorrhizal Glomeromycetes. J. Appl. Bot. and Food Qual., 2006, vol. 80, p. 69-81.
- Spain, J. L.; Sieverding, E. y Oehl, F. Appendicispora: a new genus in the arbuscular mycorrhiza-forming Glomeromycetes, with a discussion of the genus Archaeospora. Mycotaxon, 2006, vol. 97, p. 163–182.
- INVAM. International culture collection of arbuscular and vesicular mycorrhizal fungi. Species descriptions from reference culture, names and authorities of fungi in Glomales. 2009, p. 1-5.
- Schenck, N. C. y Pérez, Y. Manual for the identification of VA mycorrhizal fungi. 3ª ed. Synergistie, Gainesville, Fla. USA. 1990, 241 p.
- Glomeromycota TAXONOMY. Consultado [13 de diciembre del 2009]. Disponible en: http://www.lrz-muenchen.de/~schuessler/amphylo/
- Herrera, R. A.; Ferrer, R. L.; Ruiz, L.; Fernández, F.; Medina, N.; Furrazola, E.; Orozco, M. O.; Cueto, J. R.. Perspectivas para la generalización del uso de las MA en la agricultura cubana.--Florianópolis, SC, Brazil: Univ. Federal Sta. Catarina. Resúmenes V REBRAM, 1994. p. 37.
- Collins, N.; Pfleger, F.; Crookston, R.; Simmons, S. y Coipeland, P. Vesicular-arbuscular mycorrhizas respond to corn and soybean cropping history. New Phytol., 1991, vol. 117, p. 657-663.
- Howeler, R. H.; Sieverding, E. y Saif, S. Practical aspects of mycorrhizal technology in some tropical crops and pastures. Plant and Soil, 1987, vol. 100, p. 249-283.
- Douds, D. D.; Galvez, L.; Janke, R. R. y Wagoner, P. Effect of tillage and farming system upon populations and distribution of vesicular-arbuscular mycorrhizal fungi. Agriculture, Ecosystems and Environment, 1995, vol. 52, p. 111-118.
- Serralde, A. M. y Ramírez, M. M. Análisis de poblaciones de micorrizas en maíz (Zea mays) cultivado en suelos ácidos bajo diferentes tratamientos agronómicos. Revista Corpoica, 2004, vol. 5, p. 31-40.
- Blaszkowski, J. Comparative studies on the occurrence of arbuscular fungirhizae (Glomales) in cultivated and uncultivated soils of Poland. Acta Mycol., 1993, vol. 28, p. 93-140.
- Oehl, F.; Sieverding, E.; Ineichen, K.; Ris, E. A.; Boller, T. y Wiemken, A. Community structure of arbuscular mycorrhizal fungi at different soil depths in extensively and intensively managed agroecosystems. New Phytol., 2005, vol. 165, p. 273-283.
- Castillo, C. Biodiversidad y efectividad de hongos micorrízicos arbusculares en ecosistemas agro-forestales del centro sur de Chile, Tesis Doctorado, 2005, Universidad de la Frontera, Temuco, Chile.
- Oehl, F.; Sieverding, E.; Ineichen, K.; Mader, P.; Boller, T. y Wiemken, A. Impact of land use intensity on the species diversity of arbuscular mycorrhizal fungi in agroecosystems of Central Europe. Appl. Environ. Microbiol, 2003, vol. 69, p. 2816-2824.
- Błaszkowski, J.; Renker, C. y Buscot, F. Glomus drummondii and G. walkeri, two new species of arbuscular mycorrhizal fungi (Glomeromycota). Mycological Research, 2006, vol. 110, p. 555–566.
- Błaszkowski, J.; Czerniawska, B.; Wubet, T.; Schäfer, T.; Buscot F. y Schüßler, I. A. Molecular phylogeny and new taxa in the Archaeosporales (Glomeromycota): Ambispora fennica gen. sp. nov., Ambisporaceae fam. nov., and emendation of Archaeospora and Archaeosporaceae. Mycological Research, 2007, vol. 111, p. 137–139.
- Walker, C. Ambispora and Ambisporaceae resurrected. Mycological Research, 2008, vol. 112, p. 297–298.
Recibido: 19 de noviembre de 2009
Aprobado: 2 de junio de 2010














