Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.4 La Habana oct.-dic. 2010
CONTENIDOS DE PROLINA, GLICINA BETAÍNA Y PROTEÍNAS SOLUBLES TOTALES EN 12 VARIEDADES CUBANAS DE TRIGO EN CONDICIONES SALINAS
Content of proline, glycine betaine and soluble protein 12 TOTAL Cuban varieties of wheat in saline conditions
Ms.C. L. ArgentelI. E-mail: largentelm@udg.co.cu y Ms.C. I. FonsecaI, Dr.C. L. M. GonzálezII, Dr. D. R. LópezIII
I Profesores Auxiliares de la Universidad de Granma Bayamo
II Investigador y Profesor Titular del Instituto de Investigaciones Agropecuarias (IIA) Jorge Dimitrov, Bayamo. Cuba
III Profesor e Investigador Titular del Centro de Investigaciones Biológicas del Noreste, México.
RESUMEN
En este experimento se determinaron los contenidos de prolina, glicina betaína y proteínas solubles totales en 12 variedades cubanas de trigo, de las especies T. aestivum y T. durum, cultivadas en condiciones salinas. Para ello se montaron dos variantes experimentales basadas en una solución nutritiva concentrada. El primer tratamiento se salinizó con NaCl a una conductividad eléctrica de 8 dS.m-1 y el tratamiento control sin aplicar NaCl. Este ensayo se realizó en condiciones de hidroponía y los tratamientos se aplicaron desde el momento de la siembra hasta los 45 días de germinadas las semillas, cuando se realizaron las determinaciones. Los datos obtenidos en los tratamientos control y de estrés se compararon por la prueba de t-student para los niveles de significación del 5 y 1 %. Como resultado se obtuvo un significativo incremento del contenido de prolina en la mayoría de las variedades, siendo mayor la acumulación en el follaje que en las raíces. El contenido de glicina betaína solo fue altamente significativo en las variedades de trigo de la especie T. durum. El contenido de proteínas solubles totales presentó un comportamiento muy variable, incluso entre variedades de la misma especie, por lo que no se consideró un indicador eficiente de tolerancia a la salinidad. Las variedades Cuba C-204, INIFAT RM-26, INIFAT RM–37 e INIFAT RM-26 fueron las de mejor acumulación de prolina.
Palabras clave: prolina, glicina betaína, proteínas solubles totales, trigo, salinidad.
ABSTRACT
Proline, glicine betaíne and total soluble protein contents were determined in 12 Cuban wheat varieties, of T. aestivum and T. durum species, growing under saline conditions. Thus, two experimental variants were conducted based on a concentrated nutrient solution. The first treatment became salty with NaCl to an electric conductivity of 8 dS.m-1 and the control treatment without applying NaCl. This test was performed under hidropony conditions and treatments were applied from sowing time until 45 days after seed germination, when determinations were recorded. Data obtained in the control and stress treatments were compared by t-student test for 5 and 1 % significant levels. As a result, an important increment of proline content was obtained in most varieties, the accumulation in foliage being bigger than in roots. Glicine betaíne content was highly significant just in wheat varieties of T. durum species. Total soluble protein content showed a rather variable behaviour, even among varieties from the same species; that is why it was not considered an efficient indicator of salinity tolerance. The varieties Cuba-C-204, INIFAT RM–36, INIFAT RM–37 and INIFAT RM-26 showed the highest proline accumulation.
Key words: proline, glicine betaíne, total soluble proteins, wheat, salinity.
INTRODUCCIÓN
La mayoría de las especies de cultivo consideradas glicófitas han desarrollado a lo largo del tiempo mecanismos de tolerancia a la salinidad. De ahí se pueden diferenciar especies glicófitas tolerantes, moderadamente tolerantes y otras que no toleran la salinidad, que son clasificadas por susceptibles (1). Actualmente, se trabaja por incrementar la tolerancia a la salinidad mediante la introgresión de genes a partir de especies silvestres con tolerancia a este tipo de estrés, pero este proceso resulta extremadamente engorroso y lento, lo que trae el riesgo de que cuando se obtenga una variedad, el nivel de salinidad del suelo se haya incrementado, dado fundamentalmente por la significativa velocidad de salinización de los suelos (2). Una de las técnicas más adecuadas para la mitigación de los efectos adversos de la salinidad es la selección de cultivares con tolerancia natural para este carácter (3).
Durante el estrés salino las plantas activan diferentes mecanismos fisiológicos para asegurar la homeostasis iónica. Uno de ellos es el ajuste osmótico. Ante el inminente aumento en la concentración de Na+ y Cl-1 en el suelo, la planta garantiza disminuir el potencial osmótico y, en consecuencia, el hídrico en las células de los diferentes órganos, evitando la toxicidad iónica y la interferencia en la asimilación de cationes importantes, por lo que se induce a nivel de gen la síntesis de compuestos orgánicos osmóticamente activos entre ellos la prolina, glicina-betaína y se modifica el metabolismo proteico (2). Muchos de los osmolitos y proteínas de estrés tienen funciones específicas bien descritas y otros probablemente desintoxican las plantas de agentes estresantes o las previenen de posibles daños en su estructura (4). En algunos órganos de las plantas, ciertas sustancias como la prolina, betaína, glicina betaína, varios carbohidratos y proteínas, como la osmotina, se sintetizan y ello ha sido empleado como un patrón importante para la selección de genotipos tolerantes a este tipo de estrés (5, 6), por lo que su estudio en el germoplasma disponible en condiciones de salinidad puede emplearse, conjuntamente con otros indicadores fisiológicos y bioquímicos, para la identificación de tolerancia al estrés salino.
En la presente investigación se exponen algunos de los resultados en este sentido, en un germoplasma de trigo conformado por variedades cubanas, las cuales están siendo objeto de investigación y cultivo en condiciones salinas en la región oriental de Cuba, donde otras especies muestran susceptibilidad a la salinidad del suelo.
MATERIALES Y MÉTODOS
Las variedades se establecieron en condiciones de hidroponía, en el invernadero del laboratorio de Fisiología Vegetal, Centro de Investigaciones Biológicas del Noroeste, México, Unidad “Guerrero Negro”, con el objetivo de determinar el comportamiento de las variedades en el nivel crítico de salinidad encontrado, tomando como criterios de selección algunos indicadores del régimen hídrico y osmótico.
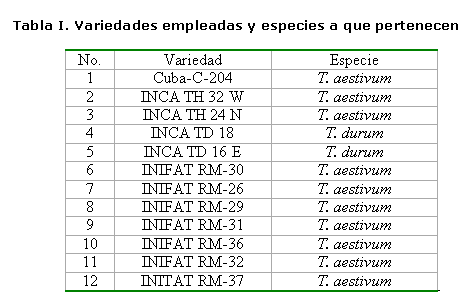
Se conformaron flotadores rectangulares de poliespuma de 30x20 cm (7) y se seccionaron en cuatro partes con una superficie de 15x8.5 cm, donde se establecieron 20 semillas por cada sección, que se ubicaron de forma alineada para un total de 80 semillas por variedad. Al fondo de los flotadores se colocó una malla plástica con orificios de 4mm2. Los flotadores se ubicaron en bandejas plásticas rectangulares transparentes de 50x39 cm, cubiertas con papel aluminio para evitar la entrada lateral de luz. En cada bandeja se establecieron dos variedades. La siembra se hizo a las 7:00 a.m. Se añadió un volumen inicial de cinco litros de soluciones, hasta completar un volumen final de 18 litros, que conformaron los tratamientos. Los flotadores se mantuvieron plenamente sobre el agua y se emplearon varillas de suspensión, para evitar la hiperhidricidad en las semillas. La aireación de las soluciones, en cada bandeja, se realizó con bombas aireadoras (Mellin 2,8), que distribuían el aire a cada bandeja con mangueras plásticas transparentes de 3 mm de diámetro. Las variedades empleadas en el estudio se describen en la Tabla I.
Tratamientos. Estos consistieron en la aplicación de dos soluciones nutritivas, que se describen a continuación:
T1: tratamiento salino: solución nutritiva (8) salinizada a base de NaCl con una conductividad eléctrica de 8 dS.m-1
T2: tratamiento control: solución nutritiva (9), siguiendo las exigencias nutricionales del cultivo, con una conductividad eléctrica de 0,36 dS.m-1.
Las soluciones nutritivas de los dos tratamientos establecidos se ajustaron a un pH de 6.0 empleando el medidor PH 40S. La conductividad eléctrica se midió por un conductímetro MQ-EC.
Los tratamientos se dispusieron mediante un arreglo experimental completamente aleatorizado. Cada variedad se repitió cuatro veces en ambos tratamientos.
Variables evaluadas
Contenido de prolina. Se midió de acuerdo con el método descrito (10). Una masa de 0.50 g de tejido foliar tomada al azar de la parte media a las 10:00 a.m. en cada órgano evaluado, replicada cuatro veces, se congeló en nitrógeno líquido y homogenizó con ácido sulfosalicílico (3 %). El residuo se separó por centrifugación a 13000 revoluciones durante 10 min. Luego, 500,0 µL del extracto se hicieron reaccionar con 500,0 µL de ácido acético glacial y 500,0 µL de ninhidrina a 100ºC por una hora. La reacción se detuvo en baño con hielo. El complejo cromóforo-prolina se extrajo con 1,0 mL de tolueno. La prolina se cuantificó en un espectrofotómetro Hewlett Packard 8452 a 520 nm, usando L-prolina para la curva de calibración.
Contenido de glicina betaína. Este contenido foliar (GB) se determinó siguiendo el método descrito (11). En las 12 variedades una masa de 2 g de follaje de 15 plantas, de la parte media del follaje, tomadas al azar en cada tratamiento, fue finamente molida y agitada mecánicamente con 20 mL de agua deionizada durante 24 h a una temperatura de 25°C. Posteriormente, las muestras se filtraron y el filtrado se diluyó a 1:1 con 2 N H SO. Las alícuotas se almacenaron a 4°C durante 16 h; posteriormente, se centrifugaron a 10000 rpm durante 15 min a una temperatura de 0°C. El sobrenadante se separó suavemente con un capilar de cristal. Los cristales se disolvieron en 9 mL de 1,2-dicloroetano. Después de 2 h de reposo, se midió la absorbancia a 365 nm, en un espectrofotómetro Hewlett Packard 8452, utilizando Glicín betainato ionizado (GBI) para la curva de calibración.
Contenido de proteínas solubles totales. Una muestra de 1.0 g de material fresco finamente cortado se depositó en un mortero y se maceró. La extracción se realizó con 40,0 mL de una solución buffer de fosfato a pH 6.86, preparado a partir de fosfato de potasio, solución que se adicionó lentamente mientras se efectuaba la extracción. El extracto se decantó en tubos de centrifugación de 50 mL y se centrifugó a 10000 rpm durante 7 min. Finalmente, la solución sobrenadante separada se trasvasó a matraces volumétricos de 50 mL. Se empleó papel filtro no. 3 en el filtrado, para prevenir la transferencia de residuos. Se agregó un volumen de 0.25 mL del reactivo Folin-Ciocalteu diluido (concentración ácida 1M). El contenido de proteínas solubles totales se cuantificó mediante fotometría de absorción en un espectrofotómetro Hewlett Packard 8452, a una longitud de onda de 750 nm.
RESULTADOS Y DISCUSIÓN
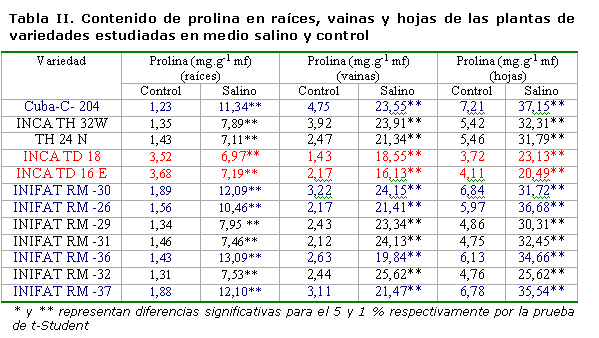
Contenido de prolina. Este se incrementó significativamente en las plantas sometidas al medio salino en todas las variedades estudiadas, existiendo una amplia variabilidad en los resultados. En las variedades Cuba-C-204, INIFAT RM-30, INIFAT RM-36 e INIFAT RM-26, los valores del contenido de prolina en las raíces se incrementaron en 10±1.42 mg.g-1 mf, siendo estas las variedades que más acumularon. Similar comportamiento se presentó en el follaje, con un incremento superior a los 20 mg.g-1 mf en las vainas y superior a 30 mg.g-1 mf en las hojas. Las variedades INIFAT RM-31, TH 24 N, INCA TD 18 e INCA TD 16 E presentaron el menor incremento del contenido de prolina en el medio salino con un promedio de 3±0.37 mg.g-1 mf (Tabla II). Este incremento en las variedades pudo haber tenido lugar para realizar el ajuste osmótico en función de este compuesto osmóticamente activo, con vistas a mantener el potencial osmótico y, en consecuencia, el hídrico a un nivel muy bajo, que permitiera absorber el agua en condiciones de estrés salino. Entre todas las variedades, INIFAT RM-36 e INIFAT RM-26 fueron las que más prolina acumularon.
Las variedades que toleran ciertos niveles de salinidad, al ser sometidas a condiciones salinas después de la germinación, realizan un rápido ajuste osmótico, generalmente en función de compuestos orgánicos (prolina y glicina betaína) y así reducen el potencial hídrico celular. Paralelamente, reducen la conductividad hidráulica de las raíces y sus membranas, para evitar la entrada de iones tóxicos; por ello, el crecimiento inicial en algunas especies se retarda (12). Una vez lograda la homeostasis, se puede restablecer el crecimiento (13).
Se ha sugerido que la prolina participa en múltiples roles en la tolerancia de las plantas al estrés, actuando como mediador del ajuste osmótico (7, 14), estabilizador de proteínas y membranas, inductor de genes relacionados con la tolerancia al ajuste osmótico mediante mecanismos de regulación génica (15), fuente de carbono y nitrógeno fácilmente disponible en la rehidratación celular (16), fuente de equivalentes de reducción del catabolismo de prolina, para sostener la fosforilación oxidativa y generación de ATP durante la recuperación del estrés. Además, ayuda al control de la acidosis del citosol y puede mantener la relación NADH/NAD+ a valores compatibles con el metabolismo (13), y ayuda a las células a superar la tensión oxidativa -cosechador de especies reactivas de oxígeno- (14). En muchas especies de cereales como en trigo T. aestivum y cebada, en condiciones de estrés salino, la acumulación de prolina ha sido atribuida a un aumento de su biosíntesis (17), debido a la inducción de la actividad de la enzima "1–pirrolina-5-carboxilasa sintetasa (P5CS) y la alta concentración de ácido glutámico (18).
En un estudio realizado al analizar 30 cultivares de Triticum aestivum L. sometidos a estrés salino, el contenido de prolina en hojas aumentó 15.2 veces en 19 cultivares considerados como tolerantes a sales, mientras que en los cultivares moderadamente tolerantes aumentó 7.8 veces y en un cultivar considerado susceptible se encontró un aumento de prolina solo de 5.4 veces en relación con el control, cuando se aplicó una concentración de NaCl de 16 dS.m-1, además de que en las variedades de mayor acumulación de prolina fueron las de mayor ajuste osmótico (14). Un comportamiento similar se ha obtenido en otras especies como el maíz (16).
La obtención de plantas genéticamente modificadas con mayor capacidad de acumulación de compuestos orgánicos con función protectora: prolina, betaína y glicina betaína, ha resultado en fenotipos con mayor tolerancia a salinidad (17). La modificación de otros factores: moléculas señal, factores de transcripción, etc., también tiene efecto en la respuesta de la planta y son objetivos promisorios en la búsqueda de tolerancia por el efecto pleiotrópico que tienes sobre los genes y proteínas de estrés (18).
Sin embargo, se ha planteado que el aumento de prolina es solamente uno de los factores que ayuda a las células a mantener el bajo potencial osmótico y, en consecuencia, el potencial hídrico, mientras que otros procesos deben llevarse a cabo para aumentar la habilidad de las plantas, a fin de tolerar la deficiencia fisiológica de agua y vencer el estrés osmótico, para sostener su crecimiento y desarrollo mediante la síntesis de otros compuestos osmóticamente activos como la glicina betaína y las proteínas solubles totales (16).
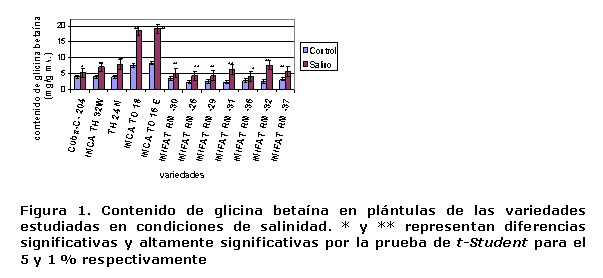
Contenido foliar de glicina betaína. Este se incrementó significativamente en el follaje de la mayoría de las variedades en el tratamiento salino, pero su incremento medio general solo fue de 2,3 mg.g-1 ms respecto a los valores obtenidos en el tratamiento control (Figura 1). Un elemento significativo en el estudio realizado fue que las variedades de T. durum acumularon más glicina betaína que las de trigo harinero y su incremento ascendió a más de 10 mg.g-1 ms en el follaje; sin embargo, estas variedades de trigo duro fueron las que menos prolina acumularon. Actualmente, se han obtenido variedades de T. durum que sintetizan más glicina betaína que prolina y han mostrado mayor tolerancia a la salinidad (19).
En muchas especies de un género determinado responden de manera muy diferente a la salinidad por su capacidad de síntesis, acumulación de compuestos osmóticamente activos y ajuste osmótico. Es algo difícil asegurar que en tales condiciones se acumula solo un tipo de compuesto osmóticamente activo (20, 21). Dentro de los compuestos orgánicos que generalmente se sintetizan a nivel celular para el ajuste osmótico en condiciones de salinidad o sequía, se encuentran la glicina betaína y prolina, siendo este último aminoácido el de mayor contribución a la adaptación de vegetales a estos tipos de estrés abióticos (22, 23).
Contenido de proteínas solubles totales. Este se incrementó significativamente en algunas variedades en el medio salino respecto al control, mientras que en otras disminuyó (Figura 2). En algunas variedades de la especie T. aestivum se produjo una disminución del contenido de proteínas solubles totales, probablemente para elevar la concentración de aminoácidos libres en el citosol y así disminuir su potencial hídrico y mantener la entrada de agua. En este caso, INIFAT RM-36, INIFAT RM-26, INIFAT RM-30, INIFAT RM-37 y Cuba-C-204 e INCA TH 24 N fueron las variedades con disminuciones más significativas. En las variedades de la especie T. durum INCA TD 16 E e INCA TD 18 y las de T. aestivum INIFAT RM-29, INIFAT RM-31, INIFAT RM-32, el contenido de proteínas solubles totales se incrementó.
En condiciones de salinidad, en muchas especies de cereales, primeramente se produce un incremento del contenido de proteínas solubles totales, pero estos valores van descendiendo debido a la actividad de las proteasas, para emplear los aminoácidos en el recambio proteico, como fuente de energía, fuente carbonada o nitrogenada, además de emplear, en un primer paso, los aminoácidos para el incremento de la concentración de compuestos osmóticamente activos y así asegurar la disminución del potencial osmótico y, en consecuencia, el potencial hídrico celular (24). Este proceso quizás fue el que se produjo en las variedades estudiadas.
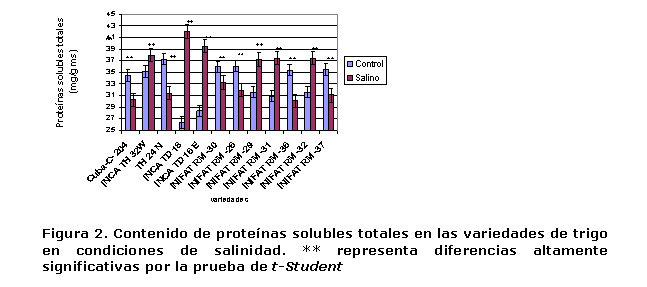
En trigo se ha planteado que existen dos mecanismos de tolerancia a la salinidad en función del metabolismo proteico: en un primer momento se produce un incremento significativo del contenido de proteínas solubles y estos valores pueden mantenerse en dependencia de las necesidades energéticas y osmóticas de la planta. En un segundo momento, fundamentalmente en variedades más sensibles, se produce de inmediato una significativa proteólisis para elevar la concentración de solutos en el citosol y mantener el potencial hídrico en valores inferiores al del suelo, asegurando la entrada de agua. Las especies y variedades que no incluyen sodio y, por consiguiente, no se produce interferencia en la asimilación de potasio, degradan más rápidamente las proteínas que las incluyentes (25).
Los resultados del presente estudio contribuyen a la evaluación de la tolerancia a la salinidad en el germoplasma de trigo que se emplea en Cuba y ofrecen un elemento importante sobre el funcionamiento vegetal en condiciones adversas como la salinidad de los suelos, visto en función de modificaciones fisiológicas y bioquímicas que garantizan el metabolismo celular y macroscópicamente la productividad.
Actualmente, el comportamiento de estas y otras variables fisiológicas, bioquímicas y agronómicas están siendo objeto de estudio, para la introducción y validación de variedades tolerantes a la salinidad en la región oriental de Cuba (26), asegurando un acercamiento a la rentabilidad de los suelos salinos y el incremento de la biodiversidad de especies en ecosistemas frágiles y degradados.
REFERENCIAS
1. Levitt, J. Response of plants to environmental stresses. En: Water, Radiation, Salt and other Stresses. Vol. II. Academic Press. London. 1980.
2. González, L. M. Efecto de la sequía simulada con PEG-6000 sobre la germinación y el crecimiento de las plántulas de dos variedades de trigo. Cultivos tropicales, 2005, vol. 26, no. 4, p. 45-49.
3. Ashraf, M. The effect of NaCl on water relations, chlorophyll, and protein and proline contents of two cultivars of Black gram (Vigna mungo L.). Plant Soil, 1989, vol. 119, p. 205-210.
4. Bray, E. A. Classification of genes differentially expressed during water-deficit stress in Arabidopsis thaliana: an analysis using microarray and differential expresión data. Annals of Botany. Water Stress, 2002, vol. 89, no. 7, p. 803-811.
5. Clarke, J., Richards, A. y Condon, G. Effect of salinity stress on genetic stability and its relationship with water regime in wheat. Can. J. Plant Sci., 1991, vol. 71, p. 695-702.
6. Feitosa de Lacerda, C., Cambraia, J., Oliva Cano, M. A., Ruiz, H. A. Plant growth and solute accumulation and distribution in two sorghum genotypes under NaCl stress. Braz. J. Plant Physiol., 2001, vol. 13, p. 270-284.
7. López, R. D. Sodium content corroboration in spectrophotometric methods with micronalisys.Water experiment. Biochemical Sciences, 2007, vol. 23, p. 156-159.
8. Hoagland, D. R. y Arnon, D. I. The water-culture for growing plants without soil. Calif. Agric. Exp. Stn. Circ., 1950, vol. 347.
9. Lutts, S., Kinet, J. M., Bouharmon, J. Effects of salt stress on growth, mineral nutrition and proline accumulation in relation to osmotic adjustment in rice (Oryza sativa L.) cultivars differing in salinity resistance. Plant Growth Regul., 1996, vol. 19, p. 207-218.
10. Bates, L. S., Waldren, R. P., Tear, I. D. Rapid determination of free proline for water stress studies. Plant Soil, 1973, vol. 39, p. 205-207.
11. Grieve, C. M. y Grattan, S. R. Rapid assay for determination of water-soluble quaternary ammonium compounds. Plant Soil, 1983, vol. 70, p. 303-307.
12. Meloni, D. A., Oliva, M. A., Ruiz, H. A., Martínez, C. A. Contribution of proline and inorganic solutes to osmotic adjustment in cotton under salt stress. J. Plant Nutr., 2001, vol. 24, p. 599-612.
13. Yancey, P. H., Clark, M. E., Hand, S. C., Bowlus, R. D., Somero, G. N. Living with water stress: evolution of osmolyte systems. Science, 1982, vol. 217, p. 1214-1222.
14. Flowers, T. J. y Yeo, A. R. Ion relations of plants under drought and salinity. En: Australian Journal of Scientific Research. Melbourne. 1986, 75 – 91 p.
15. Wyn J y Gorham, J. Physiological effects of salinity: scope for genetic improvement 177-201. En: Improvement and management of winter cereals under temperature, drought and salinity stresses. Proceeding of the International Symposium October, 1983, Cordoba, Spain.
16. Liu J. H., Inoue, H. y Moriguchi, T. Salt stress-mediated changes in free proline and expression of genes responsible its biosynthesis in wheats. Environmental and Experimental Botany, 2008, vol. 62, p. 28-35.
17. Jacovy, B. Production of wheat along the wold. En: Booklet of plant and crop stress. Edited by Pessarakli M. Ed. Marcel Dekker, Inc., Nueva York. EUA. 2008, 52–67 p.
18. Hasegawa, P. M., Bressan, R. A., Zhu, J-K, Bohnert, H. J. Plant cellular and molecular responses to high salinity. Annu. Rev. Plant Physiol. Plant Mol. Biol., 2000, vol. 51, p. 463-499.
19. Hasegawa, P. Differential gene expression for glicine betaíne and prroline content on wheat mutants. Plant J., 2004, vol. 30, p. 529-539.
20. Gilliham, M. The regulation of anion loading to the maize root xylem. Plant Physiol., 2005, vol. 137, p. 819-828.
21. Hill, A. Osmolite accumulation-salinity tolerance. J. Membrane Biol., 2004, vol. 197, p. 1-32.
22. Kavi Kishor, P. B. Regulation of proline biosynthesis, degradation, uptake and transport in higher plants: its implications in plant growth and abiotic stress tolerance. Current Science, 2005, vol. 88, no. 3, p. 424-438.
23. Horie, T. Sodium transporters in plants. Diverse genes and physiological functions. Plant Physiol., 2004, vol. 136, p. 2457-2462.
24. Iman-Barber, N. Total protein content in wheat and response to salt stress. Field Crops Research, 2005, vol. 92, no. 2-3, p. 185-202.
25. Javot, H. The role of osmolites such as proline, aminoacids and ion content in root water uptake and salinity tolerance. Annals of Botany, 2002, vol. 90, p. 301-313.
26. Argentel, L., López, R. D., González, L. M., López, R. C., Gómez, E. y Fonseca, I. Evaluación de la tolerancia a la salinidad en estadios tempranos y finales del desarrollo en triticales (X triticum secale). Cultivos Tropicales, 2010, vol. 31, no. 1, p. 47-52.
Recibido: 17 de mayo de 2009
Aceptado: 28 de septiembre de 2010