Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.4 La Habana oct.-dic. 2010
EVALUACIÓN DE LA INOCULACIÓN CONJUNTA Bradyrhizobium japonicum–HONGOS MICORRÍZICOS ARBUSCULARES Y LA APLICACIÓN DE UN BIOESTIMULADOR DEL CRECIMIENTO VEGETAL EN SOYA CULTIVADA EN ÉPOCA DE INVIERNO
EFECTOS DE LA CONTAMINACIÓN MICROBIANA Y OXIDACIÓN FENÓLICA EN EL ESTABLECIMIENTO In Vitro DE FRUTALES PERENNES JOINT ASSESSMENT Bradyrhizobium japonicum inoculation-arbuscular mycorrhizal fungi AND APPLICATION OF A PLANT GROWTH IN biostimulator soybeans grown in winter time
Ms.C. J. CorberaI y Dra.C. María C. NápolesII
I Investigador Auxiliar del departamento de Biofertilizantes y Nutrición de las Plantas. E-mail: jcorbera@inca.edu.cu
II Investigadora Titular del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana, Cuba, CP 32700
RESUMEN
El estudio se desarrolló en el Instituto Nacional de Ciencias Agrícolas (INCA) sobre un suelo Ferralítico Rojo Lixiviado, con el objetivo de evaluar el efecto de la inoculación combinada de Bradyrhizobium japonicum y hongos micorrízicos arbusculares, junto con la aplicación de un bioestimulador del crecimiento vegetal, sobre la respuesta del cultivar de soya INCAsoy-24. Se empleó un diseño de bloques al azar con cuatro réplicas por tratamiento, los cuales consistieron en la inoculación de estos microorganismos, en sus formas simples y combinados, mediante la tecnología de recubrimiento de semillas, así como la aplicación por diferentes vías del bioestimulador del crecimiento vegetal a los tratamientos anteriores. Los resultados del estudio mostraron un efecto positivo de la inoculación conjunta de ambos biofertilizantes sobre el crecimiento y rendimiento de este cultivar de soya, con incrementos de 31,2 %, lo que corroboró los efectos sinérgicos y beneficiosos de la coinoculación Bradyrhizobium japonicum–hongos micorrízicos arbusculares en este cultivo. Los incrementos fueron ligeramente superiores con la aplicación a dicho tratamiento del estimulador del crecimiento vegetal, sin diferencias significativas con este, tanto recubriendo las semillas como con la aplicación foliar, con valores alrededor de 37,6 y 34,4 % respectivamente. Los tratamientos donde se aplicó el bioestimulante produjeron rendimientos superiores a sus controles donde no se aplicó el producto, obteniéndose incrementos en la producción entre 2,44 y 14,91 %, de acuerdo al tratamiento evaluado, demostrando su efectividad en la estimulación del crecimiento vegetal.
Palabras clave: soya, Bradyrhizobium japonicum, micorriza arbuscular, bioestimulante.
ABSTRACT
The study was carried out at the National Institute of Agricultural Sciences (INCA) on a Lixiviated Red Ferralitic soil, with the objective of evaluating the effect of the combined inoculation of Bradyrhizobium japonicum and arbuscular mycorrhizal fungi, along with the application of a crop growth biostimulator, on soybean response of INCAsoy-24 cv. A randomized block design with four repetitions per treatment was employed, which consisted of inoculating these microorganisms, in their single and cocktail forms, by means of a seed recovery technology, as well as applying a crop growth biostimulator through different ways to the previous treatments. Results showed a positive effect of the combined inoculation of both biofertilizers on soybean cultivar growth and yield, with increments of 31,2 %, so confirming the synergical and beneficial effects of Bradyrhizobium japonicum-arbuscular micorrhiza fungal coinoculation in this crop. Increments were slightly higher when applying crop growth stimulator to this treatment, it showing no significant differences, either by seed recovery or leaf application, with values of about 37,6 and 34,4 % respectively. Treatments where the biostimulant was applied showed better yields than the controls; thus, production increments from 2.44 to 14,91 % were achieved, according to the treatment evaluated, it proving its effectiveness on crop growth stimulation.
Key words: soybean, Bradyrhizobium japonicum, mycorrhizal fungus, biostimulant.
INTRODUCCIÓN
En los procesos de producción agrícola sostenible se ha prestado especial interés al uso de microorganismos benéficos del suelo, que mediante la actividad simbiótica inducen la mejora de la nutrición de las plantas, coadyuvan a tolerar condiciones adversas de producción y, consecuentemente, promueven el crecimiento y la producción de los cultivos. Por estas razones dichos microorganismos benéficos se han considerado agentes de fertilización biológica o biofertilizantes (1).
Teniendo en cuenta los resultados de las investigaciones con estos biofertilizantes a nivel mundial, se ha venido trabajando en el empleo de inoculaciones conjuntas de rizobios y hongos micorrízicos arbusculares (MA) en el cultivo de las leguminosas (2, 3, 4, 5, 6, 7, 8), lográndose incrementos en el crecimiento y rendimiento de las plantas, y destacándose la importancia de esta práctica conjunta.
También, en los últimos años, se ha informado la potencialidad de las oligosacarinas, primeramente reconocidas como polisacáridos y oligosacáridos, que inducían respuestas defensivas y resistencia en plantas. Sin embargo, estudios posteriores desarrollados en la década de los años 90 las implicaron, además, en varias respuestas relacionadas con el crecimiento y desarrollo del vegetal (9, 10). El descubrimiento de la estructura del principal esqueleto carbonado de los factores de nodulación y su efecto en la morfogénesis de las raíces de las leguminosas, contribuyó a establecer a las oligosacarinas como una nueva hormona en las plantas, cuya acción precede la síntesis y acumulación de las conocidas hormonas tradicionales (10, 11).
En la actualidad, se reconoce que diferentes estructuras de oligosacarinas endógenas y exógenas juegan un papel en diferentes estadios del desarrollo de las plantas, como son la división, el crecimiento y la morfogénesis celular (12, 13, 14, 15, 16), el crecimiento radical y vegetativo (17, 18, 19), y el acortamiento y mejoramiento del período de floración y fructificación (20). Adicionalmente, las oligosacarinas sintetizadas y excretadas por rizobacterias fijadoras de nitrógeno de la familia Rhizobiaceae, provocan la germinación de algunas plantas y están involucradas en los eventos primarios de las raíces, que conllevan al establecimiento de la simbiosis entre las leguminosas y las bacterias mencionadas (11, 21, 22).
En el INCA se trabaja desde 1992 en la obtención de oligosacarinas a partir de materias primas nacionales, desarrollando una metodología (23) para la obtención de una mezcla de oligogalacturónidos a partir de pectina cítrica (Pectimorf®), que ha sido utilizada satisfactoriamente en sustitución de reguladores del crecimiento tradicionales o en sinergia con determinadas fitohormonas (24, 25).
Teniendo en cuenta lo anteriormente planteado se realizó este estudio, con el objetivo de evaluar el efecto de la inoculación combinada de Bradyrhizobium japonicum y hongos MA, así como la aplicación de un bioestimulador del crecimiento vegetal en el crecimiento y rendimiento del cultivar de soya INCAsoy 24 en época de invierno.
MATERIALES Y MÉTODOS
El estudio se desarrolló en las condiciones del área experimental Las Papas, perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), San José de las Lajas, La Habana, sobre un suelo Ferralítico Rojo Lixiviado (26), como se observa en la Tabla I.
El cultivar de soya INCAsoy-24 se sembró en época de invierno en un área experimental de alrededor de 0,15 ha, con 64 parcelas de 14 m2 (4 surcos x 5 m de largo) y 7 m2 de área de cálculo (surcos centrales), empleándose 20 plantas.m-1 y una distancia entre surcos de 0,70 m.
Se evaluaron los siguientes productos:
1. Bradyrhizobium japonicum, cepa ICA 8001: AzoFert® (Bradyrhizobium japonicum)
2. Micorriza arbuscular, cepa Glomus hoi like: EcoMic® (MA)
3. Bioestimulador del crecimiento vegetal: Pectimorf® (Pmorf).
Los biofertilizantes se aplicaron a la semilla en soporte sólido a través de la tecnología de recubrimiento de semillas (27, 28), a razón de 10 g.kg-1 para la bacteria y el 10 % del peso de la semilla para el hongo formador de micorriza arbuscular.
El bioestimulante se aplicó a una dosis de 10 mg.L-1 en tres formas diferentes: imbibición (I), recubrimiento de las semillas (R) y foliar al inicio de la floración (F).
Se empleó un diseño de bloques al azar con cuatro réplicas por tratamiento, evaluándose los resultados a través de un análisis de varianza (paquete estadístico SPSS 11.5 para Windows), donde se utilizó la prueba de rangos múltiples de Duncan para discriminar la diferencia entre las medias.
Se realizaron las siguientes evaluaciones:
Etapa de floración. Altura de las plantas (cm), masa seca (g) de la parte aérea y raíz, análisis químico foliar (% N, P y K en trifoliolos), nodulación (no. nódulos, masa seca de nódulos en g y % de efectividad de nódulos según la coloración en su interior a través del corte transversal de estos), variables fúngicas empleando la técnica de tinción de raíces y se evaluaron: no. de esporas, porcentaje de colonización a través del método de los interceptos y la variable transformada como 2arcosenov%, porcentaje de densidad visual y masa del endófito en g.g suelo-1 por cálculos matemáticos, según protocolos propuestos (29, 30, 31, 32, 33).
Etapa de cosecha. Altura de las plantas (cm), no. Vainas/planta, peso de 1000 granos (g) y rendimiento de granos (t.ha-1). Las atenciones culturales se realizaron de acuerdo con lo establecido en las normas técnicas para el cultivo (34, 35, 36).
RESULTADOS Y DISCUSIÓN
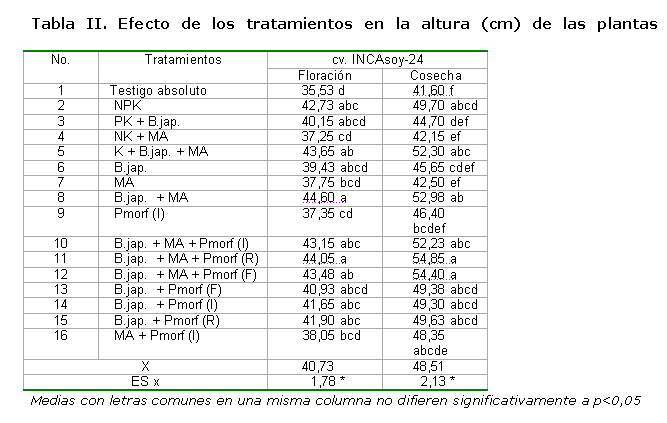
Los resultados para la variable altura de las plantas (Tabla II), tanto en floración como en cosecha, manifestaron respuestas significativas entre tratamientos, destacándose aquellos donde se realizó la inoculación conjunta de los biofertilizantes, con o sin aplicación del estimulador del crecimiento vegetal, y sin diferencias significativas con el tratamiento de fertilización mineral NPK. Resultados similares han sido reportados por otros autores (8, 37).
La aplicación del bioestimulador del crecimiento mostró ligeros incrementos en relación con sus controles donde no se aplicó, independientemente de la forma en que se empleó, principalmente al final del ciclo o etapa de cosecha, aunque las diferencias entre tratamientos, de manera general, no fueron significativas. Los efectos de este producto bioestimulador en la altura de las plantas han sido reportados (38, 39) en cultivos como el tomate y la palma areca.
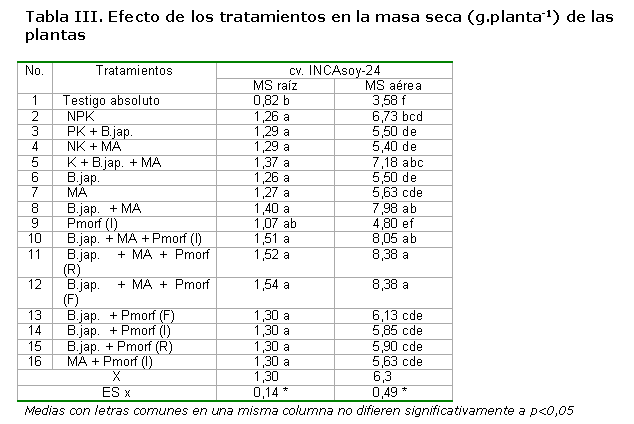
La masa seca de la raíz y parte aérea de la planta mostró respuestas diferentes (Tabla III).
Para la masa seca de la raíz solo se encontraron diferencias de los tratamientos con el testigo absoluto; sin embargo, para la parte aérea las respuestas fueron superiores cuando se aplicaron ambos biofertilizantes de manera conjunta, con incrementos ligeramente superiores cuando se le adicionó el bioestimulador del crecimiento vegetal, pero sin diferencias entre ellos. Resultados similares para la masa seca han sido señalados (38) aplicando una mezcla de oligogalacturónidos en plántulas de tomate. La aplicación del bioestimulante imbibiendo las semillas, para ambas variables evaluadas, no mostró diferencias con el tratamiento testigo absoluto.
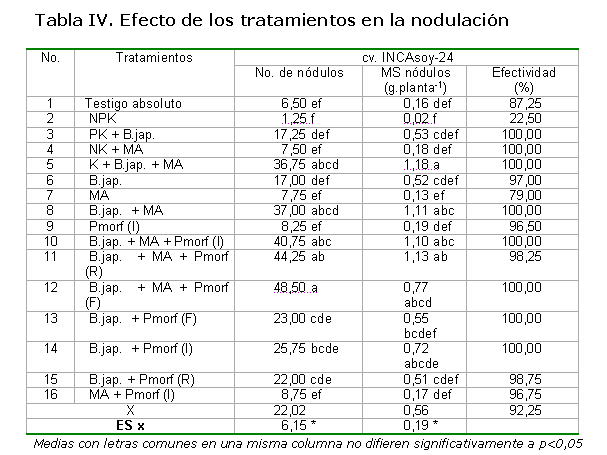
El efecto de los tratamientos sobre la nodulación se refleja en la Tabla IV, donde se observaron, para las variables número de nódulos y su masa seca, respuestas significativas a los diferentes tratamientos evaluados, correspondiendo las mayores respuestas a aquellos tratamientos donde se combinaron Bradyrhizobium japonicum y los hongos MA. Cuando se aplicó el bioestimulador del crecimiento vegetal, los valores obtenidos para las variables manifiestan un ligero incremento, pero sin diferencias con sus controles donde no se aplicó.
De manera general, la mayor efectividad de los nódulos estuvo relacionada con los tratamientos donde se aplicó Bradyrhizobium, con valores de 100 % de efectividad o cercanos a este.
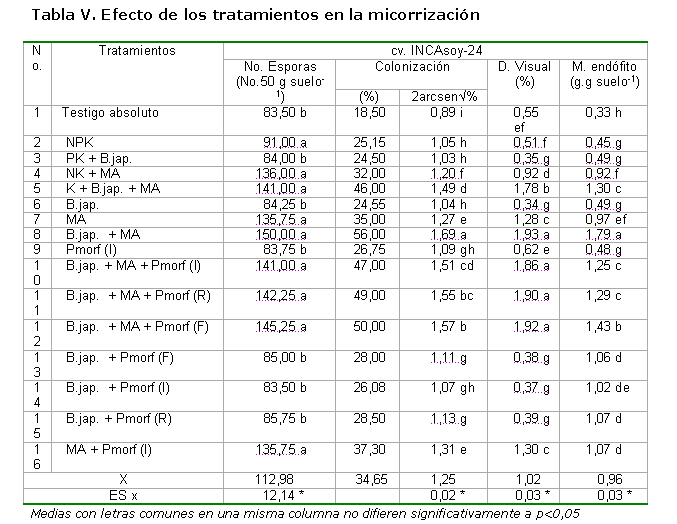
Los resultados de las variables micorrízicas, como respuesta a los diferentes tratamientos, se aprecian en la Tabla V, en la cual el no. de esporas.50 g-1 de suelo resultó superior en los tratamientos donde se aplicó el producto a base del hongo MA, sin diferencias significativas entre ellos, presentando los mayores valores absolutos donde se empleó la coinoculación de los dos biofertilizantes Por otra parte, se aprecia que la colonización micorrízica resultó superior en los tratamientos con inoculación conjunta de los biofertilizantes, no apreciándose efecto del estimulador del crecimiento vegetal.
Al observar los valores de la densidad visual (variable que mide la intensidad de la colonización micorrízica), se muestra que los mayores porcentajes estuvieron dados, al igual que en la colonización, para aquellos tratamientos donde se aplicaron ambos biofertilizantes de manera conjunta (Tabla V). Para la variable masa del endófito se obtuvieron resultados similares a las anteriores variables evaluadas. Resultados similares en el incremento de estas variables con el empleo de la coinoculación rizobio–micorriza han sido indicados en el cultivo de la alfalfa (40).
De manera general, no se observó efecto de la aplicación del bioestimulante sobre las variables fúngicas. Se aprecia, además, que la micorriza nativa o presente en el suelo al inicio del estudio tuvo un buen comportamiento, dado por los valores encontrados en las variables evaluadas para los tratamientos en los que no fue aplicado el hongo formador de micorrizas arbusculares.
El estado nutricional de las plantas, reflejado a partir de los contenidos foliares de N, P y K (Tabla VI), mostró diferencias significativas entre los tratamientos evaluados; se destacan con los mayores porcentajes de N, P y K aquellos tratamientos donde se aplicó la combinación de biofertilizantes y los que además se les adicionó el estimulador del crecimiento sin diferencias apreciables entre estos. Se encontraron valores de los elementos que se corresponden con los reportados por la literatura (41) como suficientes para este cultivo, excepto para el N, donde los valores estuvieron por debajo de los rangos de suficiencia establecidos.
En cuanto a los componentes del rendimiento y rendimiento de granos (Tabla VII), el número de vainas por planta mostró resultados similares a las variables anteriormente evaluadas, con diferencias significativas entre tratamientos, observándose resultados superiores en aquellos tratamientos donde se coinocularon las semillas con ambos biofertilizantes, con un incremento en los valores, pero sin diferencias significativas, cuando se empleó, además, el bioestimulador del crecimiento vegetal. Para la masa de 1000 granos, no se observaron diferencias significativas entre los tratamientos evaluados.
Al analizar los rendimientos de granos, como resultado del crecimiento y desarrollo del cultivo, se observaron diferencias significativas entre tratamientos, destacándose el tratamiento donde se inoculó de manera conjunta el Bradyrhizobium japonicum y la cepa de hongo formador de micorriza arbuscular Glomus hoi like, que presentó incrementos de los rendimientos de 31,2 % para el cultivar estudiado. Los incrementos fueron ligeramente superiores con la aplicación a dicho tratamiento del estimulador del crecimiento vegetal, recubriendo las semillas o con aplicación foliar y los valores oscilaron entre 37,6 y 34,4 % respectivamente, pero sin diferencias significativas entre ellos.
Para los tratamientos donde se efectuaron aplicaciones simples de microorganismos, la aplicación del bioestimulador del crecimiento mostró diferencias significativas, lográndose rendimientos superiores a sus controles donde no se aplicó el producto y con incrementos que oscilaron entre 2,44 y 14,91 % de acuerdo al tratamiento evaluado.
El rendimiento de grano, variable fundamental para evaluar el efecto que sobre este cultivo ejerce la aplicación conjunta de Bradyrhizobium japonicum y la micorriza arbuscular Glomus hoi like, así como la aplicación del bioestimulador del crecimiento vegetal, mostró respuesta positiva para las condiciones de estudio y el cultivar evaluado, manifestándose, de forma general, sus incrementos, lo que posibilita un manejo más integral de estas aplicaciones en el cultivo de la soya.
Los resultados del estudio, como ha sido señalado anteriormente en la introducción, corroboran lo encontrado por diversos autores (4, 5, 6, 7, 8, 37) en relación con el efecto de las inoculaciones mixtas de Bradyrhizobium japonicum y los hongos formadores de micorrizas arbusculares en cultivos de leguminosas, así como el efecto del bioestimulador en el crecimiento de las plantas (17, 18, 19, 20), aspecto poco estudiado para condiciones de campo con este tipo de producto.
CONCLUSIONES
1. Se encontró efecto positivo de los tratamientos para las variables de crecimiento y rendimiento evaluadas, excepto para la masa de 1000 granos, donde las respuestas no fueron significativas.
2. Los mejores resultados se manifestaron con la aplicación conjunta del Bradyrhizobium japonicum y el hongo MA, con un incremento del rendimiento de 31,2 %. Sin diferencias con dicho tratamiento, se lograron incrementos ligeramente superiores al aplicar el estimulador del crecimiento vegetal, recubriendo las semillas o con aplicación foliar, y los valores oscilaron entre 37,6 y 34,4 % respectivamente.
3. Los tratamientos con el bioestimulante produjeron rendimientos superiores a sus controles, donde no se aplicó el producto, obteniéndose incrementos en la producción entre 2,44 y 14,91 % de acuerdo al tratamiento evaluado.
REFERENCIAS
1. Díaz, A.; Ortegón, A. S. y Garza, I. Biofertilización del cártamo (Carthamus tinctorius L.) en condiciones restringidas de humedad en el suelo. Rev. Fitotec. Mex., 2006, vol. 29, no. 2, p. 175–180.
2. Azis, T. y Habte, M. Growth of transplanted Sesbania grandiflora as affected by preinfection of root with Rhizobia and VAM fungus. Nitrogen fixing tree Research Reports, 1990, vol. 8, p. 159–160.
3. Valdéz, M.; Reza–Alemán, F. y Furlán, V. World. Journal of Microbiology and Biotecnology, 1993, vol. 9, p. 93–99.
4. Hernández, A y Hernández, A. N. Efecto de la interacción Rhizobium-MA en el cultivo de la soya (Glycine max (L) Merrill). Cult. Trop., 1996, vol. 17, no. 1, p. 5–7.
5. Corbera, J. y Hernández, A. Evaluación de la asociación Rhizobium–MVA sobre el crecimiento y desarrollo del cultivo de la soya (Glycine max L. Merrill). Cult. Trop., 1997, vol. 18, p. 1, p. 10–12.
6. Corbera, J. Coinoculación Bradyrhizobium japonicum–MVA como fuente alternativa de fertilización para el cultivo de la soya. Cult. Trop., 1998, vol. 19, no. 1, p. 17–20.
7. Corbera, J. y Núñez, M. Evaluación agronómica del análogo de brasinoesteroides BB–6 en soya, inoculada con Bradyrhizobium japonicum y HMA, cultivada en invierno sobre un suelo Ferralsol. Cult. Trop., 2004, vol. 25, no. 3, p. 9-13.
8. Hernández, A. La coinoculación Glomus hoi like–Bradyrhizobium japonicum en la producción de soya (Glycine max) variedad Verónica para semilla. Cult. Trop., 2008, vol. 29, no. 4, p. 41–45.
9. Marfà, V.; Gollin, D.; Eberhard, S.; Mohnen, D.; Albersheim, P. y Darvill, A. Oligogalacturonides are able to induce flowers to form on tobacco explants. Plant J., 1991, vol. 1, p. 217–225.
10. Côté, F.; Ham, K. S.; Hahn, M. G. y Bergman, C. W. Oligosaccharide elicitors in host-pathogen interactions: Generation, perception and signal transduction. En: Biswas, B. B., Das, H. (Eds.), Subcellular biochemistry, Vol.29, Plant-microbe interactions. Plenum Press, New York, 1998, p. 385–431.
11. Prithiviraj, B.; Solumenoev, A.; Zhou, X. y Smith, D. L. Differential response of soybean (Glycine max (L.) Merr.) to lipochitooligosaccharide Nod BJ V(C18:1 Me Fuc) J. Exp. Bot., 2000, vol. 51, p. 2045-2051.
12. McDougall, G. J. y Fry, S. C. Xyloglucan oligosaccharides promote growth and activate cellulase. Evidence for a role of cellulose in cell expansion. Plant Physiol., 1990, vol. 93, p. 1042–1048.
13. Vargas-Rechia, C.; Reicher, F.; Sierakowski, M. R.; Heyraud, A.; Driguez, H. and Liénart, Y. Xyloglucan octasaccharide XXLGol derived from the seeds of Hymenaea courbaril acts as a signaling molecule. Plant Physiol., 1998, vol. 116, p. 1013-1021.
14. Plana, D.; Álvarez, M.; Florido, M.; Lara, R. M. y Cabrera, J. C. Actividad biológica en la morfogénesis in vitro del tomate variedad Amalia. Cult. Trop., 2003, vol. 24, no. 1, p. 29-33.
15. Nieves, N.; Poblete, A.; Cid, M.; Lezcano, Y.; González-Olmedo, J. L. y Cabrera, J. C. Evaluación del Pectimorf como complemento del 2,4-D en el proceso de embriogénesis somática de caña de azúcar (Saccharum spp). Cult. Trop., 2006, vol. 27, no. 1, p. 25-30.
16. Cid, M.; González-Olmedo, J. L.; Lezcano, Y. y Nieves, N. Influencia del Pectimorf sobre la calidad de la semilla artificial de caña de azúcar (Saccharum spp). Cult. Trop., 2006, vol. 27, no. 1, p. 31-34.
17. Chibu, H.; Shibayama, H. y Arima, S. Effects of chitosan application on the shoot growth of rice and soybean. Japanese J. of Crop Sci., 2002, vol. 71, p. 206-211.
18. Falcón, A. B.; Cabrera, J. C.; Reinaldo, I. M. y Nuñez, M. Desarrollo de activadores de las plantas de amplio espectro de acción. Informe Final del PNCT 00100191, CITMA, Cuba. 2005.
19. Falcón, A. B. y Cabrera, J. C. Actividad enraizadora de una mezcla de oligogalacturónidos en pecíolos de violeta africana. Cult. Trop., 2007, vol. 28, no. 2, p. 87-90.
20. Ohta, K.; Morishita, S.; Suda, K.; Kobayashi, N. y Hosoki, T. Effects of chitosan soil mixture treatment in the seedling stage on the growth and flowering of several ornamental plants. J. Japan. Soc. Hort. Sci., 2004, vol. 73, p. 66-68.
21. Lhuissier, F. G. P.; De Ruijter, N. C. A.; Sieberer, B. J.; Esseling, J. J. y Emons, A. M. C. Time course of cell biology events evoked in legume root hairs by Rhizobium Nod factors: state of the art. Ann Bot., 2001, vol. 87, p. 289-302.
22. Prithiviraj, B.; Solumenoev, A.; Zhou, X.; Kahn, W. M. y Smith, D. L. A host-specific bacteria-to-plant signal molecule (Nod factor) enhances germination and early growth of diverse crop plants. Planta, 2003, vol. 216, p. 437-445.
23. Cabrera, J. C. Procedimiento de obtención de una mezcla de oligosacáridos pécticos estimuladora del enraizamiento vegetal. Patente Cubana 22859/2003.
24. Montes, S.; Aldaz, J. P.; Ceballos, M.; Cabrera, J. C. y López, M. Uso del biorregulador Pectimorf en la propagación acelerada del Anthurium cubense. Cult. Trop., 2000, vol. 21, no. 3, p. 29–31.
25. Nieves, N.; Pobrete, A.; Cid, M.; González-Olmedo, J. L.; Lezcano, Y. y Cabrera, J. C. Evaluación del Pectimorf como complemento del 2.4-D en el proceso de embriogénesis somática de la caña de azúcar (Saccharum sp.). Cult. Trop., 2006, vol. 27, no. 1, p. 25–30.
26. Hernández, A., /et al./. Nueva versión de Clasificación Genética de los suelos de Cuba. Instituto de Suelos. MINAGRI. La Habana. AGRINFOR. 1999. 64 p.
27. Fernández, F. y Rodríguez, E. L. Estudios básicos de la tecnología de recubrimiento de semillas con inoculantes micorrizógenos V.A. En: Programa y Resúmenes X Sem. Cient. Inst. Nac. Cienc. Agríc. La Habana. 1996, p. 87–88.
28. Gómez, R., /et al./. Principales resultados en la aplicación de biofertilizantes en cultivos de interés económico para Cuba, utilizando la tecnología de recubrimiento de semillas. En: Programa y Resúmenes X Sem. Cient. Inst. Nac. Cienc. Agríc. La Habana. 1996. p 87–88.
29. Gerdemann, J. W. y Nicolson, T. H. Spore of mycorrhizae endogone species extracted from soil by wet sieving and decanting. Trans Br. Mycol. Soc., 1963, vol. 46, p. 235-244.
30. Phillips, J. M. y Hayman, D. S. Improved procedures for clearing roots and staining parasitic and vesiculararbuscular mycorrhizal fungi for rapid assessment of infection. Tranfer. Britanic: Mycology Society, 1970, vol. 55, p. 158–161.
31. Giovannetti, M. and Mosse, B. An evaluation of techniques to measure vesicular–arbuscular infection in roots. New Phytology, 1980, vol. 84, p. 489-500.
32. Trouvelot, A.; Kough, J. And Gianinazzi–Pearson, V. Mesure du taux de Mycorrhization VA d´un Systeme Radiculaire. Recherche de Methodes d´Estimation Ayantune Fonctionnelle. En: Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae (1:1986 jul. 1–5: Paris). 1986. p. 217–222.
33. Herrera, R.; Furrazola, E.; Ferrer, R. L.; Fernández, R. y Torres, Y. Funtional strategies of root hairs and arbuscular mycorrhizae in an evergreen tropical forest, Sierra del Rosario, Cuba. CENIC, Ciencias Biológicas, 2004, vol. 35, no. 2.
34. Pijeira, L., /et al./. La fertilización y nutrición de la soya. Alternativas para la producción de granos y forraje. Folleto Divulgativo para Productores. Instituto Nacional de Ciencias Agrícolas. La Habana. 1990. 22 p.
35. Díaz, H., /et al./. El cultivo de la soya para granos y forraje. La Habana: CIDA, 1992. 16p.
36. Manual Técnico. Cultivo y utilización de la soya en Cuba. Holguín. 1998. 56 p.
37. Hernández, M. y Cuevas, F. The effect of inoculating with arbuscular mycorrhiza and Bradyrhizobium strains on soybean (Glycine max (L.) Merrill) crop development. Cult. Trop., 2003, vol. 24, no. 2, p. 19–21.
38. Costales, D.; Martínez, L. y Núñez, M. Efecto del tratamiento de semillas con una mezcla de oligogaracturónidos sobre el crecimiento de plántulas de tomate (Solanum lycopersicum Cult. Trop., 2007, vol. 28, no. 1, p. 85–91.
39. Benítez, B.; Soto, F.; Núñez, M. y Yong, A. Crecimiento de plantas de palma areca (Dypsis lutescens, H. Wendel) con aspersiones foliares de una mezcla de oligogaracturónidos. Cult. Trop., 2008, vol. 29, no. 3, p. 81–85.
40. Tovar–Franco, J. Incrementos en invernadero de la cantidad y calidad de follaje de la alfalfa (Medicago sativa L.) variedad Florida 77 causado por la combinación de fertilización biológica y química en un suelo de la serie Bermeo de la Sabana de Bogotá. Pontificia Universidad Javeriana, Bogotá, Colombia. Universitas Scientiarum, 2006, vol. 11 (No. especial), p. 61–71.
41. IFA. World Fertilizer Use Manual. International Fertilizer Industry Association. Paris, France. 1992. p. 37-550.
Recibido: 19 de octubre de 2009
Aceptado: 8 de octubre de 2010