Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.32 no.1 La Habana ene.-mar. 2011
INFLUENCIA DE LA INOCULACIÓN CON Glomus hoi-like Y UN CONGLOMERADO DE ESPECIES DE HMA EN EL CRECIMIENTO DE PLANTAS DE SORGO SOMETIDAS O NO A ESTRÉS HÍDRICO
Influence of inoculation with Glomus hoi-like and a conglomerate of HMA SPECIES OF PLANTS ON THE GROWTH OF SORGHUM UNDER WATER STRESS OR NOT
Aracely Mena Echevarría1, M.Sc. Kalyanne Fernández Suárez2, D.Sc. Eduardo Jerez Mompie3, Dr. Víctor Olalde Portugal4, M.Sc. Rosalinda Serrato5
1 Especialista. E-mail: amena@inca.edu.cu
2 Investigadora Agregada del departamento de Biofertilizantes y Nutrición de las Plantas
3 Investigador Auxiliar del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700
4 Investigador Titular Jefe del laboratorio de Bioquímica Ecológica
5 Asistente del laboratorio, departamento de Biotecnología y Bioquímica del Centro de Investigaciones y Estudios Avanzados (CINVESTAV) del Instituto Politécnico Nacional (IPN), Campus Irapuato, Guanajuato, México.
RESUMEN
Los hongos micorrízicos arbusculares (HMA) no solo influyen en el crecimiento y desarrollo de las plantas, sino también en la tolerancia a condiciones de déficit hídrico y en la protección frente a diferentes patógenos del suelo. El presente trabajo se realizó con el objetivo de comparar el efecto de la inoculación con HMA (Glomus hoi-like) y un conglomerado de especies (Consorcio selva) sobre el crecimiento y desarrollo de plantas de sorgo sometidas a estrés hídrico. Para dar cumplimiento al objetivo, se llevó a cabo un experimento en condiciones de invernadero bajo un diseño completamente aleatorizado, en el que se determinaron los potenciales hídricos del suelo y las hojas, la conductancia estomática y tasa fotosintética en diferentes momentos, así como la altura de las plantas, el diámetro del tallo, la masa seca, el porcentaje de colonización micorrízica y contenido de fósforo en follaje al finalizar el experimento. Los resultados mostraron que, en general, en las plantas sometidas al estrés hubo una disminución del crecimiento y el desarrollo, no así en los tratamientos micorrizados, independientemente del déficit hídrico. Los valores superiores de las variables morfoagrónomicas se observaron en los tratamientos donde se empleó el Consorcio selva y en las variables fisiológicas se obtuvieron respuestas similares. Las plantas inoculadas con el Consorcio selva fueron las que mejor soportaron y se recuperaron del déficit hídrico, lo que pudo estar asociado a la ocurrencia de efectos sinérgicos entre las diferentes especies que lo conforman, potenciándose unas a otras.
Palabras clave: sorgo, hongos micorrízicos arbusculares, estrés hídrico.
ABSTRACT
Arbuscular mycorrhizal fungi (AMF) not only influence plant growth and development, but also they tolerate water deficiencies and protect plants against different soil pathogens. The objective of this paper was to compare the effect of two AMF inoculants (Glomus hoi–like and a concentrated species, “Consorcio selva”) on sorghum plant development and growth under water stress conditions. To reach this goal, a greenhouse experiment was conducted under a randomized complete design, determining soil and leaf water potentials, stomatal conductance and photosynthetic rate at different times, as well as plant height, stem diameter, dry weight, mycorrhizal colonization percentage and leaf phosphorus content at the end of the experiment. In general, results showed a plant growth and development reduction under water stress conditions, differently from mycorhized treatments, independently of water deficit. The highest values of morpho-agronomic variables were observed in the treatments using concentrated species, whereas similar responses were recorded in physiological variables. Plants inoculated with concentrated species were the best that endured water stress and recovered from it, which could be associated to the occurrence of synergic effects among the species making them up, strengthening one to each other.
Key words: sorghum, arbuscular micorhyzal fungi, water stress.
INTRODUCCIÓN
El sorgo (Sorghum vulgare) es uno de los cereales que por sus características agronómicas y nutricionales pudiera aportar grandes beneficios a la alimentación, tanto humana como animal a nivel nacional y mundial. Su importancia radica fundamentalmente en la utilización del grano y el forraje para el alimento animal, y como parte esencial de un sistema de rotaciones para mantener la productividad y estructura del suelo, además de ser una de las plantas hospederas más utilizadas para la producción de inoculantes micorrízicos mediante la tecnología de canteros multiplicadores (1). Es una especie típica de zonas de clima cálido, que es capaz de tolerar condiciones de sequía, baja disponibilidad de nutrientes, altas temperaturas y bajos requerimientos nutricionales (2).
Los hongos micorrízicos arbusculares (HMA) son microorganismos benéficos del suelo, que juegan un papel fundamental en la agricultura, ya que al formar simbiosis con la gran mayoría de las plantas, le confiere múltiples beneficios, dentro de los que se encuentran la resistencia al estrés hídrico (3). Un incremento en la tolerancia a la sequía puede ser atribuido en parte a la alteración de los niveles de movimiento del agua a través y fuera de las plantas hospederas con sus consiguientes efectos en los diferentes tejidos.
Teniendo en cuenta que en los últimos años las investigaciones se han encaminado a buscar alternativas que involucren a los microorganismos que están presentes en el suelo, los cuales contribuyen a la recuperación de los agroecosistemas, favoreciendo la sustitución parcial o total de los productos químicos, reduciendo el costo de producción y la posible utilización de los recursos locales renovables (4), el objetivo de este trabajo fue comparar el efecto de la inoculación con Glomus hoi- like y un conglomerado de especies (Consorcio selva) sobre el crecimiento y desarrollo de plantas de sorgo sometidas a estrés hídrico.
MATERIALES Y MÉTODOS
El experimento se realizó en el Centro de Investigaciones y Estudios Avanzados (CINVESTAV), Campus Irapuato, México.
Como material vegetal se emplearon plantas de sorgo (Sorghum vulgare) cultivar BJ 83 Caloro y como sustrato una mezcla de suelo franco y arena relación 3:1, previamente esterilizado con formol, cuyas características químicas se muestran en la Tabla I.
El estudio se realizó entre abril y junio del 2008 en condiciones de invernadero. Se utilizaron dos inóculos micorrízicos: uno compuesto por la especie Glomus hoi-like, perteneciente al cepario del INCA, Cuba y un conglomerado de especies (Consorcio Selva), perteneciente al CINVESTAV, Irapuato, México. El conglomerado estaba integrado por las siguientes especies: Glomus constrictum (Trappe); Glomus geosporum (Nicol. & Gerd.) Walker; Glomus fasciculatum (Thaxter) Gerd. & Trappe emend. Walker & Koske, Glomus tortuosum Schenck & Smith, y Acaulospora scrobiculata Trappe.
Al comienzo del experimento se realizó un conteo de esporas de HMA en el sustrato empleado (5, 6). Se emplearon macetas de plástico de 2.3 kg de capacidad, a las que se les añadieron 10 g de inóculo (11 esporas.g-1), se colocaron dos semillas por maceta y a los 10 días de la germinación se efectuó un raleo dejando una planta por maceta. Las plantas se fertilizaron semanalmente, aplicándoseles 200 mL de solución nutritiva Long Ashton, LANS (7).
Se empleó un diseño completamente aleatorizado con arreglo factorial. Los factores en estudio y sus niveles fueron la aplicación de inoculante micorrízico e inducción de estrés hídrico; se estudiaron un total de seis tratamientos con nueve plantas cada uno (Tabla II).
Para provocar la condición de estrés hídrico se suspendió el riego a las plantas de los tratamientos correspondientes a los 45 días después de la siembra (dds), durante un periodo de siete días. Pasados los siete días del estrés hídrico, se aplicó un riego de recuperación, aplicándose agua hasta la máxima saturación.
Se aplicaron 44 mg.kg-1 de fósforo y para los tratamientos micorrizados se redujo la dosis de fósforo a 22 mg.kg-1.
Determinaciones realizadas. A los 42 y 56 dds se midieron la altura y el diámetro del tallo de las plantas, mientras que la masa seca foliar y el porcentaje de colonización se determinaron al finalizar el experimento (56 dds). El porcentaje de colonización se realizó mediante el método de tinción con Azul de tripano (8, 9) y se calculó mediante las fórmulas descritas por Trouvelot et al. (10).
Los potenciales hídricos de hojas (yhjs) y suelo (ys) se determinaron en tres momentos del experimento: antes, durante el estrés y posterior al riego de recuperación; para el yhjs se tomaron tres plantas por tratamiento y se realizaron dos lecturas por planta, pero en el caso del ys se colocó un electrodo en el sustrato de las plantas analizadas. Los valores de estas variables se midieron a través de un potenciómetro HR-33T (Dew Point microvoltmeter WESCOR, USA).
Las variables fisiológicas conductancia estomática (g) y tasa fotosintética (Pn) se evaluaron a los 52 dds durante el estrés (t1) y a los 54 dds una vez aplicado el riego de recuperación (t2). Para su determinación se tomaron tres plantas por tratamiento y se analizaron dos hojas jóvenes. Ambas variables se determinaron con un equipo portátil para medir fotosíntesis, modelo Li-6200 (Licor, Nebraska, USA).
La variable fósforo en follaje se evaluó al finalizar el experimento, a través del método de azul molibdofosfórico obtenido por reducción con el ácido cloruroestañoso en un sistema sulfúrico (11).
Análisis estadísticos realizados. Los datos se analizaron mediante el software SPSS para Windows (SPSS 11.5). Se verificó el cumplimiento de las premisas del ANOVA, como la normalidad y homogeneidad de varianza y, posteriormente, los datos se procesaron estadísticamente mediante análisis de varianza bajo un arreglo bifactorial. Los datos de porcentaje de colonización micorrízica (% col) fueron transformados por la función arcsenvx. Para la discriminación de medias se utilizó la prueba de rangos múltiples de Duncan (p=0.05) en los casos en que hubo significación.
RESULTADOS Y DISCUSIÓN
Los análisis factoriales realizados a las diferentes variables de crecimiento, nutrición y colonización micorrízica no mostraron interacción entre los factores en estudio, pero sí significación para el factor Cepa. Los valores más altos de las variables altura de las plantas y diámetro del tallo, en los dos momentos evaluados, correspondieron a los tratamientos donde se empleó el Consorcio selva (Tabla III); la masa seca y el contenido de fósforo en follaje (Figura 1) tuvieron similar respuesta, la colonización micorrízica y densidad visual alcanzaron valores de un 40.3 y un 3.36 % respectivamente.
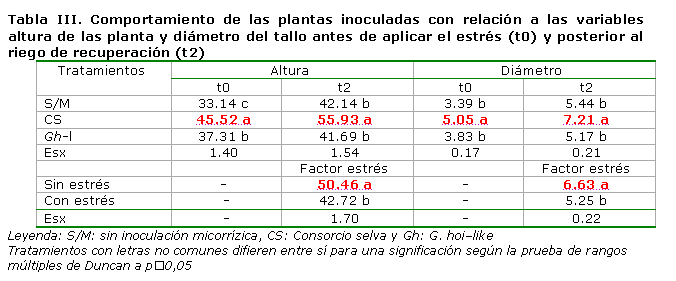

Se pudo apreciar que la condición de estrés no fue la que determinó la conducta de estas variables, sino la presencia de diferentes cepas de HMA, en este caso proporcionadas por el Consorcio selva. Esto puede estar relacionado con que el consorcio es un conglomerado formado por diferentes cepas aisladas de la región en que se realizó el ensayo; por tanto, están adaptadas a las condiciones de fertilidad del sustrato empleado. Los mejores resultados pertenecieron a los tratamientos que estuvieron bien abastecidos de agua.
Estudios realizados en plantas de sorgo han demostrado su capacidad de realizar ajuste osmótico cuando es sometido a condiciones de déficit hídrico, debido a las características propias del cultivo. Se plantea que la enzima fosfoenol-piruvato-carboxilasa (12) es la responsable de que esta planta tenga habilidad para mantener la eficiencia fotosintética en condiciones de estrés hídrico.
Se señala también que cuando el tejido experimenta estrés hídrico, debe ocurrir un cierre estomático para restringir las pérdidas de agua o se debe ajustar el tamaño celular o el potencial osmótico, que permite que el potencial hídrico de la célula baje para mantener la fluidez del agua líquida (13); sin embargo, no es posible asegurar que en este caso en particular haya ocurrido un ajuste osmótico, pues los indicadores evaluados no proporcionan esa respuesta.
En el caso de las plantas micorrizadas con la cepa Glomus hoi-like, no se apreciaron diferencias significativas en relación con los tratamientos sin micorrizar, ni se observó una respuesta superior a la obtenida en los tratamientos en que se empleó el Consorcio selva. Los valores altos en los tratamientos en que se utilizó el Consorcio selva podrían estar relacionados con que haya ocurrido un efecto sinérgico entre las especies que componen este conglomerado, potenciándose unas a otras. Formando parte del conglomerado se encuentra la especie Acauslospora scrobiculata, la cual ha demostrado ser eficiente en suelos de muy baja fertilidad (14).
Sieverding clasificó las especies de eficiencia alta y baja (1), no quedando claro cómo influía el tipo de suelo sobre la eficiencia de una especie en cuestión. Al analizar la fertilidad del sustrato empleado, según el manual de interpretación de suelos (15), se pudo apreciar que esta se correspondió con la de un sustrato de baja fertilidad (Tabla I), los contenidos de materia orgánica (fósforo, calcio y magnesio) fueron muy bajos, el pH correspondió con el de un sustrato alcalino y la capacidad de intercambio catiónico fue también baja.
Ferrer y Herrera señalaron que el pH es un factor que puede afectar el desarrollo de la simbiosis micorrízica y las diferentes especies tienen distintas preferencias por el pH (16). Por su parte, Potty informó que el pH óptimo para el desarrollo de los HMA (17) se encuentra entre 5 y 6, aunque los integrantes de Acaulospora y Gigaspora prefieren pH bajos, cercanos a 3 o 4.
Se ha demostrado que existen diferencias funcionales ecológicamente significativas entre los HMA (18), según la zona del suelo de donde absorben el fósforo. Por otra parte, Trouvelot (10) demostró que un incremento de la diversidad de HMA aumentó la absorción de fósforo y la biomasa de una comunidad de plantas, como consecuencia de un mayor desarrollo del micelio asociado a la diversidad de los HMA.
También se ha observado un incremento (18) en el contenido de fósforo y crecimiento de la alfalfa (Medicago truncatula) colonizada individualmente por Scutellospora calospora o Glomus caledonium; sin embargo, el efecto mejoró cuando fue colonizada por la mezcla de ambos hongos. Scutellospora calospora resultó ser más eficiente al adquirir fósforo en zonas cercanas a la raíz y Glomus caledonium lo es para adquirirlo lejos de esta.
Este tipo de complemento funcional puede ser en parte responsable del incremento en la efectividad para absorber fósforo del suelo, cuando se incrementa el número de especies de HMA.
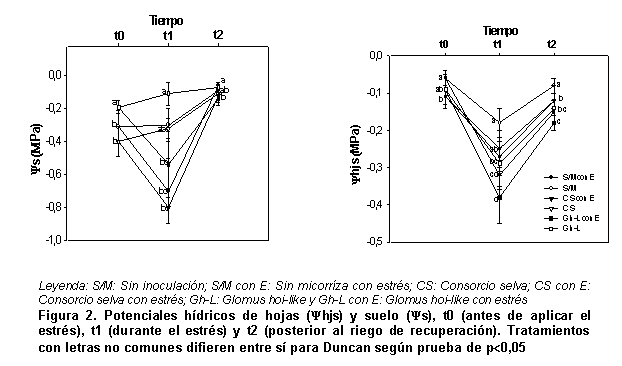
En la Figura 2 se muestran los resultados de la variable ys en los diferentes momentos evaluados y se aprecia, en los tratamientos sin estrés para el momento t0, que los valores menos negativos de ys correspondieron al tratamiento donde se empleó la cepa Glomus hoi-like; sin embargo, en los momentos t1 y t2 no hubo diferencias significativas entre los tratamientos micorrizados y el tratamiento control sin estresar. Las plantas que pertenecen al tratamiento donde se empleó la cepa Glomus hoi-like presentaron menor crecimiento y desarrollo, cuando se comparan con las plantas pertenecientes al resto de los tratamientos estudiados, por lo que las cantidades de agua que estas plantas necesitan son menores y la extracción que hacen del suelo es inferior al resto.
Por otra parte, cuando se analizaron los tratamientos estresados, en el momento t1 no se encontraron diferencias significativas entre ellos y para el momento t2 los valores más altos de ys correspondieron al tratamiento control. Los micorrizados fueron los que más agua extrajeron cuando se aplicó el riego de recuperación; al parecer este comportamiento estuvo relacionado con la presencia de HMA y una mayor extracción de agua través de sus hifas.
Los valores de yhjs (Figura 2) expresaron, para los tratamientos sin estrés, que en el momento t0 los valores menos negativos de esta variable correspondieron al tratamiento control, aunque no hubo diferencia significativa con el micorrizado con la cepa Glomus hoi-like.
Analizando el momento t1, los valores menos negativos de yhjs correspondieron también con el tratamiento control; los tratamientos en que se empleó el Consorcio selva no difirieron de este, los valores más negativos para este momento se apreciaron en el que se empleó la cepa Glomus hoi-like y para el momento t2 los valores menos negativos correspondieron al tratamiento control, seguido por aquellos en los que se empleó el Consorcio selva. Como en el momento t1, los valores más negativos se alcanzaron en el tratamiento en que se empleó la cepa Glomus hoi-like.
En el caso de los tratamientos que estuvieron sometidos a estrés, en el momento t1 se pudieron apreciar los valores más altos en el que se empleó el Consorcio selva, seguido por el tratamiento control y los valores más bajos se observaron en el tratamiento donde se empleó la cepa Glomus hoi-like. Para el momento t2, el tratamiento donde se utilizó el Consorcio selva fue el de mejor comportamiento y la respuesta fue similar a la obtenida en el momento t1.
Observando la variable conductancia estomática (g), según Figura 3, se pudo apreciar que los mejores resultados correspondieron con el tratamiento en que se empleó el Consorcio selva sin estrés, para el momento t1, y que no se hallaron diferencias significativas entre el tratamiento control y en el que se empleó la cepa Glomus hoi-like sin estrés; sin embargo, en el momento t2, los valores más bajos de la variable conductancia estomática se observaron en el tratamiento control.
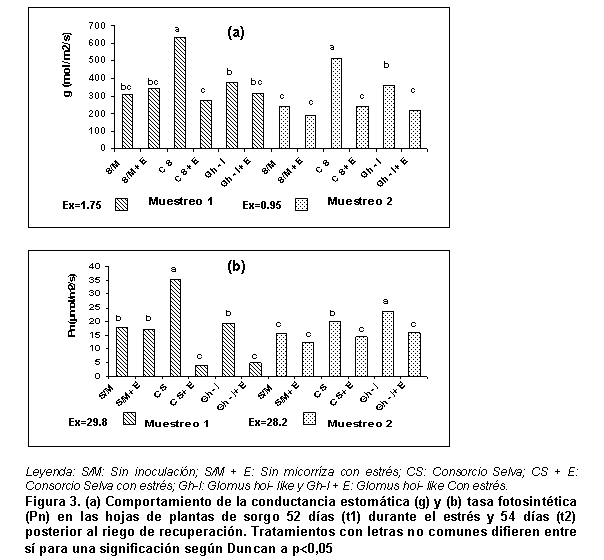
Para el caso de los tratamientos sometidos a estrés hídrico, los micorrizados mostraron valores de esta variable muy inferiores a los obtenidos cuando las plantas estaban bien abastecidas de agua. En los dos momentos (t1 y t2) no se hallaron diferencias significativas entre los tratamientos estresados.
Se apreció que la colonización con HMA, donde se empleó el conglomerado de especies Consorcio selva, incrementó la tasa fotosintética en las plantas de sorgo (Figura 3), cuando no estuvieron sometidas a estrés hídrico en el momento t1 (durante el estrés).
Aunque la cepa Glomus hoi-like no fue la de mejor comportamiento, en lo que se refiere a la biomasa vegetal, sí se observaron valores superiores de tasa fotosintética en las plantas sin estresar en el momento t2.
En general, la condición de estrés hídrico afectó la tasa fotosintética de las plantas, no observándose diferencias significativas entre los tratamientos estresados.
Las plantas micorrizadas manifiestan un aumento de la conductancia estomática en las hojas, lo que trae consigo una mayor cantidad de solutos en la planta, que son utilizados en la producción de biomasa vegetal. La fotosíntesis, al igual que otros procesos fisiológicos, está determinada por diferentes factores y su incremento puede estar condicionado por una mayor concentración de CO2 en el interior de las células; a ello contribuiría la apertura y el cierre de los estomas, que permiten el intercambio de gases con el medio que rodea a las plantas (19).
Quedó demostrada la eficiencia del aislado de cepas de HMA para las condiciones de fertilidad del sustrato en que se realizó este estudio y la dependencia de las plantas del suministro de agua. Las micorrizas son capaces de incrementar el área de absorción de los nutrientes y el agua del suelo a través de estructuras llamadas hifas (20) y al incremento en la densidad y el largo de la raíz (21).
Los hongos micorrízicos estimulan el crecimiento de las plantas y la absorción de los nutrientes (8, 22) en condiciones de estrés hídrico; la colonización micorrízica mejora las relaciones hídricas en las plantas hospederas (22).
Los posibles mecanismos involucrados incluyen el mejoramiento de la conductancia estomática (23), la reducción de la elasticidad foliar y el incremento de la turgencia de las hojas (24), de la longitud de la raíz y su efectividad (25), el incremento en la acumulación de osmorreguladores (26) y la inducción de una mayor asimilación de nutrientes (22).
Pequeños cambios en el estado de pérdida de agua en las hojas pueden tener efectos relativamente grandes en procesos fisiológicos como la fotosíntesis y el transporte del agua (19, 27). Por ello, las hojas parecen estar diseñadas para mantener un cierto grado de homeostasis hidráulico, ambos a través de las especies y los ambientes (27, 28, 29).
Algunos autores han observado un mejor comportamiento cuando se utilizan cepas eficientes que cuando emplean conglomerados (30). Por otra parte, otros (31) evaluaron el efecto de un conglomerado de cepas de HMA y lo compararon con el efecto producido por la cepa Glomus fasciculatum en plantas de chile bajo déficit hídrico y observaron que las plantas inoculadas con el conglomerado de cepas aumentaron la resistencia a la sequía, su potencial hídrico foliar, disminuyendo el menor número de plantas con signos visibles de deshidratación durante el máximo estrés.
Resultados similares fueron obtenidos en el crecimiento de plantas de mandarina en condiciones hídricas adecuadas (12). En general, el déficit hídrico afectó el crecimiento y desarrollo de las plantas; sin embargo, su respuesta no dependió de este. Se pudieron apreciar los valores más altos de las variables estudiadas en los tratamientos micorrizados con el Consorcio selva que no fueron sometidos a estrés.
De manera general, el Consorcio selva fue el inóculo que mejor se comportó en las variables de crecimiento y en la absorción de fósforo, respuesta que estuvo favorecida por el sustrato empleado; no obstante, al inducir el estrés se observó una mayor influencia de este en el comportamiento del Consorcio selva que en la cepa Glomus hoi–like, ya que al parecer esta última fue capaz de tolerar mejor la condición de estrés impuesta.
Tanto el empleo de cepas eficientes de HMA como de conglomerados de cepas que sean capaces de potenciarse unas a otras, es una opción para obtener mejores rendimientos en los cultivos, siempre y cuando se tenga en cuenta que las características de los suelos o sustratos empleados influye de manera considerable en la respuesta de estos a la micorrización, un aspecto muy importante a considerar y factor determinante para el logro de una exitosa simbiosis.
REFERENCIAS
1. Sieverding, E. Vesicular Arbuscular Mycorhiza in Tropical Agrosystem. Deutsche Gesellsschaft fur techniische Zusammenarbeit (GTZ) GMBH, Federal Republic of Germany. 1991, p. 371.
2. Verissimo, L. A. Enciclopedia práctica de la agricultura y la ganadería. Cultivos herbáceos. Cereales. Sorgo. 2003, p. 324-329.
3. Augé, R. M. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis. Mycorhiza, 2001, vol. 11, p. 3–42.
4. Azcón-Bieto, J. y Talón, M. Fundamentos de Fisiología Vegetal. 2da reimpresión España: Ed. Univ. Barcelona. 2001, p. 515.
5. Gerdemann, J. W. y Nicholson, T. H. Spore of mycorhizae endogone species extracted from soil by wet sieving and decanting. Trans Br. Mycol. Soc., 1963, vol. 46, p. 235-244.
6. Herrera, R. A.; Ferrer, R. C.; Furrazola, E. y Orozco, M. O. Estrategias de funcionamiento de las micorrizas VA en un bosque tropical. Diversidad en Iberoamérica: Ecosistemas, Evolución y Procesos sociales (M. Monasterio (Ed.). Programa de Ciencia y Tecnología para el desarrollo.
Subprograma XII, Diversidad Biológica, Mérida. 1995.
7. Hewitt, E. J. Sand and water culture methods used in the study of plant nutrition. En: Technical communications. Commonwealth Agricultural Boreaux, 2nd. Ed. Farnham Royal, U.K. 1966, no. 22, p. 547.
8. Jeffries, P.; Gianinazzi, S.; Perotto, S.; Turnau, K. y Barea, J. M. The contribution of arbuscular mycorhizal fungi in sustainable maintenance of plant health and soil fertility. Biol. Fertil. Soils, 2003, vol. 37, p. 1-16.
9. Giovanetti, M. y Mosse, B. An evaluation of techniques to measure vesicular-arbuscular infection in roots. New Phytologist, 1980, vol. 84, p. 489-500.
10. Trouvelot, A.; Kough, J. y Gianinazzi-Pearson, V. Mesure du Taux de Mycorhization VA d'un Systeme Radiculaire. Recherche de Methodes d' Estimation ayantune Signification Fonctionnelle. Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae. Eds.: V. Gianinazzi-Pearson y S. Gianinazzi. INRA, 1986, p. 217–222.
11. Jackson, M. L. Análisis químico de suelo. Ed. Omega, S.A. Barcelona, España; ISBN 84-282-0261-6. 1976, p. 662.
12. Qiang Sheng, W.; Ying Ning, Z. y Ren Xue, X. Effects of water stress and arbuscular mycorrhizal fungi on reactive oxygen metabolism and antioxidant production by citrus (Citrus tangerine) roots. European Journal of Soil Biology, 2006, vol. 42, p. 166–172.
13. Phillips, J. M. y Hayman, D. E. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorhizal fungi for rapid assessment of infection. Trans. Br Mycol. Soc., 1970, vol. 55, p. 158-161.
14. Rivera, R. y Fernández, K. El manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible: Estudio de caso El caribe, (Eds). La Habana: INCA. 2003.
15. Cuba. Dirección Nacional de Suelos y Fertilizantes. Manual de Interpretación de los Suelos. Editorial Científico-Técnica. 1984, p. 136.
16. Ferrer, R. y Herrera, R. Breve reseña sobre biofertilizantes. Ciudad de La Habana: IES–CITMA, 1991, p. 50.
17. Potty, V. P. Plan microbe interrelationship in tuber crops. Indian Farming, 1984, vol. 33, no. 12, p. 41–42.
18. Smith, F. A.; Jakobsen, I. y Smith, S. E. Spatial differences in acquisition of soil phosphate between two arbuscular mycorrhizal fungi in symbiosis with Medicago truncatula. New Phytologist, 2000, vol. 147, p. 357-366.
19. Taiz, L. y Zeiger, E. Plant physiology, 4th ed. Sinauer, Sunderland, MA. Vesicular-arbuscular mycorrhizas. Agriculture Ecosystems and Environment, 2006, vol. 35, p. 121-150.
20. Faber, B. A; Zasoske, R. J.; Munns, D. N. y Shackel, K. A method for measuring hyphal nutrition and water uptake in mycorrhizal plants. Can. J. Bot., 1991, vol. 69, p. 87–94.
21. Bryla, D. R. y Duniway, J. M. Effects of mycorhizal infection on drought tolerance and recovery in safflower and wheat. Plant Soil, 1997, vol. 97, p. 95–103.
22. Al-Karaki, G. N. Benefit, cost and water-use efficiency of arbuscular mycorrhizal durum wheat grown under drought stress. Mycorhiza, 1998, vol. 8, p. 5–41.
23. Hardie, K. y Leyton, L. The influence of vesicular-arbuscular mycorhizae on growth and water relations of red clover. I. In phosphate-deficient soil. New Phytologist, 1981, vol. 89, p. 599-608.
24. Augé, R. M., Schekel, K. A. y Waple, R. L. Leaf water and carbohydrate status of VA mycorrhizal rose exposed to drought stress. Plant and Soil, 1987, vol. 99, p. 292-302.
25. Davies, F. T.; Potter, J. R. y Linderman, P. G. Mycorhiza and repeated drought exposure affect drought resistance and extraradical hyphae development of pepper plants independent of plant size and nutrient content. Journal of Plant Physiology, 1992, vol. 139, p. 289–294.
26. Schellembaum, L.; Muller, J.; Boller, T.; Wienken, A. y Schuepp, H. Effects of drought on non-mycorhizal and mycorhizal maize: changes in the pools of non-structural carbohydrates, in the activities of invertase and trehalase, and in the pools of amino acids and imino acids. New Phytologist, 1998, vol. 138, p. 59–66.
27. Franks, P. Higher rates of leaf gas exchange are associated with higher leaf hydrodynamic pressure gradients. Plant Cell Environ., 2006, vol. 29, p. 584–592.
28. Cowan, I. R.; Farquhar, G. D. Stomatal function in relation to leaf metabolism and environment. En: Jennings D. H. (Ed) Integration of activity in the higher plant. Cambridge University Press, Cambridge, UK. 1997, p. 471–505.
29. Farquhar, G. D.; Buckley, T. N. y Miller, J. M. Optimal stomatal control in relation to leaf area and nitrogen content. Silva Fenn., 2002, vol. 36, p. 625–637.
30. Fernández, F. Manejo de las asociaciones micorrízicas arbusculares sobre la producción de postura de cafeto (C. arabica L. var. Catuaí) en algunos tipos de suelos. Tesis de grado de Dr. en Ciencias Agrícolas, INCA. 1999, p. 102.
31. Davies, F. T.; Olalde-Portugal, V.; Aguilera–Gómez, L.; Alvarado, M. J.; Ferrera-Cerrato, R. C. y Boutton, T. W. Alleviaton of drougth stress of chile ancho pepper (capsicum annuum L. cv San Luis) with arbuscular mycorrhiza indigenous to Mexico. Scientia Horticulturae, 2002, vol. 92, p. 347-359.
Recibido 5/01/2010, aceptado 16/12/2010.