Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.33 no.2 La Habana abr.-jun. 2012
RESEÑA BIBLIOGRÁFICA
Los sistemas de cultivo in vitro aplicados al estudio de los hongos micorrízicos arbusculares (HMA)
In Vitro culture systems applied to AMF studies
Dra.C. Kalyanne Fernández Suárez
Investigador Agregado del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas, gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
RESUMEN
Los avances en el estudio de los Hongos Micorrízicos Arbusculares (HMA) y de los procesos involucrados en su interacción con las plantas dependen en gran medida de los sistemas de cultivo in vitro que incluyen a ambos organismos, debido fundamentalmente a su condición de simbiontes obligados y a su carácter hipógeo. Estos sistemas han evolucionado con el decursar de los años y en la actualidad han contribuido a dar respuesta a un sinnúmero de interrogantes relacionadas con la fisiología y la bioquímica de la asociación. Algunos aspectos sobre la importancia de los sistemas de cultivo in vitro aplicados al estudio de los HMA, los tipos de sistemas existentes, sus alcances y limitaciones, así como algunos factores que influyen en el establecimiento micorrízico in vitro son considerados en esta reseña.
Palabras clave: cultivo in vitro, hongo.
ABSTRACT
The advances in the study of Arbuscular Mycorrhizal Fungi (AMF) and the process involved in their interactions with plants depend in great extent of in vitro culture systems which include both organisms, due mainly to their biotrophic condition and hypogeous nature. Those systems have evolved trough the years and at the present time a lot of questions related with the physiology and biochemistry of association had been resolved. Some aspects about the importance of in vitro culture systems applied to AMF studies, the type of current systems and their advantages and limitations, besides some factors which influence the in vitro mycorrhizal establishment are considered in this review.
Key words: in vitro culture, fungi.
ALGUNAS GENERALIDADES SOBRE LOS HMA
Las micorrizas son asociaciones mutualistas altamente evolucionadas que se establecen entre determinados hongos del suelo y las raíces de las plantas. Los individuos involucrados son hongos pertenecientes a los Phyla Glomeromycota, Ascomycota y Basiodiomycota y la mayoría de las plantas vasculares (1). Entre hongos y plantas se establece una simbiosis mutualista,altamente interdependiente, en la cual la planta hospedera recibe nutrientes minerales y agua, mientras que el hongo obtiene compuestos carbonados derivados de la fotosíntesis (2).
Existen al menos siete tipos de asociaciones micorrízicas reconocidas que incluyen diferentes grupos de hongos y plantas hospederas con variados patrones morfológicos (3).
Todas estas asociaciones varían ampliamente en estructura y función pero la asociación más común es la micorrízica arbuscular, la cual involucra a más del 80 % de las plantas terrestres incluyendo angiospermas, gymnospermas, pteridofitas, y musgos (4). Solo un pequeño número de plantas pertenecientes a las familias Brassicaceae, Caryophyllaceae, Chenopodiaceae o Urticaceae no son micorrízicas (1, 5).
La clasificación taxonómica de los HMA ha sufrido numerosas modificaciones desde su primera descripción en 1842 (6), según Koide y Mosse (7). La clasificación más reciente publicada (8), se muestra en la tabla sobre el tema.
Los HMA son parte integral de numerosos ecosistemas y se consideran particularmente ventajosos para las plantas que crecen en zonas tropicales, en las que los nutrientes se reciclan muy rápidamente y están presentes en bajas concentraciones (9).
Esta simbiosis confiere beneficios directos a las plantas hospederas, vinculados principalmente con la nutrición mineral, las relaciones con el agua y la resistencia a estrés biótico y abiótico; y a cambio provee al hongo de carbohidratos (9).
Se ha estimado mundialmente que cerca de cinco billones de toneladas de carbono (C) son transferidas cada año desde las plantas a los HMA a través de la simbiosis (10) y que la biomasa total de Glomeromycota es de 1,4 Pg (11), comparada con la estimación global de la biomasa microbiana que es de 13,9 Pg (12).
Su carácter de simbiontes obligados
El origen de la simbiosis micorrízica arbuscular se remonta al periodo Ordovícico (13), hace más de 450 millones de años. La existencia de estructuras fósiles sugiere, no solo que la simbiosis micorrízica arbuscular ha evolucionado conjuntamente con las plantas terrestres, sino que esta existía mucho antes de que las estructuras radicales hubiesen evolucionado completamente y que los hongos Glomales se hallaban en la tierra antes de que surgieran las primeras plantas con semillas (Gimnospermas) (13, 14), por lo que algunos afirman que fueron un instrumento que las plantas utilizaron para colonizar la tierra (15). Esta simbiosis es también considerada la más antigua, en comparación con otras asociaciones planta-hongo, exceptuando los líquenes. El hecho de que las plantas hayan coevolucionado con los hongos micorrízicos arbusculares explica fácilmente la amplia distribución de esta simbiosis, no solo dentro del Reino Plantae, sino en los ecosistemas de manera global (16).
Por otra parte, la existencia en la actualidad de familias de plantas que no se micorrizan (17), o incluso que la condición micorrízica se haya perdido a lo largo de la evolución con la sola mutación de un gen, demuestra que la ocurrencia de la micorrización en las plantas es la regla y no la excepción (1). Esto sugiere que la simbiosis micorrízica arbuscular (u otras menos antiguas como las micorrizas ericoides y ectomicorrizas) es de vital importancia para la supervivencia de las plantas en los ecosistemas naturales (15, 18).
Debido a su carácter de simbiontes obligados, los HMA no pueden completar su ciclo de vida en ausencia de una raíz hospedera, aunque los compuestos indispensables que requieren de las raíces aun no han sido totalmente identificados (19).
Uno de los principales factores que explica su condición de biotrófos obligados es el metabolismo o la absorción de carbono en el estadio presimbiótico (20), debido al hecho de que las hifas extrarradicales de estos hongos son incapaces de absorber carbohidratos (21).
IMPORTANCIA DE LOS SISTEMAS DE CULTIVO In Vitro EN EL ESTUDIO DE LOS HMA
Sistemas de cultivo in vitro de raíces. Los estudios fisiológicos relacionados con la simbiosis micorrízica arbuscular se dificultan considerablemente debido a la condición de simbiontes obligados que caracteriza a los hongos que intervienen en la asociación, lo cual hace imposible su crecimiento en condiciones axénicas.
Por otra parte, todos estos eventos ocurren en un ambiente hipógeo, altamente complejo, que complica aun más las investigaciones, teniendo en cuenta que cualquier estudio bioquímico o molecular de la biología de un organismo dado requiere de material puro, fácilmente obtenible y en cantidades suficientemente grandes que permitan extraer las moléculas de interés.
No obstante, el empleo del cultivo de raíces (Figura 1) como un sistema simplificado para establecer la simbiosis micorrízica arbuscular, ha sido muy utilizado y particularmente útil en numerosos estudios fisiológicos que incluyen dos aspectos fundamentales: el intercambio de señales entre los simbiontes y el metabolismo fúngico (22).
El cultivo de raíces fue desarrollado por primera vez por White (23) y perfeccionado en años posteriores por Butcher y Street (24) y Butcher (25). Posteriormente, numerosos investigadores se sumaron al reto de establecer la simbiosis micorrízica sobre medios de cultivo axénicos.
La primera esporulación in vitro fue obtenida en el año 1988 por Bécard y Fortin (26) utilizando raíces transformadas de zanahoria (Daucus carota L.) colonizadas con Glomus intraradices Schenck & Smith. Posteriormente, Bécard y Piché (27) realizaron algunas modificaciones en el medio de cultivo existente, reduciendo las concentraciones de algunos elementos para evitar la inhibición del establecimiento micorrizico sin afectar el crecimiento y desarrollo radical. Esto permitió contar con un sistema de cultivo monoxénico altamente reproducible caracterizado por la producción de grandes cantidades de micelio y esporas (28).
El uso de este sistema permitió realizar un control riguroso de determinados parámetros como: la raíz hospedera, el inóculo fúngico y las condiciones ambientales físicas, químicas y microbiológicas. Además, bajo estas condiciones se pueden llevar a cabo observaciones no destructivas a nivel morfológico y celular de gran ayuda para fisiólogos, taxónomos y genetistas. Es igualmente una poderosa herramienta para estudios de interacción con patógenos y otros organismos. Este sistema de cultivo permite también la producción de inóculo fúngico puro en diferentes estadios simbióticos y en suficientes cantidades para realizar estudios citológicos y bioquímicos (22, 29).
El incremento creciente del número de especies de HMA cultivadas in vitro y la posibilidad del cultivo continuado y la cryopreservación permitió crear una colección internacional de HMA in vitro conocida como GINCO (Colección in vitro de Glomeromycota), en la cual se conservan numerosas especies pertenecientes a varias familias de estos hongos y se reproducen nuevas especies con el objetivo de incrementar la colección. Además, GINCO proporciona inóculo libre de contaminantes y de alta calidad para las investigaciones científicas.
No obstante, la naturaleza artificial de este sistema, existen numerosas razones para continuar utilizándolo en el estudio de los HMA. Está demostrado que las especies fúngicas cultivadas forman las estructuras típicas involucradas en la colonización (apresorios, arbúsculos y vesículas) y producen un profuso micelio extrarradical, así como abundante número de esporas. La producción de esporas es morfológica y estructuralmente similar a las producidas en potes de cultivo y las estructuras intrarradicales son capaces de iniciar nuevas asociaciones micorrízicas después de un periodo de subcultivo, indicando que la especie fúngica es capaz de completar su ciclo de vida en esas condiciones (22).
Sin embargo, que determinadas especies o aislados puedan sobrevivir en el ambiente que brinda este sistema de cultivo no quiere decir que todas puedan. Existen especies llamadas recalcitrantes que se resisten a colonizar las raíces e incluso, en muchos casos, a germinar en estas condiciones. El perfeccionamiento metodológico contínuo del sistema de cultivo (ej. composición del medio de cultivo y las condiciones de crecimiento) hará que muchas de estas especies puedan ser cultivadas exitosamente.
Sistema compartimentado. El sistema de cultivo in vitro de raíces fue perfeccionado en un intento por incrementar la semejanza de este sistema con los sistemas naturales, brindándole al micelio extrarradical condiciones nutricionales cercanas a las encontradas en los ambientes edáficos. Con este propósito es que St-Arnaud y colaboradores (30) crearon un sistema de cultivo en placas Petri compartimentadas (Figura 2), en las que colocaron el cultivo de raíces en el compartimento proximal y un medio de cultivo apropiado en un compartimento distal donde solo podía crecer el micelio extrarradical.
La primera observación interesante utilizando esta técnica fue una estimulación notable del crecimiento del micelio fúngico y un valor diez veces superior del número de esporas en el compartimento distal comparado con el proximal.
Según Fortin y col. (22), el envejecimiento de la raíz en el compartimento proximal puede liberar determinadas sustancias químicas que limitan el crecimiento del hongo y la producción de esporas; aunque también es posible que estas diferencias sean el resultado de cambios en el pH o alteraciones en la disponibilidad de nutrientes.
Este sistema es muy útil para los estudios de absorción y translocación de nutrientes en raíces micorrizadas bajo condiciones controladas. Ha sido utilizado para demostrar, utilizando radioisótopos de P, cierta capacidad mineralizadora de los HMA al absorber y translocar a las raíces colonizadas formas orgánicas (32P-AMP) e inorgánicas de P (33PO4) (31). Igualmente, ha sido empleado en los estudios de transporte de C (32), N (33), U (34) y Cs (35).
También permite realizar estudios diferenciados del metabolismo fúngico al permitir separar la fase intrarradical de la extrarradical (10), lo cual es particularmente ventajoso para comparar la expresión genética entre ambas fases del micelio.
Limitaciones de los sistemas de cultivo in vitro de raíces. Si bien los sistemas de cultivo in vitro de raíces han permitido obtener valiosas informaciones sobre numerosos aspectos relacionados con la simbiosis micorrízica, es obvio que cuentan aun con no pocas limitaciones, pues son sistemas artificiales que tratan de imitar las condiciones encontradas por las raíces micorrízicas en la naturaleza. Una de las más importantes es que la planta hospedera es reemplazada por un solo órgano, la raíz. Como resultado, el beneficio simbiótico que puede obtener el hongo de la planta se ve seriamente afectado por la ausencia de tejido fotosintético, un adecuado balance hormonal y las relaciones fisiológicas normales de fuente-sumidero.
En estos sistemas las raíces se alimentan de manera artificial a través del medio de cultivo. La sacarosa es adicionada para compensar la ausencia de fotosintatos y por tanto, la interfase o matriz de intercambio se ve “sumergida”en una solución de azúcar, lo cual no ocurre en condiciones in vivo (22). En este caso, los carbohidratos llegan a la corteza y al sistema vascular a través de la epidermis, por lo que es posible que la presencia de azúcar en la interfase modifique la bioquímica de la interacción entre la planta y el hongo.
Como resultado de estas limitaciones, numerosas cuestiones quedan aun por estudiar y algunos resultados son recibidos con escepticismo. Por tanto, la necesidad de desarrollar sistemas que incluyeran la planta completa se convirtió en un reto y diversos sistemas fueron diseñados con mayor o menor éxito. Sin embargo, la gran mayoría era casi imposible de reproducir y no propiciaban un adecuado desarrollo de la colonización micorrízica, así como tampoco permitían realizar observaciones no destructivas (36), u obtener plantas micorrizadas en cortos periodos de tiempo.
Sistemas de cultivo in vitro que incluyen la planta. En el año 1995, Elmeskaoui y colaboradores (37) publicaron un novedoso sistema (Figura 3A) que permitía micorrizar in vitro plantas de fresa (Fragaria sp.) y demostrar la capacidad de los HMA de reducir el estrés hídrico en plantas micorrizadas. Este era un sistema tripartita que incluía, además de las plantas, raíces cortadas provenientes de cultivo de raíces transformadas de zanahoria previamente micorrizadas, lo cual lo hacía en extremo complicado y difícil de reproducir.
Después de transcurridos diez años, se publica un sistema de micorrización autotrófico (Figura 3B), «parcialmente» in vitro, de plantas de Solanum tuberosum L. utilizando solo placas Petr (38) En dicho sistema las raíces se desarrollan dentro de la placa, en un ambiente totalmente in vitro, y el sistema aéreo se desarrolla expuesto al ambiente.
Estos autores obtuvieron una intensa colonización micorrízica y la producción de miles de esporas después de 22 semanas de cultivo. Las esporas fueron capaces de colonizar nuevas plantas bajo las mismas condiciones. Sin embargo, al concluir el experimento, las plantas mostraban numerosas afectaciones en su desarrollo y estado fisiológico, debido al prolongado tiempo de cultivo y la escasez de nutrientes.
Un año más tarde, Dupré de Boulois y col. (36) propusieron un sistema de cultivo completamente in vitro (Figura 3C) utilizando placas bi-compartimentadas que permitió realizar estudios de transporte de elementos entre plantas de Medicago truncatula y Glomus lamellosum (MUCL 43195), pero este no fue fácilmente adaptable a todas las especies de plantas estudiadas (ej. Solanum tuberosum L., datos no publicados).
Dos años después, Cano y col. (39) publicaron un sistema medianamentecomplejo (Figura 3D) que estuvo encaminado a la producción de grandes cantidades de tejido micorrízico de una planta micorrizada in vitro y bien colonizada, factible para realizar estudios de marcaje, fácil de muestrear y que permitiera realizar cosechas subsecuentes. Este sistema solo permitía alcanzar un 20 % de colonización después de cuatro semanas de cultivo.
Todos estos sistemas (Figura 3) demostraron, por una parte, el potencial del sistema de cultivo in vitro para realizar cultivos continuados de HMA y su utilidad como herramienta para la investigación de numerosos aspectos relacionados con la simbiosis micorrízica, en las cuales se hace necesaria la presencia de tejido fotosintético activo y la relación fuente-sumidero. Por otra parte, quedó clara la necesidad de búsqueda de nuevos sistemas en los cuales se pudieran, no solo obtener igual número de esporas y de estructuras fúngicas intra y extrarradicales, sino también plantas sanas y vigorosas, con altos niveles de colonización en el menor periodo de tiempo posible, factibles de ser transplantadas y capaces de reproducir la colonia fúngica en nuevos medios o ambientes de cultivo.
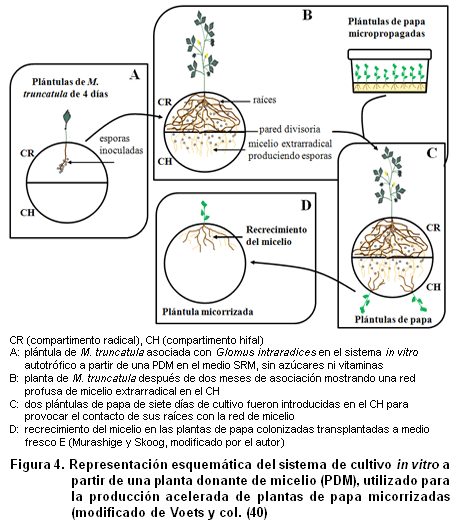
Sistema de cultivo in vitro a partir de una planta donante de micelio (PDM). Este sistema (Figura 4) fue desarrollado por Voets y col. (40) con el propósito de obtener plántulas eficientemente micorrizadas en cortos periodos de tiempo, capaces de reproducir la colonia fúngica al ser transferidas a un nuevo medio, partiendo de demostrar la capacidad del micelio extrarradical de HMA proveniente de una planta donante de colonizar plántulas rápidamente.
Los resultados demostraron el gran potencial de este nuevo sistema, en el cual con solo nueve días para el caso de Solanum tuberosum L. (papa) y 12 para Medicago truncatula Gaertn. se alcanzaron niveles de colonización en las plantas lo suficientemente altos como para reproducir la colonia fúngica tan solo transcurridas 48 horas de su transferecia a medios frescos. En el caso específico de la papa, a los 12 días de contacto con las redes de micelio extrarradical (RME), se alcanzaron valores de los parámetros fúngicos evaluados comparables con los obtenidos después de 45 días en el sistema in vitro publicado cuatro años antes también por Voets y colaboradores (38).
Estos niveles de colonización nunca habían sido alcanzados en otro sistema in vitro estudiado anteriormente y en la actualidad ya se han colonizado numerosas especies de plantas de importancia económica como Zea mays (maíz), Musa sp. (banano), Plantago lanceolata, Trifolium repens (trébol) y Vitis verlandieri (uva), utilizando este sistema y a M. truncatula como planta donante1.
Por consiguiente, son inmensas las posibilidades que este sistema ofrece, no solo desde el punto de vista investigativo, sino también de aplicación práctica, en los cuales se hace necesario tanto la colonización acelerada y homogénea de las plantas como la producción masiva de inóculo icorrízico.
ALGUNOS FACTORES A TENER EN CUENTA PARA GARANTIZAR EL ESTABLECIMIENTO DE LA SIMBIOSIS MICORRÍZICA ARBUSCULAR In Vitro
Propágulos micorrízicos. Los hongos micorrízicos arbusculares poseen tres tipos de propágulos fundamentales en el suelo, que son: las esporas extrarradicales, los propágulos intrarradicales (fragmentos de raíces micorrizadas o vesículas aisladas) y el micelio extrarradical (41). Sin embargo, para inciar los cultivos monoxénicos se utilizan por lo general dos de ellos: las esporas y los fragmentos de raíces micorrizadas que muestran recrecimiento micelial, o una combinación de ambos (29, 42).
Las esporas producidas en el suelo por los HMA son capaces de germinar en ausencia de señales derivadas de un hospedero (43), pero son incapaces de extender su micelio y completar su ciclo de vida sin establecer una simbiosis funcional con la planta. Las esporas son los propágulos más efectivos en la familia Gigasporaceae, mientras que se ha demostrado que Glomeraceae y Acaulosporaceae pueden iniciar nuevas colonias a partir de los tres tipos de propágulos antes mencionados (44).
Por otra parte, para el cultivo de especies de hongos micorrízicos que no producen vesículas (ej. especies de Scutellospora y Gigaspora) se utilizan esporas, las cuales son usualmente más grandes y germinan vigorosamente. Los esporocarpos de G. mosseae también han sido utilizados en un intento por establecer el cultivo in vitro de esta especie (45).
Las esporas, por lo general, se colectan del suelo o de potes de cultivo a través de la técnica de tamizado húmedo y decantado y posterior gradiente de centrifugación para separarlas de la fracción de suelo. Antes de que estas esporas sean utilizadas como inóculo in vitro deben someterse a un proceso de desinfección parcial (22, 27). Este paso es crítico debido a que su éxito depende de que la mayor parte de los ontaminantes sean eliminados, o al menos aquellos que no juegan un papel importante en la germinación de las esporas. Es necesario destacar que numerosos microorganismos viven entre las paredes de las esporas e incluso en su interior (46), haciendo los procesos de desinfección aun más complicados y en algunos casos imposibles de lograr (47).
Los fragmentos de raíces micorrizadas se extraen principalmente de plantas trampa, provenientes de potes de cultivo. Allium porrum L. (ajo) es comunmente utilizada para estos fines debido a que sus raíces más jóvenes son translúcidas y las vesículas pueden apreciarse facilmente en su interior. Estos fragmentos también deben ser previamente desinfectados antes de su uso utilizando un procesamiento ultrasónico, según la metodología de Declerck y col. (48). Este método ha sido empleado para el cultivo de numerosas especies de HMA (48, 49, 50, 51).
Por otra parte, también las vesículas aisladas del interior de raíces micorrizadas pueden ser utilizadas para comenzar cultivos in vitro, aunque esta metodología no es muy utilizada. Las vesículas están menos contaminadas que la superficie de las raíces por lo que podrían representar una mejor fuente de inóculo. El método de extracción de vesículas (52) es algo complicado y engorroso, por lo que raramente se utiliza para inoculaciones de rutina. Las comparaciones realizadas por Nantais (53) entre esporas producidas in vitro y vesículas aisladas de raíces de ajo provenientes de potes de cultivo, indicaron que la colonización radical fue más eficiente utilizando esporas que las vesículas aisladas.
Dentro de estos propágulos, el micelio extrarradical es considerado la «mitad oculta» (54) de la simbiosis y al parecer es el componente más dinámico y funcionalmente diverso de la asociación (55).
El micelio extrarradical de los HMA consiste en un entremezclado de hifas cenocíticas multinucleadas y altamente ramificadas que se interconectan a través de fusiones de hifas o anastomosis (55), formando redes de micelio extrarradical (RME). En la naturaleza las RME pueden interconectar plantas diferentes, teniendo en cuenta la baja especificidad de los HMA (56, 57), representando una importante fuente de inóculo para la colonización de plantas vecinas debido a la gran cantidad de ápices hifales que se ramifican de la colonia (58, 59).
Las RME que se forman están directamente involucradas en la absorción de los nutrientes (60, 61), la agregación del suelo (62, 63), la composición de las plantas y el funcionamiento de los ecosistemas (56).
Medio de cultivo. El medio de cultivo constituye un eslabón clave para garantizar el establecimiento de la simbiosis micorrízica arbuscular in vitro, pues involucra a organismos con requerimientos nutricionales muy diferentes.
Las plantas obtenidas a través de las técnicas de cultivo de tejidos se producen sobre medios sólidos, semisólidos y líquidos, cuya composición varía dependiendo de la especie de planta que se esté cultivando y de los propósitos del productor; pero en general son ricos en nutrientes minerales, en especial los que de alguna manera pueden retardar la colonización micorrízica e incluso inhibirla.
En cambio, los cultivos duales de raíces y hongos micorrizógenos son establecidos en medios sólidos, particularmente en los medios White modificado (mínimo, M) y Strullu y Romand modificado (SRM) (64, 65), los cuales presentan una concentración de macroelemntos mucho más baja que las encontradas en el medio Murashige y Skoog (MS) (66), comúnmente utilizado para la micropropagación de plantas.
La selección del medio es muy importante pues algunos tipos de agar contienen inhibidores propios debido a la presencia de trazas de metales pesados. Además, determinadas concentraciones de sulfato de sodio, fósforo y sacarosa en el medio de cultivo son de relevante importancia para el establecimiento de los hongos micorrízicos (26, 37, 67), por lo que se encuentran disminuidos en los medios en los que estos se cultivan.
La composición del medio M es incluso más pobre que el medio SRM y fue desarrollado comparando el efecto de la concentración de diferentes elementos sobre la formación de micorrizas (26). Por su parte, el medio SRM fue desarrollado empíricamente (48) para optimizar la fase intrarradical del hongo in vitro. La composición de macroelementos es similar en ambos y las diferencias mayores se encuentran en la composición de ligoelementos y vitaminas.
En la actualidad más de 30 aislados de especies micorrízicas arbusculares pertenecientes a las familias Acaulosporaceae, Gigasporaceae y Glomaceae se cultivan satisfactoriamente en estos medios, utilizando cultivos de raíces como hospedero.
Intercambio de gases. El intercabio de gases en los sistemas utilizados para el establecimiento de la micorrización de plantas in vitro es de relevante importancia para garantizar el éxito de la asociación debido a los requerimientos de los organismos involucrados, sobre todo de los propágulos fúngicos, cuyo establecimiento depende en gran medida de las concentraciones existentes de CO2 y etileno, fundamentalmente (68).
Asociados con la heterotrofía o la fotomixotrofía de las plantas se reconocen numerosas desventajas de los sistemas comúnmente utilizados para establecer los cultivos de plantas in vitro. Dentro de estas se encuentra la adición de azúcares en los medios de cultivo como fuente de carbono, lo cual incrementa la proliferación de contaminantes biológicos; el tamaño pequeño de los envases y la hermeticidad de los mismos (68). Por otra parte, estos autores también refieren que el aire en el interior de estos envases se satura casi completamente con vapor de agua y que se alteran las concentraciones de CO2 y etileno.
Todas estas condiciones medioambientales producen desórdenes morfofisiológicos, retardo en el crecimiento y mutaciones y han contribuido a que la micropropagación fotoautotrófica aumente las potencialidades de aplicación sobre los métodos convencionales.
En cuanto al desarrollo fúngico se conoce que las raíces pueden estimular a los HMA a utilizar las reservas de sus esporas por dos acciones que pueden ser simultáneas: cambios en el medio o cambios en la composición de los gases en el ambiente de cultivo (67). Esto ocurre antes de establecerse la simbiosis, momento en que las esporas germinantes necesitan ciertos factores para promover el crecimiento de las hifas. En este estadio el hongo es tróficamente dependiente de las reservas de la espora y algunos exudados provenientes de la raíces regulan la habilidad del hongo para utilizar dichas reservas (69).
Dentro de estas sustancias se han identificado los compuestos fenólicos, con los cuales se han realizado numerosas investigaciones relacionadas con su comportamiento en presencia de CO2 (69). Estos estudios han demostrado el efecto estimulador sinérgico entre el CO2 y determinados flavonoides como la quercetina, similar al obtenido anteriormente por Bécard y Piché (67) entre el CO2 y exudados radicales. Estos autores también demostraron que el CO2 por sí solo, a 0.5 %, es capaz de reemplazar los compuestos volátiles liberados por las raíces en la activación del crecimiento fúngico a partir de las reservas de las esporas.
Papel del etileno en las plantas. El etileno se encuentra dentro de un gran grupo de hormonas vegetales o fitohormonas, sustancias naturales que en bajas concentraciones regulan numerosos aspectos del crecimiento de las plantas (70), de su desarrollo y de las respuestas a estrés como sequía, heridas mecánicas y ataques de insectos y patógenos (71). Según afirma Segura (72), existen, al menos, nueve grupos de hormonas diferentes: auxinas, citoquininas (CKs), giberelinas (GAs), etileno, ácido abscísico (ABA), brasinoesteroides, ácido jasmónico (AJ) y jasmonatos, ácido salicílico (AS) y salicilatos y poliaminas (Pas).
Según Lynch y Brown (73), el etileno está implicado en la respuesta de las plantas a numerosos estreses bióticos y abióticos; sin embargo, poco se conoce sobre su papel ante el estrés nutricional en términos de deficiencia nutricional o de toxicidad mineral. El etileno también puede ser generado durante la necrosis de tejido inducida por deficiencias severas y toxicidades. La toxicidad por metales puede inducir la producción de etileno por estrés oxidativo.
Existen también evidencias que sugieren un cierto papel del etileno en la regulación de la respuesta de las plantas ante la deficiencia de macronutrientes, aunque aun no son conclusivas. Al parecer, las deficiencias de N y P están relacionadas con la producción de etileno. El posible papel del etileno mediando la respuesta adaptativa de las plantas ante el estrés por P se asume a partir de que este tipo de estrés induce una variedad de cambios morfológicos en el sistema radical en los que también está involucrado el etileno como: el gravitropismo, la formación de aerénquima y el desarrollo de los pelos radicales. Otra respuesta adaptativa puede incluir senescencia o abscisión de partes de la planta. Por otra parte, Malamy (74) afirma que el etileno y el ácido abscísico están implicados en los procesos de emergencia y activación del meristemo.
El etileno y el establecimiento de la simbiosis micorrízica arbucular in vitro. Muy poco se conoce acerca de cómo el etileno, una hormona vegetal, puede influenciar en el suelo la formación de micorrizas. La evolución del etileno es provocada no solo por la actividad física de las raíces en respuesta a varios estímulos (75), sino también por la presencia de infecciones microbianas (76).
Las infecciones fúngicas simbióticas en ciertas plantas pueden estar asociadas con incrementos en la síntesis de etileno y este a su vez, puede ser producido por los hongos micorrízicos e influir en el crecimiento y desarrollo de las plantas (75).
Las condiciones de crecimiento in vitro en las que se producen determinadas especies de plantas pueden provocar también incrementos en la producción de etileno debido al estrés que ocasionan, relacionados principalmente con la hermeticidad de los envases de cultivo (77).
En raíces micorrizadas se ha descrito una reducción en la producción de etileno (78), conjuntamente con la actividad de las enzimas quitinasas y b-1,3-glucanasas. Por otra parte, se ha informado también que la aplicación de etileno exógeno suprime el establecimiento de la colonización micorrízica, aunque según Geil y Guinel (79), en bajas concentraciones puede promover su formación.
CONSIDERACIONES
A pesar de los avances alcanzados en el diseño y elaboración de sistemas de cultivo in vitro destinados a la producción de inóculo micorrízico, en mayor medida, y a la micorrización de plantas, todavía quedan algunas cuestiones por resolver para optimizar estos sistemas. Por una parte, se desconoce la concentración de gases en el interior de los envases que limita el establecimiento de la asociación micorrízica y el desarrollo de las plantas, en función por supuesto de la especie vegetal de la cual se trate. Por otra, prevalece aun la imposibilidad de obtener plantas micorrizadas en los sistemas cerrados convencionales de producción de plantas por cultivo in vitro.
No obstante, los sistemas diseñados hasta el momento han contribuido a enriquecer los avances obtenidos en el estudio de las asociaciones micorrízicas arbusculares in vitro y sostienen las razones de Cano y col. (39) cuando expusieron que “las bases de la era del cultivo in vitro de los HMA ya están creadas”.
REFERENCIAS
1. Smith, S. E. y Read, D. J. Mycorrhizal Symbiosis. 2nd Edn, Academic Press, London. Stougaard J 2001. Genetics and genomics of root symbiosis. Curr. Opin. Plant Biol, 1997. 4, p. 328–335.
2. Harley, J. L. The significance of mycorrhiza. Mycol. Res. 92, 1989. p. 129-139.
3. Brundrett, M. Mycorrhizas in Natural Ecosystems.In Advances in Ecological Research. 1991. Begon, M, Fitter, A. H. & Macfadyen, A. (Eds.). Academic Press Limited, 2009. Vol 21, p. 171-313. ISBN 0-12-013921-9.32.
4. Harrier, L. A. The arbuscular mycorrhizal symbiosis: a molecular review of the fungal dimension. Journal of Experimental Botany, 2001. Vol. 52, p. 469-478.
5. Vierheilig, H.; Iseli, B.; Alt, M.; Raikhel, N.; Wiemken, A. y Boller, T. Resistance of Urtica dioica to mycorrhizal colonization: a possible involvement of Urtica dioica agglutinin. Plant Soil, 1996. 183, p. 131–136.
6. Nägeli, C. Pilze im Innern von Zellen. Linnaea, 1842. 16, p. 278–285.
7. Koide, R. T. y Mosse, B. 2004. A history of research on arbuscular mycorrhiza. Mycorrhiza 14, p. 145–163.
8. Glomeromycota TAXONOMY. [Consultado en: julio del 2010]. Disponible en: http://www.lrzmuenchen.de/~schuessler/amphylo/.
9. Parniske, M. Molecular genetics of the arbuscular mycorrhizal symbiosis. Current Opinion in Plant Biology,2004. 7, p. 414–421.
10. Bago, B.; Pfeffer, P. E. y Shachar-Hill, Y. Carbon metabolism and transport in arbuscular mycorrhizas. Plant Physiol, 2000124, p. 949-958.
11. Treseder, K. K. y Cross, A. Global distributions of arbuscular mycorrhizal fungi. Ecosystems, 2006. 9, p. 305-316.
12. Wardle, D. A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biol. Rev. Camb. Philos Soc, 1992 67, p. 321-358.
13. Redecker, D.; Kodner, R. y Graham, L. E. Glomalean fungi from the Ordovician. Science 289, 2000p. 1920–1921.
14. Remy, W.; Taylor, T. N.; Hass, H. y Kerp, H. Four hundredmillion- year-old vesicular arbuscular mycorrhizas. Proc. Natl. Acad. Sci. USA 91, 1994. p. 11841–11843.
15. Barker, S. J y Larkan, N. J. Molecular approaches to understanding mycorrhizal symbioses. Plant and Soil 244, 2002. pp. 107–116.
16. Hause, B y Fester, T. Molecular and cell biology of arbuscular mycorrhizal symbiosis. Planta 221, 2005. p. 184–196.
17. Fitter, A. H. y Moyersoen, B. Evolutionary trends in root microbe symbiosis. Phil. Trans. R. Soc. London B 351, 1996. p. 1367-1375.
18. Selosse, M. A. y Le Tacon, F. The land flora: a phototroph fungus. partnership? Trends Ecol. Evol. 13,1998. p. 15–20
19. Hildebrandt, U.; Janetta, K. y Bothe, H. Towards growth of arbuscular mycorrhizal fungi independent of a plant host. 68, 2002. p. 1919-1924.
20. Azcón-Aguilar, C.; Bago, B. y Barea, J. M. Saprophitic growth of AMF. In A Varma, B Hock, eds, Mycorrhiza: Structure, Function, Molecular Biology and Biotechnology, Ed 2. Springer-Verlag, Berlin, 1998. p 391–408.
21. Douds, D. D.; Pfeffer, P. E.; Shachar-Hill, Y. Carbon partitioning, cost, and metabolism of arbuscular mycorrhizas. In: Kapulnik, Y.; Douds, D. D. (eds) Arbuscular mycorrhizas: physiology and function. Kluwer, Dordrecht, 2000. p 107–129.
22. Fortin, J. A.; Bécard, G.; Declerck, S.; Dalpé, Y.; St-Arnaud, M.; Coughlan, A. P.; Piché, Y. Arbuscular mycorrhiza on root organ cultures. Can. J. Bot., 2002. p. 1-20.
23. White, P. R. In vitro cellular and de biology. Plant, 2011, vol. 47, no. 2, p. 201-204.
24. Butcher, D. N. The culture of isolated roots. In Tissue culture methods for plant pathologists. Eds. D.S. Ingram and J.P. Helgelson. Blackwell Scientific, Oxford, 1980. p. 13–17.
25. Butcher, D. N. y Street, H. E. Excised root culture. Bot. Rev. 30, 1964. p. 513–586.
26. Bécard, G.; Fortin, J. A. 1988. Bécard, G., and Fortin, J.A. Early events of vesicular–arbuscular mycorrhiza formation on Ri T-DNA transformed roots. New Phytol. 108, 1988. p. 211–218.
27. Bécard, G., y Piché, Y. Establishment of vesicular–arbuscular mycorrhiza in root organ culture: review and proposed methodology. In Techniques for the study of mycorrhiza. Eds.: J. Norris, D. Read, y A. Varma. Academic Press, New York, 1992. p. 89–108.
28. Diop, T. A.; Bécard, G.; Piché, Y. Long-term in vitro culture of an endomycorrhizal fungus, Gigaspora margarita, on Ri T-DNA transformed root of carrot. Symbiosis, 12, 1992. p. 249–259.
29. Diop, T. A. In vitro culture of arbuscular mycorrhizal fungi: Advances and future prospects. African Journal of Biotechnology, 2003. Vol. 2 (12), p. 692-697.
30. St-Arnaud, M.; Hamel, C.; Vimard, B.; Caron, M. y Fortin, J. A. Enhanced hyphal growth and spore production of the arbuscular mycorrhizal fungus Glomus intraradices in an in vitro system in the absence of host roots. Mycol Res, 1996. 100:328–332.
31. Joner, E. J.; Ravnskov, S.; Jakobsen, I. Arbuscular mycorrhizal phosphate transport under monoxenic conditions using radio-labelled inorganic and organic phosphate. Biotechnol. Lett. 22, 2000. p. 1705-1708.
32. Pfeffer, P. E.; Douds, D. D.; Bécard, G.; y Shachar-Hill, Y. Carbon uptake and the metabolism and transport of lipids in an arbuscular mycorrhiza. Plant Physiol. 120, 1999. p. 587–598.
33. Govindarajulu, M.; Pfeffer, P. E.; Jin, J. R.; Abubaker, J.; Douds, D. D.; Allen, J. W.; Bücking, H.; Lammers, P. J.; Shachar-Hill, Y. Nitrogen transfer in the Arbuscular Mycorrhizal Symbiosis. Nature 435, 2005p. 819-823.
34. Rufyikiri, G.; Thiry, Y.; Wang, L.; Delvaux, B.; Declerck, S. Uranium uptake and translocation by the arbuscular mycorrhizal fungus Glomus intraradices, under root organ culture conditions. New Phytol. 156, 2002. p. 275-281.
35. Dupré de Boulois, H.; Delvaux, B.; Declerck, S. Effects of arbuscular mycorrhizal fungi on the root uptake and translocation of radiocaesium. Environ. Pollut. 2005. Vol.134 (3), p. 515-524.
36. Dupré de Boulois, H.; Voets, L.; Delvaux, B.; Jakobsen, Y.; Declerck, S. Transport of radiocaesium by arbuscular mycorrhizal fungi to Medicago truncatula under in vitro conditions. Environmental Microbiology 11, 2006. p. 1926-1934.
37. Elmeskaoui, A; Damont, J - J. P.; Piché, Y. A culture system for endomycorrhizal inoculation of micropropagated strawberry plantlets in vitro. Mycorrhiza 5, 1995.p. 313 - 319.
38. Voets, L.; Dupré de Boulois, H.; Renard, L.; Strullu, D. G. y Declerck, S. Development of an autotrophic culture system for the in vitro mycorrhization of potato plantlets. FEMS Microbiol Lett. 248, 2005. p. 111–118.
39. Cano, C.; Dickson, S.; González-Guerrero, S; Bago, A. In vitro cultures open new prospects for basic research in arbuscular mycorrhizas. In: Mycorrhiza. State of the art, Genetics and molecular biology, Eco-Function, Biotechnology, Eco-Physiology, Structure and Systematics. Ed.: Varma, A. Springer-Verlag Berlin Heidelberg, 2008. p. 627-654.
40. Voets, L.; de la Providencia, I. E.; Fernández, K.; Ijdo, M.; Cranenbrouck, S. y Declerck, S. Extraradical mycelium network of arbuscular mycorrhizal fungi allows fast colonization of seedlings under in vitro conditions. Mycorrhiza. 19, 2009. p.347–356.
41. De Souza, F. A.; Dalpé, Y.; Declerck, S.; de la Providencia, I. E.; Séjalon-Delmas, N. Life history strategies in Gigasporaceae: insight from monoxenic culture, In: In vitro culture of Mycorrhizas. Eds.: Declerck, S.; Strullu, D. G.; Fortin, J. A. Heidelberg, Springer-verlag, 2005. p. 73-94.
42. Declerck, S.; Strullu, D. G. y Fortin, J. A. (eds). In vitro culture of mycorrhizas. Springer, Berlín, 2005.
43. Giovannetti, M. Spore Germination and Pre-Symbiotic Micelial Growth. In: Arbuscular mycorrhizas: Physiology and Function. Ed. Kapulnik, Y. and Douds, D. Chapter 3, 2000. p: 47 - 68.
44. Klironomos, J.N.; Hart, M. N. Colonization of roots by arbuscular mycorrhizal fungi using different sources of inoculum. Mycorrhiza 12, 2002. p. 181-184.
45. Budi, S. W.; Blal, B.; Gianinazzi, S. Surface-sterilization of Glomus mosseae sporocarps for studying endomycorrhization in vitro. Mycorrhiza, 9, 1999. 65–68.
46. Mirabal, L.; Kleiner, D.; Ortega, E. Spores of the mycorrhizal fungus Glomus mosseae host yeasts that solubilize phosphate and accumulate polyphosphates. Mycorrhiza 18, 2008. 197-204.
47. Walley, F. L.; Germida, J. J. Failure to decontaminate Glomus clarum NT4 spores is due to wall associated bacteria. Mycorrhiza, 6, 1996. 43 - 49.
48. Declerck, S.; Strullu, D. G. y Plenchette, C. Monoxenic culture of the intraradical forms of Glomus sp. Isolated from a tropical ecosystem: a proposed methodology for germplasm collection. Mycologia, 90, 1998. p. 579 - 585.
49. Declerck, S.; Cranenbrouck, S.; Dalpé, Y.; Granmougin-Ferjani, A.; Fontaine, J.; Sancholle, M. Glomus proliferum sp.nov.:a description based on morphological, biochemical, molecular and monoxenic cultivation data. Mycologia, 92, 2000. 1178–1187.
50. Strullu, D. G.; Diop, T. A.; Plenchette, C. Réalisation de collections in vitro de Glomus intraradices (Schenck et Smith) et de Glomus versiforme (Karsten et Berch) et proposition d’un cycle de développement. C.R. Acad. Sci. Paris, 320, 1997. p 41–47.
51. Dalpé, Y. In vitro monoxemic culture of arbuscular mycorrhizal fungi: a major tool for taxonomical studies. In Proceedings of the 3rd National Symposium on Mycorrhizal Symbioses. Guanajuato, Mexico, September, Edited by V. Olalde. Comite Nacional de Investigacion y enseñanza de la micorriza, México, 2001.
52. Strullu, D. G. y Plenchette, C. The entrapment of Glomus sp. in alginate beads and their use as root inoculum. Mycol. Res. 95, 1991. 1194–1196.
53. Nantais, L. Optimization of arbuscular mycorrhizal inoculum through selection and increased production of Glomus intraradices propagules. M.Sc. thesis, Université de Montréal, Montréal. 1997.
54. Leake, J. R.; Johnson, D.; Donnelly, D. Muckle, G. E.; Boddy, L.; Read, D. J. Networks of power and influence: The role of mycorrhizal mycelium in controlling plant communities and agro-ecosystem functioning. Canadian Journal of Botany 82, 2004. p. 1016-1045.
55. De la Providencia, I. E. Contribution of anastomosis and Hyphal Healing Mechanism to the extrarradical mycelium architecture of Arbuscular Mycorrhizal Fungi. Université catolique de Louvain. Belgique, 2007. p. 179.
56. Van der Heijden, M. G. A.; Klironomos, J. N.; Ursic, M.; Moutoglis, P., Streitwolf-Engel, R.; Boller, T.; Wiemken, A.; Sanders, I. R. Mycorrhizal fungal diversity determines plant diversity, ecosystem variability and productivity. Nature. 396, 1998. p. 69-72.
57. Voets, L.; de la Providencia, I. E.; Declerck, S. Glomeraceae and Giogasporaceae differ in their ability to form hyphal networks. New Phytologist. 172, 2006. p. 185-188.
58. Friese, C. F. y Allen, M. F. The spread of VA mycorrhizal fungal hyphea in the soil–inoculum types and external hyphal architecture. Mycologia 83, 1991. 409–418.
59. Giovannetti, M.; Sbrana, C.; Avio, L.; Strani, P. Patterns of belowgroundplant interconnections established by means of arbuscular mycorrhizal networks. New Phytol 164, 2004. p. 175–181.
60. Jeffries, P.; Gianinazzi, S.; Perotto, S.; Turnau, K.; Barea, J. M. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and fertility of soils. 37, 2003. p. 1-16.
61. Munkvold, L.; Kjoller, R.; Vestberg, M.; Rosendahl, S.; Jakobsen, I. High functional diversity within species of arbuscular mycorrhizal fungi. New Phytologist. 164, 2004. p. 357-364.
62. Rillig, M. Arbuscular mycorrhizae, glomalin and soil aggregation. Canadian Journal of Soil Science. 84, 2004. p. 355-363.
63. Van der Heijden, M. G. A.; Streitwolf-Engel, R.; Rield, R.; Siegrsit, S.; Neudecker, A.; Ineichen, K.; Boller, T.; Wiemken, A.; Sanders, I. R. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland. New Phytologist 172, 2006. p. 739-752.
64. Bago, B.; Vierheilig, H.; Piché, Y. y Azcón-Aguilar, C. Nitrate depletion and pH changes induced by extraradical mycelium of the arbuscular mycorrhizal fungus Glomus intraradices grown in monoxenic culture. New Phytol. 133, 1996. p. 273–280.
65. Pawloska, T. E.; Douds, D. D. e I. Charvat. In vitro propagation and life cycle of the arbuscular mycorrhizal fungus Glomus etunicatum. Mycol. Res. 103, 1999. p. 1549 - 1556.
66. Murashige, T. y F. Skoog. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, 1962. 473 - 497.
67. Bécard, G. y Piché, Y. Fungal growth stimulation by CO2 and root exudates in vesicular - arbuscular mycorrhizal symbiosis. Appl. Envir. Microbiol. 55, 1989. p. 2320 - 2325.
68. Kozai, T.; Kubota, Ch.; Jeong, B. R. Environmental control for the large-scale production of plants through in vitro techniques. Plant Cell, Tissue and Organ culture 51, 1997. p. 49-56.
69. Bécard, G.; Douds, D. D. y Pfeffer, P. E. Extensive in vitro hypahl growth of vesicular arbuscular mycorrhizal fungo in the presence of CO2 and flavonols. Applied and Environmental Microbiology, 1991. Vol. 58, p. 821-825.
70. Davies, P. G. Plant hormones, Physiology, biochemistry and molecular biology. Luwer Academic Publishers, Dordrecht, Holanda, 2005. 717 p.
71. Schmelz, E. A.; Engelberth, J.; Alborn, H. T.; ODonnel, P.; sammons, M.; Toshima, H. y Tumlinson III, J. H. Simultaneous analysis of phytohermones, phytotoxins and volatile organic compounds in plants. Proc. Natl. Acad. Sci. USA. 100, 2003. p. 10552-10557.
72. Segura, J. Introducción al desarrollo. Concepto de hormona vegetal. En: Fundamentos de Fisiología Vegetal. Azcón-Bieto, J. y Talón, M. (Eds.), McGraw-Hill Interamericana, Madrid y Edicions Universitat de Barcelona, Barcelona, 2000. p. 1413-1421.
73. Lynch, J.; Brown, K. M. Ethylene and plant responses to nutricional stress. Physiologia Plantarum 100, 1997. p. 613-619.
74. Malamy, J. E. Intrinsic and environmental response pathways that regulate root system architecture. Plant, Cell and Environment 28, 2005. p. 67–77.
75. Ishii, T.; Shrestha, Y. H.; Matsumoto, I.; Kadoya, K. Effect of ethylene on the growth of Vesicular-Arbuscular Mycorrhizal Fungi and on the mycorrhizal formation of trifoliate orange roots. J. Japan. Soc. Hort. Sci, 1996. Vol. 65 (3), p. 525-529.
76. Abeles, F. B.; Morgan, P. W. y Saltveit, M. E. Ethylene in plant biology, (Second Edition). Academic Press, New York, 1992.
77. Perl, A.; Aviv, D. y Galun, E. Ethylene and in vitro ulture of potato: supression of ethylene vastly improves protoplast yield, plating efficiency and transient expression of an alien gene. Plant Cell Report, 7, 1988. p. 403-406.
78. Cruz, A. F.; Ishii, T. y Kadoya, K. Effects of arbuscular mycorrhizal fungi on tree growth, leaf water potential, and levels of 1-aminocyclopropane-1-carboxylic acid and ethylene in the roots of papaya under water-stress conditions. Mycorrhiza, 10, 2000. p. 121–123.
79. Geil, R. D.; Guinel, F. C. Effects of elevated substrate-ethylene on colonization of leek (Allium porrum) by the arbuscular mycorrhizal fungus Glomus aggregatum. Canadian Journal of Botany-Revue Canadienne de Botanique, 2002. Vol. 80 (2), pp. 114-119.
Recibido: 30 de noviembre de 2010
Aceptado: 27 de marzo de 2012
Dra.C. Kalyanne Fernández Suárez, Investigador Agregado del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas, gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email: kalyanne@inca.edu.cu