Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.34 no.4 La Habana oct.-dic. 2013
Comunicación corta
Funcionamiento de la inoculación líquida con hongos micorrízicos arbusculares (HMA) en plantas de tomate (Solanum lycopersicum L.)
Arbuscular mycorrhizal fungi (AMF) liquid inoculation performance in tomato (Solanum lycopersicum L.) plants
M.Sc Yonaisy Mujica Pérez,I Dr.C Jorge Batlle SalesII
IAspirante a Investigador del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
IIProfesor Titular de Biología Vegetal, Universidad de Valencia, España.
RESUMEN
Esta investigación se realizó en la Sección de Invernaderos del Servicio Central de Soporte a la Investigación Experimental (SCSIE), en la Universidad de Valencia, España. Se utilizó el tomate (Solanum lycopersicum L. cultivar ‘Amalia’) como cultivo modelo cuyas semillas fueron desinfectadas antes de la siembra. Se utilizó como sustrato una mezcla de sustrato orgánico y vermiculita (1:1). El cultivo creció bajo condiciones controladas de temperatura y humedad relativa. Las plantas se inocularon con la especie de hongo micorrízico arbuscular (HMA) Glomus cubense, la que se inoculó en la etapa de semillero a razón de 250 esporas/mL de agua en un volumen final de 800 mL. La inoculación se realizó una sola vez durante el ciclo del experimento. A los 15 días de germinado el cultivo las posturas se trasplantaron para macetas que contenían sustrato orgánico, vermiculita, y arena sílice (1:2:1). Se estudiaron dos tratamientos siguiendo un diseño completamente aleatorizado: control sin inocular e inoculado para un total de 30 macetas por cada tratamiento. Las evaluaciones se realizaron cada 15 días hasta la etapa de floración del cultivo y se evaluaron indicadores del desarrollo vegetativo y del funcionamiento micorrízico. Los resultados permitieron comprobar que la inoculación por capilaridad de HMA en plantas de tomate bajo condiciones controladas fue efectiva según los indicadores estudiados.
Palabras clave: hortalizas, micorrizas arbusculares, invernaderos, inoculación.
ABSTRACT
Research was conducted in the Greenhouse section of the Central Experimental Research Support (SCSIE), University of Valencia, Spain. We used the tomato (Solanum lycopersicum L. cultivar ‘Amalia’) as a model crop whose seeds were disinfected prior to planting. Substrate a mixture of organic substrate and vermiculite (1:1) was used. Crop grown under controlled conditions of temperature and relative humidity. Glomus cubense was studied and it was inoculated into seed stage at 250 esporas/mL of water in a final volume of 800 mL. The inoculation was performed once during experiment cycle. At 15 days of cultivation positions germinated were transplanted to pots containing organic substrate conical, vermiculite, and silica sand (1:2:1). Two treatments were studied following a completely randomized design: uninoculated control and inoculated to a total of 30 pots for each treatment. Evaluations were performed every 15 days until the flowering stage of cultivation and development indicators were evaluated vegetative and mycorrhizal functioning. Results showed capillary AMF inoculation in tomato plants under was effective as indicators studied by controlled conditions.
Key words: vegetable, arbuscular mycorrhizae, greenhouses, inoculation.
INTRODUCCIÓN
La agricultura actual en las regiones tropicales afronta un sinnúmero de limitantes que hacen que dichos sistemas sean insostenibles, siendo uno de ellos la degradación continua de sus suelos, producto del incremento de la erosión, la rápida descomposición de la materia orgánica dada por las altas temperaturas, además de un suministro nutricional deficiente y la baja capacidad de intercambio catiónico. Por lo tanto, se hace necesario la búsqueda de soluciones que permitan beneficiar las características químicas, físicas y biológicas del suelo, lo que unido a un manejo adecuado de estas áreas degradadas, contribuirá a la recuperación de estos suelos empobrecidos (1).
Algunas alternativas a emplear en estas condiciones lo constituye el uso de inoculantes a partir de hongos micorrízicos arbusculares (HMA). La utilización de estos hongos debe ser considerada en el diseño de cualquier sistema de producción agrícola, ya que, además de ser componentes inseparables de los agroecosistemas, realizan diversas e importantes funciones en su asociación con las plantas. Entre ellas se destacan: aprovechamiento más eficiente de los nutrientes en la zona radical a partir de un aumento en el volumen de suelo explorado, mayor resistencia a las toxinas, incremento de la traslocación y solubilización de elementos esenciales, aumento de la tolerancia a condiciones abióticas adversas (sequía, salinidad, etc.), así como cierta protección contra patógenos radicales (2).
Atendiendo a los criterios anteriormente expuestos, en la década de los 90, el Instituto Nacional de Ciencias Agrícolas (INCA) inició un amplio programa de investigaciones básicas con estos simbiontes y como resultado se obtuvo un biofertilizante de formulación sólida registrado como EcoMic® (3), con alto grado de pureza y estabilidad biológica, con el cual se ejecutaron estudios que mostraron resultados satisfactorios en viveros de especies forestales (4), en cereales como el arroz cultivado en condiciones de estrés salino (5), trigo duro (6) y en hortalizas como el tomate (7).
Tomando como punto de partida la efectividad mostrada por este inoculante sólido, a partir del año 2000, se iniciaron nuevos estudios, pero esta vez con el propósito de formular un nuevo producto a partir de hongos micorrízicos arbusculares (HMA) en soporte líquido, con la finalidad de diversificar las vías de inoculación de estos simbiontes garantizando aplicaciones por la vía del fertirriego y además permitiendo reutilizar la arcilla empleada en el proceso de reproducción de los propágulos fúngicos.
Teniendo en cuenta estos antecedentes el objetivo de esta investigación fue evaluar el funcionamiento de la inoculación líquida con hongos micorrízicos arbusculares (HMA) en plantas de tomate (Solanum lycopersicum L. cultivar ‘Amalia’) en condiciones controladas.
MATERIALES Y MÉTODOS
El experimento se realizó en la Sección de Invernaderos del Servicio Central de Soporte a la Investigación Experimental (SCSIE), en la Universidad de Valencia, España.
Material Vegetal
Se utilizó el tomate (Solanum lycopersicum L. cultivar ‘Amalia’) como cultivo modelo con un 96 % de germinación, cuyas semillas fueron obtenidas en el departamento de Mejoramiento Genético del INCA (8) y se desinfectaron con una solución de hipoclorito de sodio al 10 % durante 10 minutos (9). Pasado este tiempo se decantó la solución, se lavaron tres veces con agua destilada y fueron sembradas en bandejas de polietileno con drenaje inferior central (2,5x2, 5x7,0 cm) a razón de dos semillas por alveolo. A los siete días se realizó un raleo y se dejó una sola planta. El cultivo creció bajo condiciones ambientales controladas; a una temperatura entre 17 y 27ºC y humedad relativa entre 60-70 %. El sustrato que se empleó para el semillero estuvo compuesto por una mezcla de sustrato orgánico (Kekkila Iberis S.L.) y vermiculita (1:1) y en la Tabla I se describen la características químicas de dicho sustrato.
Inoculante micorrízico
Se estudió la especie de hongo micorrízico arbuscular (HMA) Glomus cubense (Y. Rodr. & y Dalpé) (10), la que se reprodujo en el cepario de micorrizas arbusculares del INCA y fue inoculada a través de agua de riego. Las bandejas de polietileno se colocaron dentro de bandejas con 10 cm de volumen a la cual se le aplicó el agua de riego que contenía los propágulos micorrízicos a razón de 250 esporas/mL en 800 mL de agua. El riego en estas bandejas se realizó en función de la capilaridad del agua por las celdas de la bandeja y la inoculación del HMA se realizó solo en el primer riego.
Descripción de los tratamientos y evaluaciones
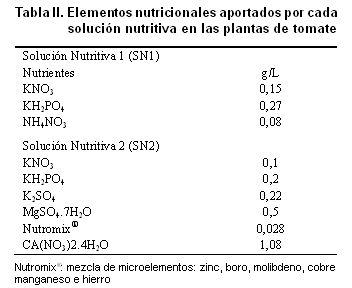
El experimento se ejecutó durante los meses de mayo a junio del 2011. La siembra se realizó en mayo y a los 15 días de germinadas las semillas de tomate se realizó el trasplante de las posturas a macetas (12x12x9 cm) de 1 kg de capacidad. El sustrato empleado en esta etapa fue una mezcla de sustrato orgánico, vermiculita y arena sílice (1:2:1). Se aplicaron soluciones nutritivas para el cultivo mediante el riego por goteo a cada maceta dos veces al día. En la Tabla II se muestran los compuestos nutricionales aportados durante el ciclo experimental, siendo la Solución Nutritiva 1 (SN1) la aplicada en las dos primeras semanas posterior al trasplante y la Solución Nutritiva 2 (SN2) para las tres últimas. En ambas soluciones se redujo a la mitad en contenido de fósforo.
Se siguió un diseño Completamente Aleatorizado con dos tratamientos: un testigo sin inocular (T1) y otro inoculado con el inoculante líquido LicoMic® (T2), con 30 macetas por cada uno. Para las determinaciones se tomaron 15 macetas al azar por tratamiento a los 15 y 30 días después del trasplante (ddt), coincidiendo el último muestreo con la etapa de floración del cultivo.
Las variables evaluadas fueron:
Parámetros fúngicos: Para la estimación de los indicadores fúngicos las raicillas fueron secadas a 70°C y teñidas (11). Se determinó la frecuencia de colonización micorrízica por el método de los interceptos (12) y la intensidad de la colonización (13).
Índices del crecimiento de las plantas: Se determinó la altura de la planta (cm), los diámetros inferior y superior del tallo (mm), el número de flores (u) y la masa seca aérea (g). Para la determinación de la masa seca las muestras permanecieron en estufa a 70°C hasta obtener peso constante.
Análisis estadístico
Los datos fueron analizados mediante el software STATGRAPHICS Centurion para Windows. Todos los caracteres cumplían los supuestos de normalidad y homogeneidad de varianza, por lo cual se procedió a efectuar un análisis de varianza según modelo de clasificación simple al dato original1. Para la discriminación de medias se utilizó el procedimiento de Duncan con una significación de un 5 % en los casos en que el ANOVA resultó significativo.
RESULTADOS Y DISCUSIÓN
El análisis de la dinámica del crecimiento de las plantas en las condiciones experimentales evaluadas arrojó un comportamiento diferenciado entre los tratamientos estudiados para todas las variables de respuesta analizadas, lo que se evidenció al existir diferencias significativas entre el tratamiento inoculado con respecto al tratamiento testigo en ambos muestreos.
En cuanto al comportamiento de los indicadores fúngicos (frecuencia e intensidad de la colonización micorrízica) se encontró una respuesta positiva al inocular la especie Glomus cubense por capilaridad. Los valores encontrados en las planta micorrizadas difirieron significativamente de las plantas controles, con cifras de un 58 % para la frecuencia de colonización y 1,23 % para la intensidad, lo que demuestra la efectividad de esta forma de aplicación del inoculante líquido en esta hortaliza para las condiciones estudiadas.
La efectividad del inoculante líquido ha sido comprobada en varios estudios en condiciones in vitro y en condiciones de parcelas experimentales al inocular la cepa Glomus cubense y Glomus mosseae en raíces transformadas de zanahoria (Daucus carota L.) y en plántulas de arroz (Oryza sativa L.) respectivamente. En ambos casos se obtuvo un efecto positivo del inoculante para los indicadores de funcionamiento micorrízico (5, 14), encontrándose valores superiores en las plantas inoculadas con respecto a las controles. Resultados similares se obtuvieron al aplicar el inoculante líquido LicoMic® a partir de Glomus cubense asperjando las semillas de trigo duro (Triticum durum L.) en el momento de la siembra (6).
Al realizar un análisis integral de los índices de crecimiento y desarrollo de las plantas evaluados en este ensayo (altura de las plantas, diámetro inferior y superior del tallo, número de flores y masa seca aérea) se comprobó la efectividad de la inoculación por capilaridad de la especie Glomus cubense, destacándose, para todas las variables, las plantas inoculadas en relación con el testigo.
Para la altura de las plantas se encontró una respuesta promisoria desde el primer muestreo realizado (15 ddt), donde se alcanzaron valores de 30,61 cm, superiores a los obtenidos por las plantas testigo (27,04 cm) (Figura). Esta tendencia se mantuvo en el segundo muestreo (30 ddt), con cifras de 42,78 cm y 33,44 cm respectivamente. Estos resultados fueron similares a los encontrados al estudiar el efecto de la inoculación de la especie Glomus fasciculatum en vivero de especies forestales, donde se obtuvo una respuesta positiva de la inoculación sobre la altura de las posturas, además de incrementos en la masa seca de la raíz y la masa seca aérea (4).

El efecto de la inoculación de hongos micorrízicos arbusculares (HMA) sobre los indicadores de crecimiento y desarrollo de las plantas ha sido ampliamente demostrado en la agricultura, horticultura y sistemas forestales. Si bien es conocido que los HMA favorecen la nutrición de las plantas, lo que se traduce en un aumento de la traslocación de nutrientes del suelo hacia la planta a través de las hifas del hongo, es vital destacar el papel de estos simbiontes en la estabilidad de agregados en el suelo, efecto que contribuye a mejorar su fertilidad y capacidad de intercambio catiónico (15).
Al concluir esta investigación pudimos comprobar la efectividad de la inoculación por capilaridad del inoculante líquido LicoMic® en plantas de tomate lo que permite considerar esta forma de aplicación de estos simbiontes para condiciones similares. Estos resultados, si bien son preliminares, inician un nuevo camino de futuras investigaciones centradas en optimizar la aplicación de este inoculante líquido.
AGRADECIMIENTOS
A la colaboración entre la Universidad de Valencia en España y el Instituto Nacional de Ciencia Agrícolas (INCA) en Cuba. En especial al colectivo de especialistas de la Sección de Invernaderos del Servicio Central de Soporte a la Investigación Experimental (SCSIE) por su apoyo incondicional.
REFERENCIAS
1. Uribe, D.; Sánchez-Nieves, J. y Vanegas, J. Role of Microbial Biofertilizers in the Development of a Sustainable Agriculture in the Tropics. In: Soil Biology and Agriculture in the Tropics. (Ed.) Springer-Verlag Berlin Heidelberg, 2010, p. 235-250.
2. Smith, S. y Read, D. Mycorrhizal Symbiosis. (Edit): Smith, S. y Read, D. Academic Press: London. 2009, p. 144-187.
3. Fernández, F.; Gómez, R.; Vanegas, L. F.; de la Noval, B. M. y Martínez, M. A. Producto inoculante micorrizógeno. Oficina Nacional de Propiedad Industrial. Cuba, Patente. 2000, no. 22641.
4. Hernández, W. y Salas, E. La inoculación con Glomus fasciculatum en el crecimiento de cuatro especies forestales en vivero y campo. Agronomía Costarricense, 2009, vol. 33, no. 1, p. 17-30.
5. Fernández, F.; Dell’Amico, J. M.; Angoa, M. V. y de la Providencia, I. E. Use of a liquid inoculum of the arbuscular mycorrhizal fungi Glomus hoi in rice plants cultivated in a saline Gleysol: A new alternative to inoculate. Journal of Plant Breeding and Crop Science, 2011, vol. 3, no. 2, p. 24-33, ISSN 2006-9758.
6. Plana, R.; González, P. J.; Dell’Amico, J. M.; Fernández, F.; Calderón, A. y Marrero, Y. Efecto de dos inoculantes micorrizicos arbusculares (base líquida y sólida) en el cultivo del trigo duro (Triticum durum). Cultivos Tropicales, 2008, vol. 29, no. 4, p. 35-40.
7. Mujica, Y.; Medina, N. y de la Noval, B. M. Efectividad de la inoculación líquida de HMA en la nutrición del tomate (Solanum lycopersicum L.) en suelo Ferralítico. Editorial Acedémica Española (EAE), España, 2009, p. 75, ISBN 978-3-8443-3983-3.
8. Álvarez, M. G.; Moya, C. L.; Dominí, M. E. C.; Arzuaga, J. S.; Martínez, B. C.; Pérez, S. M. y Cuartero, J. Z. «Amalia»: A médium-fruit size heat-tolerant tomato cultivar for tropical conditions. Hort Science, 2004, vol. 39, no. 6, p. 1503-1504.
9. Ortega, E. y Rodés, R. Manual de prácticas de laboratorio de fisiología vegetal. Ciudad de la Habana: Pueblo y Educación. 1986, 196 p.
10. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F. y Rivera, R. A. Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba. Mycotaxon, 2011, vol. 118, p. 337-347.
11. Phillips, J. M. y Hayman, D. S. Improved procedure for clearing roots and staining parasitic and vesiculararbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Brit. Mycol. Soc., 1970, p. 158-161.
12. Giovanetti, M. y Mosse, B. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytol., 1980, no. 84, p. 489-500.
13. Trouvelot, A.; Kough, J. y Gianinazzi Pearson, V. Mesure du Taux de Mycorhization VA d’un Systeme Radiculaire. Recherche de Methodes d’Estimation ayantune Signification Fonctionnelle. Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae, Dijón, 1 5 July, 1985. (V. Gianinazzi Pearson y S. Gianinazzi, eds.). INRA, Paris. 1986, p. 217-222.
14. Fernández, F.; Dell’Amico, J. M.; Pérez, Y.; Montilla, E.; Morte, A.; Honrubia, M.; Rincón, A. y de la Providencia, I. E. Evaluación de inoculantes de hongos micorrízicos arbusculares de Glomus clarum y Glomus fasciculatum en medio líquido (LicoMic®). Agricultura Andina, 2007, vol. 12, p. 67-83.
15. Anwar, Z.; Sayeed, M. y Futai, K. Mycorrhizae: sustainable agriculture and forestry. Edit: Anwar, Z.; Sayeed, M. and Futai, K. 2008, p. 359. ISBN: 978-1-4020-8769-1.
Recibido: 8 de agosto de 2012
Aceptado: 12 de marzo de 2013
M.Sc. Yonaisy Mujica Pérez, Aspirante a Investigador del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700. Email:ymujica@inca.edu.cu













