Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.35 no.1 La Habana ene.-mar. 2014
Influencia de un polímero de quitosana en el crecimiento y la actividad de enzimas defensivas en tomate (Solanum lycopersicum L.)
Influence of a chitosan polymer in the growth and the induction of defensive enzymes in tomato (Solanum lycopersicum L.)
Dianevys González Peña,I Daimy Costales,II Alejandro B. FalcónIII
IAspirante Investigador del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32700, Cuba.
IIInvestigador Agregado del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA, gaveta postal 1, San José de las Lajas, Mayabeque, CP 32700, Cuba.
IIIInvestigador Auxiliar del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA, gaveta postal 1, San José de las Lajas, Mayabeque, CP 32700, Cuba.
RESUMEN
El objetivo del trabajo fue evaluar el efecto que ejerce la quitosana sobre algunos parámetros asociados al crecimiento y la inducción de respuestas defensivas en tomate (Solanum lycopersicum L.). Para ello se embebieron semillas del cultivar Amalia durante 4 horas en las concentraciones de quitosana 0,1, 1,0, 2,5 y 10 g.L-1. Además, plántulas de 21 días de germinadas se asperjaron foliarmente con concentraciones de 0,1, 1,0 y 2,5 g.L-1de quitosana. Se evaluó la longitud de las raíces y el tallo, el peso seco de las plántulas, así como la concentración de proteínas totales y la inducción de actividad ß-1,3 glucanasa y fenil alanina amonio liasa (PAL) en las hojas en varios momentos. Como resultado se observó que, en dependencia de la concentración de quitosana que se empleó, aumentaron el crecimiento de la raíz y el tallo, pero no se incrementó la masa seca total. También se alcanzó un mayor incremento en la actividad PAL respecto al control al embeberse las semillas con 0,1 g.L-1, aunque mediante la aspersión no se observaron diferencias significativas. Para la actividad ß-1,3 glucanasa con 2,5 y 10 g.L-1 hubo un aumento respecto al control en el tratamiento a las semillas, pero al asperjar las soluciones resultó 0,1 g.L-1 la concentración que proporcionó mayores incrementos en esta variable. En general, se comprobó que la quitosana induce respuestas defensivas y de crecimiento en el tomate, en dependencia de las concentraciones y la vía de aplicación.
Palabras clave: tomate, crecimiento, plántulas, raíces, tallos.
ABSTRACT
The aim of this work was to evaluate the effect of chitosan in growth and induction of defence responses in tomato (Solanum lycopersicum L.). Tomato seeds from the Amalia cultivar, were imbibed 4 hours in chitosan solutions of 0,1, 1,0, 2,5 y 10 g.L-1. Besides, plants of 21 days were sprayed with chitosan concentrations of 0,1, 1,0 y 2,5 g.L-1. Root length, stem length, protein concentrations, and the induction of ß-1,3 glucanase and phenylalanine ammonia-lyase (PAL) activities were evaluated in several moments. Results showed that the length of the root and the stem were incremented in dependence of chitosan concentration, but not the total dry weighs. The highest increment in PAL activity in relation to control was observed when the seeds were treated at concentration of 0,1 g.L-1 of chitosan, while foliar aspersion treatments did not showed significances differences in this parameter. The seeds treatments with chitosan at concentrations of 2,5 y 10 kg.L-1 induced increases in the ß-1,3 glucanase activity, but foliar sprays of 0,1 g.L-1showed the highest levels of this enzymatic activity. These results suggested that chitosan induce defensive and growing responses in tomato which depends of concentrations and application manner.
Key words: tomato, growth, seedlings, roots, stems.
INTRODUCCIÓN
La inducción de resistencia en las plantas es un proceso complejo en el que influyen una serie de factores como el tipo de estrés. Ante un estrés biótico se activan un grupo de mecanismos de defensa en la planta que contribuyen a limitar el desarrollo del microorganismo (1). Durante la interacción que se establece entre ambos seres vivos, se liberan fragmentos de paredes celulares que desencadenan diversas e incrementadas respuestas defensivas en el vegetal. Estos fragmentos se denominan elicitores y su estructura es muy diversa ya que pueden ser de naturaleza lipídica, proteica o glúsida (1, 2).
Otros compuestos de similar estructura también se consideran elicitores por su capacidad para inducir una resistencia basal en las plantas (2, 3).
Su aplicación pudiera incrementar la velocidad y magnitud con que estas respuestas se expresen, elementos determinantes para no permitir el establecimiento de una infección en el vegetal (4).
En la literatura se informan varios tipos de elicitores, donde se incluyen la quitina y la quitosana, que forman parte de las paredes celulares de numerosos hongos filamentosos. La quitosana es un compuesto inocuo y biodegradable que se obtiene en cantidades industriales por desacetilación básica de la quitina del exoesqueleto de los crustáceos (5).
Los beneficios de la quitosana en la agricultura son numerosos: inhibe el desarrollo de fitopatógenos (5-12); induce respuestas defensivas en las plantas y aumentan su protección contra microorganismos (9, 10, 13, 14, 15); funciona como cobertura de frutos para minimizar las pérdidas postcosecha (5, 7, 9, 16) y se utiliza como agente quelatante de metales pesados en los suelos (17), entre otras funciones.
Diversos trabajos demuestran la capacidad de la quitosana para disminuir los daños en los cultivos mediante la inducción de mecanismos de defensa ante estrés biótico, a través de la activación de determinadas enzimas, como algunas proteínas relacionadas con la patogénesis (PRs -Pathogenesis Related proteins, por sus siglas en inglés) (13, 14, 5, 18). Dentro de este grupo se encuentran quitinasas, quitosanasas, y glucanasas que degradan las paredes celulares de los hongos fitopatógenos (1). También se informa de aumentos en los niveles de fenil alanina amonio liasa (PAL), clave en la vía de los fenilapropanoides para la síntesis de lignina y posterior fortalecimiento de la pared vegetal (14, 15, 18), aunque estas respuestas varían en dependencia de la forma y el momento de aplicación (15, 18).
Debido a la importancia de un grupo de cultivos para la alimentación humana resulta necesaria la realización de estudios con nuevos productos que favorezcan el crecimiento y la inducción de mecanismos de resistencia que le puedan conferir protección ante la presencia de patógenos. El tomate (Solanum lycopersicum L.) es un cultivo de preferencia nacional y de gran demanda mundial debido a su alto contenido de vitaminas C y E, potasio y sus propiedades antioxidantes (19, 20). Una serie de patógenos de tipo fúngicos y oomycetes, tales como Cladosporium, Alternaria, Sclerotinia, Sclerotium, Rhizoctonia, Pythium y Phytophthora, se encuentran entre los principales agentes que provocan pérdidas significativas en este cultivo. Sin embargo, la mayoría de los productos que se emplean para la nutrición y protección de estas hortalizas son compuestos químicos, contaminantes del ecosistema, por lo que es necesario buscar alternativas más ecológicas y menos costosas. A raíz de esta problemática, en los últimos años ha habido un auge en el empleo de bioproductos que estimulan el crecimiento del tomate, como los análogos de brasinoestreoides, micorrizas, mezclas de oligogalacturónidos, y quitosanas, entre otros (21, 22, 23).
El objetivo del presente trabajo fue evaluar el efecto que ejerce la quitosana sobre el comportamiento de enzimas defensivas en el tomate, así como sobre variables relacionadas con el crecimiento de estas plántulas.
MATERIALES Y MÉTODOS
En los experimentos se emplearon semillas de tomate del cultivar Amalia, que se desinfectaron con hipoclorito de sodio durante 30 segundos y se lavaron con abundante agua destilada estéril.
Se empleó, una quitosana con un grado de acetilación del 12% y masa molar de 1,35x105 g.mol-1. Se disolvió en solución de ácido acético al 1 % y el pH se ajustó a 5,6 con KOH (14).
Imbibición de las semillas con quitosana
Las semillas se desinfectaron y se trataron con 10 mL de solución de quitosana, a las concentraciones de 0, 0,1, 1,0, 2,5 y 10,0 g.L-1 durante cuatro horas. Se colocaron en placas Petri con papel de filtro humedecido en condiciones de oscuridad.
Se evaluó la longitud que alcanzaron las raicillas a las 72 horas, previo a su siembra en los cepellones, los que contenían como sustrato una mezcla de materia orgánica y suelo en proporción 1:1, pH =6,8. Las plantas se colocaron en un régimen de 16 horas luz/8 horas de oscuridad a 28°C± 2. Se tomaron 60 plántulas por tratamiento a los 10, 17 y 24 días después de la siembra y se midió la longitud de la raíz y el tallo por planta. Posterior a la medición, las plantas se colocaron en la estufa a 60°C durante cinco días antes de determinar su masa en balanza analítica. Paralelo a las mediciones se tomaron las hojas verdaderas de 20 plántulas por tratamiento y se realizó la extracción del material vegetal a razón de 1g de foliolo / 1,5ml de buffer de extracción (Ac-Na+ 0,05M pH 5,2 + NaCl 1M + EDTA 0,005M+ Mercaptoetanol 0,005M). La solución se centrifugó durante 15 minutos a 5000 rpm a 5°C, se desechó el pellet y el sobrenadante volvió a centrifugarse a 12000 rpm por cinco minutos. El sobrenadante se colectó y conservó a -10°C hasta hacer las determinaciones de proteínas totales y actividades enzimáticas.
Aspersión de plántulas de tomate con quitosana
Las semillas de tomate desinfectadas se colocaron en placas Petri con papel de filtro humedecido durante 72 horas en oscuridad. Posteriormente, se sembraron en cepellones los que contenían como sustrato una mezcla de materia orgánica y suelo en proporción 1:1, pH =6,8 bajo un régimen de 16 horas luz/8 horas oscuridad a 28°C± 2. Después de 21 días de sembradas las plántulas de tomate, de alrededor de 10 cm de altura, se asperjaron diferentes concentraciones de quitosana (0,1, 1,0 y 2,5 g.L-1) con un volumen de 0,1 mL
por plántula. Como control se asperjó agua destilada.
A las 24, 48, 72 y 96 horas de asperjadas se tomaron las hojas verdaderas de 20 plántulas por tratamiento y se realizó la extracción del material vegetal de manera similar al experimento anterior para realizar las determinaciones de proteínas totales (Conc.prot) y actividades enzimáticas (AE).
Determinación de proteínas y actividades enzimáticas
El contenido de proteínas se determinó mediante la metodología micro- Lowry descrita por Sun (1994), con el empleo de una curva patrón de BSA y se expresó como mg de proteína por gramo de tejido vegetal fresco.
La actividad ß-1,3 glucanasa se evaluó de acuerdo a la metodología descrita por Falcón y et al., (2009) y se cuantificó la liberación de azúcares reductores de laminarina (Sigma) como sustrato, por acción de las enzimas del extracto. El total de azúcares reductores se determinó por el método colorimétrico de Somogyi (1952) y los resultados se expresaron como actividad específica (UAE.min-1.mg proteína-1), definiéndose una unidad de actividad enzimática como la liberación de 1 microgramo de glucosa equivalente por minuto por mg de proteína. Para esto se empleó una curva patrón de glucosa a 520nm.
La determinación de actividad fenilalanina-amonio liasa (PAL) se realizó según la metodología de Vander et al. (1998) con la diferencia de que el ensayo se incubó por 2 horas. Se cuantificó la formación de ácido cinámico por acción de las enzimas PAL presentes en el extracto con el uso de L-Fenilalanina como sustrato (Sigma). La actividad enzimática fue expresada como actividad específica (UAE.min-1.mg proteína-1), definiéndose una unidad de actividad enzimática como la formación de un microgramo de ácido cinámico por minuto por mg de proteína. La curva patrón se determinó a partir de las lecturas de ácido cinámico a 275 nm.
Análisis estadístico
Los experimentos se repitieron en tres ocasiones y los datos se procesaron estadísticamente a través de un ANOVA de clasificación simple. Las medias se compararon mediante la prueba de Tukey con un nivel de significación de p≤0,05. En los casos señalados se realizó el análisis a través de intervalos de confianza para p≤0,05. En ambos casos se empleó el paquete estadístico SPSS versión 15.01, año 2006.
RESULTADOS Y DISCUSIÓN
Al analizar las variables de crecimiento se observó que, en la mayoría de los casos la imbibición de las semillas de tomate en soluciones de quitosana ejerció un efecto positivo sobre la longitud de las raíces. Con las concentraciones de 0,1, 1,0 y 2,5 g.L-1, se alcanzaron valores superiores al control (Figura 1). Sin embargo, al utilizar 10 g.L-1 se inhibió el crecimiento parcialmente, tal vez debido a que esos niveles resultan tóxicos para determinados eventos relacionados con la germinación. También la viscosidad del polímero, que resulta muy superior a las demás concentraciones empleadas, pudo interferir al formar una película que reduce el intercambio de gases (5, 26). De hecho, esta propiedad de formar filmes es explotada en el manejo postcosecha para mejorar la conservación de los frutos y hortalizas y así aumentar el tiempo de almacenaje sin afectar la calidad de los mismos (27).
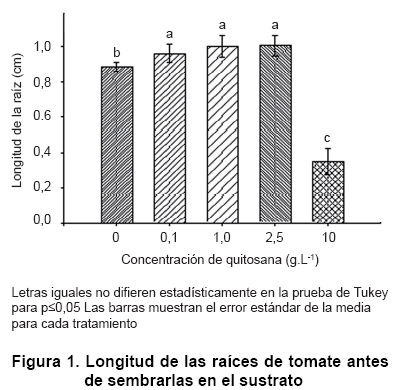
Varios estudios realizados por otros autores resumen el efecto de la quitosana sobre la germinación de diferentes semillas y coinciden con los resultados positivos obtenidos en el presente trabajo (28, 29, 30). En el caso del maíz, se observó que la quitosana promovió el índice de germinación de los granos, redujo el tiempo promedio de germinación e incrementó la longitud y el peso fresco de la raíz (30). También se demostró que este compuesto aumentaba el porcentaje de germinación y el vigor de las posturas de millo (29), además de inducir un alto porcentaje de emergencia y de sobrevivencia de semillas de chile inoculadas con Colletotrichum (31).
El efecto inhibitorio que se obtuvo sobre la longitud de la raíz, muy marcado en un primer momento con 10 g.L-1, desapareció en las evaluaciones que se realizaron a las raíces a los 10, 17 y 24 días de germinadas las plántulas y este tratamiento se comportó de manera similar al control (Figura 2).
A los 10 días de germinadas las plántulas se observaron diferencias en la longitud de la raíz entre el control y 0,1 g.L-1 de quitosana, pero esta dejó de ser significativa a medida que transcurrió el tiempo (Figura 2). De particular interés es el hecho que el crecimiento fue inferior al control en los tratamientos con las concentraciones 1,0 y 2,5 g.L-1, a los 17 y 24 días. Esta acción inhibitoria puede deberse a la activación de mecanismos defensivos que consumen recursos energéticos que, en condiciones normales favorecerían el crecimiento vegetal. Resultados que pueden corroborar esta idea se encontraron al analizar la relación costo-beneficio del efecto de un elicitor de resistencia en plantas como el ácido ß-amino butírico. La aplicación de bajas dosis de este compuesto, en Arabidopsis provocó pequeñas reducciones en el crecimiento y no ejercía efecto en la producción de semillas, pero dosis superiores afectaron significativamente ambos parámetros (32).
Estudios similares al del presente trabajo mostraron un comportamiento diferente ya que, después de imbibirse las semillas durante cuatro horas, a los 27 días de sembradas y con 0,001 g.L-1 aumentaban la longitud de las raíces de tomate por encima del control (21). Otro trabajo que corrobora el efecto de bajas concentraciones de quitosana sobre esta variable se realizó con explantes de meristemos de orquídea donde se observó un mayor efecto al adicionar solamente 0,015 g.L-1 de quitosana (33).
La aplicación de quitosana, mediante imbibición de las semillas, apenas influyó en la longitud del tallo de las plántulas de tomate hasta los 24 días de sembradas, cuando se notó un aumento de esta variable con el tratamiento de 1,0 g.L-1 (Figura 3). No obstante, esta diferencia no se reflejó en la masa seca de las plántulas, donde no hubo diferencias estadísticamente significativas entre los tratamientos (Figura 4).
En condiciones similares, se observó que la imbibición de las semillas de tomate durante cuatro horas en una solución de quitosana de 2,0 g.L-1 estimuló el aumento del diámetro del tallo a los 27 días después de sembradas, aunque la imbibición durante ocho horas con igual concentración del polímero no provocó variación respecto al control (23). Además, se obtuvo un aumento de las masas secas de hojas y tallos con las concentraciones 0,001, 0,1 y 2,0 g.L-1 de quitosana aunque los incrementos en la raíz solo se alcanzaron con 0,001 y 0,01 g.L-1 del polímero (21).
Al analizar los niveles de proteínas en las hojas como resultado de la imbibición de las semillas se distinguió una disminución de la mayoría de los tratamientos en el tiempo (Figura 5A). Los valores que se obtuvieron a los 17 días de sembradas las semillas fueron superiores a los que se determinaron a los 24 días, excepto para la concentración 0,1 g.L-1 en la que no hubo diferencias significativas en los dos momentos. Respecto al control, la imbibición con quitosana redujo los niveles de proteína, tal vez por inducir la síntesis de otros compuestos de tipo lipídicos o glúsidos relacionados con la maquinaria defensiva (34). Algunos autores informaron del incremento de estructuras del metabolismo secundario como la síntesis de fenoles (35) y fitoalexinas, así como la formación de calosa y lignina (36).
En las variables enzimáticas defensivas en las hojas de las plántulas de tomate no se detectaron diferencias de actividad -1,3 glucanasa entre los tratamientos y el control a los 17 días después de imbibir las semillas, mientras que a los 24 días solo las concentraciones más altas (2,5 y 10 g.L-1) duplicaron los niveles enzimáticos del testigo (Figura 5B). Esto demuestra un incremento en la resistencia basal de la planta al emplear estas concentraciones, si se tiene en cuenta que la actividad -1,3 glucanasa se considera un factor de resistencia contra patógenos, fundamentalmente contra aquellos que pertenecen a la clase Oomycete (1, 37).
La actividad PAL en hojas de plántulas de tomate tuvo un comportamiento diferente al de la -1,3 glucanasa (Figura 5C). Solo la concentración de 0,1 g.L-1 causó incrementos de la actividad PAL por encima del control, en los dos momentos que se analizaron. En este tratamiento los niveles alcanzaron cinco y más de 10 veces los valores del control a los 17 y 24 días, respectivamente.
Otros autores también demostraron incrementos por enzima del control con esta concentración al aplicar este polímero de quitosana vía raíz y al sustrato en plantas de tabaco (18, 38). De hecho la imbibición de semillas de tabaco con este polímero durante 4 horas causó la duplicación de la actividad PAL a los 30 días de aplicar el tratamiento (38), lo que resulta significativo, ya que se ha demostrado la importancia de los genes PAL en la contención de patógenos de Oomycetes en SolanáceasA (39).
El análisis de los resultados de aspersión de quitosana en las plántulas de tomate mostró que la concentración de proteínas varió en el tiempo con las diferentes soluciones del polímero (Figura 6).
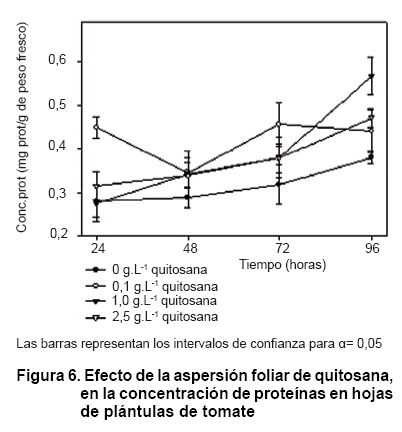
A las 24 horas solo con la aplicación de la concentración de 0,1 g.L-1 se obtuvo valores diferentes significativamente del control; sin embargo, a las 96 horas los tratamientos de 1 y 2,5 g.L-1 mostraron incrementos por encima y diferentes del control. Con anterioridad, otros autores observaron duplicaciones de los contenidos de proteínas respecto al control cuando se asperjaron plantas de tabaco con iguales concentraciones de este polímero de quitosanaA, por lo que este resultado pudiera ser una tendencia en Solanáceas.
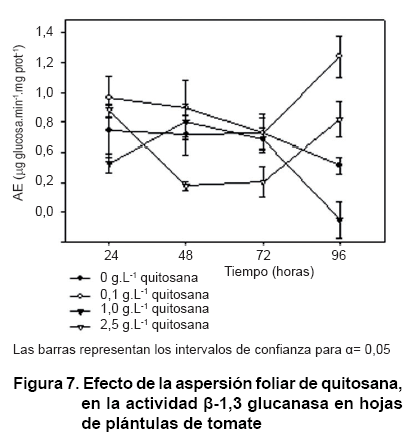
La actividad ß-1,3 glucanasa en las hojas asperjadas con quitosana fue superior que cuando se imbibieron las semillas (Figura 7). El tratamiento de 0,1 g.L-1 influyó significativamente en el aumento de la actividad de la enzima a las 96 horas. En cambio, con el empleo de las concentraciones mayores, este parámetro no superó a los valores basales de la planta que muestra el control. Resultados similares se observaron a las 72 horas de adicionar 1 y 2 g.L-1 de quitosana a la rizosfera de plántulas de tabaco, donde los niveles de ß-1,3 glucanasa se redujeron significativamente respecto al controlA.
La actividad PAL varió al aplicársele quitosana a las hojas de tomate (Figura 8). Aunque el control a las 24 horas fue superior, se observó que a las 48 horas su valor se redujo significativamente y permaneció sin variaciones estadísticas en el tiempo. La aplicación de 1,0 y 2,5 g.L-1 no modificó los niveles de actividad de la enzima en los cuatro momentos evaluados. Tampoco difirieron del control a partir de las 48 horas pero sí a las 24 en que la actividad del control fue significativamente superior. La adición de 0,1 g.L-1 en cambio, mostró un pico de actividad a las 72 horas pero este disminuyó significativamente a las 96.
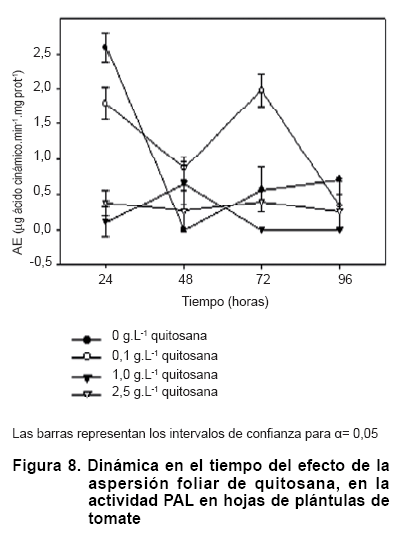
Varios trabajos informan de los aumentos de la actividad de esta enzima en especies tan diversas como trigo, tabaco o cultivo de células de coco (13, 15, 18, 40). En el caso del tabaco, se observó un notable aumento de los niveles de esta enzima a los 3, 6, 9 y 12 días de aspersión de 1 g.L-1 de quitosana en plántulas de 32 días de sembradas (18), de hecho se consideró la principal enzima vinculada a la resistencia del tabaco contra P. nicotianaeA. La importancia de esta enzima radica en ser clave en la vía de los fenilpropanoides, que intervienen en la síntesis de compuestos como el ácido clorogénico con actividad antimicrobiana, y en el reforzamiento de las paredes celulares del vegetal a través de la síntesis de lignina (41). Un nivel elevado de esta actividad en la planta, en teoría, le pudiera permitir responder con mayor fortaleza y velocidad ante la presencia de fitopatógenos.
De manera general, se comprobó que las aplicaciones de quitosana influyeron en las variables de crecimiento y las actividades enzimáticas evaluadas en las plántulas de tomate. La respuesta estuvo modulada por las concentraciones del polímero y las formas de aplicación aunque los resultados también variaron con el momento en que se hicieron las determinaciones. La concentración de 0,1 g.L-1 mostró efectos positivos sobre el crecimiento cuando se embebieron las semillas, así como en la inducción de actividades enzimáticas con las dos formas de aplicación.
Estos resultados constituyen puntos de partida para futuros trabajos donde se pueda correlacionar la propiedad elicitora de la quitosana sobre las actividades enzimáticas glucanasas y PAL, con la posible protección del tomate ante la presencia de fitopatógenos fungosos y oomycetes. Además, el producto muestra sus potencialidades al favorecer el crecimiento de las plántulas, lo que de conjunto con la inducción de resistencia a estrés biótico, sería de gran utilidad en la práctica, ya que favorecería la calidad de las posturas, paso que resulta esencial para lograr un buen rendimiento de los cultivos.
AGRADECIMIENTOS
Este trabajo ha sido realizado con el financiamiento de la Fundación Internacional para la Ciencia (IFS), a través del proyecto No. F/4446-1.
REFERENCIAS
1. van Loon, L. C.; Rep, M. y Pieterse, C. M. J. Significance of inducible defense-related proteins in infected plants. Annual Reviews of Phytopathology, 2006, vol. 44, p. 135-162.
2. Schwessinger, B. y Ronald P. Plant Innate Immunity: Perception of Conserved Microbial Signatures. Annual Review of Plant Biology, 2012, vol. 63, p. 451-82.
3. Boller, T. y Felix, G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors. Annual Review of Plant Biology, 2009, vol. 60, p. 379-406.
4. Goellner, K. y Conrath, U. Priming: it’s all the world to induced disease resistance. European Journal of Plant Pathology, 2008, vol. 121, p. 233-242.
5. Badawy, M. y Rabea, E. A. Biopolymer chitosan and its derivatives as promising antimicrobial agents against plant pathogens and their applications in crop protection. International Journal of Carbohydrate Chemistry, 2011, p. 1-29.
6. Sánchez-Domínguez, D.; Bautista-Baños, S. B. y Castillo, P. Efecto del quitosano en el desarrollo y morfología de Alternaria alternata (Fr.) Keissl. Anales de Biología, 2007, vol. 29, p. 23-32.
7. Chien, P. J.; Sheu, F. y Lin, H. R. Coating citrus (Murcott tangor) fruit with low molecular weight chitosan increases postharvest quality and shelf life. Food Chemistry, 2007, vol. 100, no. 3, p. 1160-1164.
8. Xu, J.; Zhao, X.; Han, X. y Du, Y. Antifungal activity of oligochitosan against Phytophthora capsici and other plant pathogenic fungi in vitro. Pesticide Biochemistry and Physiology, 2007, vol. 87, p. 220-228.
9. Liu, J.; Tian, S.; Meng, X. y Xu, Y. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit. Postharvest Biology and Technology, 2007, vol. 44, p. 300-306.
10. Prapagdee, B.; Kotchadat, K.; Kumsopa, A. y Visarathanonth, N. The role of chitosan in protection of soybean from sudden death syndrome caused by Fusarium solani f. sp. Glycines. Bioresource Technology, 2007, vol. 98, p. 1353-1358.
11. Palma-Guerrero, J.; Huang, I. C.; Jansson, H. B.; Salinas, J.; López-Llorca, L. V. y Read, N. D. Chitosan permeabilizes the plasma membrane and kills cells of Neurospora crassa in an energy dependent manner. Fungal Genetics and Biology, 2009, vol. 46, p. 585-594.
12. Guerra-Sánchez, M. G.; Vega-Pérez, J.; Velázquez del Valle, M. G. y Hernández-Lauzardo, A. N. Antifungal activity and release of compounds on Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. by effect of chitosan with different molecular weights. Pesticide Biochemistry and Physiology, 2009, vol. 93, p. 18-22.
13. Rodríguez, A. T.; Ramírez, M. A.; Cárdenas, R. M.; Hernández, A. N.; Velázquez, M. G. y Bautista, S. Induction of defense response of Oryza sativa L. against Pyricularia grisea (Cooke) Sacc. by treating seeds with chitosan and hydrolyzed chitosan. Pesticide Biochemistry and Physiology, 2007, vol. 89, p. 206-215.
14. Falcón, A.; Cabrera, J. C.; Costales, D.; Ramírez, M. A.; Cabrera, G.; Toledo, V. y Martínez-Téllez, M. A. The effect of size and acetylation degree of chitosan derivatives on tobacco plant protection against Phytophthora parasitica nicotianae. World Journal Microbiol. Biotechnol., 2008, vol. 24, p. 103-112.
15. Lárez, C. Algunas potencialidades de la quitina y el quitosano para usos relacionados con la agricultura en Latinoamérica. Revista UDO Agrícola, 2008, vol. 8, no. 1, p. 1-22.
16. Vander, P.; Kjell, M. V.; Domard, A.; El-Gueddari, N. E. y Moerschbacher, B. M. Comparison of the ability of partially N- acetylated chitosans and oligosaccharides to elicit resistance in wheat leaves. Plant Physiology, 1998, vol. 118, p. 1353-1359.
17. Cartaya, O.; Marrero, O.; Reynaldo, I. y Peniche, C. Adsorción de iones Cu2+ por quitosana y su aplicación al suelo para la protección de las plantas ante la toxicidad del metal. Cultivos Tropicales, 2008, vol. 29, no. 3, p. 87-91.
18. Falcón, A.; Cabrera, J. C.; Ortega, E. y Martínez-Téllez, M. A. Concentration and Physicochemical Properties of Chitosan Derivatives Determine the Induction of Defense Responses in Roots and Leaves of Tobacco (Nicotiana tabacum) Plants. American Journal of Agricultural and Biological Sciences, 2009, vol. 4, no. 3, p. 192-200.
19. Porrata-Maury, C. Consumo y preferencias alimentarias de la población cubana con 15 y más años de edad. Rev Cub. Aliment. Nutr., 2009, vol. 19, no. 1, p. 87-105.
20. Brunele, F. R.; Henriques, D. J.; Stringheta, P. C.; Rezende, P. C.; Rodrigues, G. y Chartuni, E. Quality of tomatoes grown under a protected environment and field conditions. Chile: IDESIA, 2010, vol. 28, no. 2, p. 75-82.
21. Martínez, L.; Castro, I.; Díaz, L. y Núñez, M. Influencia del tratamiento a semillas de quitosana en el crecimiento de plantas de tomate (Solanum lycopersicum L.). Cultivos Tropicales, 2007, vol. 28, no. 4, p. 79-82.
22. Terry, E. y Ruiz, J. Evaluación de bioproductos para la producción de tomate (Solanum lycopersicum, Mill) bajo sistema de cultivo protegido. Cultivos Tropicales, 2008, vol. 29, no. 3, p. 11-15.
23. Ruiz, J.; Terry, E.; Tejeda, T. y Díaz, M. Aplicación de bioproductos a la producción ecológica de tomate. Cultivos Tropicales, 2009, vol. 30, no. 3, p. 60-64.
24. Sun, S. M. Methods in plant molecular biology and agricultural biotechnology: A laboratory training manual. Taiwan: ROC, Asian Research and Development Center. 1994, 94 p.
25. Somogyi, M. Notes on sugar determination. J. Biol. Chem.,1952, vol. 195, p. 19-23.
26. El Ghaouth, A.; Ponnampalam, R. y Boulet, M. Chitosan coating effect on storability and quality of fresh strawberries. Journal of Food Science, 1991, vol. 56, p. 1618-1621.
27. Badawy, M. y Rabea, E. Potential of the biopolymer chitosan with different molecular weights to control postharvest gray mold of tomato fruit. Postharvest Biology and Technology, 2009, vol. 51, no. 1, p. 110-117.
28. El Hadrami, A.; Adam, L. R.; El Hadrami, I. y Daayf, F. Chitosan in Plant Protection. Marine Drugs, 2010, vol. 8, p. 968-987.
29. Sharathchandra, R. G.; Raj, S. N.; Shetty, N. P.; Amruthesh, K. N. y Shetty, H. S. A Chitosan formulation ElexaTM induces downy mildew disease resistance and growth promotion in pearl millet. Crop Protection, 2004, vol. 23, p. 881-888.
30. Guan, Y. J.; Hu, J.; Wang, X. J. y Shao, C. X. Seed priming with chitosan improves maize germination and seedling growth in relation to physiological changes under low temperature stress. J. Zhejiang Univ. Sci., 2009, vol. 10, p. 427-433.
31. Photchanacha, S.; Singkaew, J. y Thamthong, J. Effects of chitosan seed treatment on Colletotrichum sp. and seedling growth of chili cv. ‘Jinda’. Acta Horticulturae, 2006, vol. 712, p. 585-588.
32. van Hulten, M.; Pelser, M.; van Loon, L. C.; Pieterse, C. M. J. y Ton, J. Costs and benefits of priming for defense in Arabidopsis. PNAS, 2006, vol. 103, no. 14, p. 5602-5607.
33. Nge, K. L.; New, N.; Chandrkrachang, S. y Stevens, W. F. Chitosan as a growth stimulator in orchid tissue culture. Plant Science, 2006, vol. 170, p. 1185-1190.
34. Benhamou, N. y Thériault, G. Treatment with chitosan enhances resistance of tomato plants to the crown and root pathogen Fusarium oxysporum F. sp. Radicis–lycopersici. Physiological and Molecular Plant Pathology, 1992, vol. 41, p. 34-52.
35. Pen, L. T. y Jiang, Y. M. Effects of chitosan coating on shelf life and quality of fresh-cut chinese water chestnut. Lebensm. Wiss. U. Technol., 2003, vol. 36, p. 359-364.
36. Shibuya, N. y Minami, E. Oligosaccharide signalling for defence responses in plant. Physiological and Molecular Plant Pathology, 2001, vol. 59, p. 223-233.
37. Funnell, D. L.; Lawrence, C. B.; Pedersen, J. F. y Schardl, C. L. Expression of the tobacco ß-1,3-glucanase glucanase gene, PR-2d, following induction of SAR with Peronospora tabacina. Physiol. Mol. Plant Pathol., 2004, vol. 65, p. 285-296.
38. Falcón-Rodríguez, A. B.; Costales, D.; Ortega, E.; León, O.; Cabrera, J. C. y Martínez, M. A. Evaluation of chitosan as an inhibitor of soil-borne pathogens and as an elicitor of defence markers and resistance in tobacco plants. Spanish Journal of Agricultural Research, 2007, vol. 5, no. 4, p. 533-541.
39. Way, H. M.; Kazan, K.; Mitter, N.; Goulter, K. C.; Birch, R. G. y Manners, J. M. Constitutive expression of a phenylalanine ammonia-lyase gene from Stylosanthes humilis in transgenic tobacco leads to enhanced disease resistance but impaired plant growth. Physiol. Mol. Plant Pathol., 2002, vol. 60, p. 275-282.
40. Chakraborty, M.; Karun, A. y Mitra, A. Accumulation of phenyilpropanoid derivatives in chitosan-induced cell suspension culture of Cocos nucifera. Journal of Plant Physiology, 2009, vol. 166, p. 63-71.
41. Umezawa, T. The cinnamate/monolignol pathway. Phytochemistry Reviews, 2010, vol. 9, no. 1, p. 1-17.
Recibido: 19 de septiembre de 2012
Aceptado: 28 de enero de 2013
Dianevys González Peña, Aspirante Investigador del departamento de Fisiología y Bioquímica Vegetal. Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32700, Cuba. Email: dianevys@inca.edu.cu














