Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.35 no.2 La Habana abr.--jun. 2014
Variaciones en la respuesta de indicadores defensivos y en el contenido de componentes del metabolismo primario en plántulas de tabaco (Nicotiana tabacum, L.) aplicadas con quitosana
Variations in the response of defensive markers and in the contents of primary metabolism components in tobacco (Nicotiana tabacum, L.) seedlings applied with chitosan
M.Sc. Daimy Costales Menéndez,I Trudy Ann Gordon,III Dr.C. Alejandro B. Falcón RodríguezII
IInvestigador Agregado del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700.
IIInvestigador Auxiliar del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700.
IIIUniversidad Agraria de La Habana (UNAH). Autopista Nacional y carretera de Tapaste, San José de las Lajas, Mayabeque, Cuba.
RESUMEN
Plántulas de tabaco de 25 días de sembradas (dds), variedad Criollo 98, fueron tratadas mediante adición a la rizosfera con un polímero de quitosana, a diferentes concentraciones: 0, 0,1, 1, 2,5 y 10 g.L-1. A los 30 dds se determinaron los contenidos de proteínas y carbohidratos reductores solubles y la actividad de indicadores defensivos (fenilalanina amonio liasa (PAL), EC 4.3.1.5 y ß 1-3 glucanasa, EC 3.2.1.6) en hojas, mientras que la actividad de la enzima nitrato reductasa (EC 1.6.6.1) se determinó a los 30, 37 y 44 dds. El polímero de quitosana causó estimulación e inhibición de las variables determinadas, en dependencia de las concentraciones ensayadas. El polímero no provocó variaciones significativas en el contenido de proteínas solubles, excepto para la concentración de 0,1 g.L-1; mientras que sí afectó el contenido de carbohidratos reductores, causando importantes reducciones de los niveles de este, principalmente con las concentraciones 1 y 2,5 g.L-1 del compuesto. Igual fue reducida la actividad de la enzima nitrato reductasa con las mismas concentraciones intermedias del polímero a los 30 y 37 dds. Las concentraciones de 0,1 y 10 g.L-1 del polímero incrementaron la actividad PAL, mientras que con la concentración de 2,5 g.L-1 se obtuvo la máxima actividad ß 1-3 glucanasa, aunque todas las concentraciones evaluadas aumentaron la actividad del control. Los resultados demuestran que la actividad defensiva inducida en plantas de tabaco por quitosana, afecta los contenidos de compuestos y la actividad enzimática relacionada con el metabolismo primario y esta afectación depende de las concentraciones empleadas del polímero, así como del indicador evaluado.
Palabras clave: tabaco, quitosana, proteínas, carbohidratos, respuestas enzimáticas.
ABSTRACT
Twenty five days old tobacco plants (Criollo 98) were treated with different concentrations (0, 0,1, 0,5, 1, 2,5 g.L-1) of a chitosan polymer by soil drench to the rhizosphere. At 30 days soluble protein and reducing sugar contents were determined in plant leaves, as well as, defense enzymatic markers (Phenylalanine ammonia liase (PAL), EC 4.3.1.5 and ß 1-3 glucanase, EC 3.2.1.6). In addition, enzymatic activity of nitrate reductase (EC 1.6.6.1) was detected at 30, 37 and 44 days after planting. Treatments with chitosan polymer did not cause significant changes in soluble protein contents in tobacco leaves, excepted for the lowest concentration tested, while all chitosan treatments affected the reducing sugar contents, by decreasing it, mainly with the two intermediated concentrations. These two treatments also caused significant reductions of nitrate reductase enzymatic activity, regarding to control activity, at 30 and 37 days after planting. In turn, defensive markers evaluated were induced above control, depending on concentration tested. PAL activity was increased above control with the lowest and the highest chitosan concentration employed (0.1 y 10 g.L-1), while ß 1-3 glucanase was significant activated with all chitosan treatments tested, causing 2,5 g.L-1 the maximum activity found. All results showed that defense induced in tobacco plants by chitosan, affected compound contents and enzymatic activity related to the primary metabolism and this influence depends on the concentration of the polymer tested, as well as the marker evaluated.
Key words: tobacco, chitosan, proteins, carbohydrates, enzymatic responses.
INTRODUCCIÓN
La quitina es el segundo polímero natural de mayor abundancia después de la celulosa y forma parte de la pared celular de los hongos y del exoesqueleto de los artrópodos, este último grupo es su principal fuente de obtención a escala mundial. Su abundancia permanente en la biosfera se estima en alrededor de 10 giga toneladas anuales (1 x 1013 kg). Una gran parte de la producción mundial de quitina, polímero lineal de N-acetil glucosamina, se realiza a partir del exoesqueleto de cangrejo y camarón, siendo muy escasa su producción a partir del exoesqueleto de langosta (1, 2).
La quitosana, principal derivado de la quitina, es un polímero lineal de glucosaminas parcialmente acetiladas y unidas por enlaces ß 1-4. Se obtiene por desacetilación alcalina de la quitina, proceso que produce un polímero soluble en ácidos diluidos, lo cual, es una de las principales ventajas de este compuesto para su uso en la agricultura, respecto a la quitina. En esta rama, la quitosana y sus derivados de menor masa molar (también llamados de conjunto quitosacáridos) (2), pueden tener una amplia aplicación a partir de las potencialidades biológicas que se le han demostrado a estos compuestos, como son, una importante actividad antimicrobiana sobre el crecimiento y desarrollo de hongos, bacterias y oomycetes (3, 4, 5), la protección de plantas contra patógenos potenciales (4, 5, 6) y la promoción del crecimiento y desarrollo de varios cultivosA (7, 8, 9).
En la última década varios autores han informado de la protección del tabaco (Nicotiana tabacum, L.) contra algunos de sus patógenos potenciales mediante la aplicación de quitosanas y por activación de respuestas defensivas que le confieren resistencia a las plantas contra dichos patógenos (10, 11, 12). En específico la inducción de actividades ß 1-3 glucanasa y PAL se encuentra directamente ligada a la protección contra el oomycete Phytophthora nicotianae (12, 13).
Recientemente se informó la inducción de resistencia en tabaco contra Phytophthora nicotianae como resultado de aplicaciones de quitosana. En el trabajo se demostró que el incremento local y sistémico de la actividad PAL y ß 1-3 glucanasa tenía una estrecha relación con la reducción de la infección de plántulas de tabaco por P. nicotianae, por lo que estas enzimas pueden constituir indicadores de resistencia sistémica inducida en dicha planta. Estos indicadores pueden ser inducidos por quitosacáridos en esta planta, previo y en ausencia de la infección patogénica (12,14).
Tomando en cuenta que se ha informado que la acción elicitora de diversos compuestos puede causar reducción de precursores y energía del metabolismo primario y afectar los procesos de crecimiento y desarrollo de las plantas (15), resulta de interés conocer, si los quitosacáridos inductores de resistencia en tabaco tienen algún efecto sobre componentes del metabolismo primario durante el proceso de inducción defensiva.
Por lo anterior, este trabajo es un primer acercamiento al problema científico planteado y el objetivo es conocer el efecto que ejerce la aplicación de un polímero de quitosana al sustrato de crecimiento de plántulas de tabaco, en la activación de indicadores defensivos y de algunos componentes del metabolismo primario de las plántulas.
MATERIALES Y MÉTODOS
Obtención del polímero y preparación de las disoluciones de quitosana
A partir del polímero con masa molar de 1,35 x 105 g.mol-1 y un grado de N-acetilación del 12 % que se obtuvo mediante desacetilación básica (NaOH) de quitina de langosta cubana, de calidad farmacéutica, por el Grupo de Productos Bioactivos del Instituto Nacional de Ciencias Agrícolas (16), se preparó una disolución madre al 1 % con el siguiente procedimiento. Se disolvió el polímero en ácido acético al 1 % con agitación y se ajustó el pH de la disolución con hidróxido de potasio (2 mol.L-1) hasta pH 5,5, completándose con agua destilada hasta el volumen correspondiente. Como control de los experimentos biológicos se preparó una disolución de ácido acético neutralizado con hidróxido de potasio, a partir de ácido acético (1 %) con similar procedimiento de ajuste de pH. Tanto la disolución madre de quitosana como la disolución control se diluyeron con agua destilada hasta las concentraciones deseadas en cada experimento.
Condiciones de crecimiento de las plántulas y experimentación
Semillas de tabaco (Nicotiana tabacum, L.), variedad Criollo 98, se sembraron en cepellones conteniendo suelo Ferralítico Rojo mezclado con cachaza, turba ácida y turba rubia en proporción 2:4:2:0,5 (v:v), respectivamente a pH 6,0, sustrato utilizado con éxito para el crecimiento del tabaco en trabajos anteriores (11). Las plántulas se crecieron en condiciones semicontroladas con iluminación artificial (16 horas de luz/ocho horas de oscuridad) y temperatura diurna de 25/20ºC nocturna. Se realizaron riegos diarios a los cepellones para garantizar una adecuada humedad en el sustrato y un buen crecimiento de las plantas.
A la rizosfera de las plántulas de tabaco, con 25 días de sembradas (dds) se le adicionaron disoluciones contentivas del polímero de quitosana a distintas concentraciones: 0,1, 1, 2,5 y 10 g.L-1 a razón de 1 mL por cm2 de suelo. A partir de extractos de hojas verdaderas de tabaco, se conformaron tres muestras de tres plántulas por tratamiento que se les determinó, a los 30 dds, el contenido de proteínas y de carbohidratos solubles reductores, así como los indicadores defensivos ß 1-3 glucanasa, fenilalanina-amonio liasa (PAL) y la actividad nitrato reductasa a los 30, 37 y 44 dds.
Los extractos de los diferentes tratamientos se hicieron a partir de hojas de tabaco que fueron maceradas con nitrógeno líquido en morteros de porcelana. El material pulverizado se homogenizó en solución de acetato de sodio 0,05 mol.L-1 pH 5,2 + cloruro de sodio 1 mol.L-1 + EDTA 0,005 mol.L-1 + ß-Mercaptoetanol 0,005 mol.L-1, a razón de 1,5 mL por gramo de hojas. Cada extracto se centrifugó por 15 minutos a 12000 g en frío, se descartó el precipitado y se centrifugó nuevamente por cinco minutos. Seguidamente se colectó el sobrenadante y se guardó por debajo de 0ºC hasta las determinaciones realizadas.
La concentración de proteínas se realizó siguiendo una metodología micro Lowry descrita por Sun (17) y fue expresada en mg de proteínas por gramo de tejido vegetal fresco. Se usó albúmina de suero bovino como estándar; mientras que el contenido de carbohidratos solubles reductores fue determinado por el método colorimétrico de Somogyi (18) y los resultados se expresaron como µg de glucosa gramo de tejido fresco-1, a partir de una curva de azúcares reductores sobre un patrón de glucosa.
Para la determinación de actividad ß 1-3 glucanasa se siguió una metodología previamente descrita (19). En el ensayo se cuantificó la liberación de azúcares reductores a partir de laminarina (Sigma) por acción de las enzimas del extracto. El total de azúcares reductores liberado en el ensayo fue determinado por el método colorimétrico de Somogyi (18) y los resultados se expresaron como actividad específica (µg de glucosa.min-1.mg proteína-1), a partir de una curva de azúcares reductores realizada con un patrón de glucosa.
La actividad fenilalanina-amonio liasa (PAL) fue determinada según una metodología descrita (19). Se cuantificó la formación de ácido trans-cinámico por acción de las enzimas PAL presentes en el extracto usando L-fenilalalina como sustrato (Sigma). La actividad enzimática fue expresada como actividad específica (µg ácido trans-cinámico.min-1.mg proteína-1), a partir de una curva de ácido trans-cinámico leída a 290 nm.
La determinación de la actividad nitrato reductasa se ejecutó según un método descrito con anterioridad usando el a naftil etilendiamino dihidroclórico como sustrato (19). A la mezcla resultante se le determinó la absorbancia a 540 nm. La actividad enzimática se expresó como nmoles de NO2 formados por minuto por gramos de tejido.
Análisis estadístico de las determinaciones metabólicas y enzimáticas
El experimento se repitió dos veces y se utilizó un diseño completamente aleatorizado. Los datos resultantes se sometieron a la verificación de las premisas del ANOVA antes de realizar un análisis de varianza de clasificación simple a cuatro réplicas por tratamiento. Las medias resultantes se compararon con la prueba de Duncan para p≤0,05 en el programa Statgraphics, versión 5.0 (Statistical Graphics Corporation, 2000).
RESULTADOS Y DISCUSIÓN
La adición de las soluciones de quitosana a la rizosfera de las plantas de tabaco no causó cambios significativos en el contenido de proteínas solubles a los cinco días de aplicados los tratamientos (30 dds), excepto para la concentración más baja (0,1 g.L-1) utilizada del quitosacárido, que redujo en un 16 % los niveles de proteína detectados en las hojas de las plantas control (Figura 1). A diferencia de lo anterior, el comportamiento en los niveles de carbohidratos reductores en las mismas plantas fue afectado sensiblemente en relación con el control y demostrando diferencias entre los tratamientos de quitosana en dependencia de las concentraciones utilizadas (Figura 2). Todos los tratamientos del quitosacárido causaron reducciones significativas que estuvieron entre el 50 y el 90 % de los valores del tratamiento control, lo que indica un importante efecto del polímero en este indicador. Las mayores reducciones ocurrieron con las concentraciones intermedias (1 y 2,5 g.L-1) mientras que la concentración más alta fue la que menos reducción causó (50 %) con respecto a los contenidos de carbohidratos reductores en el tratamiento control.
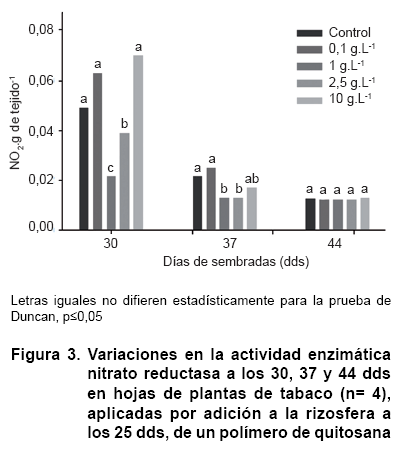
La determinación del efecto del quitosacárido sobre la actividad de la enzima nitrato reductasa se realizó en tres momentos dentro de un período de dos semanas posteriores a la aplicación de las soluciones de quitosana, ya que este indicador nunca ha sido investigado como resultado de la aplicación de estos polímeros. Los resultados demostraron una reducción de la actividad enzimática en los dos primeros momentos determinados (30 y 37 dds) para las concentraciones de 1 y 2,5 g.L-1 (Figura 3), mientras que las concentraciones 0,1 y 10 g.L-1 no se diferenciaron del control. Por su parte, a los 44 dds las plantas no presentaron diferencias significativas entre los tratamientos y el control. Se pudo encontrar, además, diferencias para los niveles enzimáticos del control en dependencia del momento evaluado, lo que pudiera atribuirse a diferentes comportamientos de la actividad de la enzima, en general, como resultado de los distintos momentos del crecimiento de las plántulas en que se hicieron las determinaciones.
La determinación de indicadores defensivos se realizó a los 30 dds. Es conocido que la inducción de indicadores enzimáticos defensivos en plántulas completas de tabaco, tratadas con quitosacáridos, se incrementa a partir de las 48 horas, pudiendo tener valores máximos entre 72 y 120 horas transcurridas las aplicaciones (11, 12, 14), por lo que se escogió este momento para comparar con las otras determinaciones no defensivas.
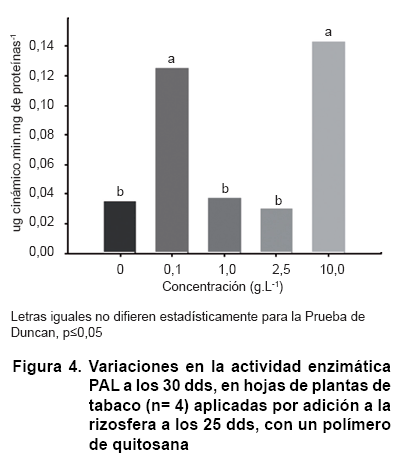
Los resultados del comportamiento de la actividad PAL en las hojas de plantas de tabaco en presencia del quitosacárido mostraron incrementos de tres y de cuatro veces los niveles del control para los tratamientos de 0,1 y 10 g.L-1 respectivamente, mientras no se obtuvieron diferencias significativas con las concentraciones intermedias y el control (Figura 4).
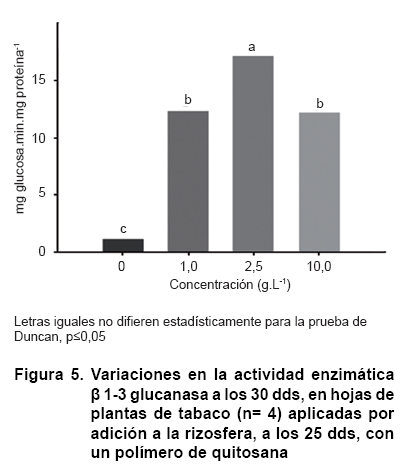
Sin embargo, el comportamiento de la actividad ß 1-3 glucanasa mostró incrementos marcados y significativos en todos los tratamientos con quitosana determinados con respecto al control, obteniéndose valores de actividad enzimática de entre 10 y 15 veces por encima del nivel del control, siendo el mayor obtenido con la concentración de 2,5 g.L-1 (Figura 5).
Se ha informado que las enzimas PAL y ß 1-3 glucanasa constituyen indicadores inducibles de resistencia basal que le confieren protección a las plantas contra sus patógenos, ya que se incrementan sus valores enzimáticos varias veces respecto a sus niveles basales, como respuesta a infecciones y como resultado de la aplicación de elicitores, siendo particularmente inducidas por quitosacáridos (20, 21). En particular, estas dos enzimas son críticas en la contención del ataque de oomycetes en el tabaco (12, 13) y se ha demostrado su activación, en ausencia de patógenos, por encima del control, cuando las plantas de tabaco son tratadas con derivados de quitosana (11, 12, 14). Por lo anterior, es posible emplearlas como indicadores de resistencia basal en este cultivo aun en ausencia de patógenos.
Los resultados de este trabajo demuestran que la aplicación de concentraciones de quitosana que causan incrementos de los indicadores enzimáticos defensivos mencionados, afectan además, variables relacionadas con el metabolismo primario de la planta en dependencia de las concentraciones evaluadas del polímero. De esta forma, todas las concentraciones empleadas redujeron principalmente los contenidos de azúcares reductores con valores varias veces por debajo del control, lo cual podría ser una indicación del desvío de precursores del metabolismo primario hacia la inducción de resistencia en la planta.
En el proceso de acumulación del nitrógeno en las plantas, la nitrato reductasa es la primera enzima que acciona la reducción del NO3- en la vía para formar el amonio que posteriormente será asimilado también enzimáticamente. Esta enzima es inducible por su sustrato y puede ser reprimida por los productos finales del propio proceso de asimilación, como son la glutamina u otros aminoácidos; sin embargo, existen otros agentes que pueden regular la actividad de la enzima como son la luz y el oxígeno como los principales externos, y la acción kinasa, fosfatasa, enzimas proteolíticas a nivel del citosol, las proteínas de unión 14-3-3 y los niveles de azúcares externos o asimilados que influyen sobre estas últimas (22).En este trabajo las concentraciones de 1 y 2,5 g.L-1 del polímero que causaron las mayores reducciones de carbohidratos reductores (90 % por debajo del control) a los cinco días de la aspersión, causaron también disminuciones significativas de la actividad nitrato reductasa respecto al control a los 5 y 12 días de aplicados los tratamientos, siendo restituida la actividad a los 19 días de la aplicación. Es posible que la disminución de ambas variables esté relacionada, ya que se ha informado del impacto del contenido de azúcares en la regulación de la actividad nitrato reductasa, incluso mayor que la regulación que puede ejercer la presencia de su sustrato (22).
De esta forma una posible reducción del contenido de carbohidratos (incluyendo azúcares reductores) hacia la formación de compuestos carbonados, relacionados con las vías defensivas, podría repercutir en la reducción de la actividad nitrato reductasa. Precisamente, las concentraciones de 1 y 2,5 g.L-1 del polímero coinciden con los mayores incrementos de la actividad ß 1-3 glucanasa (10 y 15 veces por encima de la actividad del control); sin embargo, esta hipótesis podría no soportar los resultados logrados con la concentración de 10 g.L-1 que mostró incrementos elevados en ambos indicadores defensivos y no se vio afectada la actividad nitrato reductasa. No obstante, a favor de la hipótesis, esta última concentración causó menor reducción de los azúcares reductores (aproximadamente un 50 %) que las concentraciones de 1 y 2,5 g.L-1 del polímero.
Por otra parte, en las concentraciones intermedias mencionadas (1 y 2,5 g.L-1) no hubo cambios en la actividad PAL y el comportamiento fue dependiente de la concentración. Un estudio previo de este laboratorio demostró reducciones por debajo del control o no incrementos de actividad enzimática ß 1-3 glucanasa y PAL, respectivamente, cuando se hicieron aplicaciones con las concentraciones mencionadas al sustrato de crecimiento de las plántulas (12). Si tomamos en cuenta que estas concentraciones que afectaron los incrementos de actividad PAL en este trabajo, coinciden con los menores valores del contenido de carbohidratos reductores, podría pensarse en un ajuste de la inducción defensiva por la planta en función de la baja disponibilidad de precursores, es decir, el aumento de algunas defensas y la reducción o no incremento de otras.
Al aplicar la concentración más alta de quitosana (10 g.L-1) siempre se obtuvo incremento de la actividad defensiva por encima del control, mientras que la reducción de los carbohidratos reductores respecto a este, fue menos marcada que en las concentraciones intermedias. Este resultado podría deberse a la mayor disponibilidad del polímero de quitosana en la rizosfera que facilite la absorción del nitrógeno por la planta, evento que permitiría mayor producción de compuestos carbonados en beneficio de la respuesta defensiva inducida.
Se ha informado que la aplicación de elicitores de resistencia en plantas de cultivo puede causar reducción del crecimiento y los rendimientos, dependiendo de las concentraciones, como resultado del desvío de energía y precursores del metabolismo primario hacia la inducción de resistencia en la planta (15). Hasta el momento son muy pocos los estudios de este tipo utilizando como elicitores oligosacarinas inductoras de resistencia (23, 24), en particular, recientemente se ha informado los primeros trabajos de este tipo con la aplicación de quitosana.
Existen referencias acerca de la utilización de una sola concentración (0,5 g.L-1), por debajo de algunas de las utilizadas en este trabajo (23), sin encontrar afectaciones en los rendimientos del cultivo del frijol.
El presente trabajo constituyó un primer acercamiento para conocer las posibles afectaciones sobre precursores y enzimas del metabolismo primario que pueden ejercer concentraciones elevadas de quitosana que activan resistencia inducida contra patógenos, con el objetivo adicional de poder utilizar estas variables como indicadores de afectación. Es preciso profundizar este estudio evaluando otros precursores y enzimas relacionadas con el metabolismo primario e incluso extender el estudio a experimentos que evalúen la productividad biológica y agrícola en todo el ciclo de desarrollo del cultivo. Es necesario tomar en cuenta, además, el aporte del proceso de respiración cuando se aplican quitosanas, máxime cuando se ha informado de aumentos de respiración en soya en respuesta a tratamientos con estos compuestos (25).
CONCLUSIONES
Del trabajo se puede concluir que la aplicación de determinadas dosis de quitosana en plántulas de tabaco, que causan incrementos de indicadores defensivos de la resistencia basal, también provoca afectaciones en variables del metabolismo primario relacionados con la formación de nuevos precursores, lo que podría interpretarse como una demanda energética adicional de la respuesta defensiva al metabolismo primario de la planta.
REFERENCIAS
1. Prashanth, K. V. H. y Tharanathan, R. N. Chitin/chitosan: modifications and their unlimited application potential-an overview. Trends in Food Sci. & Tech., 2007, vol. 18, p. 117-131.
2. Kim, S. K. Chitin, chitosan, oligosaccharides and their derivatives. Biological activities and applications. CRC Press: Taylor and Francis group, 2011, ISBN 978-1-4398-1603-5.
3. El Hadrami, A.; Adam, L. R.; El Hadrami, I.; Daayf, F. Chitosan in Plant Protection. Marine Druggs, 2010, vol. 8, p. 968-987.
4. Badawy, M. E. I. and Rabea, E. I. A. Biopolymer chitosan and its derivatives as promising antimicrobial agents against plant pathogens and their applications in crop protection. International Journal of Carbohydrate Chemistry. 2011, Article ID 460381, 29 p. DOI: 10. 1155/2011/460381.
5. Chaweewan Boonreung, C. and Boonlertnirun, S. Efficiency of chitosan for controlling dirty panicle disease in rice plants. ARPN Journal of Agricultural and Biological Science, 2013, vol. 8, no. 5, p. 380-384. ISBN 1990-6145.
6. Falcón-Rodríguez, A. B.; Costales-Menéndez, D.; Cabrera, J. C. y Martínez-Téllez, M. A. Chitosan physic-chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae. Pest. Biochem. Physiol., 2011, vol. 100, no. 3, p. 221-228.
7. Shehata, S. A.; Fawzy, Z. F. and El-Ramady, H. R. Response of Cucumber Plants to Foliar Application of Chitosan and Yeast under Greenhouse Conditions. Australian Journal of Basic and Applied Sciences, 2012, vol. 6, no. 4, p. 63-71.
8. Lizárraga-Paulín, E. G.; Miranda-Castro, S. P.; Moreno-Martínez, E.; Lara-Sagahón, A. V. y Torres-Pacheco, I. Maize seed coatings and seedling sprayings with chitosan and hydrogen peroxide: their influence on some phenological and biochemical behaviors. Journal of Zhejiang University SCIENCE B, 2013, vol. 14, no. 2, p. 87-96.
9. Mahdavi, Batool. Seed germination and growth responses of Isabgol (Plantago ovata Forsk) to chitosan and salinity. Intl J Agri Crop Sci., 2013. vol. 5, no. 10, p. 1084-1088.
10. Iriti, M.; Sironi, M.; Gomarasca, S.; Casazza, A. P.; Soave, C. y Faoro, F. Cell death-mediated antiviral effect of chitosan in tobacco. Plant Physiol. Biochem., 2006, vol. 44, p. 893-900.
11. Falcón, A. B.; Cabrera, J. C.; Costales, D.; Ramírez, M. A.; Cabrera, G.; Toledo, V. y Martínez-Téllez, M. A. The effect of size and acetylation degree of chitosan derivatives on tobacco plant protection against Phytophthora parasitica nicotianae. World J. Microbiol. Biotech, 2008, vol. 24, p. 103-112.
12. Falcón-Rodríguez, A. B.; Costales, D.; Cabrera, J. C. y Martínez-Téllez, M. A. Chitosan physico–chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae. Pest. Biochem. Physiol., 2011, vol. 100, p. 221-228.
13. Way, H. M.; Kazan, K.; Mitter, N.; Goulter, K. C.; Birch, R. G. y Manners, J. M. Constitutive expression of a phenylalanine ammonia-lyase gene from Stylosanthes humilis in transgenic tobacco leads to enhanced disease resistance but impaired plant growth. Physiol. Mol. Plant Pathol., 2002, vol. 60, p. 275-282.
14. Falcón-Rodríguez, A. B.; Cabrera, J. C.; Ortega, E. y Martínez-Téllez, M. A. Concentration and physicochemical properties of chitosan derivatives determine the induction of defense responses in roots and leaves of tobacco (Nicotiana tabacum) plants. Am. J. Agric. Biol. Sciences, 2009, vol. 4, p. 192-200.
15. Heil, M. y Walters, D. R. Ecological Consequences of Plant Defence Signalling. En: Van Loon, L. C. editor: Advances in Botanical Research, Burlington: Academic Press. 2009. p. 667-716. ISBN 978-0-12-374834-8.
16. Falcón-Rodríguez, A. B.; Rodríguez, A. T.; Ramírez, M. A.; Rivero, D.; Martínez, B.; Cabrera, J. C.; Costales, D.; Cruz, A.; González, L. G.; Jiménez, M. C.; Jiménez, L.; Hernández, I.; González-Peña, D. y Márquez, R. Chitosan as bioactive macromolecules to protect economically relevant crops from their main pathogens. Biotecnología Aplicada, 2010, vol. 27, p. 305-309.
17. Sun, S. M. Methods in plant molecular biology and agricultural biotechnology: A laboratory training manual, Asian Research and Development Center. Shanhua, Tainan, Taiwan (ROC), 1994, 94 p.
18. Somogyi, M. Notes on sugar determination. J. Biol. Chem., 1952, vol. 195. p. 19-23.
19. Falcón-Rodríguez, A. B.; Gordon, T. A.; Costales, D. y Martínez-Téllez, M. Á. Respuesta enzimática y de crecimiento en una variedad comercial de tabaco (Nicotiana tabacum, L.) tratada por aspersión foliar de un polímero de quitosana. Cultivos Tropicales, 2012, vol. 33, p. 65-70.
20. Garcion, C.; Lamotte, O. y Métraux, J. P. Chapter 6: Mechanism of defence to pathogens: Biochemistry and Physiology. En: Editores: Walters, D.; Newton, A.; Lyon, G.Induced resistance for plant defence. A sustainable approach to crop protection. UK: Blackwell Publishing. 2007. 109 p. ISBN 978-1-4051-3447-7.
21. Falcón-Rodríguez, A. B.; Wégria, G. y Cabrera, J. C. Exploiting plant innate immunity to protect crops against biotic stress: Chitosaccharides as natural and suitable candidates for this purpose. En: "New Perspectives in Plant Protection". In Tech. Croatia. 2012. 139 p. ISBN 979-953-307-548-7.
22. Kaiser, W. M.; Weiner, H.; Kandlbinder, A.; Bey-Tsai, C.; Rockel, P.; Sonoda, M. y Planchet, E. Modulation of nitrate reductase: some new insights. An unusual case and a potentially important side reaction. J. Exp. Bot., 2002, vol. 53, p. 875-882.
23. Iriti, M.; Giulia, C.; Sara, V.; Ilaria, M.; Soave, C.; Fico, G. y Faoro, F. Chitosan-induced ethylene-independent resistance does not reduce crop yield in bean. Biol. Control, 2010, vol. 54, p. 241-247.
24. Cabrera, J. C.; Nápoles, M. C.; Falcón-Rodríguez, A. B.; Costales, D.; Diosdado, E.; González, S.; González, L.; González, G.; Rogers, H. J.; Cabrera, G.; Wégria, G.; Onderwater, R. C. A. y Wattiez, R. Developing application for oligosaccharins in agriculture. Acta Horticulturae, 2013, no. 1009, p. 195-212.
25. Lee, Y. S.; Kim, Y.-H. y Kim, S. B. Changes in the respiration, growth and vitamin C content of soybean sprouts in response to chitosan of different molecular weights. HortScience, 2005, vol. 40, p. 1333-1335.
Recibido: 4 de marzo de 2011
Aceptado: 3 de mayo de 2013
M.Sc. Daimy Costales Menéndez, Investigador Agregado del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700. Email:daimy@inca.edu.cu