Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936versión On-line ISSN 1819-4087
cultrop vol.37 no.1 La Habana ene.-mar. 2016
Isolation and characterization of rhizobia from Crotalaria sp. in southern Ecuador
Francisco Guamán Díaz,I Roldán Torres Gutiérrez,II Kléver Granda Mora,III Dra.C. María C. Nápoles GarcíaIV
IUniversidad Nacional de Loja, La Argelia, PBX: 072546671, Loja-Ecuador.
IIProyecto Becas Prometeo, SENESCYT, Ecuador.
IIICentro de Biotecnología, Universidad Nacional de Loja, Ciudadela Guillermo Falconi, La Argelia, PBX: 072547252, Casilla Letra S, Loja-Ecuador.
IVInstituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
La presente investigación tuvo como objetivos aislar y caracterizar cepas nativas de bacterias diazotróficas y evaluar su efecto en la nodulación y el crecimiento de Crotalaria sp. Para el aislamiento se tomaron muestras de plantas de Crotalaria con presencia de nódulos en sus raíces, en diferentes condiciones agroclimáticas de la provincia de Loja, Ecuador. Se realizó una caracterización morfo-cultural, bioquímica y fisiológica de los aislados y se evaluó el efecto de cada uno de los aislados sobre las variables de nodulación, crecimiento y biomasa de Crotalaria en condiciones de invernadero. De los aislamientos realizados se obtuvieron 10 cepas con características correspondientes al orden Rhizobiales. Todos los aislados evidenciaron la capacidad de nodular la planta hospedante. Se destacaron los resultados en tres de los aislados por su mayor capacidad de nodulación y eficiencia en la inoculación de las plantas. Estos resultados constituyen un punto de partida en la obtención de inoculantes y su posible efecto sobre plantas de Crotalaria, utilizadas como fijadoras de N2 en condiciones de campo.
Palabras clave: inoculación, leguminosas, nodulación, selección.
ABSTRACT
The present investigation was aimed to isolate and characterize native diazotrophic bacteria strains and assess their effect on nodulation and growth of Crotalaria sp. For the isolation, samples were taken from Crotalaria plants with root nodules, under different agro-climatic conditions of Loja province, Ecuador. A morpho-cultural, biochemical and physiological characterization of isolates was performed, also evaluating the effect of each isolate on the nodulation, growth and biomass of Crotalaria under greenhouse conditions. From these isolates, 10 strains with Rhizobial characteristics were obtained. All of them showed the ability to nodulate host plant. Results were remarkable in three isolates, due to a higher nodulation ability and efficiency on plant inoculation. These results are a starting point to obtain inoculants and its possible effect on Crotalaria plants used as N2 fixers under field conditions.
Key words: inoculation, legumes, nodulation, selection.
INTRODUCCIÓN
El establecimiento de leguminosas eficientes en el uso de nitrógeno (N) en sistemas de producción agropecuaria, es uno de los principales objetivos, en los que se han centrado muchos investigadores para lograr la sostenibilidad y estabilidad de las producciones agrícolas (1). Estas plantas desempeñan un papel fundamental en los ecosistemas naturales, ya que son responsables de una parte sustancial del flujo global de nitrógeno atmosférico (N2) a formas asimilables (2).
Debido a su capacidad de fijar N2 en simbiosis con los rizobios, las leguminosas son excelentes colonizadoras de ambientes pobres en este elementoA. Dentro de las leguminosas, el género Crotalaria reviste vital importancia, por su utilización como abono verde en sistemas agrícolas sostenibles en regiones tropicales y subtropicales (3, 4). Su aporte no solo se evidencia por las altas cantidades de N fijado (300-350 kg N ha-1 año-1) y el consecuente efecto sobre el crecimiento de las plantas que se benefician por la incorporación de este abono verde, sino a la vez por la eliminación de nematodos, su alta tolerancia a la sequía, ser hospederas de varios géneros de insectos benéficos y sus propiedades antioxidantes demostradas recientemente (5, 6).
El grado en que un cultivo se puede beneficiar del aporte de N por las leguminosas depende de la cantidad de N biológicamente fijado, el cual se incorpora en el sistema por la asociación simbiótica que establecen con los rizobios. Se calcula que esta simbiosis alcanza el 20 % de la cantidad total del N, fijada anualmente sobre el planeta (7). Esta asociación determina la proporción de N residual que queda para el cultivo siguiente y su eficiencia de utilización (8). Las evidencias ponen de manifiesto la importancia de lograr relaciones simbióticas eficientes entre las especies vegetales y los microsimbiontes afines.
Para lograr un aislamiento efectivo de cepas nativas de rizobios, se recomienda realizar la extracción directa de nódulos de las plantas en estudio, ya que se puede obtener un aislado de altas proporciones y claramente compatible con esa planta (9). En Ecuador son muy escasos los estudios dedicados a las poblaciones microbianas diazotróficas asociadas a la leguminosa Crotalaria. Las zonas estacionalmente secas de la provincia de Loja, al sur del país, se caracterizan por la baja fertilidad de los suelosB, lo cual incide en la disminución de los rendimientos agrícolas de varios cultivos de importancia económica.
Resulta interesante estudiar y utilizar el beneficio de la interacción rizobio-Crotalaria, por lo que se hace imprescindible el estudio de la microbiota diazotrófica simbiótica asociada a este cultivo y su efecto sobre la planta hospedera. De esta forma, los objetivos de esta investigación estuvieron encaminados a aislar y caracterizar cepas nativas de rizobios a partir de plantas de Crotalaria sp., así como evaluar su efecto en la nodulación y el crecimiento de esta leguminosa.
MATERIALES Y MÉTODOS
Toma de muestras y aislamiento de bacterias diazotróficas simbióticas
La toma de muestras se realizó en el Cantón Paltas de la provincia de Loja, Ecuador. Se muestrearon seis comunidades, según sus pisos de altitud, las cuales fueron geoposicionadas con la utilización del Sistema de Posicionamiento Global (GPS) por sus siglas en inglés. La Tabla I muestra el geoposicionamiento de los sitios de colecta, donde se observa que de las áreas muestreadas el 66,7 % pertenece al piso altitudinal de 1200 a 1700 m s. n. m. (piso 1) y el 33,3 % pertenece al piso altitudinal de 2000 a 2200 m s. n. m. (piso 2).
Se colectaron plantas de Crotalaria sp. que crecían silvestres con presencia de nódulos en sus raíces. Con el uso de un pico se extrajeron las plantas sin dejar raíces y se depositaron en bolsas Ziplog con adecuada humedad. Las muestras se trasladaron al Laboratorio de Microbiología del Centro de Biotecnología en la Universidad Nacional de Loja, para la realización de los aislamientos.
Para el aislamiento de los microsimbiontes se tomaron de 15 a 20 nódulos, ubicados en la raíz principal, por cada zona de muestreo, los cuales se separaron cuidadosamente de las raíces y se lavaron con agua común, para eliminar los restos de suelo. Posteriormente, los nódulos se desinfectaron superficialmente mediante la inmersión en etanol (70 %, v/v) durante un minuto y se enjuagaron otras tres veces con agua destilada estéril, para eliminar la residualidad del alcohol. Se añadió entonces hipoclorito de sodio (NaOCl, 3 %, v/v) durante tres minutos y estos se lavaron con abundante agua destilada estéril. Luego del lavado, se realizó la maceración de los nódulos en microtubos de 2 mL conteniendo 300 µL de agua destilada estéril.
Se procedió a realizar la siembra del contenido de los nódulos mediante el método de agotamiento por estrías en placas Petri con medio Levadura Manitol Agar (LMA) (10). Las placas se incubaron a 30 °C durante siete días. Los aislados crecidos se purificaron en medio de cultivo LMA más Rojo Congo mediante estriado. La conservación se realizó en tubos de cultivos conteniendo medio LMA en plano inclinado, a la temperatura de 4 °C y en glicerol (50 % v/v) a -80 °C.
Caracterización morfológica, bioquímica y fisiológica de los aislados
Se estudió la morfología de las colonias obtenidas mediante microscopía estereoscópica, evaluándose las principales características: forma, color, mucosidad, bordes y elevación de las colonias. Además, se evaluó la tasa de crecimiento en este medio, mediante el monitoreo a partir de las 24 horas de incubación y la morfología de las células, así como la respuesta a la tinción de Gram con la utilización de microscopía óptica (Olympus ID 81617, Alemania).
Los ensayos bioquímicos se realizaron para evaluar la capacidad de los aislados de fermentar los azúcares glucosa y lactosa, mediante el crecimiento en medio Agar Kligler y Agar Mac Conkey y Peptona Glucosa Agar (PGA), incubados durante 48 horas a 28 °C (11), así como la presencia de catalasa, empleando peróxido de hidrógeno al 3 % (12). La producción de ácido o base se determinó mediante la siembra por agotamiento en medio YEM a pH 6,8, con adición del indicador azul de bromotimol (0,5 % en NaOH 0,016N) y a pH 5,5 con púrpura de bromocresol, en igual concentración. Los cultivos se incubaron a 30 °C durante siete días. A partir de esta fecha se observó el cambio de coloración en el medio (12). Finalmente, se determinó el crecimiento de las cepas a diferentes concentraciones de NaCl (0,1; 1 y 2 %), niveles de pH (4,0; 5,0; 6,8 y 9,0) y temperaturas (10, 35 y 40 °C).
Efecto de la inoculación sobre plantas de Crotalaria
Se realizó un ensayo en condiciones de invernadero, para comprobar que los aislados en estudio eran capaces de formar nódulos en plantas de Crotalaria y analizar la efectividad de cada uno de ellos sobre esta variable, así como otras de crecimiento y biomasa. Las semillas de Crotalaria se sumergieron en agua hirviendo durante 10 segundos para su escarificación y eliminación de agentes contaminantes (13). Posteriormente, fueron germinadas en placas Petri, conteniendo agar-agua (1,5 %) e incubadas a 28 °C durante siete días.
El inóculo bacteriano se obtuvo mediante el crecimiento de todos los aislados en medio Levadura Manitol (LM) durante 24 horas a 30 °C en zaranda orbital (Techine TS1500, USA) a 250 rpm. Se midió la densidad óptica de cada cultivo por espectrofotometría UV/VIS a 595 nm (JenWay 6505 UV/VIS, UK), para estandarizar la concentración celular a 108 UFC (Unidades Formadoras de Colonias) mL-1.
La mezcla de sustrato (tierra, arena y turba, 2:1:1) fue previamente sometida a esterilización mediante tindalización por dos horas durante tres días consecutivos. Luego se colocó 1 kg de este sustrato estéril en macetas de plástico. Se regó cada maceta con agua destilada, hasta alcanzar una humedad correspondiente a la capacidad de campo. Con el uso de una pinza se realizaron los hoyos, en los cuales se depositaron cuidadosamente dos semillas pregerminadas, que se ralearon posteriormente para dejar una planta por maceta. Las semillas se inocularon con 1 mL de cada aislado, según cada tratamiento.
El experimento constó de 12 tratamientos: 10 aislados inoculados, un tratamiento no inoculado pero fertilizado con N a razón de 60 kg ha-1 y un tratamiento sin ninguna aplicación (control).
Las plantas fueron regadas con agua destilada cada dos días al inicio y luego tres veces por semana, durante todo el ensayo.
Evaluaciones y análisis estadístico
Para el estudio morfológico, bioquímico y fisiológico, se realizaron ensayos por duplicado de cada uno de los aislados.
En el ensayo de inoculación se utilizó un diseño experimental completamente aleatorizado, con 10 réplicas por cada tratamiento. A los 75 días posteriores a la siembra, se evaluaron el número de nódulos totales; la altura de las plantas (cm); el número de hojas; el peso fresco y seco del follaje y de la raíz (mg). Para la determinación del peso seco, las plantas se secaron en estufa a 70 °C durante 72 h.
Los datos obtenidos se analizaron mediante el paquete estadístico STATGRAPHICS v. 15 (14). Se analizó la normalidad de los datos para la utilización del estadístico Análisis de Varianza Simple (One-Way ANOVA) y la prueba de Tuckey HSD con nivel de significación P<0,05.
RESULTADOS Y DISCUSIÓN
Muestreos de Crotalaria y obtención de bacterias diazotróficas simbióticas
De los muestreos realizados se logró obtener plantas de Crotalaria noduladas en las localidades de San Fernando, Palomontón, Chapango, Guinuma, Copasombrero y Puritaca.
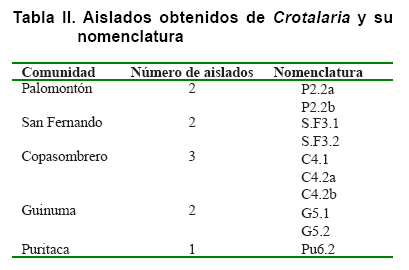
Del aislamiento de los microsimbiontes, a partir de los nódulos extraídos, se obtuvieron 19 colonias bacterianas diferentes. Luego del proceso de purificación en medio LMA con la adición de Rojo Congo (LMA-RC), el número de aislados se redujo a 10, que cumplieron con los criterios elegibles para clasificarlos dentro del grupo de los rizobios, los cuales fueron nombrados como se muestra en la Tabla II.
Caracterización morfológica, bioquímica y fisiológica de los aislados
En la Tabla III se observan las características morfológicas de los 10 aislados obtenidos posterior a la purificación. Se aprecia que no existe una alta variabilidad entre estos, según los parámetros evaluados; sin embargo, respecto al crecimiento, la producción de mucus (polisacáridos extracelulares) y elevación de las colonias, se evidencian las diferencias entre aislados de la misma localidad. Los aislados obtenidos en las localidades Copasombrero, San Fernando y Palomontón son un ejemplo de lo antes descrito, donde se destaca el crecimiento del aislado C4.2a como abundante, mientras que C4.2b es moderado y C4.1 es ligero. Similares resultados se obtienen en la producción de mucus y elevación de las colonias. Estos resultados ponen de manifiesto que no todos los aislados microbianos de la misma localidad y el mismo hospedero presentan iguales características morfológicas. En este sentido, otros autores reportan la variabilidad de características morfológicas de aislados de Rhizobium del cultivo de frijol común (Phaseolus vulgaris) en las provincias centrales de CubaC.
Al analizar el crecimiento de las colonias se observa que tres aislados (27 %) tuvieron un crecimiento abundante, seis un crecimiento moderado (55 %) y dos un crecimiento ligero (18 %), obteniéndose un 82 % de estos entre las categorías de abundante y moderado; sin embargo, todos tuvieron un crecimiento rápido, entre las 24 y 48 horas, coincidiendo con los resultados de otros trabajos, los cuales aislaron rizobios de crecimiento rápido a partir de Crotalaria juncea, Crotalaria labumifolia, Crotalaria retusa y Crotalaria verrucosa (15).
La presencia de colonias con bordes regulares y un color opaco, así como la observación al microscopio óptico que mostró en todos los casos bacilos cortos Gram negativos, muestran características similares a las obtenidas por otros autores para bacterias pertenecientes al grupo de los rizobios (16).
En la Tabla IV se muestran los resultados de las pruebas bioquímicas, donde se observa que los aislados cambiaron la coloración verde del medio LMA + bromotimol azul y el color azul del medio LMA + púrpura de bromocresol a amarillo, lo que indica que son productores de ácido y, por tanto, posibles miembros de la familia Rhizobiaceae. Estos resultados coinciden con otras investigaciones realizadas en cultivos similares, donde se determinó la capacidad de producción de ácidos o bases por cepas pertenecientes a los géneros Rhizobium y Bradyrhizobium, respectivamente (17, 18).
Ninguno de los aislados fermentó la lactosa; no obstante, C4.1, P2.2a y P2.2b si la fermentaron. Resultados de otros estudios demuestran que varios aislados obtenidos de Pueraria phaseoloides (kudzú tropical) lograron fermentar estos dos azúcares (19). Sin embargo, se conoce que ni la glucosa ni la lactosa son fuentes de carbono preferidas por los rizobios (9). Todos los aislados fueron positivos a la catalasa, liberando oxígeno en forma de burbujas al reaccionar con el peróxido de hidrógeno. Este comportamiento es típico de este grupo de bacterias (17, 20).
Dilucidar los parámetros fisiológicos evaluados en los aislados obtenidos es de vital importancia, ya que estos se encuentran en estrecha relación con indicadores que pueden tener los suelos, donde pudieran aplicarse como biofertilizantes. La Tabla V muestra las características fisiológicas relacionadas con la tolerancia de los aislados a tres concentraciones de NaCl, tres niveles de pH y tres temperaturas.
Los 10 aislados crecieron adecuadamente en las tres concentraciones de NaCl y todos estuvieron enmarcados en las categorías de crecimiento moderado y abundante. La tolerancia a la salinidad es uno de los aspectos en discusión respecto al crecimiento de los rizobios.
Resultados de otros autores en habichuela roja no muestran crecimiento de ningún aislado al 2 % de esta salD, mientras que algunos encontraron que del total de aislamientos realizados en frijol caupí, el 21 % no lograron crecer a ninguna concentración de NaCl, el 15 % solo toleraron el 1 % y el 38 % tuvieron la capacidad de crecer en un 3 % (17).
A valores de pH ácido (4 y 5) no crecieron G5.1 ni C4.2a. Estos aislados solo toleraron el pH alcalino. Se destaca que la cepa G5.1 se aisló de un suelo con pH 5,97 (datos no mostrados); que aunque es ácido, es algo superior al valor probado en placas de 5. Por su parte, P2.2a, Pu6.2 y SF3.2 no crecieron en el valor 4, pero sí en pH 5. Los 10 aislados crecieron abundantemente a pH 9, lo que significa que toleran bien la alcalinidad y es lógico, teniendo en cuenta que son productores de ácido (20). De forma general, los aislados C4.1, S.F3.1, P2.2b y C4.2b toleraron los tres niveles de pH estudiados. Está bien documentado que el pH óptimo para el crecimiento de los rizobios está en torno a la neutralidad (6), aunque algunas cepas pueden crecer entre 6 y 8 (19). Otros trabajos refieren tolerancia a valores de pH más ácidosD. Algunas veces se ha encontrado correlación entre el pH del suelo del que se aíslan las cepas y la tolerancia al pH en medio de cultivo, como es el caso de aislados de P. vulgarisD o de P. phaseoloidesE.
Al analizar el crecimiento a diferentes temperaturas, se pudo apreciar que a 10 °C no creció ninguno de los aislados. Tampoco a 40 °C crecieron P2.2a, C4.2a, ni SF 3.2, lo que quiere decir que estos aislados no toleraron las temperaturas extremas. Se plantea que en climas templados, temperaturas por encima de 37 °C permiten establecer diferencias entre algunas especies del género Rhizobium (21).
La temperatura óptima de crecimiento de los rizobios es a 28-30 °C (22), de ahí que casi todos los aislados de Crotalaria presentaron un crecimiento abundante a temperatura de 35 °C. Según otros informes, existe tolerancia de algunas cepas de Rhizobium, tal como R. tropici, para crecer a diferentes rangos de temperaturas, pero ninguno de ellos soportan condiciones de psicrofilia o termofilia (23).
Efecto de la inoculación sobre plantas de Crotalaria
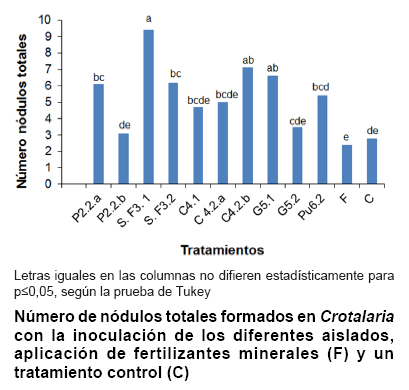
La prueba definitiva para demostrar que los aislamientos realizados corresponden a simbiontes de Crotalaria, consiste en poner en contacto ambos organismos y observar la aparición de nódulos, siempre que existan las condiciones mínimas para la interacción. En la figura se presenta la nodulación de los 10 aislados sobre plantas de Crotalaria en condiciones de invernadero. Todos los aislados fueron capaces de formar nódulos efectivos sobre las raíces, lo que indica su autenticidad como microsimbionte de esta especie vegetal.
Se detectó la presencia de nódulos en los tratamientos fertilizados y sin inocular, que aunque inferiores a cinco de los tratamientos inoculados, no mostraron diferencias con las cepas P2.2b, C4.1, C4.2a ni G5.2.
Aunque se esterilizó el soporte empleado en este ensayo, el método de tindalización no garantiza una esterilidad tan efectiva como la autoclave, pues este método no combina cambios de temperatura y presión, sino solo cambios en la temperatura, por lo que es posible que no haya sido suficiente y aún permanecieran rizobios residentes en el soporte, capaces de nodular dichas plantas. No obstante, se aprecia el marcado efecto de los aislados S.F3.1, con 9,4 nódulos por planta; C4.2b con 7,1 nódulos y G5.1, con 6,6 nódulos por planta.
La Crotalaria se ha clasificado en el grupo de leguminosas que nodulan efectivamente con un rango amplio de cepas, según estudios que caracterizan su nodulación de mediana, con nódulos grandes, color interno rojo y con una presencia mayoritaria de estas estructuras en la raíz principalF.
El efecto de los diferentes tratamientos sobre las variables de crecimiento: peso fresco y seco del follaje, peso fresco y seco de la raíz, la altura y el número de hojas, se presenta en la Tabla VI. Existieron diferencias estadísticas entre los aislados, a favor de S.F3.1 y entre este aislado y C4.2b con el tratamiento fertilizado, a favor de las bacterias. A pesar de que no hubo diferencias con el tratamiento control para las variables peso fresco y seco radical, altura y número de hojas, los mejores resultados correspondieron al tratamiento inoculado con el aislado S.F3.1, seguido por el aislado C4.2b, lo que coincide con los resultados de la nodulación.
Es lógico pensar que una mayor nodulación sobre estas plantas se haya traducido en resultados superiores de su biomasa, lo que puede indirectamente relacionarse con un mayor aporte de N a través de la fijación simbiótica con estos aislados. Resulta interesante que estos aislados superaron incluso al testigo fertilizado, en las condiciones del ensayo.
Resultados similares se obtuvieron al evaluar la eficiencia de las necesidades de nitrógeno frente a la inoculación con Rhizobium en chiplin (Crotalaria longirostrata), determinando que la inoculación con las rizobacterias promovía significativamente la biomasa de las plantas en comparación con la fertilización mineral y el tratamiento controlA.
CONCLUSIONES
Las plantas de Crotalaria, que crecen de forma silvestre en las comunidades de Loja, se asocian naturalmente con cepas eficientes de rizobios, que pueden contribuir en su crecimiento y desarrollo.
Notas al pie
ACamarillo, F. del R. Evaluation of the nitrogen needs and efficiency of Rhizobia strains to provide nitrogen to Chiplin (Crotalaria longirosrata Hook and ARN). [Master thesis], University of Massachusetts, U.S., 2014.
BValdivieso, E. Estrategias de Desarrollo en base a la agrobiodiversidad y los sistemas productivos para la soberanía alimentaria en la Comuna Collana Catacocha. [Tesis de Maestría], UNLoja, Ecuador, 2013, 87 p.
CColás, S. A.; Torres, G. R.; Eichler, L. B.; Granda, M. K. I.; Gutiérrez, S. Y.; Willems, A.; Michiels, J. y Vanderleyden, J. Genetic identification of Rhizobia isolates. Behavior on bean (Phaseolus vulgaris L.) genotypes. Inst. International Research on Food Security, Natural Resources Management and Rural Development, 2011.
DDíaz-Alcántara, C. A. Aislamiento, caracterización y selección de Rizobia autóctonos que nodulan habichuela roja (Phaseolus vulgaris L.), en la República Dominicana. [Tesis de Doctorado], Universidad de León, Departamento de Ingeniería y Ciencias Agrarias, República Dominicana, 2010.
EPérez, G. Selección de aislados de rizobios provenientes de la leguminosa forrajera Pueraria phaseoloides (Kudzú Tropical), cultivada en condiciones de acidez. [Tesis de Maestría], Universidad de La Habana, Ciudad de La Habana, Cuba, 2010.
FF Bisson, A. y Mason, T. Identification of rhizobia species that can establish nitrogen-fixing nodules in Crotalaria longirostrata. Bachelor of Science, University of Massachusetts, U.S., 2010, 106 p.
BIBLIOGRAFÏA
1. Daimon, H. Traits of the Genus Crotalaria Used as a Green Manure Legume on Sustainable Cropping Systems. Japan Agricultural Research Quarterly: JARQ, vol. 40, no. 4, 2006, pp. 299-305, ISSN 0021-3551, DOI 10.6090/jarq.40.299.
2. Marschner, H. Mineral Nutrition of Higher Plants. edit. Academic Press, 8 de agosto de 2011, 668 p., ISBN 978-0-12-384906-9.
3. Miyazawa, K.; Murakami, T.; Takeda, M. y Murayama, T. Intercropping green manure crops-effects on rooting patterns. Plant and Soil, vol. 331, no. 1-2, 18 de diciembre de 2009, pp. 231-239, ISSN 0032-079X, 1573-5036, DOI 10.1007/s11104-009-0248-y.
4. Prager, M. M.; Sanclemente, R. O. E.; Sánchez, de P. M.; Miller, G. J.; Sánchez, Á. y Iván, D. Abonos verdes: Tecnología para el manejo agroecológico de los cultivos. Agroecología, vol. 7, no. 1, 2012, pp. 53-62, ISSN 1989-4686.
5. Kimenju, J. W.; Kagundu, A. M.; Nderitu, J. H.; Mambala, F.; Mutua, G. K. y Kariuki, G. M. Incorporation of green manure plants into bean cropping systems contribute to root-knot nematode suppression. Asian Journal of Plant Sciences, vol. 7, no. 4, 2008, pp. 404–408,
ISSN 1682-3974.
6. Deepha, V.; Praveena, R.; Sivakumar, R. y Sadasivam, K. Experimental and theoretical investigations on the antioxidant activity of isoorientin from Crotalaria globosa. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, vol. 121, 5 de marzo de 2014, pp. 737-745, ISSN 1386-1425, DOI 10.1016/j.saa.2013.12.025.
7. Martínez, V. R. y Dibut, A. B. Biofertilizantes bacterianos. edit. Editorial Científico Técnica, La Habana, Cuba, 2012, 279 p., ISBN 978-959-05-0659-8.
8. Giller, K. E. Nitrogen Fixation in Tropical Cropping Systems. Second edition ed., edit. CABI, Wallingford, Oxon, UK?; New York, NY, USA, 6 de julio de 2001, 352 p., ISBN 978-0-85199-417-8.
9. Hernández, J. L.; Cubillos-Hinojosa, J. G. y Milian, P. E. Aislamiento de cepas de Rhizobium sp., asociados a dos leguminosas forrajeras en el Centro Biotecnológico del Caribe. Revista Colombiana de Microbiología Tropical, vol. 2, 2012, pp. 51–62, ISSN 2215-8375.
10. Vincent, J. M. A Manual for the Practical Study of Root-nodule Bacteria. vol. 15, edit. International Biological Programme, Blackwell Scientific, London, 1 de enero de 1970, 202 p., ISBN 978-0-632-06410-6.
11. Bécquer, C. J.; Prévost, D. y Prieto, A. Caracterización fisiológica-bioquímica de cepas de rizobios, aislados en leguminosas forrajeras. Revista Biología, vol. 14, no. 1, 2000, pp. 57-65, ISSN 0864-3490.
12. Sosa, A.; Elías, A.; García, O. A. y Sarmiento, M. Aislamiento y caracterización fenotípica parcial de cepas de rizobios que nodulan leguminosas rastreras. Revista Cubana de Ciencia Agrícola, vol. 38, no. 2, 2004, pp. 197-201, ISSN 2079-3472.
13. Sanabria, V. D.; Silva, A. R.; Alfaro, C. y Oliveros, M. Escarificación térmica de semillas de tres accesiones de Leucaena leucocephala. Zootecnia Tropical, vol. 15, no. 2, 1997, pp. 67–80, ISSN 0798-7269.
14. StatPoint Technologies. Statgraphics Centurion [en línea]. (ser. Centurion), versión 16.1 (XV), [Windows], 21 de mayo de 2010, Disponible en: <http://statgraphics-centurion.software.informer.com/download/>.
15. Wang, E. T. y Martínez-Romero, J. Taxonomía del Rhizobium. En: eds. Martínez-Romero E. y Martínez-Romero J. C., Microbios, edit. Centro de Investigaciones sobre Fijación de Nitrógeno. Universidad Nacional Autónoma de México, México, 2001, p. 264, ISBN 968-36-8879-9.
16. Granda-Mora, K. I.; Ochoa, M. A.; Ruviela, V.; Guamán-Díaz, J. F. y Torres-Gutiérrez, R. Evaluación de cepas nativas de Rhizobium sobre parámetros fenotípicos en fréjol común (Phaseolus vulgaris L.). Centro de Biotecnología, vol. 3, no. 1, 2013, pp. 25-37, ISSN 1390-7573.
17. Cuadrado, B.; Rubio, G. y Santos, W. Caracterización de cepas de Rhizobium y Bradyrhizobium (con habilidad de nodulación) seleccionados de los cultivos de fríjol caupi (Vigna unguiculata) como potenciales bioinóculos Revista Colombiana de Ciencias Químico-Farmacéuticas, vol. 38, no. 1, enero de 2009, pp. 78-104, ISSN 0034-7418.
18. Lei, Z.; Jian, P. G.; Shi, Q. W.; Ze, Y. Z.; Chao, Z. y Yongxiong, Y. Mechanism of acid tolerance in a rhizobium strain isolated from Pueraria lobata (Willd.) Ohwi. Canadian Journal of Microbiology, vol. 57, no. 6, 1 de junio de 2011, pp. 514-524, ISSN 0008-4166, DOI 10.1139/w11-036.
19. Boboye, B. E. y Ajayi, G. O. Biodegradation of Selected Nigerian Fruit Peels by the use of a Non-pathogenic Rhizobium species CWP 34B. The Open Microbiology Journal, vol. 6, 2 de noviembre de 2012, pp. 88-93, ISSN 1874-2858, DOI 10.2174/1874285801206010088.
20. Moscatiello, R.; Baldan, B.; Squartini, A.; Mariani, P. y Navazio, L. Oligogalacturonides: Novel Signaling Molecules in Rhizobium-Legume Communications. Molecular Plant-Microbe Interactions, vol. 25, no. 11, 26 de julio de 2012, pp. 1387-1395, ISSN 0894-0282, DOI 10.1094/MPMI-03-12-0066-R.
21. López, L. G.; Tabche, M. L.; Castillo, R. S.; Mendoza, V. A.; Ramírez, R. M. A. y Dávila, G. RNA-Seq analysis of the multipartite genome of Rhizobium etli CE3 shows different replicon contributions under heat and saline shock. BMC Genomics, vol. 15, no. 1, 8 de septiembre de 2014, p. 770, ISSN 1471-2164, DOI 10.1186/1471-2164-15-770.
22. Reina, B. M.; Argandoña, M.; Nieto, J. J.; Hidalgo, G. A.; Iglesias, G. F.; Delgado, M. J. y Vargas, C. Role of trehalose in heat and desiccation tolerance in the soil bacterium Rhizobium etli. BMC Microbiology, vol. 12, no. 1, 17 de septiembre de 2012, p. 207, ISSN 1471-2180, DOI 10.1186/1471-2180-12-207.
23. Ormeño, O. E.; Menna, P.; Almeida, L. G. P.; Ollero, F. J.; Nicolás, M. F.; Rodrigues, E. P.; Nakatani, A. S.; Batista, J. S. S.; Chueire, L. M. O.; Souza, R. C.; Vasconcelos, A. T. R.; Megías, M.; Hungria, M. y Martínez, R. E. Genomic basis of broad host range and environmental adaptability of Rhizobium tropici CIAT 899 and Rhizobium sp. PRF 81 which are used in inoculants for common bean (Phaseolus vulgaris L.). BMC Genomics, vol. 13, no. 1, 27 de diciembre de 2012, p. 735, ISSN 1471-2164, DOI 10.1186/1471-2164-13-735.
Recibido: 19 de noviembre de 2014
Aceptado: 27 de enero de 2015
Francisco Guamán Díaz, Universidad Nacional de Loja, La Argelia, PBX: 072546671, Loja-Ecuador. Email: fguaman100@gmail.com