Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop vol.37 no.3 La Habana jul.-set. 2016
http://dx.doi.org/10.13140/RG.2.1.1077.0165
http://dx.doi.org/10.13140/RG.2.1.1077.0165
Efecto de productos bioactivos en plantas de frijol (Phaseolus vulgaris L.) biofertilizadas
Effect of bioactive products in biofertilized bean (Phaseolus vulgaris L.) plants
Lisbel Martínez-González, M.Cs. Yanelis Reyes-Guerrero, Dr.C. Alejandro Falcón-Rodríguez, Dra.C. María C. Nápoles-García, Dra.C. Miriam de la C. Núñez-Vázquez
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700.
RESUMEN
El uso de biofertilizantes en la agricultura permite asegurar la productividad de los cultivos a un costo bajo y con un consumo mínimo de fertilizantes químicos. El Azofert® es un biopreparado a base de cepas de rizobios, que ejerce un efecto beneficioso en la fijación biológica del nitrógeno. Biobras-16 y Quitomax son bioestimulantes que ayudan a la planta a afrontar diversos tipos de estrés e incrementar los rendimientos; sin embargo, no existe información acerca del efecto de la aplicación de estos bioestimulantes a las semillas de frijol, previo a la inoculación con el biofertilizante. El objetivo de este trabajo fue determinar el efecto de Biobras-16 y Quitomax en la nodulación y el crecimiento de plantas de frijol, biofertilizadas con Azofert®. Un día antes de la siembra, las semillas fueron asperjadas con dos concentraciones de Quitomax y Biobras-16 y en el momento de la siembra, se inocularon con Azofert® y se colocaron en macetas con suelo Ferralítico Rojo Lixiviado típico, éutrico. A los 35 días se realizaron las siguientes evaluaciones a diez plantas por tratamiento: número de nódulos y masa seca de los mismos, longitud del tallo y la raíz, masa seca de ambos órganos y contenido de clorofilas, nitrógeno y fósforo en las hojas. Los resultados mostraron que la aspersión de las semillas, con determinadas concentraciones de Biobras-16 o Quitomax y la inoculación con Azofert® estimularon, de forma general, el crecimiento de las plantas; destacándose el efecto de Biobras-16, que también incrementó la concentración de clorofilas y nitrógeno en las hojas.
Palabras clave: brasinoesteroides, crecimiento, leguminosa, quitosana, rizobios.
ABSTRACT
Biofertilizers use in agriculture allow to ensure culture productivity, reducing chemical fertilizers and cost. Azofert® is a bioprepared composed by rizobia strains, with a positive effect on biological nitrogen fixation. Biobras-16 and Quitomax are natural bioactive products, considered as biostimulants which help plant to face various kinds of stresses and increase yields; however there is no information about the effect of the application of these biostimulants to seeds before biofertilizer inoculation on bean crop. The objective of this work was to determinate the Biobras 16 and Quitomax effect on nodulation and growth of common bean biofertilized with Azofert®. Two concentrations of Quitomax and Biobras-16 were applied on seeds the day before sowing and with Azofert® at the sowing moment, then they were put on Ferralític Red Lixiviated típic éutrico soil. 35 days after sowing were determined in ten plants by treatment: number and dry weight of nodules, shoot and root length and dry weight. Determination of leaf chlorophyll, nitrogen and phosphorus were also made. The results showed that application of specific concentration of Biobras-16 and Quitomax plus Azofer®t inoculation; stimulate, in a general way, the growth of plants; mainly with Biobras-16, which also increased leaf chlorophyll and nitrogen contents.
Key words: brassinosteroids, growth, leguminous, chitosan, rhizobia.
INTRODUCCIÓN
El frijol (Phaseolus vulgaris) es uno de los alimentos más importantes de la dieta diaria en la mayoría de los países de América Latina, debido al alto porcentaje de proteína (20-28 %) y aminoácidos esenciales que contienen sus granosA. El nivel de producción del frijol en Latinoamérica es relativamente bajo, no se obtienen los resultados de cosecha esperados, debido a diversos factores que afectan la productividad del cultivo, incluyendo los cambios drásticos en el clima, la presencia de plagas y enfermedades y la deficiencia de nutrientes en los suelos.
Como respuesta al uso desmedido de los fertilizantes de síntesis química y a los problemas ambientales que causan, se estimula cada vez más, la implementación de una agricultura sostenible, que permita cultivar el suelo, dañando lo menos posible el medio ambiente (1). En este contexto, particular importancia se le ha brindado a los microorganismos benéficos (2, 3). Al ser una leguminosa, el frijol tiene la capacidad de asociarse con las bacterias del suelo capaces de formar nódulos en las plantas, conocidas como rizobios (4, 5). Estos microorganismos le proporcionan a la planta nitrógeno a partir de la fijación biológica del dinitrógeno atmosférico (FBN). El establecimiento de esta simbiosis es un proceso complejo, que implica un intercambio coordinado de múltiples señales entre la planta huésped y su microsimbionte (6).
Por otra parte, en la agricultura existe una gama de bioestimulantes con efecto antiestrés y capacidad para incrementar los rendimientos (7–10). El Quitomax es una formulación líquida que tiene como ingrediente activo polímeros de quitosana, que se obtienen, fundamentalmente, del exoesqueleto del cangrejo, camarón o langosta (11, 12). La quitosana ha sido ampliamente usada en la agricultura, principalmente por poseer actividad antimicrobiana (13, 14), inducir resistencia en plantas (15), además de promover el crecimiento vegetal (16). Biobras-16 es una formulación que tiene como ingrediente activo un análogo espirostánico de brasinoesteroides, que posee como principales características: incrementar los rendimientos, aumentar la calidad de las cosechas e incrementar la tolerancia a condiciones de estrés ambiental (déficit hídrico, salinidad en el suelo, altas temperaturas). Está demostrado, además, que no produce daños fisiológicos, por lo que ha sido ampliamente utilizado en diferentes cultivos como arroz, maíz, soya, tomate, entre otros (17).
Sin embargo, se desconoce el efecto que puede ejercer la aplicación previa de estos productos bioactivos a semillas de frijol que serán inoculadas, en el momento de la siembra, con biofertilizantes como el Azofert®.
El objetivo de este trabajo fue determinar el efecto que la aplicación de determinadas concentraciones de Biobras-16 y Quitomax ejercen en la nodulación y el crecimiento de plantas de frijol, variedad Cubacueto 25-9, biofertilizadas con Azofert®.
MATERIALES Y MÉTODOS
El experimento fue realizado en el Departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas (INCA). 50 semillas de frijol cv. Cubacueto 25-9 (18), 24 horas antes de la siembra, con 3 x 10-3 L de dos concentraciones de Biobras-16 y dos de Quitomax, según cada tratamiento. En el momento de la siembra, cada semilla se inoculó con 1 mL de Azofert®, cepa Rhizobium leguminosarum CF1, a una concentración de 5,4 x 108 Unidades formadoras de colonias (UFC) mL-1. Se utilizaron como controles un tratamiento sin productos (control sin aplicación) y un tratamiento solamente inoculado con Azofert®. Los tratamientos quedaron conformados de la forma siguiente:
1-Control sin aplicación
2-Azofert®
3-Azofert®+Quitomax (100 mg L-1)
4-Azofert®+Quitomax (500 mg L-1)
5-Azofert®+Biobras-16 (0,005 mg L-1)
6-Azofert®+Biobras-16 (0,05 mg L-1
Las semillllas fueron sembradas en macetas con 250 g de suelo Ferralítico Rojo Lixiviado típico, éutrico (19) y las mismas se colocaron en un cuarto de luces, manteniéndose en condiciones de 24 ± 2 °C de temperatura, 12 horas luz de fotoperíodo y una humedad relativa del 70 %, durante 35 días. Las plantas se regaron diariamente con agua corriente.
Las características agroquímicas del suelo, se determinaron de acuerdo con lo establecido (20) y se presentan en la Tabla I; mientras que las características microbiológicas, relacionadas con la presencia de rizobios, aparecen en la Tabla II.
Al final del experimento (35 días después de la siembra), se tomaron diez plantas por tratamiento y se les realizaron las siguientes evaluaciones por planta: número de nódulos totales y masa seca nodular, longitud y masa seca de las raíces y la parte aérea. Además, se estimó la concentración de clorofilas totales en las hojas, utilizando un equipo Spad 502 y se tomaron tres muestras de 0,2 g de hojas por tratamiento para determinar el contenido de nitrógeno y fósforo. Estas determinaciones se realizaron por el método colorimétrico, empleando el reactivo de Nessler para el N y el azul de molibdeno para el P (20).
Los datos fueron procesados por análisis de varianza de clasificación simple. Se utilizó el test de comparación de rangos múltiple de Duncan para α<0,05, con el objetivo de discriminar diferencias entre las medias. Todos los gráficos fueron realizados con el programa Microsoft Excel 2010.
RESULTADOS Y DISCUSIÓN
En la Figura 1 se presentan los resultados del efecto de los tratamientos sobre el número de nódulos totales (A) y masa seca de nódulos (B), en las plántulas de frijol.
En el número de nódulos formados, en el tratamiento Biobras-16, su mayor concentración (T6) fue el que más se destacó, sin diferencias significativas con el tratamiento con Azofert®. Similares resultados se obtuvieron con la combinación con el brasinoesteroide a la menor concentración (T5). El empleo de Quitomax a las concentraciones de 100 y 500 mg L-1 disminuyó el número de nódulos formados, sin diferencias significativas con el control absoluto (T1) (Figura 1A).
Al analizar la masa seca nodular, de igual forma los mejores resultados se obtuvieron con el tratamiento inoculado (T2) y aquellos que, además, contenían Biobras16 (T5 y T6) (Figura 1B), aunque estos últimos tampoco difirieron de los tratamientos con Quitomax (T3 y T4) ni del control (T1).
En otros estudios realizados se demostró que la inmersión de semillas de soya durante una hora en una solución de Biobras-16 (0,05 mg L-1), mejoró la respuesta de la interacción simbiótica Bradyrhizobium-soya, incrementando tanto el número de nódulos como las masas fresca y seca de los mismos (21).
Se ha observado, en trabajos con plantas de frijol cv. Arka Suvidha asperjadas con 0,1, 5 µM de homobrasinolida (HBL) o epibrasinólida (EBL) en la fase de floración, que los brasinoesteroides estimularon el número de nódulos, la masa de las raíces noduladas y la longitud de las raíces, destacándose la EBL a la concentración de 5 µM como el tratamiento más efectivo (22).
En cuanto al efecto de los quitosacáridos en la nodulación in vitro de plántulas de soya, inoculadas con Bradyrhizobium elkaniiB, se encontró que concentraciones de hasta 100 mg L-1 no modificaron el número de nódulos, mientras que las concentraciones de 500 y 1000 mg L-1 redujeron significativamente la aparición de estas estructuras en las raíces.
Existen diversos factores que afectan la nodulación y la fijación biológica de nitrógeno en frijol. Entre ellos la amplia variación que se presenta entre genotipos y su capacidad de fijación simbiótica, donde los cultivares de hábito indeterminado trepador resultan más eficientes. Otros factores ambientales como acidez, toxicidad de aluminio y manganeso, la disponibilidad de fósforo en el suelo, la temperatura ambiente y la competencia con cepas nativas, también afectan significativamente la capacidad de nodulación y de fijación biológica del nitrógeno por esta leguminosa (23, 24).
Al analizar la longitud de la parte aérea se pudo observar que solamente la aspersión foliar con 0,05 mg L-1 de BB-16 fue capaz de incrementar significativamente este indicador en las plantas inoculadas con el biofertilizante.
Por otra parte, se debe destacar que el Azofert® estimuló significativamente este indicador en comparación con las plantas del tratamiento control (Figura 2A). En la longitud de las raíces, igualmente el tratamiento con Azofert®+0,05 mg L-1 de BB-16 fue el que mostró los resultados superiores (Figura 2B).
La masa seca aérea fue mayor en el tratamiento T5 (Azofert®+BB-16 0,005 mg L-1) y menor para los tratamientos control e inoculado solamente (Figura 2C). Mientras que la masa seca radical (Figura 2D) se vio favorecida con la combinación de Azofert®+Quitomax (500 mg L-1) y de Azofert®+Biobras-16 (0,05 mg L-1).
Se ha reportado que el tratamiento a semillas de frijol cv. Cuba-Cueto 25-9 con rizobios, incrementa la altura de las plantas con respecto a plantas no inoculadas (25). En esta investigación, aunque todos los tratamientos superaron al control, los mejores resultados, de forma general, se obtuvieron cuando se asperjaron las semillas con Biobras-16 (0,05 mg L-1) y posteriormente se inocularon con Azofert®. Diversos autores han demostrado que los brasinoesteriodes son capaces de estimular el crecimiento de los órganos de la planta (26).
En cuanto a la estimulación del enraizamiento, se ha visto que la inmersión de esquejes de guayaba (Psidium guajava L.), durante 15 minutos, en una solución de BB-16 0,05 mg L-1 indujo el enraizamiento y estimuló el crecimiento de las posturas (17).
En dos especies de orquídeas, las aspersiones foliares repetidas con BB-16 (0,05 mg L-1) incrementaron tanto el número de pseudobulbos o tallos como el número de raíces, además de favorecer la coloración de las plantas y la calidad de las flores (27).
En soya, la aspersión foliar de Biobras-16 (20 mg ha-1) en plantas de tres variedades inoculadas con Bradyrhizobium japonicum y Glomus clarum, arrojaron resultados satisfactorios (28).
Otros autores han informado que el tratamiento de semillas de frijol con 24-epibrasinólida (EBL) durante seis horas, es capaz de estimular la longitud de las plántulas (raíces y parte aérea) a los ocho días (29).
También se ha encontrado que la aspersión a semillas de frijol cv. Bronco con EBL (5 µM), incrementó significativamente la longitud de los tallos y las raíces, el número y área foliar de las hojas por planta, así como la masa seca de las mismas (30).
En cuanto a la quitosana, varias investigaciones informan que estimula el crecimiento y desarrollo de las plantas (31–33). Recientemente se encontró que la aplicación del polímero en plantas de pepino incrementó la producción de biomasa y el rendimiento. Se ha informado que semillas de soya recubiertas con solución de quitosana 1000 mg L-1 por seis horas, incrementa la longitud y la masa fresca de las raíces (33).
También se ha podido constatar el efecto que el tratamiento de las semillas de ispaghul (Plantago ovata Forsk) con diferentes concentraciones de quitosana (0,01; 0,05; 0,1; 0,2 y 0,5 %) produjo un aumento de la longitud y la masa seca de las raíces y los tallos, siendo las concentraciones más efectivas 0,2 y 0,5 % (34). En este trabajo que se presenta no fue necesario utilizar concentraciones tan altas de quitosana para favorecer la masa seca de las raíces, lo cual puede estar relacionado con la presencia de Rhizobium.
La aplicación foliar con quitosana en dos momentos del ciclo del cultivo de frijol mungo (Vigna radiata (L.) Wilzeck) favoreció la masa seca de las plantas; sin embargo, las concentraciones efectivas dependieron de la forma en que se cultivaron las plantas, si fue en macetas o en condiciones de campo, destacándose las de 25, 50, 75 y 100 mg L-1 en el primer caso y 75 y 100 mg L-1 en el segundo (35).
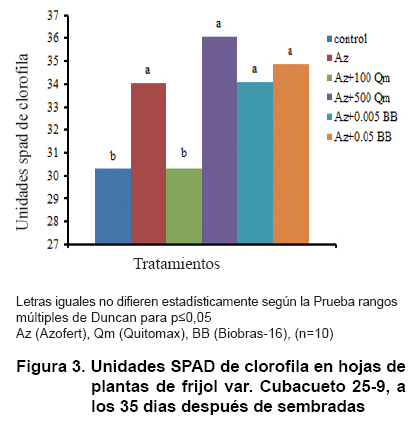
Un análisis de cada tratamiento y su contribución al contenido de clorofilas se muestra en la Figura 3. Como se puede observar, todos los tratamientos, excepto el de Quitomax (100 mg L-1)+Azofert®, fueron significativamente superiores al tratamiento control sin aplicación.
Se ha demostrado que semillas de frijol mungo (Vigna radiata L. Wilczek) cv. T-44, inoculadas con Rhizobium y tratadas con homobrasinólida (HBL) 0,01 µM, a los diez días de sembradas, incrementaron el área foliar, el contenido relativo de agua y el potencial hídrico foliar, así como la actividad de las enzimas nitrato reductasa y anhidrasa carbónica, la eficiencia en la carboxilación y el contenido de clorofila (36).
En otras especies de plantas se ha informado que la aplicación de determinadas concentraciones de quitosana estimula la concentración de clorofilas en las hojas (37, 38).
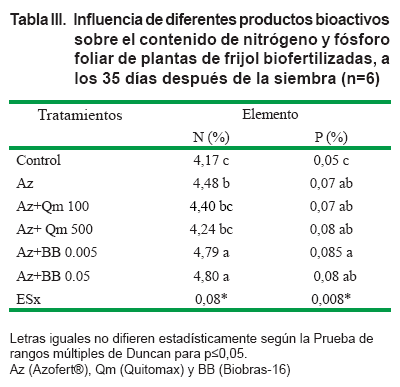
Como se aprecia en la Tabla III, la inoculación con Azofert® incrementó la concentración de nitrógeno y fósforo en las hojas, con respecto a las plantas control. La aplicación de los bioestimulantes no influyó en la concentración de fósforo foliar; sin embargo, en los tratamientos donde se aplicó el Biobras-16 se incrementó significativamente la concentración de nitrógeno en las hojas de las plantas de frijol a los 35 días después de la siembra.
El nitrógeno y el fósforo son considerados entre los elementos que más influyen en la producción de los cultivos (39); sin embargo, el alto costo de los fertilizantes limitan su uso, por lo que en la actualidad se utilizan alternativas capaces de suplir las necesidades de los cultivos sin dañar el medio ambiente (40).
El tratamiento a las semillas con Biobras-16 y la posterior inoculación con Azofert® mostró los mejores resultados en el contenido de nitrógeno en las hojas, por lo que pudiera ser una alternativa para la incorporación de este elemento a la planta.
Los productos Biobras-16 y Quitomax no incrementaron la nodulación del cultivar de frijol utilizado. Sin embargo, la aspersión con Quitomax estimuló significativamente la masa seca de las plantas; mientras que la aspersión foliar a las semillas con Biobras-16 ejerció un efecto positivo sobre todos los indicadores del crecimiento evaluados, así como sobre el contenido de clorofilas y de N en las hojas.
CONCLUSIONES
El uso de biofertilizantes en la agricultura constituye una alternativa para asegurar la sustentabilidad y productividad de los cultivos. La necesidad de obtener elevados rendimientos agrícolas y al mismo tiempo preservar el medio ambiente está ligada al uso generalizado de estos productos. Su combinación con otros productos bioactivos como el Biobras-16 o el Quitomax, en concentraciones adecuadas, puede incrementar los resultados positivos que los biofertilizantes producen en las leguminosas.
Notas al pie
ACommon bean [en línea]. CGIAR, 24 de marzo de 2016, [Consultado: 24 de marzo de 2016], Disponible en: <http://www.cgiar.org/our-strategy/crop-factsheets/beans/>.
BCostales, M. D. Quitosácaridos en la nodulación y el crecimiento in vitro de soya (Glycine max L. Merrill) inoculada con Bradyrhizobium elkanii. Tesis de Maestría, Instituto Nacional de Ciencias Agrícolas, La Habana, Cuba, 2010, 56 p.
BIBLIOGRAFÍA
1. Singh, J. S.; Pandey, V. C. y Singh, D. P. ‘‘Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development’’. Agriculture, Ecosystems & Environment, vol. 140, no. 3–4, marzo de 2011, pp. 339-353, ISSN 0167-8809, DOI 10.1016/j.agee.2011.01.017.
2. Tikhonovich, I. A. y Provorov, N. A. ‘‘Microbiology is the basis of sustainable agriculture: an opinion’’. Annals of Applied Biology, vol. 159, no. 2, 1 de septiembre de 2011, pp. 155-168, ISSN 1744-7348, DOI 10.1111/j.1744-7348.2011.00489.x.
3. Ribeiro, R. A.; Ormeño, O. E.; Dall’Agnol, R. F.; Graham, P. H.; Martinez, R. E. y Hungria, M. ‘‘Novel Rhizobium lineages isolated from root nodules of the common bean (Phaseolus vulgaris L.) in Andean and Mesoamerican areas’’. Research in Microbiology, vol. 164, no. 7, septiembre de 2013, pp. 740-748, ISSN 0923-2508, DOI 10.1016/j.resmic.2013.05.002.
4. López, G. M. G.; Ormeño, O. E.; Velázquez, E.; Rogel, M. A.; Acosta, J. L.; Gónzalez, V.; Martínez, J. y Martínez, R. E. ‘‘Rhizobium etli taxonomy revised with novel genomic data and analyses’’. Systematic and Applied Microbiology, vol. 35, no. 6, septiembre de 2012, pp. 353-358, ISSN 0723-2020, DOI 10.1016/j.syapm.2012.06.009.
5. Rai, R.; Dash, P. K.; Mohapatra, T. y Singh, A. ‘‘Phenotypic and molecular characterization of indigenous rhizobia nodulating chickpea in India’’. Indian Journal of Experimental Biology, vol. 50, no. 5, mayo de 2012, pp. 340-350, ISSN 0019-5189.
6. Murray, J. D. ‘‘Invasion by Invitation: Rhizobial Infection in Legumes’’. Molecular Plant-Microbe Interactions, vol. 24, no. 6, 4 de mayo de 2011, pp. 631-639, ISSN 0894-0282, DOI 10.1094/MPMI-08-10-0181.
7. Corbera, J. y Nápoles, M. C. ‘‘Evaluación de la incoulación conjunta Bradyrhizobium elkanii-hongos micorrízicosarbusculares y la aplicación de unbioestimulador del crecimiento vegetal ensoya cultivada en época de invierno’’. Cultivos Tropicales, vol. 31, no. 4, 2010, pp. 43-50, ISSN 0258-5936.
8. Salinas, R. N.; Escalante, E. J. A.; Rodríguez, G. M. y Sosa, M. E. ‘‘Yield and nutritional quality of snap bean in terms of biofertilization’’. Tropical and Subtropical Agroecosystems, vol. 13, no. 3, 6 de noviembre de 2011, pp. 347-355, ISSN 1870-0462.
9. Nuñez, M. de la C. Brasinoesteroides y las respuestas de las plantas al estrés ambiental. edit. Edicciones INCA, Mayabeque, Cuba, 2012, 80 p., ISBN 978-959-7023-57-9.
10. Salachna, P. y Zawadzińska, A. ‘‘Effect of chitosan on plant growth, flowering and corms yield of Potted freesia’’. Journal of Ecological Engineering, vol. 15, no. 3, 2014, pp. 97–102, ISSN 2299-8993, DOI 10.12911/22998993.1110223.
11. Ramírez, M. A.; Cabrera, G.; Gutiérrez, A. y Rodríguez, T. ‘‘Metodología de obtención de quitosana a bajas temperaturas a partir de quitina de langosta’’. Cultivos Tropicales, vol. 21, no. 1, 2000, pp. 81-84, ISSN 0258-5936.
12. El Hadrami, A.; Adam, L. R.; El Hadrami, I. y Daayf, F. ‘‘Chitosan in Plant Protection’’. Marine Drugs, vol. 8, no. 4, 30 de marzo de 2010, pp. 968-987, ISSN 1660-3397, DOI 10.3390/md8040968.
13. Falcón, A. B.; Cabrera, J. C.; Costales, D.; Ramírez, M. A.; Cabrera, G.; Toledo, V. y Martínez, T. M. A. ‘‘The effect of size and acetylation degree of chitosan derivatives on tobacco plant protection against Phytophthora parasitica nicotianae’’. World Journal of Microbiology and Biotechnology, vol. 24, no. 1, 23 de junio de 2007, pp. 103-112, ISSN 0959-3993, 1573-0972, DOI 10.1007/s11274-007-9445-0.
14. Yin, H.; Zhao, X. y Du, Y. ‘‘Oligochitosan: A plant diseases vaccine-A review’’. Carbohydrate Polymers, vol. 82, no. 1, 2 de agosto de 2010, pp. 1-8, ISSN 0144-8617, DOI 10.1016/j.carbpol.2010.03.066.
15. Falcón, R. A. B.; Costales, D.; Cabrera, J. C. y Martínez, T. M. Á. ‘‘Chitosan physico–chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae’’. Pesticide Biochemistry and Physiology, vol. 100, no. 3, julio de 2011, pp. 221-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2011.04.005.
16. Van Toan, N. y Hanh, T. T. ‘‘Application of chitosan solutions for rice production in Vietnam’’. African Journal of Biotechnology, vol. 12, no. 4, 2015, pp. 382-384, ISSN 1684-5315, DOI 10.4314/ajb.v12i4.
17. Núñez, V. M.; Reyes, G. Y.; Rosabal, A. L. y Martínez, G. L. ‘‘Análogos espirostánicos de brasinoesteroides y sus potencialidades de uso en la agricultura’’. Cultivos Tropicales, vol. 35, no. 2, junio de 2014, pp. 34-42, ISSN 0258-5936.
18. Costales, D.; Nápoles, M. C. y Falcón, A. ‘‘Quitosácaridos en la nodulación y el crecimiento in vitro de soya (Glycine max (L.) Merill) inoculado con Bradyrhizobium Elkani’’. En: XVII Congreso Científico Internacional del INCA, edit. Ediciones INCA, La Habana, Cuba, 2010, ISBN 978-959-7023-48-7.
19. Hernández, J. A.; Pérez, J. J. M.; Bosch, I. D. y Castro, S. N. Clasificación de los suelos de Cuba 2015. edit. Ediciones INCA, Mayabeque, Cuba, 2015, 93 p., ISBN 978-959-7023-77-7.
20. Paneque, P. V. M.; Calaña, J. M.; Calderón, M.; Borges, Y.; Hernández, T. y Caruncho, M. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos [en línea]. edit. Ediciones INCA, La Habana, 2010, 157 p., ISBN 978-959-7023-51-7, [Consultado: 27 de enero de 2016], Disponible en: <http://mst.ama.cu/578/>.
21. Costales, D.; Nápoles, M. C.; Núñez, M. y Falcó, A. ‘‘Influencia de un análogo de brasinoesteroide sobre la nodulación de plántulas de soya (Glycine max (L) Merril)’’. Cultivos Tropicales, vol. 29, no. 2, junio de 2008, pp. 65-69, ISSN 0258-5936.
22. Upreti, K. K. y Murti, G. S. R. ‘‘Effects of Brassmosteroids on Growth, Nodulation, Phytohormone Content and Nitrogenase Activity in French Bean Under Water Stress’’. Biologia Plantarum, vol. 48, no. 3, septiembre de 2004, pp. 407-411, ISSN 0006-3134, 1573-8264, DOI 10.1023/B:BIOP.0000041094.13342.1b.
23. Graham, P. ‘‘Problemas de la nodulación y la fijación de nitrógeno en Phaseolus vulgaris L. Una reevaluación’’. Terra, vol. 8, no. sp., 1990, pp. 71–82, ISSN 1012-7089.
24. Acuña, O.; Rodríguez, E.; Llano, A.; Calderón, V. R.; Flores, G.; Viana, A. y Lépiz, R. ‘‘Validación técnica de inoculantes en frijol con cepas de Rhizobium eficientes en fijación de nitrógeno en Centroamérica’’. Agronomía Mesoamericana, vol. 12, no. 1, 2001, pp. 25-32, ISSN 2215-3608.
25. Liriano, G. R.; Núñez, S. D. B. y Barceló, D. R. ‘‘Efecto de la aplicación de Rhizobium y Mycorriza en el crecimiento del frijol (Phaseolus vulgaris L) variedad CC-25-9 negro’’. Centro Agrícola, vol. 39, no. 4, 2012, pp. 17–20, ISSN 0253-5785.
26. Núñez, V. M.; Reyes, G. Y.; Rosabal, A. L.; Martínez, L.; González, C. M. C. y María C. ‘‘Brasinoesteroides y sus análogos estimulan el crecimiento de plántulas de dos genotipos de arroz (Oryza sativa L.) en medio salino’’. Cultivos Tropicales, vol. 34, no. 1, marzo de 2013, pp. 74-80, ISSN 0258-5936.
27. Sathiyamoorthy, P. y Nakamura, S. ‘‘In vitro root induction by 24-epibrassinolide on hypocotyl segments of soybean (Glycine max (L.) Merr.)’’. Plant Growth Regulation, vol. 9, no. 1, febrero de 1990, pp. 73-76, ISSN 0167-6903, 1573-5087, DOI 10.1007/BF00025281.
28. Corbera, J. y Núñez, M. ‘‘Evaluación agronómica del análogo de Brasinoesteroides BB-6 en soya, inoculada con Bradyrhizobium japonicum y HMA, cultivada en invierno sobre un suelo ferralsol’’. Cultivos Tropicales, vol. 25, no. 3, 2004, pp. 9-13, ISSN 0258-5936.
29. Ali, A. A. y Abdel-Fattah, R. I. ‘‘Osmolytes-antioxidant Behaviour in Phaseolus vulgaris and Hordeum vulgare with Brassinosteroid under Salt Stress’’. Journal of Agronomy, vol. 5, no. 1, 1 de enero de 2006, pp. 167-174, ISSN 18125379, 18125417, DOI 10.3923/ja.2006.167.174.
30. Rady, M. M. ‘‘Effect of 24-epibrassinolide on growth, yield, antioxidant system and cadmium content of bean (Phaseolus vulgaris L.) plants under salinity and cadmium stress’’. Scientia Horticulturae, vol. 129, no. 2, 10 de junio de 2011, pp. 232-237, ISSN 0304-4238, DOI 10.1016/j.scienta.2011.03.035.
31. Khan, W. M.; Prithiviraj, B. y Smith, D. L. ‘‘Effect of Foliar Application of Chitin and Chitosan Oligosaccharides on Photosynthesis of Maize and Soybean’’. Photosynthetica, vol. 40, no. 4, diciembre de 2002, pp. 621-624, ISSN 0300-3604, 1573-9058, DOI 10.1023/A:1024320606812.
32. Mondal, M. M. A.; Malek, M. A.; Puteh, A. B.; Ismail, M. R. y Ashrafuzzaman, M. ‘‘Effect of foliar application of chitosan on growth and yield in okra’’. Australian Journal of Crop Science, vol. 6, no. 5, 2012, pp. 918-921, ISSN 1835-2707.
33. Katiyar, D.; Hemantaranjan, A.; Singh, B. y Nishant, B. A. ‘‘A Future Perspective in Crop Protection: Chitosan and its Oligosaccharides’’. Advances in Plants & Agriculture Research, vol. 1, no. 1, 2014, pp. 1-8, ISSN 2373-6402, DOI 10.15406/apar...00006.
34. Mahdavi, B. ‘‘Seed germination and growth responses of Isabgol (Plantago ovata Forsk) to chitosan and salinity’’. International Journal of Agriculture and Crop Sciences, vol. 5, no. 10, 2013, pp. 1084-1088, ISSN 2227-670X.
35. Mondal, M.; Malek, M.; Puteh, A. y Ismail, M. ‘‘Foliar application of chitosan on growth and yield attributes of mungbean (Vigna radiata (L.) Wilczek)’’. Bangladesh Journal of Botany, vol. 42, no. 1, 28 de julio de 2013, ISSN 2079-9926, 0253-5416, DOI 10.3329/bjb.v42i1.15910, [Consultado: 24 de marzo de 2016], Disponible en: <http://banglajol.info/index.php/BJB/article/view/15910>.
36. Hayat, S.; Hasan, S. A.; Yusuf, M.; Hayat, Q. y Ahmad, A. ‘‘Effect of 28-homobrassinolide on photosynthesis, fluorescence and antioxidant system in the presence or absence of salinity and temperature in Vigna radiata’’. Environmental and Experimental Botany, vol. 69, no. 2, noviembre de 2010, pp. 105-112, ISSN 0098-8472, DOI 10.1016/j.envexpbot.2010.03.004.
37. Yuedong, Y.; Yongguo, Z.; Yinge, Q.; Xiujuan, W.; Zhimeng, Z. y Yourong, S. ‘‘Effect of chitosan on physiological activities in germinating seed and seedling leaves of maize’’. Journal of Hebei Vocationtechnical Teachers College, vol. 15, no. 4, diciembre de 2000, pp. 9-12, ISSN 1008-9519.
38. XianLing, J.; YingPing, G.; ZhiMei, M. y WeiGuo, L. ‘‘Effect of chitosan on physiological and biochemical characteristic of seed germination and seedling of mulberry (Morus alba)’’. Acta Sericologica Sinica, vol. 28, no. 3, 2002, pp. 253–255, ISSN 0257-4799.
39. Nguyen, V. S.; Dinh, M. H. y Nguyen, A. D. ‘‘Study on chitosan nanoparticles on biophysical characteristics and growth of Robusta coffee in green house’’. Biocatalysis and Agricultural Biotechnology, vol. 2, no. 4, octubre de 2013, pp. 289-294, ISSN 1878-8181, DOI 10.1016/j.bcab.2013.06.001.
40. Glick, B. R. ‘‘Plant Growth-Promoting Bacteria: Mechanisms and Applications’’. Scientifica, vol. 2012, 11 de octubre de 2012, ISSN 2090-908X, DOI 10.6064/2012/963401, [Consultado: 24 de marzo de 2016], Disponible en: <http://www.hindawi.com/journals/scientifica/2012/963401/abs/>.
Recibido: 06/07/2015
Aceptado: 12/11/2015
Lisbel Martínez González, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email: lisbel@inca.edu.cu