Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop vol.38 no.4 La Habana oct.-dic. 2017
ARTÍCULO ORIGINAL
Efecto del QuitoMax® en plantas de (Phaseolus vulgaris L.) sometidas a dos regímenes de riego. II. variables fisiológicas
A QuitoMax® effect in plants of (Phaseolus vulgaris L.) under two irrigation regimes. II. physiological variables
Dr.C. Donaldo Morales-Guevara, Dr.C. José Dell’Amico-Rodríguez, Dr.C. Eduardo Jerez-Mompie, Dr.C. Pedro Rodríguez-Hernández, Dr.C. Idioleydis Álvarez-Bello, M.Cs. Yusnier Díaz-Hernández, M.Cs. Roberqui Martín-Martín
Instituto Nacional de Ciencias Agrícolas. Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
Este trabajo se realizó con el objetivo de evaluar el efecto del QuitoMax® en diferentes variables fisiológicas en plantas de frijol (Phaseolus vulgaris L) sometidas a dos regímenes de riego. Se utilizó la variedad de frijol negro ̏ Tomeguín ̋ sembradas en canaletas de hormigón de 2,60 m de largo por 0,60 m de ancho, en las que se colocaron dos hileras separadas a 0,40 m y una separación entre plantas de 0,11 cm para un total de 44 plantas por canaleta, cada tratamiento contó con tres réplicas. Los tratamientos fueron: 100 (T100) por ciento de la ETc. (Evapotranspiración estándar del cultivo) y el 50 (T50) por ciento de la ETc, contándose en cada tratamiento de riego con una variante en la que se aplicaron 200 mg ha-1 de QuitoMax® a los 20-25 días posteriores a la siembra y una dosis similar al inicio de la floración y otra en la que no se aplicó el bioestimulante. Las evaluaciones realizadas fueron los potenciales hídrico foliar, osmótico actual, osmótico saturado, contenido relativo de agua, conductancia estomática, clorofilas a, b y totales y en unidades SPAD, se observaron los estomas, y se estimó el potencial de turgencia a partir de los potenciales hídrico foliar y el osmótico actual. Los resultados indicaron en primer lugar, que las plantas de frijol (Phaseolus vulgaris L.) se ven afectadas al ser sometidas a un régimen de riego insuficiente y en segundo lugar que las dos aplicaciones de QuitoMax®, fueron capaces de atenuar los efectos de la deficiencia de agua.
Palabras clave: clorofilas, conductancia estomática, potencial hídrico, potencial osmótico, quitosano.
ABSTRACT
This work was carried out with the objective to evaluate the effect of QuitoMax® on different physiological variables in bean plants (Phaseolus vulgaris L) conducted under two irrigation regimes. The black bean, variety ̏ Tomeguín ̋ was planted in concrete gutters of 2,60 m long by 0,60 m wide, in which two separate rows were placed at 0,40 m and a plant spacing of 0,11 cm for a total of 44 plants per channel, each treatment counted on three replicates. The treatments were: 100 (T100) percent of the ETc. (Standard crop evapotranspiration) and 50 (T50) percent of ETc, counting in each irrigation treatment with a variant in which 200 mg ha-1 of QuitoMax® were applied at 20-25 days after sowing and a dose similar to the beginning of flowering and another dose in which the biostimulant was not applied. The evaluations were leaf water potential, current osmotic and saturated osmotic potentials, relative water content, stomatal conductance, total chlorophylls a and b and in SPAD units, the stomata were observed, and also turgor potential is estimated from the leaf water and osmotic potentials. The results indicated first, that bean plants (Phaseolus vulgaris L.) are affected when subjected to a regime of insufficient irrigation and secondly, that the two applications of QuitoMax® were able to attenuate the effects of water deficiency.
Key words: chlorophyll, stomatal conductance, water potential, osmotic potential, chitosan.
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) es una legumbre de grano muy importante en las Américas y partes de África donde sirve como fuente vital de proteínas, vitaminas y nutrientes minerales (1).
El manejo adecuado de la nutrición de las plantas y el control eficiente de las plagas que las afectan, constituyen dos elementos esenciales para obtener una alta productividad y calidad de la producción agrícola, así como, que la aplicación indiscriminada de productos químicos puede ocasionar perjuicios al medio ambiente, crear resistencia por parte de los microorganismos fitopatógenos y causar daños a la salud humana (2). La práctica del biocontrol de las enfermedades en los vegetales muestra una alternativa viable en relación con el método químico tradicional.
La gestión sostenible de la fertilidad del suelo es una de las principales preocupaciones de varios investigadores (3), dado el impacto adverso y las amenazas ecológicas que plantea el uso de fertilizantes químicos convencionales (4). En este contexto, los bioestimulantes representan una alternativa interesante. Consisten en diversas sustancias y microorganismos que se utilizan para mejorar el crecimiento y desarrollo de las plantas (5).
Entre los productos estudiados para el biocontrol, se destaca el polisacárido de quitosana encontrado naturalmente en la pared celular de algunos hongos y que ha sido obtenido comercialmente a partir de la quitina, destacándose por su biocompatibildad, biodegradabilidad, baja toxicidad, alta bioactividad y actividad microbiana (6), resultados positivos en el uso de bioestimulantes han sido verificados en varias investigaciones, entre ellas las realizadas en Vigna unguiculata (7).
Aunque no se conocen con exactitud los mecanismos por los que la quitosana estimula el crecimiento y desarrollo de las plantas, se ha planteado que las mismas están involucradas en procesos fisiológicos, tales como evitar las pérdidas de agua por vía de la transpiración (8). En tal sentido, se ha demostrado la presencia de cierre estomático en plantas asperjadas con quitosano, lo que sugirió que el efecto estimulante del crecimiento luego del cierre estomático podría estar relacionado con un efecto antitranspirante en la planta (9,10), señalándose además que la aplicación foliar de quitosano en papa redujo los efectos del estrés hídrico (11).
Por otra parte, se ha señalado a partir de los resultados encontrados en el cultivo del frijol (Phaseolus vulgaris L.), que uno de los aspectos a través de los cuales el quitosano estaba influyendo en la reducción de la transpiración es que este producto incrementa los niveles de ácido abscísico (ABA) en las hojas tratadas, el cual activa el cierre parcial de los estomas (12).
Teniendo en cuenta lo antes señalado, el presente trabajo se realizó con el objetivo de evaluar el efecto del QuitoMax® en diferentes variables fisiológicas en plantas de frijol (Phaseolus vulgaris L) sometidas a dos regímenes de riego.
MATERIALES Y MÉTODOS
El trabajo se realizó durante los meses de enero a abril de 2013 en el área central del Instituto Nacional de Ciencias Agrícolas (INCA), para ello se sembraron 12 canaletas de hormigón de 2,60 m de largo por 0,60 m de ancho (1,56 m2) que contenían suelo Ferralítico Rojo Lixiviado (13). En cada canaleta fueron sembradas 44 plantas de frijol negro de la variedad Tomeguín dispuestas en dos hileras separadas a 0,40 m y un espaciamiento entre plantas de 0,11 m.
Se utilizaron dos tratamientos de riego, en cada uno de ellos se realizaron dos aplicaciones de QuitoMax® a razón de 200 mg ha-1, la primera a los 22 días posteriores a la siembra y la segunda a los 39 días coincidiendo con el inicio de la floración, así como, se contó con dos tratamientos en los que no se aplicó el producto, dando lugar a cuatro tratamientos distribuidos según un diseño experimental de bloques al azar con tres repeticiones (tres canaletas por tratamiento). Los tratamientos ensayados fueron:
T100, regado al 100 por ciento de la ETc. (Evapotranspiración estándar del cultivo)
T50, regado al 50 por ciento de la ETc.
T100 + QuitoMax®
T50 + QuitoMax®
El riego se aplicó mediante un sistema de micro aspersión automatizada y la entrega del agua se controló mediante válvulas colocadas en cada tratamiento.
La evapotranspiración del cultivo de referencia (ETo) se calculó utilizando los datos de una estación meteorológica cercana (aproximadamente a 200 m del experimento) y se empleó el método de FAO Penman-Monteith (14). La evapotranspiración del cultivo bajo condiciones estándar (ETc.) se calculó mediante la siguiente ecuación:
ETc. = ETo * Kc. [1]
donde:
ETc. Evapotranspiración del cultivo [mm d-1],
Kc. Coeficiente del cultivo [adimensional],
ETo Evapotranspiración del cultivo de referencia [mm d-1].
Los coeficientes de cultivo Kc empleados fueron los siguientes:
Kc. inicial= 0,15; Kc. medio= 1,10 y Kc. final= 0,65
Durante el período comprendido entre el 21 y 26 de enero el riego fue de 3 mm diarios en todos los tratamientos para garantizar una germinación y crecimiento inicial homogéneos. A partir de ese momento el riego se aplicó según correspondió a cada tratamiento. Se consideró lluvia efectiva cuando esta fue superior a 3 mm. Otras atenciones culturales fueron realizadas por igual en ambos tratamientos.
Los datos graficados de las temperaturas máximas, mínimas, de radiación solar y lluvia corresponden a los valores decenales obtenidos.
La humedad del suelo (%) se determinó semanalmente, mediante una sonda TDR (Reflectrometría en Dominio del Tiempo) Field Scout TDR 100 System, Spectrum Technologies, Inc., en cada tratamiento se realizaron 30 mediciones (diez en cada contenedor) a 20 cm de profundidad.
Evaluaciones
Se determinó el potencial hídrico foliar (Ψw) con una cámara de presión (Soil Moisture Equipment Co Santa Barbara USA). Las hojas usadas para las medidas de Ψw se congelaron en nitrógeno líquido, después se descongelaron y se les determinó el potencial osmótico (Ψs), utilizando un osmómetro de presión de vapor Wescor 5500 (Wescor, Logan, EE.UU). El potencial de presión (Ψp) se estimó como la diferencia entre Ψw y Ψs.
Para la medida del potencial osmótico a máxima saturación (Ψos) las hojas fueron hidratadas durante 24 horas colocando sus peciolos en un recipiente con agua destilada, cubiertos con papel parafilm y situados a bajas temperaturas en un refrigerador doméstico, posteriormente se congelaron en nitrógeno líquido y se siguió el mismo procedimiento aplicado para determinar el Ψs.
Para la determinación del Contenido Relativo de Agua (CRA) se tomaron diez hojas por tratamiento a las 11:00 horas a las que se les determinó la masa fresca (MF), luego se hidrataron durante 24 horas siguiendo el mismo procedimiento utilizado para la obtención del Ψos, transcurrido ese tiempo se les determinó la Masa Saturada (MFS) antes de colocarlas en una estufa a 80 oC hasta alcanzar un peso constante (MS). El CRA se calculó según la expresión siguiente:
CRA=MF-MS/MFS-MS
La conductancia estomática se determinó en dos momentos del desarrollo de las plantas. Las medidas se realizaron a las 11:00 horas con un porómetro de difusión modelo AP4 en hojas bien expuestas a la luz solar del tercio superior de las plantas.
Se realizaron determinaciones del contenido de clorofilas utilizando un medidor de clorofila SPAD-502 PIus, marca Minolta, modelo estándar; el cual mediante la lectura de las absorbancias de la hoja en el rojo y cerca de las regiones infrarroja, calcula un valor numérico en unidades SPAD que es proporcional a la cantidad de la clorofila.
Las clorofilas a, b y totales se determinaron utilizando el método de extracción con acetona, realizando las determinaciones de absorbancia en el espectrofotómetro a longitudes de onda de 660 y 642,5.
Para observar los estomas se realizó un muestreo a los 41 días posteriores a la siembra tomando hojas de la parte superior de la planta realizando las observaciones en la parte central del foliolo y a ambos lados de la nervadura principal; el proceso consistió en realizar un raspado en el lado adaxial de la hoja, una vez obtenida la lámina epidérmica se colocó en un portaobjeto, con una gota de azul de toluidina, durante cinco minutos. Posteriormente se le realizaron dos lavados de cinco minutos cada uno, se le colocó una gota de glicerina y se colocó un cubreobjetos.
Las muestras se observaron en un microscopio óptico de luz (Zeiss) y se fotografiaron con una cámara (Motic) acoplada al mismo.
Las labores culturales y fitosanitarias se realizaron de acuerdo a lo planteado en las Guías Técnicas para el cultivo del frijol (15).
Para el procesamiento de los datos y la comparación de medias en los momentos evaluados, se utilizó el Programa estadístico SPSS 19.0 para Windows (16). Las figuras con los resultados se realizaron mediante el programa SIGMA PLOT 11.0.
RESULTADOS Y DISCUSIÓN
Los datos de temperaturas y de lluvia evidencian que el período experimental se caracterizó por ser relativamente caliente y seco, como se puede observar en las (Figuras 1A y C) debido fundamentalmente a que las temperaturas mínimas y máximas tuvieron muy poca variación y sus rangos de valores estuvieron entre 16 y 18 ºC las mínimas, entre 26 y 30 ºC las máximas y la lluvia acumulada fue de 77 mm equivalentes solo a 6,4 mm semanales.
Por otra parte, la radiación solar mostró un rango de valores entre 19 y 28 Mj m-2 d-1 y los valores más altos se presentaron al final del experimento. La demanda hídrica climática acumulada (ETo) en el período fue de 327 mm, lo que representa una evapotranspiración media diaria de 5 mm.
En general, excepto las temperaturas que fueron relativamente cálidas, aunque se plantea que el frijol puede cultivarse con temperaturas promedio que oscilan de 15 a 27 ºC, con una óptima de 25 ºC (17), aunque en otros trabajos se ha encontrado que el frijol soporta hasta 50 ºC sin que se produzcan daños en sus células (18). Los valores de las precipitaciones y de ETo, son típicas de los meses en que se realizó el experimento.
Los componentes del clima juegan un rol importante en la vida de los organismos vivos y de la naturaleza en su conjunto (19,20), de ahí que se haya planteado que los impactos directos del cambio climático en los sistemas naturales, económicos y sociales, por altas temperaturas y cambios en los patrones de lluvia, son cada vez más evidentes, siendo el sector de la producción primaria uno de los más afectados negativamente.
En la Figura 2 se representan las variaciones del contenido de humedad del suelo, donde se pudo apreciar que en los tratamientos de riego T100 y T100+ QuitoMax® la humedad del suelo siempre se mantuvo por encima del 27 % y a los 40 DDS alcanzó valores máximos de alrededor de 46 % con muy pocas diferencias entre ambos.
En cuanto a T100 y T100+ QuitoMax® los valores de esta variable estuvieron entre el 20 y el 30 % y sólo se encontraron diferencias entre ellos a partir de los 40 DDS. Estos resultados evidencian el efecto de los tratamientos de riego aplicados al cultivo.
El potencial hídrico foliar mostró una respuesta diferenciada tan solo pasaron ocho días de aplicados los mayores valores en las plantas que recibieron un mejor abastecimiento hídrico (Figura 3A). Se aprecia que las diferencias entre los tratamientos se mantuvieron hasta los 20 días posteriores a la aplicación del producto, mostrando el mayor potencial en las plantas mejor abastecidas sin la adición de QuitoMax® con diferencia del que bajo este mismo nivel de humedad del suelo recibió la dosis del producto, una respuesta similar mostraron los tratamientos con menor abastecimiento hídrico, pero con un potencial diferenciadamente superior en las plantas tratadas con el bioestimulante. Estos resultados confirman los planteados por otros autores quienes han señalado las potencialidades de las quitosanas ante condiciones adversas de distinto origen (21,22).
El potencial osmótico actual diferenció la respuesta de las plantas en dos grupos bien definidos según la disponibilidad de agua con que contaron las plantas pero sin diferencia entre los dos tratamientos en cada uno de los casos (Figura 3B), cuestión que debe estar dada por una mayor concentración de solutos en esas plantas al contar con una menor hidratación de sus tejidos según se pudo apreciar en el comportamiento del potencial hídrico foliar.
Por su parte, el potencial de turgencia mostró un comportamiento similar entre los tratamientos mejor abastecidos de agua y el que con la reducción del 50 % del agua disponible recibió las aplicaciones de QuitoMax® sin diferencias entre ellos (Figura 3C), los que a su vez se diferenciaron del menos abastecido de agua y sin el bioestimulante, ratificando el criterio de los efectos positivos de los derivados de quitosano ante condiciones adversas para las plantas.
El potencial osmótico saturado si bien a los ocho días de impuestos los tratamientos no mostraron un comportamiento muy diferente entre ellos (Figura 3D), a partir de ese momento se empezaron a diferenciar y en la última evaluación se evidenció una clara diferencia entre los tratamientos mejor abastecidos de agua y los menos favorecidos, con diferencias en esta última condición entre el tratado con el bioestimulante y el que no se trató, diferencias que parecen indicar la presencia de un ajuste osmótico o quizás una fuerte regulación estomática como vía para evitar las pérdidas de agua vía transpiración.
Esta respuesta de las plantas pudiera estar relacionada con la síntesis de ácido abscísico (ABA) que se produce cuando están en presencia de un estrés de este tipo (23), cuestión que se ha planteado por otros autores quienes han informado que se ha evidenciado que la sequía causa un incremento en la biosíntesis y acumulación del ABA al activar los genes que codifican para las enzimas que participan en la biosíntesis de esta hormona. Este incremento del ABA es la señal que permite amplificar otras cascadas de señalización que al parecer regulan el balance hídrico en la planta y la tolerancia al estrés. De esta forma la síntesis y regulación de este biorregulador constituye un mecanismo de respuesta ante el déficit hídrico del suelo.
La conductancia estomática medida en dos momentos del desarrollo del cultivo mostró los menores valores en el tratamiento que recibió el 50 % del agua necesaria para cubrir su demanda evaporativa (Figura 4A), mientras que esta variable se vio favorecida con la aplicación del QuitoMax® al reflejar estos tratamientos valores superiores o similares al de las plantas que recibieron el 100 % del agua.
Por su parte, el Contenido Relativo de Agua medido en cuatro momentos del desarrollo del cultivo hasta los 49 días posteriores a la siembra (Figura 4B), mostró la tendencia a descender en la medida en que las plantas fueron envejeciendo, así como, los valores extremos se encontraron en los tratamientos que no recibieron aplicaciones del bioestimulante, mientras que el comportamiento de las plantas tratadas con el producto fue similar hasta los 41 días; momento a partir del cual todos los tratamientos se diferenciaron entre sí con los mayores valores en los tratamientos con mayor disponibilidad de agua en el suelo, ocupando una posición intermedia los que recibieron las aplicaciones de QuitoMax®.
El comportamiento de estas variables en condiciones diferenciadas de agua en el suelo es bien conocida para distintos tipos de plantas al igual que para el frijol en el que se ha encontrado una reducción de la conductancia estomática como consecuencia de las regulaciones estomáticas que se producen cuando la disponibilidad de agua en el suelo constituye una limitante para el buen desarrollo de las plantas (24,25). esto explica según se ha planteado a partir de estudios realizados con diferentes variedades de Phaseolus vulgaris y Vigna unguiculata, respectivamente que en estas condiciones se produce una reducción de la conductancia estomática, la transpiración y de la fotosíntesis.
Destacan en este trabajo los tratamientos con la aplicación del bioestimulante en los que esta variable se vio favorecida y seguramente los demás procesos relacionados respecto a las plantas con menor disponibilidad de agua en el suelo y sin la aplicación del bioestimulante.
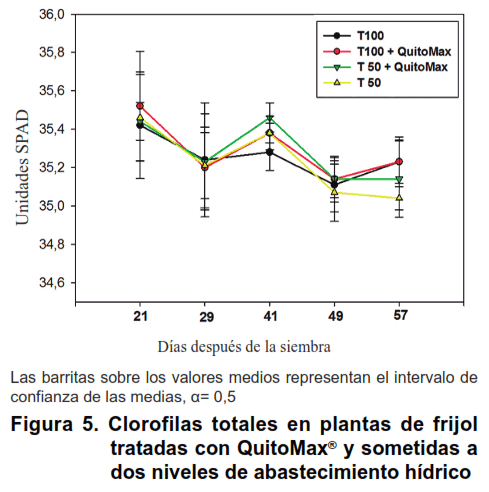
Las clorofilas totales medidas en diferentes momentos del desarrollo de las plantas reflejaron un comportamiento similar entre todos los tratamientos, pues no se evidencian diferencias entre ellos y en los momentos en que más se distanciaron los valores, las diferencias no sobrepasaron 0,2 Unidades SPAD (Figura 5).
Este resultado indica que las plantas en general estuvieron suficientemente abastecidas de nutrientes, principalmente de nitrógeno por lo que la disponibilidad de nutrientes no constituyó una limitante para su normal desarrollo.
Por otra parte, se puede inferir que el sistema fotosintético de las hojas mantuvo su integridad, garantizándose por tanto condiciones favorables para el desarrollo de las plantas, aspectos que han sido señalados por otros autores a partir de trabajos realizados en Coffea canephora Pierre (26).
Como se observa en la Figura 6A, la clorofila a mostró diferencias entre los tratamientos con un comportamiento descendente desde las plantas bien abastecidas de agua hasta las medianamente abastecidas, con diferencias a su vez entre las que aun cuando recibieron las aplicaciones de QuitoMax® contaron con diferente contenido de agua en el suelo, mientras que la clorofila b presentó un comportamiento similar entre los tratamientos aunque con valores superiores en los tratamientos mejor abastecidos de agua y con el menor valor en el que no recibió el bioestimulante y dispuso de una inferior cantidad de agua (Figura 6B).
Al valorar el comportamiento de las clorofilas totales se pudo apreciar que todos los tratamientos se diferenciaron entre sí (Figura 6C), mostrando una respuesta concordante con la mostrada por la clorofila a, lo que indica que fue este tipo de clorofila la que mayor contribución hizo a las clorofilas totales.
Por otra parte, la relación clorofila a/clorofila b siguió el mismo comportamiento que la clorofila a,mostrando el mayor valor en las plantas que no carecieron de agua durante el ciclo del cultivo (Figura 6D), seguido de los tratamientos asperjados con QuitoMax® y la relación inferior en el tratamiento sin producto y con menor disponibilidad de agua. En general se puede decir que la relación entre ambos tipos de clorofila no fue alta.
Se ha demostrado que el déficit hídrico provoca una disminución tanto del crecimiento y desarrollo de las plantas, como del contenido de clorofilas (27,28) al igual que de la relación clorofila a/clorofila b, señalándose que esta disminución de la proporción entre ambos tipos de clorofilas pudiera estar relacionada con limitaciones estomáticas (24).
Al observar el estado de los estomas en los diferentes tratamientos utilizados, se pudo apreciar que estos presentan un estado muy semejante entre ellos, donde al parecer existe un incipiente grado de apertura, lo que pudiera estar relacionado con el diferente grado de polimerización y acetilación de la quitosana utilizada o con las dosis de QuitoMax® empleadas, las que en general fueron bajas en relación con las utilizadas por otros autores quienes han encontrado que la aplicación de quitosano estimula el cierre estomático y por tanto ejerciendo un efecto antitranspirante (9,10,29), aunque es de señalar que otros autores en trabajos realizados en Glycine max y en Zea mays informaron que la quitosana estimuló la apertura estomática y la transpiración (30).
CONCLUSIONES
-
A modos de conclusión se puede señalar que el QuitoMax® aplicado en dos momentos del desarrollo del cultivo a dosis de 200 mg ha-1 favorece el estado hídrico de las plantas cultivadas en condiciones de deficiencia hídrica en el suelo.
-
Por otra parte, se sugiere continuar los estudios relacionados con esta temática teniendo en cuenta que el QuitoMax® podría ser un material prometedor utilizado para reducir el efecto nocivo del estrés hídrico en las plantas.
BIBLIOGRAFÍAS
1. Dorcinvil R, Sotomayor-Ramírez D, Beaver J. Agronomic performance of common bean (Phaseolus vulgaris L.) lines in an Oxisol. Field Crops Research. 2010;118(3):264–72. doi:10.1016/j.fcr.2010.06.003
2. Ramos LR, Montenegro TC, Pereira N. Empelo del quitosano en agricultura. Revista Iberoamericana de Polímeros. 2011;12(4):195–215.
3. Le Mire G, Luan Nguyen M, Fassotte B, du Jardin P, Verheggen F, Delaplace P, et al. Review: implementing plant biostimulants and biocontrol strategies in the agroecological management of cultivated ecosystems. Biotechnology, Agronomy, Society and Environment. 2016;20(Suppl.1):299–313.
4. Wezel A, Casagrande M, Celette F, Vian J-F, Ferrer A, Peigné J. Agroecological practices for sustainable agriculture. A review. Agronomy for Sustainable Development. 2014;34(1):1–20. doi:10.1007/s13593-013-0180-7
5. Calvo P, Nelson L, Kloepper JW. Agricultural uses of plant biostimulants. Plant and Soil. 2014;383(1–2):3–41.
6. Falcón-Rodríguez A, Costales-Menéndez D, Martínez-Téllez MÁ, Ann-Gordon T. Respuesta enzimática y de crecimiento en una variedad comercial de tabaco (Nicotiana tabacum, L.) tratada por aspersión foliar de un polímero de quitosana. Cultivos Tropicales. 2012;33(1):65–70.
7. de Oliveira F de A, de Medeiros JF, de Oliveira MKT, Souza AAT, Ferreira JA, Souza MS. Interação entre salinidade e bioestimulante na cultura do feijão caupi. Revista Brasileira de Engenharia Agrícola e Ambiental. 2013;17(5):465–71. doi:10.1590/S1415-43662013000500001
8. Kim S-K. Chitin, chitosan, oligosaccharides and their derivatives: biological activities and applications. Boca Raton, Fla - London: CRC Press - Taylor & Francis Group; 2011. 643 p.
9. Bittelli M, Flury M, Campbell GS, Nichols EJ. Reduction of transpiration through foliar application of chitosan. Agricultural and Forest Meteorology. 2001;107(3):167–75. doi:10.1016/S0168-1923(00)00242-2
10. Safaei Z, Azizi M, Maryam Y, Aroiee H, Davarynejad G. Effect of Different Irrigation Intervals and Anti-Transpirants Compounds on Yield and Yield Components of Black Cumin (Nigella Sativa). International Journal of Advanced Biological and Biomedical Research. 2014;2(0):326–35.
11. Iriti M, Picchi V, Rossoni M, Gomarasca S, Ludwig N, Gargano M, et al. Chitosan antitranspirant activity is due to abscisic acid-dependent stomatal closure. Environmental and Experimental Botany. 2009;66(3):493–500. doi:10.1016/j.envexpbot.2009.01.004
12. Jiao Z, Li Y, Li J, Xu X, Li H, Lu D, et al. Effects of Exogenous Chitosan on Physiological Characteristics of Potato Seedlings Under Drought Stress and Rehydration. Potato Research. 2012;55(3–4):293–301. doi:10.1007/s11540-012-9223-8
13. Hernández JA, Pérez JJM, Bosch ID, Castro SN. Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA; 2015. 93 p.
14. Allen RG, Pereira LS, Raes D, Smith M. Evapotranspiración del cultivo: Guías para la determinación de los requerimientos de agua de los cultivos [Internet]. Rome, Italy: FAO; 2006 [cited 2017 Feb 16]. 299 p. (Estudio FAO Riego y Drenaje). Available from: http://www.fao.org/docrep/009/x0490s/x0490s00.htm
15. Instituto de Investigaciones Hortícolas. Guía Técnica para el cultivo del frijol. La Habana, Cuba: Liliana Dimitrova; 2000. 38 p.
16. IBM Corporation. IBM SPSS Statistics [Internet]. Version 19.0. U.S: IBM Corporation; 2010. Available from: http://www.ibm.com
17. Barrios EJ, López C, Kohashi J, Acosta JA, Miranda S, Mayek N. Avances en el mejoramiento genético del frijol en México por tolerancia a temperatura alta y a sequía. Revista Fitotecnia Mexicana. 2011;34(4):247–55.
18. Castro-Nava S. Temperatura óptima y etapa fenológica para determinar la termoestabilidad de la membrana celular en maíz y frijol. Phyton (Buenos Aires). 2013;82(2):249–54.
19. Lal R, Delgado JA, Gulliford J, Nielsen D, Rice CW, Pelt RSV. Adapting agriculture to drought and extreme events. Journal of Soil and Water Conservation. 2012;67(6):162A–166A. doi:10.2489/jswc.67.6.162A
20. Al-Kaisi MM, Elmore RW, Guzman JG, Hanna HM, Hart CE, Helmers MJ, et al. Drought impact on crop production and the soil environment: 2012 experiences from Iowa. Journal of Soil and Water Conservation. 2013;68(1):19A–24A. doi:10.2489/jswc.68.1.19A
21. Lizárraga-Paulín EG, Torres-Pacheco I, Moreno-Martínez E, Miranda-Castro SP. Chitosan application in maize (Zea mays) to counteract the effects of abiotic stress at seedling level. African Journal of Biotechnology. 2011;10(34):6439–46. doi:10.5897/AJB10.1448
22. Yan J, Cao J, Jiang W, Zhao Y. Effects of preharvest oligochitosan sprays on postharvest fungal diseases, storage quality, and defense responses in jujube (Zizyphus jujuba Mill. cv. Dongzao) fruit. Scientia Horticulturae. 2012;142:196–204. doi:10.1016/j.scienta.2012.05.025
23. Rosabal-Ayan L, Martínez-González L, Reyes-Guerrero Y, Núñez-Vázquez M. Resultados preliminares del efecto de la aplicación de Biobras-16 en el cultivo del frijol (Phaseolus vulgaris L.). Cultivos Tropicales. 2013;34(3):71–5.
24. Cardona-Ayala C, Jarma-Orozco A, Áramendiz-Tatis H, Peña-Agresott M, Vergara-Córdoba C. Respuestas fisiológicas y bioquímicas del fríjol caupí (Vigna unguiculata L. Walp.) bajo déficit hídrico. Revista Colombiana de Ciencias Hortícolas. 2014;8(2):250–61.
25. Pedroza-Sandoval A, Trejo-Calzada R, Sánchez-Cohen I, Samaniego-Gaxiola JA, Yánez-Chávez LG. Evaluación de tres variedades de frijol pinto bajo riego y sequía en Durango, México. Agronomía Mesoamericana. 2016;27(1):167–76. doi:10.15517/am.v27i1.21896
26. Netto AT, Campostrini E, Oliveira JG de, Bressan-Smith RE. Photosynthetic pigments, nitrogen, chlorophyll a fluorescence and SPAD-502 readings in coffee leaves. Scientia Horticulturae. 2005;104(2):199–209. doi:10.1016/j.scienta.2004.08.013
27. Abdelraouf RE, El-Habbasha SF, Hozayn M, Hoballah E. Water Stress Mitigation on Growth, Yield and Quality Traits of Wheat (Triticum aestivum L.) Using Biofertilizer Inoculation. Journal of Applied Sciences Research. 2013;9(3):2135–45.
28. Abu-Muriefah SS. Effect of chitosan on common bean (Phaseolus vulgaris L.) plants grown under water stress conditions. International Research Journal of Agricultural Science and Soil Science. 2013;3(6):192–9.
29.Issak M, Okuma E, Munemasa S, Nakamura Y, Mori IC, Murata Y. Neither Endogenous Abscisic Acid nor Endogenous Jasmonate Is Involved in Salicylic Acid-, Yeast Elicitor-, or Chitosan-Induced Stomatal Closure in Arabidopsis thaliana. Bioscience, Biotechnology, and Biochemistry. 2013;77(5):1111–3. doi:10.1271/bbb.120980
30. Sharp R. A Review of the Applications of Chitin and Its Derivatives in Agriculture to Modify Plant-Microbial Interactions and Improve Crop Yields. Agronomy. 2013;3(4):757–93. doi:10.3390/agronomy3040757
Recibido: 05/12/2016
Aceptado: 21/04/2017
Dr.C. Donaldo Morales-Guevara, Instituto Nacional de Ciencias Agrícolas. Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email:dmorales@inca.edu.cu