Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop vol.39 no.1 La Habana ene.-mar. 2018
ARTÍCULO ORIGINAL
Nematodos fitoparásitos asociados al cultivo de la caña de azúcar (Saccharum officinarum L.) en la provincia guantánamo, Cuba
Phyto-parasitic nematodes associated with cultivation of sugar cane (Saccharum officinarum L.) in Guantanamo province, Cuba
M.Cs. Midiala Peña-Prades,I Noris Olivares-Reyes,II Dra.C. Mérida Rodríguez-Regal,I M.Cs. Leonides Peña-Rivera,I Agustín Cobas-Elías,I Gerardo Cervera-Duverger,I Odalis Barquié-PérezI
IInstituto de Investigaciones de la Caña de Azúcar. Habana. Cuba. Grupo de Extensión y Servicios Agrícolas (GESA) Guantánamo Km 1½. Carretera a El Salvador, Montesano. Guantánamo.
IILaboratorio de Nematología. Dirección de Protección Fitosanitaria Guantánamo. Km 1½ Carretera a El Salvador, Montesano. Guantánamo. Cuba.
RESUMEN
Los nematodos fitoparásitos se asocian a afectaciones en el desarrollo y producción de los cultivos agrícolas, reconociéndose como uno de los factores limitantes en los rendimientos. La necesidad de actualizar el registro de estos organismos asociados a la caña de azúcar en la provincia Guantánamo, constituyó el objetivo principal de esta investigación. Para ello se procesaron muestras de suelo y raíz, tomadas en dos unidades productoras de caña. La determinación de géneros y especies se realizó en el Laboratorio de Nematología de la Dirección Provincial de Sanidad Vegetal, además se caracterizó la población mediante la determinación de los índices de riqueza de género y especies de Margaleff y el índice de dominancia de Berger Parker. Se identificaron 24 especies de fitonematodos agrupados en 16 géneros, y Pratylenchus como el género de mayor representación con cinco especies. Estos resultados constituyen una contribución al conocimiento de la nematofauna asociada al cultivo de la caña de azúcar en la provincia.
Palabras clave: densidad de la población, Meloidogyne, Pratylenchus.
ABSTRACT
Phyto-parasitic nematodes are associated with affectations in the development and production of agricultural crops, recognized as one of the limiting factors on yields. The need to update the record of these organisms associated with sugar cane in Guantanamo province was the main objective of this research. For this, soil and root samples taken in two cane production units were processed. The determination of genera and species was conducted at the of Laboratory Nematology of the Provincial Directorate of Plant Protection, also the population was characterized by determining indices of genus and species richness of Margaleff and dominance index of Berger Parker. 24 species of phyto-parasitic nematodes grouped in 16 genera were identified, and Pratylenchus as the most represented genus with 5 species. These results constitute a contribution to knowledge of the nematodes composition associated with the cultivation of sugarcane in the province.
Key words: population density, Meloidogyne, Pratylenchus.
INTRODUCCIÓN
Los nematodos fitoparásitos constituyen plagas de los agroecosistemas y se considera que ejercen una importante influencia en su estructura y estabilidad. Se conocen 4,105 especies de fitonematodos, las cuales causan pérdidas anuales entre 11 y 14 % de la producción en cultivos de importancia económica como leguminosas, granos, banano, yuca, coco, remolacha azucarera, caña de azúcar, papa, hortalizas y varios frutales; equivalentes a 80 billones de USD por año (1).
Los daños que ocasionan frecuentemente los nematodos, se atribuyen a causas más evidentes como son las deficiencias nutricionales o el estrés hídrico entre otras, dado que es imposible observarlos a simple vista en el campo y a que los síntomas que producen son inespecíficos, por ende, los agricultores y los técnicos a menudo subestiman sus efectos (2). Algunos estudios indican que la capacidad de causar daño de los nematodos se ve favorecida por factores edafoclimáticos y agronómicos como el monocultivo (3), las altas precipitaciones (4) y los suelos arenosos (5).
El problema del parasitismo por nematodos en caña de azúcar es un hecho reconocido, en aquellos países donde éste cultivo es de importancia económica (6). En los últimos años se han realizado esfuerzos en el estudio y control de ésta plaga con el fin de disminuir su daño y obtener mejores cosechas (6-8). la mayoría de esas investigaciones indican que los nematodos inciden en la malformación de las plantas de caña de azúcar y en la merma de su rendimiento (9). En los Estados Unidos, el promedio estimado de pérdidas debidas a nematodos en áreas cañeras fue del 4 % (10). En Costa Rica, estudios preliminares realizados en diferentes áreas cañeras, revelaron la existencia de altas poblaciones de nematodos fitoparásitos asociados a plantas de aspecto raquítico y de baja producción (11); por tanto, el análisis de la densidad de población es importante para determinar las estrategias de control de estos patógenos (12). Se ha observado, además, que el aumento del rendimiento en caña de azúcar, es concomitante con la reducción brusca de la densidad de la comunidad de nematodos poco después de la plantación y la cosecha (13).
Por otra parte, los rendimientos agrícolas de la caña de azúcar en la provincia de Guantánamo han declinado en los últimos años, desde 45,3 t ha-1 en el año 2007 hasta 25,1 t ha-1 en el año 2010 (14). Esta reducción podría estar asociada, entre otras causas (15), a la presencia de nematodos fitoparásitos.
A pesar de la importancia de estos factores, los estudios de nematodos en caña de azúcar en Cuba son muy escasos y se remontan a casi tres décadas atrás. Por estas razones, el objetivo de este trabajo consistió en identificar la nematofauna asociada a este cultivo en dos unidades de producción de caña en la provincia Guantánamo; así como, estimar la densidad y distribución poblacional de los géneros y especies más comunes en el campo.
MATERIALES Y MÉTODOS
El estudio se desarrolló en la provincia Guantánamo, en dos Unidades Básicas de Producción Cooperativa (UBPC) La Esperanza y Mártires de Barbados, pertenecientes a los municipios Manuel Tames (localidad de Argeo Martínez) y Guantánamo (localidad de Paraguay) respectivamente, en el período comprendido de junio a noviembre de 2014.
Para el muestreo de suelo y raíces se seleccionaron tres campos de tres bloques cañeros de la cepa retoño. La información primaria del área en estudio se muestra en la Tabla I. Se tuvieron en cuenta los cuatro cultivares principales de la provincia en cuanto al porcentaje de área plantada.
El experimento se realizó en cinco estaciones de muestreo, una en cada esquina y en el centro del campo. Cada estación fue conformada por dos surcos de tres metros de largo y en cada una de ellas se tomaron cuatro sub-muestras correspondientes a cuatro plantones. Las porciones de suelo y de raíces se tomaron en el área de la rizosfera de cada plantón seleccionado, por debajo de los primeros 5 cm y hasta los 30 cm de profundidad. De esta forma, la muestra de cada campo estuvo conformada por 20 sub-muestras de suelo y raíces, extraídas con la ayuda de pico y pala, mezcladas homogéneamente. de ellas se tomó una porción de 500 g de suelo y 100 g de raíces, las que se guardaron juntas en una bolsa plástica de 2 kg para ayudar a conservar las raíces, evitando la desecación. Las bolsas se etiquetaron debidamente con los datos correspondientes a cada plantación y se trasladaron para su procesamiento al Laboratorio Provincial de Sanidad Vegetal. Se tomó, además, una fracción de suelo adicional en cada campo para el montaje de la técnica de las plantas indicadoras.
Los nematodos se extrajeron por el método de Fenwick modificado para cistógenos y para la extracción de vermiformes por el método de decantación-tamizado (16). Los recobrados se depositaron en embudos Baermann (17). La identificación de las especies de fitonematodos se realizó mediante métodos morfológicos y morfométricos, a partir de las claves y referencias taxonómicas utilizadas en este tipo de investigación (18-22). Las poblaciones de nematodos se contaron y expresaron como número de individuos en 25 g de suelo y número de nematodos en 25 g de raíz fresca.
Simultáneamente se realizó el montaje de plantas indicadoras en las bolsas que contenían sólo suelo, en las que se sembraron tres semillas de calabaza. A los 35 días de haber germinado y crecido las plantas, se llevaron al Laboratorio para determinar la presencia o no de nematodos formadores de agallas y determinar género y especie, así como la gradología, por la metodología de Zeck (23).
Los datos se analizaron por medio de la estadística descriptiva, se determinó la frecuencia de aparición y la densidad poblacional expresadas en porcentaje, de cada género de nematodos en cada localidad estudiada y de forma general.
Para caracterizar el patrón de las comunidades de especies y géneros en las dos localidades muestreadas, se realizaron los cálculos de dos índices (24):
Índices de Riqueza de Género y especies de Margaleff. DMg= (S-1)/ln N
Índice de Dominancia de Berger Parker. BP = N máx/N
N = Número de individuos
S= Número de géneros
RESULTADOS Y DISCUSIÓN
Géneros y especies de nematodos fitoparásitos más frecuentes. Densidad poblacional
El análisis de las muestras definió 16 géneros de nematodos fitoparásitos asociados con el cultivo de la caña de azúcar en las zonas muestreadas, de ellos 15 se encontraron en el suelo y 12 en las raíces. Los géneros Criconemoides, Paratrophurus, Psilenchus y Trophurus se encontraban presentes en las muestras de suelo, pero no en las de raíces, así como Rotylenchus fue encontrado en las muestras de raíces y no en las de suelo (Tabla II).
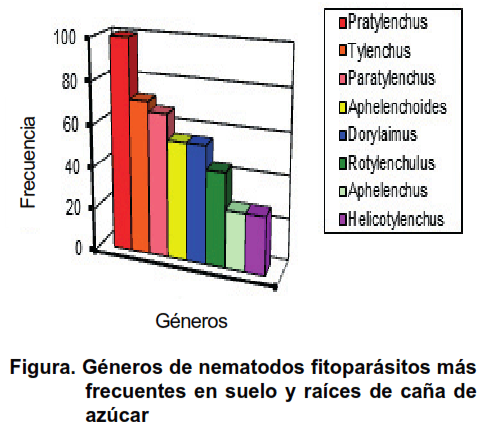
De forma general, los géneros de nematodos más frecuentes fueron Pratylenchus (100 %), Tylenchus (72 %), Paratylenchus (67 %), Aphelenchoides y Dorylaimus (55 %), mientras que las poblaciones más altas fueron observadas en los géneros Pratylenchus (21,5 %), Paratylenchus (14,4 %), Dorylaimus (11,4 %) y Rotylenchulus (11,2 %), de un total de 2106 individuos (Figura). Otros géneros de nematodos encontrados en orden de porcentaje de ocurrencia en el total de las muestras fueron Rotylenchulus (44 %), Aphelenchus y Helicotylenchus (27 %).
Varios autores señalan que Helicotylenchus, Pratylenchus y Trichodorus son los géneros de mayor dispersión en plantaciones de caña de azúcar a nivel mundial (12). En Brasil predominan Pratylenchus y Meloidogyne, mientras que en diversas zonas de Australia aparecen ampliamente distribuidas especies de Pratylenchus, Meloidogyne y Helicotylenchus (25). En la India, se identificaron ocho géneros de nematodos fitopatógenos de importancia en caña de azúcar (26), entre ellos: Heterodera, Rotylenchus, Hoplolaimus, Longidorus, Tylenchus, Aphelenchoides, Pratylenchus y Meloidogyne. En Venezuela Pratylenchus zeae Graham se informa como una de las especies más abundantes, encontrándose en los estados Aragua, Carabobo y Yaracuy (27). Como puede observarse, Pratylenchus es el género común en todos estos estudios de nematofauna asociada a este cultivo.
Los nematodos pueden provocar numerosos síntomas, entre ellos amarillamiento generalizado, clorosis y achaparramiento en las plantas, sintomatología que guarda estrecha relación con las densidades poblacionales de los mismos (28). Estos patógenos, después de penetrar a la raíz se nutren de las células causando lesiones, al principio pequeñas, que aumentan de tamaño gradualmente. Además, los daños causados por los fitonematodos en las raíces son reflejados en los tejidos aéreos como crecimiento deficiente de los tallos, clorosis de las hojas y muerte de las plantas, debido a una reducida absorción de agua y nutrientes por las raíces secundarias (29).
Los nematodos del género Pratylenchus conocidos como lesionadores de las raíces, son endoparásitos migratorios que penetran al sistema radical y se alimentan de las células, pasando de una raíz a otra. En consecuencia, las raíces están poco desarrolladas, pobres en raíces secundarias, deficientes e imposibilitadas para desempeñar sus funciones. Las aberturas en las raíces son fuente de entrada a hongos y bacterias patógenas, lo que agrava en mayor grado al sistema radical de la planta. Pratylenchus sp. ha formado parte de complejos con Fusarium sp., Pythium sp. y otros géneros de patógenos fúngicos (30).
En este estudio, se encontró al género Pratylenchus como el más frecuente y de mayor población, apareciendo en el 100 % de las muestras analizadas. Este hecho, puede estar incidiendo en los bajos rendimientos agrícolas obtenidos en caña de azúcar en las dos zonas estudiadas. Se han informado afectaciones del rendimiento en caña de azúcar, al realizar estudios relacionados con la nematofauna asociada a este cultivo en diferentes regiones del mundo (6,10,12,13).
En el estudio se identificaron un total de 24 especies de nematodos en los campos muestreados, de ellas 24 en suelos y 18 en raíces (Tabla III).
Se informan a escala global en caña, la presencia de más de 275 especies de 48 géneros (31). Sin embargo, en Cuba se encontró en este cultivo 72 especies en suelo y 62 en las raíces (32). Otros investigadores informan 83 especies (33), mientras que en la provincia Granma, se registraron 36 especies de nematodos agrupados en 15 géneros en áreas dedicadas a la producción de caña (34).
Por otra parte, se encontraron diferencias notables en la población de las localidades estudiadas, incluso a nivel de campos muestreados; en este sentido se destaca la UBPC Mártires de Barbados con una población total de 1400 individuos. En esta localidad, la mayor población (201 individuos) se encontró en el campo uno del bloque 11. Paratylenchus fue el género más frecuente con el 100 % de aparición en los campos muestreados, lo que le da el carácter de dominancia sobre el resto de los géneros, seguido de Tylenchus (77,8 %), Aphelenchoides (55,6 %) y Dorylaimus (44,4 %). A su vez la mayor cantidad de individuos se encontró en los géneros Paratylenchus (21 %), Dorylaimus y Pratylenchus (10 %).
En la UBPC La Esperanza, predominaron los géneros Pratylenchus (77, 8 %), Aphelenchoides, Dorylaimus y Tylenchus con el 66,7 % de frecuencia. La mayor población en esta localidad se encontró en los géneros Dorylaimus (13,8 %), seguido de Helicotylenchus y Aphelenchoides con el 12,2 % y Rotylenchulus (7,2 %) de un total de 706 nematodos presentes en las muestras.
Existen especies que se diagnosticaron en una localidad determinada, este es el caso de Aphelenchus sp., H. multicinctus (Cobb) Golden, H. dihystera (Cobb) Sher, Paratrophurus sp. y Trophurus sp., que únicamente se encontraron en las muestras de suelos de la UBPC La Esperanza, así como Pratylenchus scribneri (Steiner) que sólo se observó en las muestras de raíces.
Diversidad y riqueza de géneros en las localidades muestreadas
Los índices de diversidad biológica nos permiten determinar la variedad de organismos que forman parte de un ecosistema. Los valores calculados del índice de Margaleff para las localidades muestreadas, revelan la mayor riqueza de géneros (2,21) en las muestras de suelo de la UBPC La Esperanza, seguido de las muestras de suelo de la UBPC Mártires de Barbados (1,56), lo que indica, que la comunidad de géneros de nematodos identificados y cuantificados en las muestras de suelo son los más diversos (Tabla IV). Para este índice, valores inferiores a dos son zonas de baja diversidad y los valores superiores a cinco son indicativos de alta biodiversidad (35).
Los mayores valores del índice de Dominancia de Berger Parker se presentan en las muestras de suelo y raíces de la UBPC Mártires de Barbados. Esta es una medida que expresa la importancia proporcional de los géneros más abundantes, dado por el género Pratylenchus, que representa el 61 % de los nematodos identificados en las muestras de suelo y el 77 % en las raíces. Este resultado indica que en esta zona Pratylenchus domina sobre el resto de los géneros identificados.
Según lo planteado por algunos autores (28), para conseguir un control efectivo de las enfermedades causadas por nematodos fitoparásitos es necesario reducir sus densidades de población para minimizar la severidad de la enfermedad y las pérdidas en los rendimientos que éstos patógenos ocasionan; por tanto, se debe tener en cuenta este resultado en el manejo integrado de plagas en esta UBPC, con medidas que estén dirigidas fundamentalmente a este género, que tiene la mayor población en las muestras analizadas.
Para el índice de Berger Parker normalmente se adopta su recíproco, y los valores obtenidos demuestran que un incremento en el valor de éste, acompaña un incremento de la diversidad y una reducción de la dominancia y con ello una mayor uniformidad (24). Los valores de este índice nos indican que la comunidad de nematodos en la UBPC La Esperanza en las muestras de suelo y raíces es más diversa y la dominancia de géneros es menor con respecto a la localidad de Paraguay, y a su vez es la comunidad más uniforme, ya que se identificaron 18 y 13 especies de nematodos en suelo y raíces respectivamente (Tabla V).
En estudios similares realizados en la provincia Granma (34), se encontraron valores del índice de Margaleff de 1,37 en las muestras de suelo en Bancos de Semilla Registrada, y de 1,29 en las muestras de las raíces de áreas de producción. Esto denota que son zonas de baja diversidad de géneros al estar por debajo de dos los valores del índice de Margaleff calculados.
Resultados del montaje de las plantas indicadoras
Se informan cientos de géneros de nematodos fitoparásitos a nivel mundial; sin embargo, sólo un número reducido se reconocen como causantes de los principales impactos en los cultivos agrícolas. El género Meloidogyne se considera como el de mayor importancia económica (dentro de éste, M. incognita es la especie más dañina), y a continuación se ubican otros como Bursaphelenchus, Globodera, Heterodera, Pratylenchus, Radopholus, Rotylenchulus y Xiphinema (36). Como consecuencia de la creciente inquietud de los agricultores por los nematodos formadores de agallas y de las limitaciones de los nematicidas químicos debido a sus efectos negativos en los agroecosistemas, se hace necesario desarrollar alternativas para resolver esta problemática (37-40).
El montaje de plantas indicadoras de nematodos cecidógenos se realizó en el 100 % de las muestras; sin embargo, sólo dieron positivas para la especie Meloidogyne incognita (Kofoid y White) Chitwood, los campos uno y tres del bloque 19 de la UBPC Mártires de Barbados.
La morfología de los nematodos formadores de agallas cambia durante su ciclo de vida y se caracteriza por presentar un marcado dimorfismo sexual (21). Por otra parte, los niveles poblacionales y duración del ciclo de vida del género Meloidogyne, dependen de su adaptación al ambiente físico y biológico del suelo, su compatibilidad con la planta hospedante y el consiguiente acceso a fuentes de nutrientes (41). Esto provoca que el diagnóstico de éste género sea difícil, lo que puede haber influido en que no se haya podido detectar su presencia en el análisis de las muestras de suelo. Sin embargo, con la técnica de las plantas indicadoras, aún con bajos niveles poblacionales del nematodo, al ser colocados frente a un hospedero alternativo y en buenas condiciones de humedad y temperatura se favorece el desarrollo del mismo, completando su ciclo de vida hasta llegar a formar las agallas en las raíces de las plantas de calabaza fácilmente detectables a simple vista.
En estudios similares (13), se reportó la especie Meloidogyne sp., apareciendo en cuatro de los nueve distritos muestreados cultivados con caña de azúcar, en Luisiana, Estados Unidos.
Los resultados obtenidos en este estudio demuestran la presencia de nematodos fitoparásitos en las plantaciones cañeras de las unidades productoras estudiadas, que pueden estar influyendo en los resultados agroproductivos del cultivo. Varios autores han encontrado efectos depresivos del rendimiento entre un 17 y un 20 %, causado por nematodos fitoparásitos (42,43).
CONCLUSIONES
-
Se identificaron 24 especies de fitonematodos asociados al cultivo de la caña de azúcar en la provincia Guantánamo, agrupados en 16 géneros, siendo el género Pratylenchus el más frecuente y el más abundante.
-
La mayor riqueza de géneros se encontró en las muestras de suelo.
-
La especie Meloidogyne incognita se diagnosticó sólo en la localidad de Paraguay.
RECOMENDACIONES
Estudiar la nematofauna existente en las localidades de Manuel Tames y Cuneira, representativas de otras zonas edafoclimáticas de la provincia.
Ejecutar estudios con diferentes métodos de control para poder recomendar una estrategia de lucha contra los nematodos fitoparásitos asociados a la caña de azúcar.
BIBLIOGRAFÍA
1. Agrios GN. Plant pathology. 5th ed. Amsterdam ; Boston: Elsevier Academic Press; 2005. 922 p.
2. Fernández, G. E. Manejo de fitonemátodos en la agricultura cubana. Fitosanidad [Internet]. 2007;11(3). Disponible en: http://www.fitosanidad.cu/index.php/fitosanidad/article/view/193.
3. Chen P, Tsay TT. Effect of crop rotation on Meloidogyne spp. and Pratylenchus spp. Populations in Strawberry Fields in Taiwan. Journal of Nematology. 2006;38(3):339-44.
4. Masse D, Manlay RJ, Diatta M, Pontanier R, Chotte JL. Soil organic matter dynamic and nutrients balance in a short-term fallows with different types of vegetation experiments in Senegal. Soil Use Manage. 2004;20:92-5.
5. Starr JL, Heald CM, Robinson AF, Smith RG, Krausz JP. Meloidogyne incognita and Rotylenchulus reniformis and associated soil textures from some cotton production areas of texas. Journal of Nematology. 1993;25(4 Suppl):895-9.
6. Desgarennes D, Carrión G, Núñez-Sánchez ÁE, Zulueta R, Zárate-Contreras JA. Nematofauna asociada a la rizósfera de Saccharum officinarum en la región Costa-Centro de Veracruz, México. Agrociencia. 2011;45(7):785-95.
7. Rivas, B. O, Gandarilla, B. H, Fernández, G. E. Fitonemátodos asociados a los cultivos de frutos tropicales. Fitosanidad [Internet]. 2014;18. Disponible en: http://www.redalyc.org/articulo.oa?id=209143451009>
8. Mondino EA, Tavares OCH, Lima E, Berbara RLL. Comunidades de nemátodos en caña de azúcar bajo diferentes sistemas de labranza y cosecha [communities of nematodes in sugarcane under different tillage and harvest systems]. Nematropica. 2010;40(2):203.
9. Abrego L, Tarjan AC. Reconocimiento de nematodos en cultivos de importancia economica en el Salvador. Nematropica. 1972;2(2):27-9.
10. Koenning SR, Overstreet C, Noling JW, Donald PA, Becker JO, Fortnum BA. Survey of crop losses in response to phytoparasitic nematodes in the United States for 1994. Journal of Nematology. 1999;31(4S):587-618.
11. Ramirez AR. Muestreo poblacional de nemátodos fitoparásitos en caña de azúcar. En: Resúmenes II Congreso Agronómico Nacional. San José, Costa Rica; 1976. p. 37.
12. Severino JJ, Dias-Arieira CR, Tessmann DJ. Nematodes associated with sugarcane ( Saccharum spp.) in sandy soils in parana, brazil. Nematropica. 2010;40(1):111-9.
13. Bond JP, McGawley EC, Hoy JW. Distribution of plant-parasitic nematodes on sugarcane in louisiana and efficacy of nematicides. Journal of Nematology. 2000;32(4S):493-501.
14. Fuentes M, González R. La reconversión azucarera en la provincia de Guantánamo, Cuba. Una mirada desde lo local. Retos de la Dirección. 2012;6(1):60-79.
15. González CM. La agroindustria cañera cubana: transformaciones recientes [Internet]. Bildner Center for Western Hemisphere Studies; 2015. 131 p. Disponible en: http://www.gc.cuny.edu/CUNY_GC/media/365-Images/SugarEbook.pdf
16. García O. Métodos de extracción de nemátodos del suelo y tejido vegetal. información Técnica. 1979;2(4):1-42.
17. Barker KR, Carter CC, Sasser JN, editores. Ecology of Meloidogyne spp.: Emphasis on enviromental factors affecting survival and pathogenicity. En: An advanced treatise on meloidogyne. Raleigh, N.C., U.S.A: Dept. of Plant Pathology, North Carolina State University; 1985.
18. Siddiqi MR. Tylenchida: Parasites of plants and insects. CABI; 2000. 856 p.
19. Loof P a. A, Luc M, Baujard P. A revised polytomous key for the identification of species of the genus Xiphinema Cobb, 1913 (Nematoda: Longidoridae) with exclusion of the X. americanum group: Supplement 2. Systematic Parasitology. 1996;33(1):23-9. doi:10.1007/BF01526631
20. Rahaman PF, Ahmad I. Hemicriconemoides variabilis sp. n. and two known species of hemicriconemoides from india. Nematología Mediterránea. 1995;23(2):158-63.
21. Hunt, D. J, Luc, M, Manzanilla, R. H, editores. Identification, morphology and biology of plant parasitic nematodes. En: Plant parasitic nematodes in subtropical and tropical agriculture. 2nd ed. Wallingford, Oxfordshire, UK ; Cambridge, MA: CABI Pub; 2005. p. 11-52.
22. Hunt, D. J, Handoo, Z. A. Taxonomy, identification and principal species. En: Root-knot Nematodes. 1st ed. CAB International,Wallingford; 2009.
23. Pérez GY, Ayala SJL, Calero H A. Aplicación del Trichobiol 34 PH en el control de nemátodos en casas de cultivo. Centro Agrícola. 2014;41(3):43-5.
24. Magurran AE. Diversidad ecológica y su medición. Barcelona: Vedra; 1989. 200 p.
25. Blair BL, Stirling GR, Pattemore JA, Whittle PJL. Occurrence of pest nematodes in Burdekin and central Queensland sugarcane fields. En: Proceedings of the 1999 Conference of the Australian Society of Sugar Cane Technologists. [Internet]. 1999 [citado 22 de marzo de 2018]. p. 227-33. Disponible en: https://www.cabdirect.org/cabdirect/abstract/19991700666
26. Shireesha, R, Vanita, D. V. Identification of plant nematodes in sugarcane. Journal of Pharmaceutical Sciences and Research. 2014;6(11):389-91.
27. Crozzoli R, Jiménez-Pérez N. Una revisión de las especies de nemátodos fitoparásitos en Venezuela. Revista de la Facultad de Agronomía. 2015;41(3):117-26.
28. Gómez, I, Pantaleón G, Cabrera, M. Impacto de los nemátodos fitoparásitos en el sistema radicular de la caña de azúcar en el área de influencia del central Motzorongo. In: Congreso de la ATAM, Mexico; 2012. Available from: http://www.atamexico.com.mx/wp-content/uploads/2017/11/9.-PÖSTERES.pdf
29. Guzmán, P. O, Castaño, Z. J, Villegas, E. B. Principales nemátodos fitoparásitos y síntomas ocasionados en cultivos de importancia económica. Estimación histopatológica del grado de infección inducido por stagonospora nodorum (berk.) castellani & germano en plántulas de trigo (triticum aestivum l.). Agronomía. 2012;20(1):38-50.
30. Rodríguez MG, Sánchez L. Nemátodos asociados a plantas de caña de azúcar en Cuba con síntomas de amarillamiento (YLS) y sin estos. Protección Vegetal. 2002;17(1):59-63.
31. Shireesha R, Vanita V. Studies of plant parasitic nematodes in sugarcane plants in nizamabad district (Telangana), India. The International Journal of Science & Technology [Internet]. 2014;2(13). Disponible en: http://www.theijst.com/force_download.php?file_path=wp-content/uploads/2015/01/32.-ST1412-076.pdf&id=956.
32. O´Relly J. Análisis ecotaxonómico de los nemátodos de la caña de azúcar Saccharum sp.(Híbrido) en Cuba. [ACC , La Habana]: Tesis de Candidato a Doctor; 1979. 163 p.
33. Fernández, M, Ortega, J. Lista de nemátodos fitoparásitos de Cuba. Cuba: Científico Técnica; 1986. 76 p.
34. Loddo VZ, Rivas BO, Rodríguez RM, Granado RC, Llorente GE. Fitonemátodos asociados al cultivo de la caña de azúcar en la región sur oriental de Cuba. In: IX Congreso Científico Internacional del Instituto Nacional de Ciencias Agrícolas, Cuba; 2014.
35. Margalef R. Teoría de los sistemas ecológicos. Barcelona: Universitat de Barcelona; 1994. 290 p.
36. Fernández Gonzálvez E. Manejo de fitonemátodos en la agricultura cubana. Fitosanidad. 2007;11(3):57-60.
37. Collange B, Navarrete M, Peyre G, Mateille T, Tchamitchian M. Root-knot nematode (Meloidogyne) management in vegetable crop production: The challenge of an agronomic system analysis. Crop Protection. 2011;30(10):1251-62. doi:10.1016/j.cropro.2011.04.016
38. Kayani MZ, Mukhtar T, Hussain MA. Evaluation of nematicidal effects of Cannabis sativa L. and Zanthoxylum alatum Roxb. against root-knot nematodes, Meloidogyne incognita. Crop Protection. 2012;39(1):52-6. doi:10.1016/j.cropro.2012.04.005
39. Dong L, Huang C, Huang L, Li X, Zuo Y. Screening plants resistant against Meloidogyne incognita and integrated management of plant resources for nematode control. Crop Protection. 2012;33(1):34-9. doi:10.1016/j.cropro.2011.11.012
40. Solano, C. T. F, Agurto, C. G. B, Quezada, Z. C. R, Ruiz, T. J. Efecto de extractos de Tagetes spp. y Melia azedarach L. sobre el nemátodo Meloidogyne incognita (Kofoid and White) Chitwood. Centro Agrícola. 2013;40(4):87-93.
41. Van Gundy SD. Ecology of Meloidogyne spp.: Emphasis on enviromental factors affecting survival and pathogenicity. En: An Advanced Treatise on Meloidogyne. 1.a ed. 1985. p. 178-82.
42. Román J, Grullón L. Estudio preliminar sobre los nemátodos asociados con la caña de azúcar en la República Dominicana. Nematrópica. 1974;4(2):18.
43.Ramírez A. Reconocimiento de nemátodos asociados con la caña de azúcar en Costa Rica. Agronomía Costarricense. 1978;2(1):39-46.
Recibido: 06/09/2016
Aceptado: 12/10/2017
M.Cs. Midiala Peña-Prades, Instituto de Investigaciones de la Caña de Azúcar. Habana. Cuba. Grupo de Extensión y Servicios Agrícolas (GESA) Guantánamo Km 1½. Carretera a El Salvador, Montesano. Guantánamo. Email: midiala.pp@inicagm.azcuba.cu