Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936versión On-line ISSN 1819-4087
cultrop vol.39 no.3 La Habana jul.-set. 2018
ARTÍCULO ORIGINAL
Tiamina como promotora del crecimiento inicial en variedades de caña de azúcar
Thiamine as a promoter on initial development in varieties of sugarcane
Lucas A. Manzani-Lisboa, Gabriel Combinato, Lucas Boaventura-Scavacini, Laura H. da Silva, Paulo A. Monteiro-de Figueiredo
São Paulo State University (Unesp), College of Agricultural and Technological Sciences, Dracena, SP, Brazil
RESUMEN
El objetivo de este trabajo es conocer la respuesta de la tiamina como promotora de crecimiento en variedades de caña de azúcar. Se instaló un experimento mediante un diseño completamente aleatorizado en esquema factorial doble en los niveles 3x4, en el cual el primer factor consiste en variedades de caña de azúcar, siendo ellas: RB86-7515; RB96-6928 y CTC-4; El segundo factor fueron dosis de tiamina variando en cinco niveles, o sea: cero mg L-1; 100 mg L-1; 200 mg L-1; 400 mg L-1 y 800 mg L-1; que representan 15 tratamientos con cinco repeticiones, totalizando 75 parcelas. Cuarenta y cinco días después de la siembra se determinaron las siguientes variables: IVE - índice de velocidad de emergencia; AFM – área foliar media; CPA – longitud de la parte aérea; MSPA – masa seca de la parte aérea; MSR – masa seca de raíz; DX – diámetro de los vasos xilemáticos de la hoja y DF – diámetro de los vasos floemáticos de la hoja. Se recomienda el uso de 400 mg L-1 de Tiamina como promotora de crecimiento en las variedades RB86-7515; RB96-9628 y CTC-4. El índice de velocidad de emergencia y el diámetro de los vasos xilemáticos de las hojas de la variedad CTC-4 presentó una respuesta negativa al uso de la Tiamina. Sin embargo, como el trabajo se llevó a cabo sólo una vez es necesario realizar más estudios para la comprobación de los resultados.
Palabras clave: Saccharum sp., vitamina, masa seca; vasos xilemáticos, vasos floemáticos.
ABSTRACT
This work aims to know thiamine response as a growth promoter in sugarcane varieties. A completely randomized experimental was installed and designed in a double factorial scheme at 3x4 levels, in which the first factor consists of a variety of sugarcane: RB86-7515; RB96-6928 and CTC-4; the second factor was thiamine doses in five levels: zero mg L-1; 100 mg L-1; 200 mg L-1; 400 mg L-1 and 800 mgL-1; fifteen treatments were made with five replications, 75 plots in total. Forty five days after planting the following variables were determined: ESI – emergence speed index; ALA – average leaf area; APL – aerial part length; DMAP – dry mass of aerial part ; DMR – dry mass of root; XD – leaf xylem vessel diameter and PD – leaf phloem vessel diameter. It is recommended doses of 400 mg L-1 Thiamine use as a promoter of growth in varieties RB86-7515; RB96-9628 and CTC-4 of sugarcane. Emergence speed index and diameter of xylem vases of leafs in CTC-4 varieties showed a negative response to Thiamine use. However, since the work was conducted only once, more studies are needed to prove the results.
Key words: Saccharum sp., vitamin, dry mass, xylematyc vasess, phloematic vases.
INTRODUCCIÓN
Es perceptible que las raíces de una planta son tan grandes como su capacidad de explorar el suelo disponible, nutrientes y agua. Se ha demostrado que la mayor parte del sistema de raíces en la caña de azúcar se encuentra en los primeros 0,30 cm de suelo (1).
El sistema radicular de la caña representa un importante campo de estudio, ya que tiene un papel esencial en la regeneración de la ración después de la cosecha, además, influye directamente en la eficiencia de la absorción de nutrientes en las plantas, en la resistencia a los términos secos y en la tolerancia al ataque de plagas, que afectan el desarrollo de toda la planta. Sin embargo, el sistema radicular de la caña de azúcar ha sido relegado a investigaciones, debido a la dificultad de acceso y visualización, principalmente en evaluaciones al aire libre (2).
La forma activa de la vitamina B, el pirofosfato de tiamina (TPP), es un cofactor indispensable para las enzimas específicas que actúan sobre el metabolismo de los aminoácidos y los carbohidratos. Su biosíntesis ocurre por la formación independiente de sus compuestos, como piridina y tiazol. La ruta de síntesis de la vitamina B en procariotas se ha aclarado; sin embargo, faltan estudios con respecto a los eucariotas. En Arabidopsis thaliana, la proteína Thi1 es probablemente responsable de la síntesis tiazólica, una vez que se encontró un compuesto para TPP en su estructura (3). La propagación vegetativa de las papas en cultivos líquidos, a medida que se utilizaron diferentes concentraciones de ácido pantoténico, vitaminas y tiamina condujo a una respuesta positiva sobre la tasa de multiplicación del material vegetal (4).
El uso de la tiamina puede provocar cambios en la anatomía de la planta, visibles a simple vista que, de hecho, se derivan de cambios en las estructuras de la epidermis, tejidos fundamentales o vasculares de las plantas, por lo que es necesario tener un conocimiento profundo de estas transformaciones causadas por cambios en el entorno (5). La sintomatología es ampliamente utilizada para evaluar el daño causado por factores bióticos o abióticos. En este caso, los aspectos estructurales ayudan a comprender los mecanismos que causan las lesiones (6).
Este trabajo tiene como objetivo conocer las diferentes respuestas, utilizando la tiamina como promotor del crecimiento en variedades de caña de azúcar.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en la Facultad de Ciencias Agrícolas y Tecnológicas de la Universidad Estatal de São Paulo, en Dracena, Estado de São Paulo, Brasil, con coordenadas geográficas: 21° 29’10,24 “S y 51 ° 31’ 41,29” O, con un promedio de 411 m sobre el nivel del mar, en abril de 2016.
El clima local, según la clasificación de Köppen, es del tipo Cwa: clima cálido en verano y seco en invierno, con las mayores tasas de lluvia entre noviembre y marzo. El promedio anual de temperatura varía entre 30,4 °C y 19,2 °C, la precipitación promedio de 1 311,6 mm y la humedad del aire del 78 %.
El suelo se recolectó en la profundidad de 30-50 cm y se clasificó como Argissolo rojo amarillo (7), con los parámetros químicos que se muestra en la Tabla (8).
El diseño experimental fue completamente aleatorizado con tres variedades de caña de azúcar: RB86-7515; RB96-6928 y CTC-4; el segundo factor se refiere a las dosis de tiamina, en cinco niveles diferentes: nulo L-1; 100 mg L-1; 200 mg L-1; 400 mg L-1 y 800 mg L-1; dentro de 15 tratamientos y 5 repeticiones, 75 parcelas en total.
Las parcelas se plantaron en macetas de plástico, con una capacidad de 9 dm3 de suelo tamizado y se corrigieron de acuerdo con los requerimientos nutricionales del cultivo, se usaron los fertilizantes de urea, súper simple y cloruro de potasio. El experimento fue instalado y conducido en un ambiente desprotegido y regado de acuerdo con el factor de humedad del suelo.
Durante los 30 primeros días se evaluó o se calculó: IVE-índice de velocidad de emergencia, de acuerdo con la fórmula de cálculo IVE= PN/NDTE, en la cual PN=número de cultivador emergente y NDTE=Número de días de emergencia de la caña. Cuarenta y cinco días después de la siembra, se evaluaron o calcularon las siguientes variables: AFM-área foliar promedio (9) y NH=número de hojas; CPA-longitud de la parte aérea, establecida a través de una regla graduada de un centímetro; MSPA-masa seca de la parte aérea y MSR - masa seca de la raíz, en la que toda la masa verde desarrollada se secó en un horno de laboratorio con circulación y renovación del aire a una temperatura de 65 ºC, hasta alcanzar un peso constante. Para el tratamiento fueron utilizadas 10 plantas.
Cuarenta y cinco días después de la siembra, también se evaluaron las características ultraestructurales de la hoja de caña de azúcar, del fragmento cinco con cinco centímetros de la región media de las hojas del tercio medio central del tallo y un fragmento de cinco centímetros de la región de la raíz media. Los fragmentos fueron transportados al Laboratorio de Morfofisiología Vegetal y Forrajes en la Facultad de Ciencias Agrícolas y Tecnológicas - Universidad Estatal de São Paulo. Todo el material recogido se sumergió en F.A.A. 70 (formaldehído al 37 %, ácido acético y 70 % de etanol en la relación de 1,0: 1,0: 18,0 - V / V).
Después de 24 horas, los fragmentos se lavaron y almacenaron en etanol al 70 % hasta la fecha de los análisis (10). Todos los fragmentos de tejidos vegetales recibieron los procedimientos pertinentes para la deshidratación, la diafanización, la inclusión y la incrustación, mediante el uso de un microtomo Leica que contiene cuchillas de acero, se realizaron secciones transversales de 8 μm en cada fragmento incrustado.
Las primeras secciones transversales sin daños causados por el corte de los tejidos de las plantas, se eligieron para la preparación de los portaobjetos histológicos. Las mismas se fijaron con parches (albúmina), se tiñeron con safranina con una proporción de 1 % y se colocaron en microscopio y portaobjetos de vidrio con parche Entellan® (10).
Todas las diapositivas se observaron con un microscopio óptico Olympus modelo BX 43, con una cámara adjunta para realizar las fotografías de los cortes. Las imágenes se usaron para medir parámetros anatómicos a través del software cellSens Standart que se calibró con una regla microscópica con las mismas ganancias (11).
Mediante el uso de secciones transversales, se midieron las siguientes características anatómicas de morfología: diámetro de los vasos xilemáticos de las hojas (DX) y diámetro de los vasos floemáticos de las hojas (DF). Se realizaron cinco mediciones para todas las características en cada portaobjetos de microscopio. Las parcelas se representaron por el valor promedio obtenido en cada característica.
Todas las variables se sometieron a la prueba F (p<0,05) y el análisis de regresión se aplicó a las dosis de tiamina, en las cuales se probaron sus modelos: lineal, cuadrático y cúbico (12). Se usó el software estático Assistat 7.7 (13).
RESULTADOS Y DISCUSIÓN
Como se muestra en la Figura 1, se observó un efecto cuadrático significativo en las dosis de tiamina en los tipos de caña de azúcar RB86-7515 y RB96-9628 en el índice de velocidad de emergencia variable, sin embargo, se observó un efecto lineal decreciente a la variedad CTC-4.
Los picos de dosis de 400 y 350 mg L-1 de tiamina se observaron en las variedades RB86-7515 y RB96-9628, que muestran una respuesta positiva en la velocidad de emergencia en la caña de azúcar. Sin embargo, el uso de tiamina en CTC-4 no fue significativo por su aplicación. Debido a la estimulación desencadenada por el uso de tiamina en la fisiología de las gemas de caña de azúcar, su aparición fue elevada; sin embargo, cuando hubo un aumento en las dosis de este compuesto, hubo una disminución en este índice donde las dosis superiores a 400 mg L-1 de tiamina, en solución, fueron dañinas para el cultivo de la caña de azúcar. Los resultados contrarios fueron observados cuando se estudió la propagación del roble brasileño (14), ya que no se observó una respuesta positiva al uso de tiamina en la participación del roble, que no lanzó nuevos brotes.
Se sabe que la tiamina es un precursor de la molécula NAD (15), que es importante en el balance energético en la cadena de transporte de electrones, que puede desempeñar un papel clave en la disponibilidad de energía, en el crecimiento de brotes de caña de azúcar, en las primeras etapas de desarrollo; además, actúa sobre la biosíntesis de la molécula de tiazol, como precursor de las enzimas descarboxilasas que favorecen a la verdura.
Se observó un efecto cuadrático significativo sobre el uso de tiamina en variedades de caña de azúcar en el área foliar promedio, como se muestra en la Figura 2.
Puntos máximos de 349,28; 359,83 y 403,27 mg L-1 se observaron respectivamente en RB86-7515, RB96-9628 y CTC-4, lo que demuestra la eficacia del uso de este compuesto en el cultivo de la caña de azúcar, ya que proporcionó un aumento en su área de la hoja hasta la dosis de 400 mg L-1. En el caso de que una planta tenga un área foliar más grande, su tasa fotosintética se potencia y, en consecuencia, se produce un aumento en su crecimiento (16).
La acción de tiamina sobre la síntesis de tiazol debería ocurrir en cloroplastos (17), mientras que el paso final de pirofosforilación de tiamina a difosfato (DPT), aparentemente ocurre exclusivamente en el citosol, que luego sirve como cofactor en reacciones enzimáticas que ocurren en la mitocondria, lo que puede favorecer el suministro de energía a las células. A menos que se descubran rutas alternativas de tiamina en las mitocondrias y los cloroplastos, los orgánulos importantes promueven un mayor índice de área foliar en estas plantas, lo que influye en el crecimiento de su parte aérea (3,18), como se muestra en la Figura 3.
Se observó un efecto cuadrático en la variable de longitud de la parte aérea en las variedades RB86-7515, RB96-9628 y CTC-4 cuando se sometió al uso de tiamina, en el que alcanzaron sus picos de crecimiento en dosis de 437,00; 253,5 y 272,77 mg L-1, respectivamente.
El desarrollo de la parte aérea de la planta está directamente relacionado con la tasa de asimilación del carbono de la fotosíntesis en las hojas (19), ya que, debido a su elevación de la parte aérea de la hoja, puede contribuir a su desarrollo, demandando una mayor cantidad de energía para su metabolismo de proteína estructural (3,15) y promoviendo un mayor retraso de carbono atmosférico en su masa seca parte aérea, de acuerdo con la Figura 4.
Las variedades RB86-7515, RB96-9628 y CTC-4 mostraron un efecto cuadrático significativo en la masa seca variable de la parte aérea. Nuevamente, las dosis de tiamina alrededor de 400 mg L-1 tuvieron resultados positivos, debido al gran proceso metabólico que ocurre en la parte aérea de las plantas, principalmente en las hojas. La tiamina puede haber proporcionado una mayor eficiencia en estos procesos, ya que proporciona una mayor cantidad de energía a su metabolismo (15,20), en el que la tiamina puede sufrir fosforilación en su grupo hidroxilo, con el fin de producir ésteres de monofosfato, difosfato y trifosfato. Entonces DPT actúa como un cofactor de deshidrogenasa mitocondrial piruvato durante la glucosa y favorece la disponibilidad de energía.
Otros factores pueden influir en el desarrollo de la parte aérea y en la acumulación de la masa seca, tales como: la luminosidad (11), los nutrientes e incluso, la presencia de metales pesados que liberan estrés oxidativo en la planta, que inicia esos metales en sus tejidos (17, 21), en el que la acción de la tiamina favorece el estrés antioxidante a través de la enzima descarboxilasa en su fisiología (18,20,22).
El desarrollo de la parte aérea se puede potenciar con la mayor absorción de nutrientes y agua por el sistema radicular, como se indica en la Figura 4B. Se ha informado que los propágulos de pachulí que permanecen con las hojas, tienen un mayor porcentaje de enraizamiento (23).
Se observó un efecto cuadrático significativo en RB86-7515, RB96-9628 y CTC-4 sometidos a dosis de tiamina, que mostraron un desarrollo creciente de la raíz hasta una dosis cercana a los 400 mg L-1. Las plantas necesitan tiamina para el desarrollo de la raíz (17); sin embargo, algunas especies, como el trébol, no tienen tiamina como requisitos para esa función. Debido a una mayor provisión de tiamina a las células apicales del tallo y la raíz, se favorece su crecimiento, lo que muestra que la caña de azúcar es susceptible al uso de tiamina en las fases de establecimiento del cultivar en su sustrato, principalmente en su desarrollo radicular.
Este aumento en el desarrollo de los órganos del vegetal, como la hoja, el tallo y la raíz, está relacionado con la biosíntesis de moléculas orgánicas y la acumulación de carbono mediante la fotosíntesis. El metabolismo de las verduras se puede mejorar o maximizar ya que sus tejidos muestran un mayor desarrollo y desempeñan sus funciones en sus órganos, como se muestra en la Figura 5.
El xilema muestra funciones específicas al organismo vegetal, de esa manera se destaca entre los tejidos principales del vegetal, ya que presenta capacidad de transporte de savia, rica en sales provenientes del suelo.
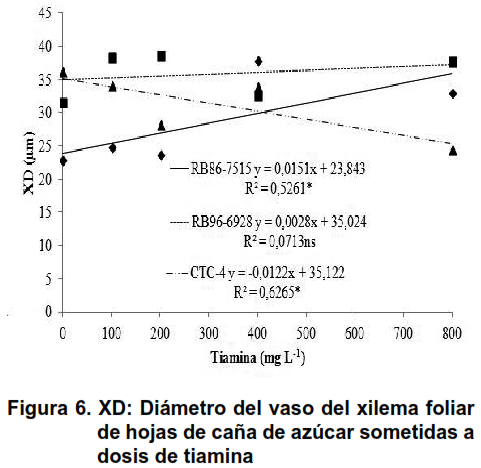
Como se ha descrito (24), estos tejidos transportan tiamina de origen exógeno, independientemente de las condiciones energéticas disponibles para el metabolismo vegetal. De esta forma, se observó un efecto lineal significativo sobre el diámetro variable de los vasos de xilema de las hojas de caña de azúcar en las variedades RB86-7515 y CTC-4, que no ocurrió en la variedad RB96-9628, como se muestra en la Figura 6.
La variedad RB86-757 tuvo una respuesta positiva al uso de tiamina, ya que el CTC-4 tuvo un resultado opuesto, con una respuesta negativa. Estos resultados no se esperaban, ya que las otras variedades respondieron positivamente, lo que hace necesarios más estudios.
Con el aumento del diámetro de los vasos de xilema, el volumen de savia no metabolizada pudo haber ocurrido proporcionalmente a este aumento. De esta forma, una mayor disponibilidad de sal, de agua y minerales a las hojas, conduce a un mayor retraso de la masa seca en la parte aérea (Figura 4A). Una mayor eficiencia de las materias absorbidas por el xilema podría haber proporcionado un mejor desarrollo del floema de las hojas y la raíz.
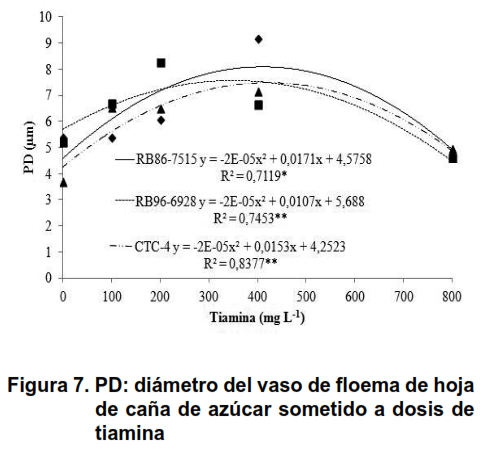
Se ha informado que el exudado de xilema muestra una mayor concentración de sustancias como la putrescina y la espermidina, en el grupo de poliaminas, lo que demuestra que las sustancias se transportan por toda la planta (25). Esta translocación de larga distancia, también respalda la hipótesis de que las poliaminas tienen un papel regulador en el crecimiento de la planta, así como su respuesta al estrés, que muestra la translocación de tiamina a través de este tejido (26,27). La presencia de tiamina en el metabolismo de la planta, causada por la distribución de este compuesto por los vasos conductores puede haber causado un aumento en el diámetro de los vasos del floema, como se muestra en la Figura 7.
Después de la distribución de tiamina a otras áreas del vegetal, a través del xilema y el floema, este compuesto cumple su función como precursor del pirofosfato de tiamina (TPP) (17), que comienza a actuar como un cofactor indispensable para las enzimas ligadas al metabolismo de carbohidratos y amino ácidos, su biosíntesis se produce por la formación independiente de sus compuestos, principalmente pirimidina y tiazol (3,15,20,28), de esa manera el metabolismo de las células de la caña de azúcar se vio beneficiado por la presencia de tiamina.
CONCLUSIONES Y RECOMENDACIONES
-
El índice de velocidad de aparición y el diámetro de vasos de xilema de hojas en variedades CTC-4 mostraron una respuesta negativa al uso de tiamina.
-
Dado que el trabajo se realizó una sola vez, se necesitan más estudios para probar los resultados.
-
Se recomiendan dosis de 400 mg L-1 de uso de tiamina como promotor de crecimiento en las variedades RB86-7515; RB96-9628 y CTC-4 de la caña de azúcar.
BIBLIOGRAFÍA
1. Silva OAM, Cerri CEP, Cerri CC. Comparação de métodos de amostragem para avaliação do sistema radicular da cana-de-açúcar. Revista de Ciencias Agrícolas. 2017;34(1):7–16. doi:10.22267/rcia.173401.59
2. Aquino GS de, Medina C de C, Porteira JAL, Santos LO, Cunha ACB, Kussaba DAO, et al. Sistema radicular e produtividade de soqueiras de cana‑de‑açúcar sob diferentes quantidades de palhada. Pesquisa Agropecuária Brasileira. 2015;50(12):1150–9.
3. Garcia AF, Dyszy F, Munte CE, Demarco R, Beltramini LM, Oliva G, et al. THI1, a protein involved in the biosynthesis of thiamin in Arabidopsis thaliana: Structural analysis of THI1(A140V) mutant. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 2014;1844(6):1094–103. doi:10.1016/j.bbapap.2014.03.005
4. Pereira JES, Fortes GR de L. Protocolo para produção de material propagativo de batata em meio líquido. Pesquisa Agropecuária Brasileira. 2003;38(9):1035–43.
5. Raven PH, Evert RF, Eichhorn SE. Biologia vegetal. 8va ed. Guanabara Koogan: Guanabara Dois; 1978. 850 p.
6. Figueiredo PAM, Ramos SB, Viana RS, Lisboa LAM, Heinrichs R. Alterações morfoanatômicas foliares da cana-de-açúcar na fase de estabelecimento em condições de matocompetição. Planta Daninha. 2013;31(4):777–84. doi:10.1590/S0100-83582013000400003
7. Embrapa Solos. Sistema brasileiro de classificação de solos. 3ra ed. Brasilia, Brasil: Embrapa; 2013. 353 p.
8. Raij B van, Cantarella H, Quaggio JA, Furlani A MC. Recomendações de adubação e calagem para o Estado de São Paulo. 2da ed. Campinas , Brazil: IAC Campinas; 1996. 285 p.
9. Easlon HM, Bloom AJ. Easy Leaf Area: Automated Digital Image Analysis for Rapid and Accurate Measurement of Leaf Area. Applications in Plant Sciences. 2014;2(7):1–4. doi:10.3732/apps.1400033
10. Reis AR, Barcelos JPQ, Osório CRW, Santos EF, Lisboa LAM, Santini JMK, et al. A glimpse into the physiological, biochemical and nutritional status of soybean plants under Ni-stress conditions. Environmental and Experimental Botany. 2017;144:76–87. doi:10.1016/j.envexpbot.2017.10.006
11. Lisboa LAM, Alves VG da C, Viana R da S, Figueiredo PAM, Lavres J, Gratão PL. Desenvolvimento Inicial Da Cultura Da Cana-De-Açúcar Submetida a Estresse Luminoso. Revista Mirante. 2015;8(3):60–9.
12. Banzatto DA, Kronka S. Experimentação Agrícola. 4 ed. Jaboticabal,Brasil: Funep; 2013. 237 p.
13. Silva F de AS, Azevedo CAV de. The Assistat Software Version 7.7 and its use in the analysis of experimental data. African Journal of Agricultural Research. 2016;11(39):3733–40. doi:10.5897/AJAR2016.11522
14. Dorigon EB, Pomicinski SA. Macropropagação De Carvalho Brasileiro (roupala Brasiliensis Klotzsch): Submetida À Fitoextratos Vegetais, Tiamina E Ácido Indolbutírico. Unoesc & Ciência - ACET. 2014;5(2):173–80.
15. Chatterjee A, Jurgenson CT, Schroeder FC, Ealick SE, Begley TP. Biosynthesis of Thiamin Thiazole in Eukaryotes: Conversion of NAD to an Advanced Intermediate. Journal of the American Chemical Society. 2007;129(10):2914–22. doi:10.1021/ja067606t
16. Clemente PRA, Bezerra BKL, Silva VSG da, Santos JCM, Endres L. Root growth and yield of sugarcane as a function of increasing gypsum doses. Pesquisa Agropecuária Tropical. 2017;47(1):110–7.
17. Goyer A. Thiamine in plants: Aspects of its metabolism and functions. Phytochemistry. 2010;71(14–15):1615–24. doi:10.1016/j.phytochem.2010.06.022
18. Souza MVN de, Ferreira SB, Mendonça JS, Costa M, Rebello FR. Métodos de obtenção e aplicações sintéticas de tiazóis, uma importante classe de compostos heterocíclicos. Química Nova. 2005;28(1):78–83. doi:10.1590/S0100-40422005000100016
19. Taiz L, Zeiger E. Fisiologia vegetal [Internet]. 6ta ed. Porto Alegre, Brasil: Artmed; 2017 [cited 2018 Jun 5]. 858 p. Available from: http://loja.grupoa.com.br/livros/botanica/fisiologia-e-desenvolvimento-vegetal/9788582713662
20. Woodward JB, Abeydeera ND, Paul D, Phillips K, RapalaKozik M, Freeling M, et al. A Maize Thiamine Auxotroph Is Defective in Shoot Meristem Maintenance. The Plant Cell. 2010;22(10):3305–17. doi:10.1105/tpc.110.077776
21. Oliveira RS de, Santos DALQ, Cavalcanti JR de A, de Araujo HJT, Silva CM. Determinação de chumbo e cádimo em açúcar comercializado na cidade de Recife. Revista de Engenharia e Pesquisa Aplicada. 2016;2(1):556–60. doi:10.25286/repa.v2i1.513
22. Begley TP, Begley SE, McLafferty FW. Thiamin biosynthesis: still yielding fascinating biological chemistry. Biochemical Society Transactions. 2012;40(3):555–60. doi:10.1042/BST20120084
23. Garbuio C, Biasi LA, Kowalski AP de J, Signor D, Machado EM, Deschamps C. Propagação Por Estaquia Em Patchouli Com Diferentes Números De Folhas E Tipos De Estacas. Scientia Agraria. 2007;8(4):435–8. doi:10.5380/rsa.v8i4.9893
24. Rebeille F, Douce R. Biosynthesis of Vitamins in Plants Part A [Internet]. Cambridge , Massachusetts, E.U: Academic Press; 2011 [cited 2018 Jun 5]. 322 p. Available from: https://books.google.com/books/about/Biosynthesis_of_Vitamins_in_Plants_Part.html?hl=es&id=63j-A2U9FdMC
25. Friedman R, Levin N, Altman A. Presence and identification of polyamines in xylem and phloem exudates of plants. Plant physiology. 1986;82(4):1154–7. doi:10.1104/pp.82.4.1154
26. Martinis J, Gas Pascual E, Szydlowski N, Crèvecoeur M, Gisler A, Bürkle L, et al. Long-Distance Transport of Thiamine (Vitamin B 1 ) is Concomitant with That of Polyamines. Plant Physiology. 2016;171(1):542–53. doi:10.1104/pp.16.00009
27. Tetyuk O, Benning UF, Hoffmann BS. Collection and Analysis of Arabidopsis Phloem Exudates Using the EDTA-facilitated Method. Journal of Visualized Experiments. 2013;80(80):1–11. doi:10.3791/51111
28. Dare AP, Yar KY, Tomes S, McGhie TK, Rebstock RS, Cooney JM, et al. Silencing a phloretin-specific glycosyltransferase perturbs both general phenylpropanoid biosynthesis and plant development. The Plant Journal. 2017;91(2):237–50. doi:10.1111/tpj.13559
Recibido: 31/10/2017
Aceptado: 17/05/2018
Lucas A. Manzani-Lisboa. São Paulo State University (Unesp), College of Agricultural and Technological Sciences, Dracena, SP, Brazil. Email: mailto:lucas.lisboa@unesp.br