INTRODUCCIÓN
La importancia de aumentar los rendimientos de los cultivos en los sistemas de agricultura de subsistencia, caracterizados por un uso mínimo de fertilizantes minerales pasa por mejorar las interacciones de microorganismos beneficiosos-raíz-suelo que conducen a rendimientos más altos de los cultivos 1. El efecto en las leguminosas de coinoculación con simbióticos fijadores de nitrógeno y los géneros no simbióticos que promueven el crecimiento de plantas (PGPRs), están ganando cada vez más interés dentro de la fijación biológica de nitrógeno actual y se han propuesto como una nueva herramienta biotecnológica para mejorar el rendimiento y la sostenibilidad 2.
A. brasilense es una rizobacteria promotora del crecimiento de plantas fijadoras de nitrógeno (PGPR), con un potencial importante como biofertilizante para plantas leguminosas y no leguminosas. Cultivos de importancia agrícola, especialmente la caña de azúcar, se han inoculado a menudo con A. brasilense, lo que produce un aumento en los parámetros de crecimiento y rendimiento en diferentes suelos y regiones climáticas 3. Se han propuesto diferentes mecanismos de acción para explicar la mejora del crecimiento de las plantas, como la proliferación del sistema radical 4. La estimulación del crecimiento, generalmente se debe a la producción de fitohormonas como las auxinas, citoquininas, giberelinas 5,6. Además, se ha descrito la inducción de la tolerancia al estrés de las plantas y los genes de defensa 7.
La aplicación combinada de bacterias del género Rhizobium o Bradyrhizobium con Azospirillum, produjo un efecto positivo en las leguminosas 8. El efecto positivo da como resultado nodulación temprana, aumento en el número de nódulos, actividad de la nitrogenasa y la respiración de la raíz, así como una mejora general en la absorción de agua y nutrientes por parte de las raíces. Las características de PGPR de Azospirillum pueden ser la razón de su efecto sobre las coinoculaciones de leguminosas, que se relacionarían con la inducción de un mayor número de pelos radicales infectantes, diferenciados de las células epidérmicas y un aumento en la secreción de flavonoides que inducen genes nod9.
El intercalamiento de cultivos es un método sostenible que se utiliza para maximizar la utilización de los recursos disponibles y podría mejorar la biodiversidad de los suelos. En suelos tropicales se ha comprobado que el cultivo intercalado de gramíneas con leguminosas representa un conjunto de ventajas, entre las cuales podemos destacar, la contribución del nitrógeno al suelo y la obtención de producciones adicionales de fibra, grasa y alimentos 10. Además, el intercalamiento de cultivos mejora la resiliencia, la seguridad alimentaria 11 y la nutrición.
En experimentos de campo, en suelos cubanos de intercalamiento de caña de azúcar inoculada con A. brasilense y soya no inoculada10, se han observado aumentos en la mayoría de los parámetros de crecimiento de la caña de azúcar, pero no se conocen los efectos producidos por la inoculación de Azospirillum en la otra planta intercalada. El objetivo de este trabajo fue evaluar, bajo condiciones controladas, el efecto de A. brasilense 8-INICA y B. japonicum USDA-110 por separado y la coinoculación de los dos microorganismos sobre la altura de la planta, peso fresco de tallo y raíces, peso seco de nódulos, así como actividad nitrogenasa en nódulos de las raíces de soya (Glycine max (L) Merr), con énfasis en la colonización de la raíz de soya por Azospirillum.
MATERIALES Y MÉTODOS
Cepas
A. brasilense cepa 8-INICA aislada de rizosfera de caña de azúcar cv. Ja 60-5 en la provincia de Ciego de Ávila, Cuba 12 cultivada en medio NFb a 28 ºC, 100 rpm y mantenida en caldo BMS 13 con glicerol al 20 % (v/v) a -80 ºC. B. japonicum cepa USDA-110 14 donada por el Centro de Investigación y Formación Agraria Las Torres-Tomejil (Sevilla, España), cultivada y mantenida en medio Vincent 15.
Crecimiento de las plantas y actividad nitrogenasa
Las semillas de soya (Glycine max cv. Williams) se esterilizaron superficialmente en HgCl2 al 0,1 % durante 5 min y luego se lavaron varias veces con agua destilada estéril. Las semillas se sembraron en frascos Leonard de 1 L pasados por autoclave llenos de vermiculita estéril y se inocularon con 1 mL de A. brasilense 8-INICA o B. japonicum USDA-110 en suspensiones con concentraciones del orden 108 unidades formadoras de colonias (UFC. mL-1). Los tratamientos fueron: plantas no inoculadas regadas con una solución de nitrato de potasio conteniendo 35 ppm de nitrógeno (tratamiento control); plantas inoculadas solo con A. brasilense 8-INICA; plantas inoculadas solo con B. japonicum USDA-110 y plantas inoculadas con los dos microorganismos. Los tratamientos de inoculación se regaron con una solución nutritiva libre de nitrógeno. Las soluciones nutritivas fueron reemplazadas tres veces por semana. Las condiciones de la cámara de crecimiento fueron: un fotoperíodo de 16 h de luz/8h de oscuridad, 25 ºC día/15 ºC de temperatura nocturna, 58 % de humedad relativa y un nivel de irradiación de 200 μm m-2 s-1. Se usaron tres réplicas para plantas inoculadas y no inoculadas. Después de cinco semanas, las plantas se recolectaron para determinaciones de parámetros de crecimiento de plantas y para microscopía. Se determinó la altura de la planta, el peso fresco de los tallos y las raíces, el peso seco de los nódulos y la actividad nitrogenasa en los nódulos. La actividad nitrogenasa se midió mediante el ensayo de reducción de acetileno (ARA) en raíces noduladas de plantas inoculadas con Bradyrhizobium y coinoculadas con Bradyrhizobium + Azospirillum respectivamente siguiendo el método descrito por otros autores 16.
Anticuerpos contra Azospirillum
Se obtuvieron anticuerpos contra Azospirillum para confirmar que la cepa de Azospirillum inoculada fue la misma que la que se encontró en las raíces de soya. La cepa A. brasilense 8-INICA se cultivó como se indicó anteriormente durante 24 h, en un volumen conocido de medio BMS. Se concentraron las células y se añadió formaldehído estéril al sedimento para lograr una concentración final de 5 por 1000 y se dejó durante la noche a 27 ºC. Posteriormente se centrifugaron a 5000 rpm durante 5 min. El sedimento se lavó con solución salina tamponada con fosfato estéril pH 7,2 (PBS) y se suspendió en PBS estéril pH 7 hasta alcanzar 109 cel.mL-1, medida por densidad óptica a 680 nm. Los sedimentos finales se suspendieron en cantidades iguales de adyuvante completo de Freund. Se obtuvo antisuero en conejos blancos por vía de inmunización intravenosa, una inyección cada ocho días durante cinco semanas. La sangre se recogió ocho días después de la última inyección. El suero de purga final de cada conejo se recogió mediante centrifugación de la sangre coagulada a 2.000 g y se almacenó a -20 ºC. Se obtuvieron sueros de preinmunización de cada conejo.
Procesamiento de muestreo para microscopía
Solamente las plantas inoculadas con Azospirillum fueron procesadas para microscopía. Para probar la especificidad del antisuero, los cultivos in vitro de Azospirillum se incluyeron primero en agar 17. Las piezas de agar se procesaron como muestras de raíces para embeberse en resina LR-White 18. Se seleccionaron pequeños trozos de raíces frescas para una etapa de desarrollo comparable. Las muestras se tomaron en el momento de la cosecha, se cortaron con una cuchilla de afeitar, se fijaron en glutaraldehído al 2,5 % (v/v) en 50 mM de cacodilato de Na, pH 7,4 y se infiltraron al vacío para mejorar la penetración del fijador. La deshidratación se realizó utilizando una serie de etanol y los nódulos se infiltraron y finalmente se incluyeron en LR-White Resin (London Resin Corporation) mediante polimerización por calor a 60 °C durante 24 h en cápsulas de gelatina 19. Se cortaron secciones semi-gruesas (1 μm) y ultrafinas (70 nm-espesor) en un ultramicrotomo Reichert Ultracut S para microscopía óptica y microscopía electrónica, respectivamente. Las secciones semi-gruesas se tiñeron con azul de toluidina al 1% (p/v) en borato de sodio acuoso (1 %) para examen directo utilizando un fotomicroscopio Zeiss Axiophot
Microscopía óptica y electrónica: inmunocitoquímica y silver enhancement
Para la inmunocitoquímica y el silver enhancement, se colocaron portaobjetos de vidrio con secciones de 1 µm de espesor a 37 ºC, durante la noche para asegurar la adhesión de las secciones. Las secciones se lavaron a fondo en PBS, pH 7,2, que contenía gelatina pura al 0,01 %, BSA al 0,1 % y azida sódica al 0,05 %. El bloqueo de los sitios de unión inespecíficos se logró mediante la incubación de secciones en la solución anterior que contenía 20 mg de albúmina de suero bovino (BSA) por mL, durante 20 minutos a temperatura ambiente. La incubación en anticuerpos primarios (anti-A. Brasilense 8-INICA) diluidos 1: 500 en el mismo tampón, se llevó a cabo durante 1 h en horno a 37 ºC. Las secciones se enjuagaron luego en PBS y el exceso de tampón se eliminó suavemente. La incubación con conjugado de oro anti-conejo de cabra (GAR 15 nm; BioCell, Cardiff, U.K.) diluido 1:40 en PBS se realizó durante 1 hora a temperatura ambiente. Las secciones se enjuagaron luego en PBS y agua destilada. El silver enhancement se llevó a cabo con el kit IntenSE M (Amersham, Buckinghamshire, U.K.) y se permitió que progresara mientras se controlaba bajo el microscopio 19. Las secciones se enjuagaron luego enérgicamente con agua del grifo y agua destilada, se tiñeron con 0,05 % (w/v) de fucsina básica (Carlo Erba, Milano, Italia) en etanol acuoso al 5 % (v/v), se enjuagaron y se dejaron secar. Las secciones fueron montadas y fotografiadas bajo un fotomicroscopio Zeiss Axiophot. Para microscopía electrónica, se recogieron secciones (de 70 nm de espesor) en rejillas de níquel e inmunorotuladas 18. La contracción de las secciones se obtuvo con acetato de uranilo acuoso al 2 % (5 min) y citrato de plomo durante 2 min. Después de enjuagar y secar al aire, se examinaron las secciones utilizando un microscopio electrónico STEM LEO 910 a un voltaje de aceleración de 80 kV.
RESULTADOS Y DISCUSIÓN
La capacidad de A. brasilense para estimular el crecimiento de las plantas ha sido ampliamente demostrada 5,7. Informes anteriores han demostrado que la coinoculación de Rhizobium y Azospirillum mejoró la nodulación y el rendimiento de las plantas leguminosas 2. En nuestros resultados, la inoculación de A. brasilense 8-INICA no produjo cambios en la altura y la biomasa de las partes aéreas de la planta, ni en la actividad nitrogenasa (Tabla 1). Sin embargo, se observó un aumento del 61,8 % en el peso de la raíz, con respecto al control, en plantas inoculadas solamente con Azospirillum, mientras que se observó un aumento de solo el 6 % en plantas inoculadas sólo con Bradyrhizobium; no obstante, la coinoculación produjo un aumento del 11 % en este parámetro. Se observó un aumento en el peso de los nódulos del 78,9 % en plantas inoculadas, conjuntamente con plantas inoculadas solamente con Bradyrhizobium. Dado que el aumento en el peso de los nódulos no se tradujo en un aumento en la actividad nitrogenasa, este aumento no puede entenderse como un aumento en el número de bacteroides, sino en el tejido vegetal del nódulo. Las plantas tratadas sólo con nitrógeno o A. brasilense 8-INICA, respectivamente, no produjeron nódulos. El aumento en el peso de la raíz y los nódulos con la inoculación de Azospirillum fue consistente con otros resultados en Phaseolus vulgaris9) inoculado con Rhizobium tropici y R. etli y la misma especie de Azospirillum. El incremento del crecimiento de la raíz se puede producir mediante una mayor captación de minerales y agua 20, por lo que las inoculaciones de soya con Azospirillum podrían representar una ventaja en el rendimiento del cultivo.
Tabla 1 Efectos de A. brasilense 8-INICA y B. japonicum USDA-110 y coinoculación de los dos microorganismos en los parámetros de crecimiento de la soya y la actividad nitrogenasa
| Tratamiento | Altura (cm) | Brote FW (g) | Raíz FW (g) | Nodulos DW (g) | Actividad nitrogenasa (µmol etileno g nodulo-1 h-1) |
|---|---|---|---|---|---|
| Nitrogeno | 38,55±0,96a | 1,48±0,13a | 3,82±0,54b | nn | - |
|
|
38,94±3,03a | 1,40±0,16a | 6,18±0,32a | nn | - |
|
|
41,29±2,59a | 1,45±0,15a | 4,05±0,58b | 0,019±0,003b | 8,81±1,053a |
|
|
42,40±1,73a | 1,13±0,19a | 4,26±0,54b | 0,034±0,006a | 7,96±1,19a |
Leyenda: FW (peso fresco), DW (peso seco) y nn (no nodulos)
A.b+B.j: co-inoculación de Azospirillum y Bradyrhizobium
Los tratamientos con Azospirillum y Bradyrhizobium se regaron con una solución nutritiva libre de nitrógeno y con una solución que contenía 35 ppm en el tratamiento con nitrógeno. Los datos son medias seguidas de error estándar de tres repeticiones. Las medias seguidas por la misma letra dentro de una columna no son significativamente diferentes. Los datos estadísticos fueron obtenidos por SPSS.
Colonización de raíces de soya por Azospirillum
El establecimiento de poblaciones bacterianas eficientes en la rizosfera es esencial para mejorar la colonización de las raíces y la productividad de las plantas 21. La colonización de la raíz de soya se estudió al final del cultivo de plantas, en plantas inoculadas sólo con Azospirillum, utilizando microscopía óptica y electrónica e inmunocitoquímica. A. brasilense 8-INICA colonizó la superficie de la raíz por adhesión al material mucilaginoso, producido por la planta donde proliferan las bacterias (Figura 1 y Figura 2A y B).
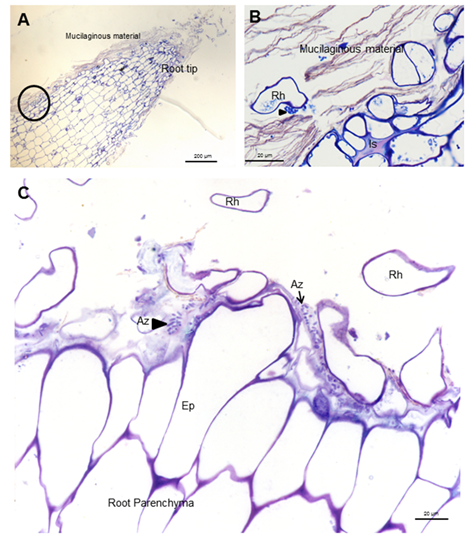 A, ápice radical B, área enmarcada de A. Azospirillum aislado (Az y flechas) o formando microcolonias (cabezas de flechas) dentro del material mucilaginoso Ep (epidermis), Is (intercelular) y Rh (pelo radical)
A, ápice radical B, área enmarcada de A. Azospirillum aislado (Az y flechas) o formando microcolonias (cabezas de flechas) dentro del material mucilaginoso Ep (epidermis), Is (intercelular) y Rh (pelo radical)Figura 1 Micrografías ópticas de cortes longitudinales y transversales que muestran colonización de la superficie por A. Brasilense 8-INICA, cinco semanas después de la inoculación, teñidas con azul de toluidina
Además, se pueden observar los carbohidratos producidos por las bacterias. Los carbohidratos se detectaron mediante tinción con fucsina 19. (Figura 1C y Figura 2B y C).
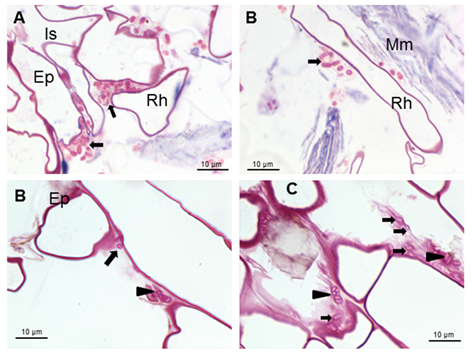 Las flechas indican las bacterias de Azospirillum aisladas alrededor de los pelos radicales o formando microcolonias rodeadas por carbohidratos producidos por las bacterias (cabezas de flechas) Ep (epidermis), Is (intercelular), Rh (pelo radical) y Mm (material mucilaginoso)
Las flechas indican las bacterias de Azospirillum aisladas alrededor de los pelos radicales o formando microcolonias rodeadas por carbohidratos producidos por las bacterias (cabezas de flechas) Ep (epidermis), Is (intercelular), Rh (pelo radical) y Mm (material mucilaginoso)Figura 2 Micrografías ópticas de cortes longitudinales que muestran la colonización de la superficie por A brasilense 8-INICA cinco semanas después de la inoculación, teñidas con fucsina
Estos carbohidratos podrían conferir protección a la raíz contra condiciones externas y podrían favorecer la colonización de la bacteria en su hábitat natural 22. Los resultados muestran bacterias muy cerca de los pelos radicales cerca de la punta radical (Figura 1A y B). Se observan microcolonias en la superficie de la raíz embebidas en una matriz de polímero de carbohidratos de producción propia que fue consistente 23, como se muestra en las figuras 2B y C (puntas de flecha) y bajo protección del pelo radical (Figuras 2A y C). Esto da lugar a la biopelícula, que es un mecanismo que permite a las bacterias vivir en condiciones extremas o cambiantes y uno de los más utilizados en la colonización competitiva de raíces por bacterias eficientes. Después de la colonización de la raíz superficial, se produce la colonización parenquimática intercelular. Azospirillum pudo tomar la ruptura causada por la emergencia de una raíz secundaria (Figuras 3A y B) e ingresar en los espacios intercelulares del parénquima de la raíz de la planta (Figuras 3A y C) y entre las células epidermis radical, permitiendo la colonización. La morfología de la raíz cambió como consecuencia de esta colonización, produciendo una matriz entre dos capas de células del parénquima de la raíz (Figuras 3B y D).
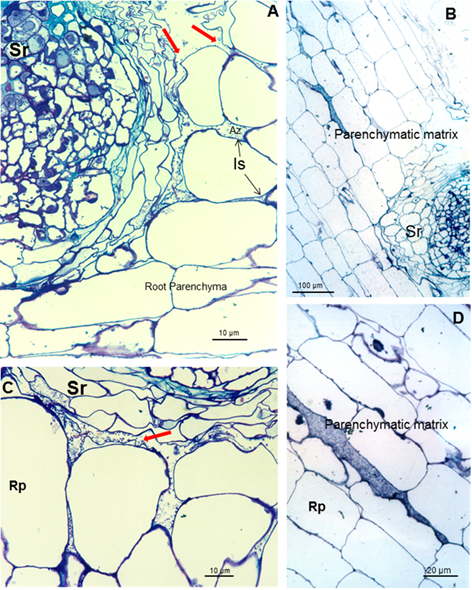 Las flechas rojas indican el espacio donde la matriz parenquimática (B) comienza a formarse entre dos capas de células. Es (espacio intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y Sr (raíz secundaria)
Las flechas rojas indican el espacio donde la matriz parenquimática (B) comienza a formarse entre dos capas de células. Es (espacio intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y Sr (raíz secundaria)Figura 3 Micrografías ópticas de cortes longitudinales y transversales de raíces de soya inoculadas con A. brasilense 8-INICA que muestran colonización de las raíces después de cinco semanas de inoculación (A-C); colonización de las raíces de la soya a través de los orificios producidos por la aparición de una raíz secundaria y D los espacios intercelulares de las capas internas de las células corticales
Esta matriz parenquimática facilita el crecimiento bacteriano y las bajas presiones parciales de oxígeno para la expresión de la nitrogenasa y puede contribuir directamente al nitrógeno de la planta y asegura el intercambio de nutrientes entre las bacterias y la planta. Las bacterias del suelo y de la rizosfera pueden afectar la nutrición mineral de las plantas al cambiar las características de absorción de la raíz, debido a una modificación de la morfología de la raíz o la alteración de los mecanismos de absorción, la tasa de crecimiento relativa o la composición interna de las plantas 24. El hecho de sobrevivir dentro de la raíz y no producir ninguna lesión confirma este microorganismo como una bacteria endofítica 25. Los endófitos pueden ser útiles para proteger a la planta del estrés ambiental, así como para suministrar nitrógeno y otras sustancias que promueven el crecimiento 26.
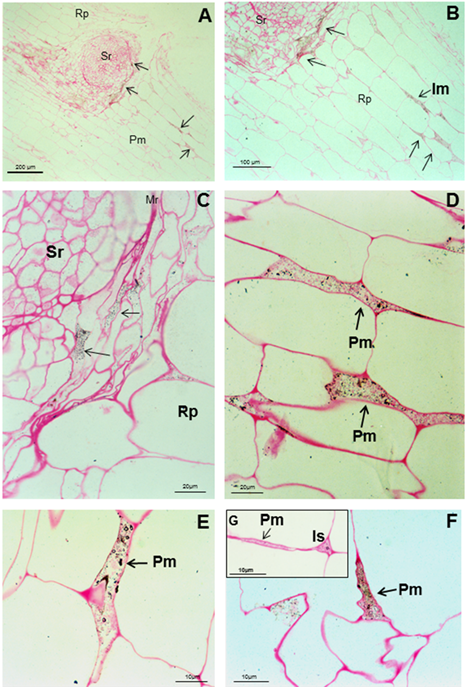 Las bacterias pueden verse como cuerpos negros y cuerpos rodeados por un círculo negro en la ruptura producida por el surgimiento de una raíz secundaria (AC), en los espacios intercelulares, el parénquima de las raíces de soya y dentro de la matriz parenquimática (D, E y F), señaladas como flechas negras. G es la ampliación del espacio intercelular y la conexión de la matriz parenquimática. Es (espacio intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y Sr (raíz secundaria)
Las bacterias pueden verse como cuerpos negros y cuerpos rodeados por un círculo negro en la ruptura producida por el surgimiento de una raíz secundaria (AC), en los espacios intercelulares, el parénquima de las raíces de soya y dentro de la matriz parenquimática (D, E y F), señaladas como flechas negras. G es la ampliación del espacio intercelular y la conexión de la matriz parenquimática. Es (espacio intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y Sr (raíz secundaria)Figura 4 Micrografías ópticas de cortes longitudinales y transversales a través de la raíz de soya cinco semanas después de la inoculación de semillas con A. brasilense 8-INICA
Las reacciones del anti-A brasilense 8-INICA con el microorganismo mostraron, en el microscopio óptico, las bacterias rodeadas de partículas de oro (Figura 4). La inmunolocalización y el silver enhancement demuestran que se logra la colonización por A. brasilense 8-INICA, conociendo que las bacterias están marcadas en la ruptura causada por la aparición de una raíz secundaria (Figura 4A-C), en los espacios intercelulares (Figura 4D) y en la matriz parenquimática producida por la colonización de Azospirillum del parénquima de la raíz (Figura 4D-F). Con el gran aumento en la microscopía óptica (Figura 4G) se puede observar que los espacios intercelulares y la matriz parenquimática están conectados, y Azospirillum identificado por el anticuerpo puede verse como cuerpos rodeados por un círculo negro. Estos resultados en experimentos de inoculación en soya muestran firmemente la colonización por Azospirillum, lo cual es consistente con informes similares sobre arroz 27, tabaco 28, tomate 29 y cebada 30. En el caso de la caña de azúcar, la controversia de si es solo una bacteria rizosférica o asociada a la raíz o un endófito, requiere estudios adicionales que permitan aclarar este aspecto, que podría verse influido por manifestación de quorum sensing3 y otros factores. La inmunolocalización en portaobjetos ultrafinos de células de Azospirillum, embebidas en agar con el anticuerpo anti-A. brasilense 8-INICA, muestra una enorme afinidad del anticuerpo al antígeno (Figura 5A). Hay un marcaje intenso de las bacterias con partículas de oro de 15 nm. El número de partículas de oro es elevado y marcó las diferentes capas de las envolturas celulares (Figura 5A, flechas).
La cantidad de partículas de oro disminuye considerablemente cuando el marcaje se realiza en los espacios intercelulares, como si las bacterias perdieran algunas de las capas con la colonización del parénquima de la raíz (Figura 5B), aunque también se puede observar el marcaje en diferentes capas (flechas). Dentro de la matriz parenquimática solo una capa aparece marcada (Figura 5C y D) y no se detectan partículas de oro en el interior de las bacterias. Se puede observar un marcaje inespecífico en las vesículas de la matriz parenquimática, probablemente formadas por la degradación de las membranas bacterianas (Figura 5C).
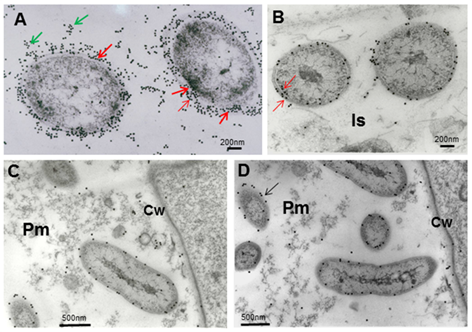 Note el intenso marcaje de las bacterias con partículas de oro de 15 nm (flechas)B, note la gran disminución de partículas de oro cuando las bacterias están colonizando la raíz y llegan a la matriz parenquimática(B-D), A. brasilense 8-INICA dentro de la matriz parenquimáticaCw (pared celular), Is (intercelular), Pm (matriz parenquimática)
Note el intenso marcaje de las bacterias con partículas de oro de 15 nm (flechas)B, note la gran disminución de partículas de oro cuando las bacterias están colonizando la raíz y llegan a la matriz parenquimática(B-D), A. brasilense 8-INICA dentro de la matriz parenquimáticaCw (pared celular), Is (intercelular), Pm (matriz parenquimática)Figura 5 Micrografías electrónicas que muestran la inmunolocalización de los epítopes de A. brasilense 8-INICA que crecen en el medio de cultivo (A) y colonizan los espacios intercelulares y el parénquima de las raíces de soya (B-D). (A), células incluidas primero en agar y en resina LR-White
Cuando la bacteria envejece, el citoplasma se retrae y las partículas de oro permanecen en la capa más externa de las envolturas de la bacteria (Figura 6A y B). Aunque no es normal, en algunas áreas aparecen partículas de oro en la pared celular (Figura 6C). Muy pocas partículas de oro aparecen en el citoplasma de las células adyacentes a la matriz. No hay localización de partículas de oro en orgánulos envejecidos (Figura 6D).
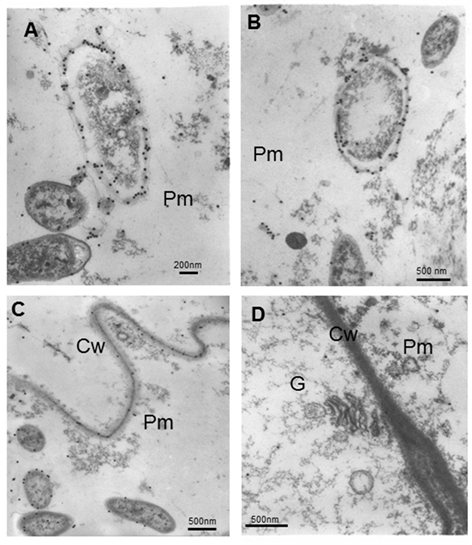 A y B note que cuando la bacteria envejece el citoplasma se retrae y el marcaje permanece en la capa más externa de la bacteriaC y D Matriz parenquimática y células adyacentesCw (pared celular), G (Golgi), Pm (matriz parenquimática)
A y B note que cuando la bacteria envejece el citoplasma se retrae y el marcaje permanece en la capa más externa de la bacteriaC y D Matriz parenquimática y células adyacentesCw (pared celular), G (Golgi), Pm (matriz parenquimática)Figura 6 Micrografías electrónicas que muestran la inmunolocalización de A. brasilense 8-INICA colonizando los espacios intercelulares y el parénquima de las raíces de soya embebidas en la resina LR-White
Azospirillum generalmente se asocia con raíces de pastos como la caña de azúcar, el arroz y el maíz 4, lo que se traduce en beneficios para las plantas por su contribución a la nutrición. Las técnicas de microscopía e inmunolocalización permitieron confirmar en este trabajo que A. brasilense 8-INICA puede actuar como un endófito en las raíces de soya. Los endófitos pueden ser útiles para proteger a la planta del estrés ambiental, así como para suministrar nitrógeno y otras sustancias que promueven el crecimiento 26. Este trabajo enfatiza que Azospirillum no sólo es interesante para la inoculación en caña de azúcar, sino también en la soya y, por lo tanto, funcionaría muy bien en el intercalamiento de la soya y la caña de azúcar, con la ventaja de no tener que introducir cepas extrañas en los suelos cubanos.
CONCLUSIONES
brasilense 8-INICA es capaz de colonizar las raíces de la soja, no sólo de forma superficial, sino también intercelular, formando una matriz parenquimática que favorece el intercambio entre la bacteria y la planta, demostrando a A. brasilense 8-INICA como un endófito de las raíces de soya. Además de sus efectos mejorados sobre el peso de las raíces y los nódulos en comparación con especies nodulares como B. japonicum USDA-110, que confirman los informes de otros investigadores, este resultado de ser un endófito en las raíces de soya es importante para lograr la sostenibilidad en la agricultura, considerando que las inoculaciones de campo son amigables con el medio ambiente y una forma económica y viable de obtener buenas producciones mediante prácticas agrícolas orgánicas.
Se deben realizar estudios de campo adicionales en condiciones no controladas con esta cepa para explorar su potencial como biofertilizante en las prácticas de cultivo intercalado con esta leguminosa y caña de azúcar. Es importante destacar que A. brasilense 8-INICA está adaptado a las condiciones de los suelos cubanos, lo que evita que se introduzcan cepas extrañas en los ambientes de los suelos cubanos.











 texto em
texto em 


