INTRODUCCIÓN
En los últimos años, la Moringa oleifera Lam. se ha utilizado ampliamente en la alimentación humana y animal, en la medicina tradicional, en la producción de biodiesel y en la industria farmacéutica y cosmética 1-3. Además, a sus extractos se les adjudican actividad bioestimulante debido a que son ricos en aminoácidos, iones minerales, ascorbato y fitohormonas 4,5. Esto hace que favorezca el crecimiento de algunas plantas, lo que permite su uso en distintas ramas de la agricultura. Sin embargo, en la mayoría de los estudios, los extractos de hojas de moringa se han utilizado para estimular la germinación de las semillas de leguminosas y cereales, así como evaluar su efecto en el crecimiento y desarrollo de las plantas 6,7. La presencia en los extractos de moringa de fitoquímicos como cumarinas, flavonoides, terpenoides, carotenoides, taninos y compuestos fenólicos le confiere actividad antimicrobiana frente a patógenos de interés agrícola 8-10.
La piña (Ananas comosus var. comosus) es la tercera fruta de mayor producción mundial. Posee un agradable sabor y aroma, así como vitaminas C, B1, B6, ácido fólico y minerales como el K + (11) . En el año 2016, su producción mundial ascendió a 25 809 038 toneladas y en Cuba a 48 501 toneladas 12. Para los países productores de piña y en particular para Cuba, la deficiencia de material de propagación es un problema que se presenta cuando se desea fomentar nuevas áreas o introducir una nueva variedad.
El híbrido ‘MD-2’ posee características de gran importancia económica, como son los altos rendimientos y la calidad de la fruta. Es uno de los cultivares con mayores volúmenes de importación como fruta fresca en los mercados de Estados Unidos y la Unión Europea (13). Sin embargo, las plantas cultivadas en el campo promedian apenas dos propágulos por ciclo productivo. Esto hace necesario establecer esquemas de producción de semillas a través de la biotecnología y evaluar su introducción en las condiciones de Cuba y, en específico, del territorio avileño.
El desarrollo de las técnicas de micropropagación ha tenido resultados altamente ventajosos en la propagación rápida y con calidad, de diversas especies de plantas económicamente importantes 14. En este entorno, el Centro de Bioplantas, desarrolló un protocolo de micropropagación basado en el uso del medio líquido y la tecnología de inmersión temporal, unido a la implementación de un sistema semiautomatizado 15, que posibilita reducir el tiempo necesario para generar cantidades suficientes de vitroplantas destinadas a la creación de bancos de semillas básicas que permitan el fomento de plantaciones piñeras con semilla de alta calidad.
Una de las etapas determinantes en el protocolo general de propagación es la aclimatización, debido a que las plantas experimentan cambios fisiológicos que pueden influir en las etapas siguientes. La piña posee un lento crecimiento, lo que dilata la duración de esta fase. Además, las plantas de piña durante la aclimatización pueden verse afectadas por oomicetes y hongos fitopatógenos, fundamentalmente, de los géneros Phytophtora, Fusarium y Rhizoctonia, produciéndose pérdidas importantes 16.
Este trabajo tuvo como objetivo evaluar el efecto del extracto acuoso obtenido a partir de hojas de Moringa oleifera Lam. en los cambios morfológicos de las plantas de piña ‘MD-2’ en la etapa inicial de la aclimatización.
MATERIALES Y MÉTODOS
Material vegetal
El material vegetal de piña (Ananas comosus var. comosus) ‘MD-2’ lo suministró el Laboratorio de Escalado y Transferencia Tecnológica del Centro de Bioplantas. Se utilizaron plantas que provenían de la fase de enraizamiento in vitro (30 días) y se encontraban en un medio de cultivo que contenía: sales MS 17, 100 mg L-1 de mioinositol, sacarosa al 30 g L-1, 0,1 mg L-1 de tiamina-HCl y 2,69 µmol L-1 de ácido naftalen acético (ANA).
Obtención y caracterización del extracto acuoso de hojas de moringa
Para obtener el extracto acuoso se utilizaron las hojas de Moringa oleifera Lam. cv. Supergenius provenientes de plantas adultas de tres años, crecidas en la Estación Experimental “Juan Tomás Roig”, Centro de Bioplantas, que poseían los componentes fitoquímicos que se muestran en la Tabla 1.
Tabla 1 Componentes fitoquímicos detectados en las hojas de Moringa oleifera Lam. cv Supergenius
| Compuesto | Test o reactivo utilizado | Hojas |
|---|---|---|
| Cumarinas volátiles | NaOH | + |
| Saponinas | Formación de espuma | - |
| Triterpenos y esteroides | Reacción de Liebermann-Buchard | + |
| Reacción de Salkowski | + | |
| Flavonoides | Reacción de Shinoda | - |
| Derivados antracénicos | Reacción de Borntrager | - |
| Compuestos fenólicos | FeCl3 | + |
| Taninos | Gelatina-NaCl | - |
-Ausencia del compuesto, + Presencia del compuesto
Para la obtención del extracto acuoso se molieron 400 g de masa fresca de hojas de moringa con nitrógeno líquido en batidora comercial. La proporción de material vegetal y agua fue de 1:2.5 (m:v). La extracción se realizó durante una hora con agitación y posteriormente se filtró con gasa para eliminar el material vegetal. A continuación, se centrifugó la muestra durante 20 minutos a 15 000 x g y se colectó el sobrenadante. Al extracto acuoso se le determinó la concentración de proteínas 18, la concentración de carbohidratos 19 y la concentración de compuestos fenólicos solubles 20 (Tabla 2).
Efecto de la concentración y el tiempo de inmersión en el extracto acuoso de moringa en la aclimatización de plantas de piña
Se seleccionaron plantas homogéneas enraizadas in vitro para su aclimatización, las cuales poseían entre 0,8-1,62 g de masa fresca, 8-10 cm de longitud, 4-6 hojas y 3-4 raíces, como establece el instructivo técnico para la propagación de la piña del Centro de Bioplantas 21. Se prepararon dos disoluciones del extracto acuoso de moringa: extracto diluido cuatro veces (1:4) y extracto diluido ocho veces (1:8). Las raíces de las plantas se sumergieron durante: 0, 24, 48 y 72 horas en las disoluciones. Se utilizaron 7,5 mL de las diluciones del extracto acuoso/planta.
Las mismas se colocaron el tiempo que duró la inmersión en cámaras de cultivo (KOXKA; mod. EC -1200F) con condiciones ambientales controladas. La temperatura (25±1 °C), flujo de fotones fotosintéticos (FFF=80 µmol m-2s-1) y humedad relativa (HR=70 %) se fijaron durante todo el experimento para favorecer el desarrollo del cultivo, el fotoperiodo fue de 16 horas luz y ocho horas de oscuridad.
Las plantas fueron sembradas en envases plásticos con un volumen de 222,59 cm3 con mezcla del sustrato tamizado de suelo Ferralítico Rojo y cachaza (derivado de la caña de azúcar) a una proporción de 1:1 (v/v). Las mismas fueron aclimatizadas en una casa de cultivo bajo condiciones de 80±3 % de humedad relativa, 30±2 °C de temperatura, luz natural con flujo de fotones fotosintéticos de 400±25 µmol m-2s-1 y condiciones atmosféricas de concentración de CO2 y fotoperiodo natural. Estas se asperjaron cada 10 días con una mezcla de fertilizante foliar que contenía 16,0 g de N-P-K cristalino y 1,0 g de Multimicro Combi (Haifa Chemicals Ltd., Haifa Bay 26120).
A los 42 días se determinó la supervivencia (%) de las plantas como el cociente del número de plantas vivas al finalizar esta etapa entre el número inicial de plantas (30 plantas). Además, se evaluaron los indicadores morfológicos: masa fresca (g), masa seca (g), longitud de la planta (cm), número de hojas, longitud de la raíz más larga (cm) y número de raíces por planta.
Comparación del extracto acuoso de hojas de moringa y el Previcur® Energy LS 84 en la aclimatización de plantas de piña
Se diseñaron cuatro tratamientos: raíces sumergidas en agua destilada durante 72 horas (control), raíces sumergidas en extracto de moringa diluido ocho veces (1:8) durante 72 horas, raíces sumergidas en Previcur® Energy LS 84 (Bayer CropScience, 1.0 ml·L-1) durante tres minutos y una combinación de inmersión de las raíces en extracto de moringa diluido ocho veces (1:8) durante 72 horas y luego en Previcur Energy® durante tres minutos 22.
Las plantas fueron sembradas y cultivadas en las mismas condiciones que en el experimento anterior. A los 42 días se evaluaron los mismos indicadores descritos en el experimento anterior.
Análisis estadístico
En el procesamiento estadístico de los datos se utilizó el utilitario SPSS Version 21 para Windows, SPSS Inc. Se utilizó el análisis de varianza (ANOVA) simple y bifactorial (tiempo de inmersión y la dilución del extracto acuoso). Las medias de los tratamientos se compararon utilizando la prueba de rangos múltiple de Tukey (p<0,05) previa comprobación de los supuestos de normalidad y homogeneidad de varianzas. En los indicadores supervivencia, número de hojas y número de raíces fue necesaria la transformación de los datos para lograr los supuestos de las pruebas paramétricas realizadas. En ambos experimentos se utilizaron 30 plantas por tratamiento con un diseño experimental completamente aleatorizado. Los experimentos se repitieron tres veces. El porcentaje de supervivencia representa el promedio de las tres repeticiones (n=3). Para el resto de los indicadores evaluados cada planta fue considerada como una unidad experimental y representa el promedio de todas las mediciones individuales (n=90).
RESULTADOS Y DISCUSIÓN
Efecto de la concentración y el tiempo de inmersión en el extracto acuoso de moringa en la aclimatización de plantas de piña
La Figura 1 muestra la supervivencia de plantas de piña luego de 42 días en aclimatización, posterior a la inmersión de las plantas en extracto de Moringa oleifera Lam diluido cuatro (1:4) y ocho veces (1:8) durante 24, 48 y 72 horas. Los mejores resultados se obtuvieron con la inmersión de las raíces de las plantas de piña por 24 y 48 horas en el extracto acuoso diluido 1:4, sin diferencias significativas con la dilución 1:8 por 72 horas. En estos tratamientos se logró el 100 % de supervivencia de las plantas. Por otra parte, las plantas cuyas raíces fueron sumergidas en extracto acuoso de moringa (1:4) por 72 horas, disminuyeron significativamente su porcentaje de supervivencia. Sin embargo, la dilución (1:8) necesitó 72 horas de inmersión para proporcionar un 100 % de supervivencia.
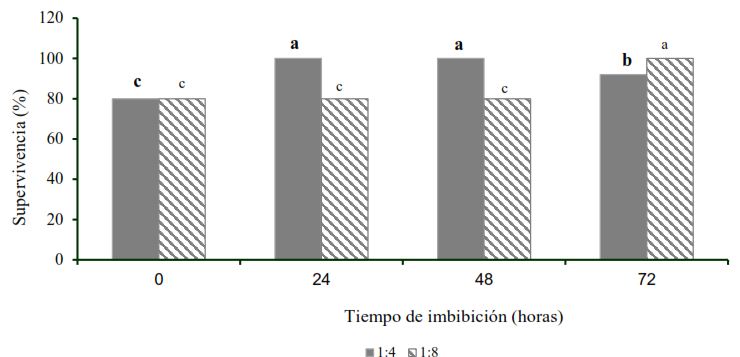
Medias con letras desiguales difieren estadísticamente (n=3, ANOVA bifactorial; Tukey; p≤0,05)
Para el tratamiento estadístico, los datos se transformaron de acuerdo con x´= 2arcoseno (x/100)0,5. ESx=16,2. Los datos que se presentan en la figura son no transformados
Figura 1 Efecto del tiempo de inmersión de las raíces de las plantas de Ananas comosus var. comosus ‘MD-2’ en diluciones del extracto acuoso de hojas de Moringa oleifera Lam. cv Supergenius en la supervivencia a los 42 días en condiciones ambientales controladas
En las plantas que murieron durante el experimento se observó flacidez en las hojas con síntomas de pudrición y coloración parda-negruzca hacia la base de las hojas. Esto pudiera estar asociado a la presencia de Phytophthora parasitica Dastur que es el principal patógeno que afecta al cultivo de la piña ‘MD-2’ durante la aclimatización 16. No obstante, es necesaria la realización de análisis de laboratorio que permitan identificar si los daños se deben a la presencia de este patógeno.
La Tabla 3 muestra los valores de los indicadores morfológicos de las plantas de piña como respuesta a diferentes tiempos de inmersión en diluciones del extracto acuoso de hojas de moringa. El número de hojas y la masa fresca fueron significativamente superior cuando las plantas se sumergieron por 72 horas en extracto diluido 1:8, sin diferencias estadísticas con el resto de los tratamientos donde se utilizó el extracto acuoso de hojas de moringa, independientemente de la dilución y el tiempo de inmersión. La longitud de la planta alcanzó los mayores valores cuando se utilizó el extracto diluido 1:4 por 48 horas y el extracto diluido 1:8 por 72 horas, sin diferencias estadísticas con los tratamientos donde se utilizó el extracto acuoso de hojas de moringa independientemente del tiempo de inmersión. La longitud de la raíz más larga fue mayor cuando la inmersión en el extracto acuoso de hojas de moringa se realizó por 48 y 72 horas, independientemente de la dilución. La masa seca no mostró diferencias significativas entre las diluciones utilizadas, excepto cuando la inmersión se realizó en la dilución 1:4 por 72 horas. El número de raíces no mostró diferencia entre los tratamientos.
Tabla 3 Efecto del tiempo de inmersión y la dilución del extracto acuoso de hojas de Moringa oleifera Lam. cv Supergenius sobre indicadores morfológicos de plantas de Ananas comosus var. comosus ‘MD-2’ luego de 42 días en aclimatización
| Dilución extracto | Tiempo (horas) 0 | Número de hojas | Longitud planta (cm) | Número de raíces | Longitud raíz más larga (cm) | Masa fresca (g) | Masa seca (g) |
|---|---|---|---|---|---|---|---|
| 1:4 | 0 | 3,61 (13) b* | 9,36 b | 2,65 (7) | 3,09 b | 3,78 b | 0,27 b |
| 24 | 3,74 (14) ab | 11,51 ab | 2,65 (7) | 3,19 b | 4,02 ab | 0,34 ab | |
| 48 | 3,74 (14) ab | 13,88 a | 2,65 (7) | 3,83 ab | 4,77 ab | 0,33 ab | |
| 72 | 3,74 (14) ab | 12,23 ab | 2,65 (7) | 4,07 ab | 4,22 ab | 0,30 b | |
| 1:8 | 24 | 3,74 (14) ab | 11,76 ab | 2,65 (7) | 3,18 b | 3,97 ab | 0,34 ab |
| 48 | 3,87 (15) ab | 11,47 ab | 2,65 (7) | 3,87 ab | 4,13 ab | 0,31 ab | |
| 72 | 4,13 (17) a | 14,48 a | 2,83 (8) | 4,58 a | 4,97 a | 0,39 a | |
| ESx | 0,24 | 1,7 | NS | 0,58 | 0,51 | 0,04 |
*Medias con letras desiguales difieren estadísticamente para cada indicador (n=90, ANOVA bifactorial; Tukey; p≤ 0,05). Para el tratamiento estadístico, los datos de número de hojas y número raíces se transformaron de acuerdo con x´= x0,5. En la tabla se presentan los datos transformados y entre paréntesis aparecen los datos originales
El hecho de que la inmersión en la mayor dilución del extracto acuoso de moringa (1:8) a las 72 horas mostrara los mejores resultados, en cuanto a la supervivencia y los indicadores morfológicos, pudiera estar relacionada con que la viscosidad de esta disolución es menor, lo que favorece la entrada del agua y la penetración de iones minerales y otros nutrientes que benefician el crecimiento. Por esta razón, se seleccionó este tratamiento para continuar la experimentación debido a que la supervivencia y los indicadores morfológicos evaluados en las plantas mostraron una calidad superior.
Comparación del extracto acuoso de hojas de moringa y el Previcur® Energy LS 84 en la aclimatización de plantas de piña
Luego de 42 días de cultivo, la supervivencia de las plantas tratadas con Previcur®Energy LS 84, extracto acuoso diluido ocho veces (1:8) y la combinación de ambos fue de 100 %; mientras que la del tratamiento control de 81 % (datos no mostrados).
En la Tabla 4 se muestran los valores de los indicadores morfológicos de las plantas de piña como respuesta a la inmersión, previo a la aclimatización en el extracto acuoso de hojas de Moringa oleifera Lam. y en el Previcur® Energy LS 84. La longitud de la planta y la longitud de la raíz más larga fueron superiores en las plantas tratadas con Previcur®Energy LS 84, sin diferencias significativas con el extracto acuoso diluido 1:8. La masa fresca mostró los mejores resultados en los tratamientos con Previcur®Energy LS 84 y el extracto acuoso diluido 1:8, sin diferencias significativas con el control. Los indicadores número de hojas, número de raíces y la masa seca no mostraron diferencias para los tratamientos evaluados.
Tabla 4 Indicadores morfológicos de las plantas de Ananas comosus var. comosus ‘MD-2’ en respuesta a la inmersión en el extracto acuoso de hojas de Moringa oleifera Lam. cv Supergenius y en Previcur®Energy LS 84, luego de 42 días en aclimatización
| Tratamiento | Número hojas | Longitud plantas (cm) | Número Raíces | Longitud raíz más larga (cm) | Masa fresca (g) | Masa seca (g) |
|---|---|---|---|---|---|---|
| Control | 3,74 (14) | 9,38 c | 2,64 (7) | 3,30 b | 3,39 a | 0,29 |
| Extracto acuoso (1:8) | 4,00 (16) | 14,60 a | 2,82 (8) | 4,53 a | 3,55 a | 0,37 |
| Previcur®Energy LS 84 | 4,00 (16) | 15,35 a | 2,82 (8) | 4,95 a | 3,66 a | 0,35 |
| Extracto acuoso (1:8) + Previcur®Energy LS 84 | 4,00 (16) | 12,30 b | 2,64 (7) | 2,60 b | 2,72 b | 0,25 |
| ESx | NS | 1,33 | NS | 0,52 | 0,24 | NS |
*Medias con letras desiguales difieren estadísticamente para cada indicador (n=90, ANOVA de un factor; Tukey; p≤0,05). Para el tratamiento estadístico, los datos de número de hojas y número de raíces se transformaron de acuerdo con x´= x0,5. En la tabla se presentan los datos transformados y entre paréntesis aparecen los datos originales
Los indicadores morfológicos de las plantas que se trataron con la inmersión durante 72 horas en extracto acuoso diluido 1:8 seguido de tres minutos en Previcur®Energy LS 84 se vieron afectados. Es posible que los compuestos fenólicos y los aminoácidos aromáticos de las proteínas presentes en el extracto crudo de hojas de moringa interactuaran con el ingrediente activo del Previcur®Energy LS 84 (propamocarb fosetilato) generando compuestos químicos del tipo de los fenilcarbamatos. Estos compuestos son reconocidos por tener actividad herbicida y pueden actuar como inhibidores de la mitosis o del transporte de electrones en los cloroplastos afectando del crecimiento de las plantas 23.
Los resultados de esta investigación demostraron el efecto beneficioso del extracto acuoso de hojas de moringa sobre los indicadores morfológicos en la aclimatización de la piña ‘MD-2’. El contacto directo del extracto acuoso de hojas de moringa por 72 horas con las estructuras absorbentes de las raíces de las plantas de piña ‘MD-2’ pudo haber favorecido la entrada de minerales y compuestos orgánicos presentes en el extracto. Algunos autores reconocen el efecto estimulador del crecimiento de los extractos crudos acuosos de hojas de Moringa oleifera Lam., asociado a la presencia de aminoácidos, iones minerales como K+ y Ca2+, ácido ascórbico y compuestos fenólicos 24.
Además, cuando se aplicó el extracto acuoso diluido 1:8, el Previcur®Energy LS 84 y la combinación de ambos tratamientos no se notaron síntomas visibles de enfermedades fungosas que aparecen en esta etapa crucial de la aclimatización, donde se reconoce que la mayor mortalidad de las plantas está asociada a Phytophthora parasitica Dastur 16. Este comportamiento observado con el extracto acuoso pudiera estar asociado a la presencia de compuestos fenólicos (Tabla 1), los que poseen reconocida actividad antimicrobiana 25.
CONCLUSIONES
El extracto acuoso de hojas de moringa favoreció la etapa inicial de la aclimatización de la piña ‘MD-2’. La inmersión de las raíces de las plantas de piña por 72 horas en extracto acuoso diluido ocho veces (1:8) benefició el crecimiento de las plantas y no se apreciaron diferencias con el Previcur®Energy LS 84.











 texto en
texto en 


