INTRODUCCIÓN
La enfermedad conocida como “pata prieta” provocada por el oomycetes Phytophthora nicotianae Breda de Haan, produce cuantiosas pérdidas anuales a la producción de tabaco en Cuba y el resto del mundo 1,2. El control de esta enfermedad se realiza a través de un manejo integrado que comprende: la rotación de cultivos, el uso de productos químicos y las variedades resistentes, siendo esta última la estrategia más económica y duradera 3,4.
La obtención de cultivares resistentes a la enfermedad en Cuba, a través de los programas de mejoramiento genético actuales, resulta en un largo período de unos 10 o 12 años. Las diferentes razas de este patógeno son capaces de evolucionar de manera acelerada en cortos periodos de tiempo, desarrollándose aislados mucho más agresivos 5; por esta razón, el patógeno logra vencer la resistencia de las nuevas variedades que se liberan a la producción en solo unos pocos años. A esto se suma la posible consanguinidad presente en los cultivares debido al uso recurrente y continuo de los mismos progenitores, que provoca una baja variabilidad genética a la cual le resulta fácil adaptarse el patógeno.
Hasta el momento se encuentran bien identificadas cuatro fuentes de resistencia monogénica y multigénica a P. nicotianae. La resistencia parcial, controlada por múltiples genes y raza no específica, que proviene del cultivar 'Florida 301', es una de las más difundidas pero se asocia a bajos rendimientos y a una reducción de la calidad de la hoja curada en tabaco Virginia 6.
El cultivar de tabaco negro 'Beinhart-1000' posee una fuerte resistencia a las Razas 0 y 1 del patógeno, pero se emplea poco en programas de mejora por la presencia de compuestos no deseados en la hoja curada 1,7. La región genómica conocida como Wz proveniente de la especie silvestre Nicotiana rustica ha sido introgresada en algunos cultivares de tabaco Virginia en Estados Unidos de América y Zimbabwe a través de una línea estable designada como 'Wz'. Líneas de tabaco, en las cuales ha sido introgresada la región Wz, contienen un gen o genes que confieren un alto nivel de resistencia a la Raza 0 y afectan la resistencia a la Raza 1 de P. nicotianae7.
Por último, tenemos la transferencia de los genes Php y Phl a cultivares comerciales de tabaco a partir de las especies silvestres Nicotiana plumbaginifolia Viv. y Nicotiana longiflora Cav., respectivamente. Ambos genes poseen efectos similares, con un carácter monogénico dominante que aporta resistencia completa solo a la Raza 0 de P. nicotianae8-12.
En Cuba sólo se informa la presencia de la Raza 0 de P. nicotianae y los cultivares cubanos muestran niveles de resistencia variables, desde susceptibles hasta altamente resistentes, en el momento de su liberación a la producción. 5
Existe ambigüedad entre los productores y fitomejoradores sobre el origen de la resistencia a P. nicotianae en los cultivares de tabaco cubano, por lo que se hace difícil determinar si el gen Php se introdujo en los cultivares comerciales como parte del programa de mejoramiento genético en la década de los 60 y 70 del siglo anterior. Esto impide saber si este gen de resistencia se ha desplegado en el genofondo del tabaco en Cuba a lo largo de más de 40 años de mejoramiento genético.
Una búsqueda intensa y rigurosa en el pedigree de los cultivares comerciales de tabaco cubanos, muestra que probablemente solo se introdujo en Cuba la resistencia a la “pata prieta” que proviene de 'Florida 301', a través de cultivares que se emplearon como progenitores en los programas de mejora. Cultivares como 'K326' y el propio 'Florida 301', se utilizaron en la mejora de cultivares de tabaco cubano tipo Virginia unos años atrás 13. No tenemos evidencia de la presencia del gen Php como fuente de resistencia en el tabaco cubano, un conocimiento fundamental que se necesita para los programas de mejora y para el establecimiento de una adecuada política varietal de tabaco en nuestro país.
Tomando en cuenta lo anterior el objetivo de esta investigación fue identificar la presencia del gen Php en cultivares actuales comerciales de tabaco, cultivares que en su momento fueron comerciales y cultivares que se han empleado y emplean en los programas de mejora del tabaco en Cuba como parentales desde hace más de 40 años.
MATERIALES Y MÉTODOS
Todos los cultivares de esta investigación se utilizaron o utilizan en los programas de mejora genética del tabaco en Cuba. Se plantaron semillas de 29 cultivares de tabaco (Nicotiana tabacum L.) y semillas de la especie silvestre Nicotiana plumbaginifolia Viv. (fuente natural del gen Php) en bandejas de poliestireno expandido, con 264 alveolos, que contenían sustrato orgánico con la siguiente composición: 70 % de turba negra, 15 % de cáscara de arroz y 15 % de zeolita 14, basado en la tecnología de bandejas flotantes, según García y Andino 15. Las bandejas se colocaron en condiciones de cultivo protegido o túneles.
Extracción de ADN
La extracción se realizó de hojas jóvenes de plantas de 45 días de edad, según el método del CTAB modificado 16. Las concentraciones de ADN se determinaron de forma espectrofotométrica, según las relaciones 260/280 nm y 260/230 nm. La integridad del ADN se determinó mediante electroforesis en agar al 0,8 %.
Condiciones de la PCR
El marcador RAPD, UBC 304908, se utilizó para identificar la presencia del gen Php. La PCR se realizó en un volumen de 15 µl. Las condiciones consistieron en 25 ng ADN genómico, 0,4 µM de oligo, tampón de reacción 1X TaqPol (Promega, EUA), 2,5 mM MgCl2, 200 µM de PCR Nucleotide Mix (Promega, EUA), y 1.0 U de Taq Polimerasa (Promega, EUA). El programa de amplificación utilizado fue el de Johnson et al, 2008 8. Brevemente, la reacción fue desnaturalizada inicialmente a 94 °C por 2 min, seguido por tres ciclos a 94 °C por 1 min, 38 °C por 1 min, y 72 °C por 2 min; 35 ciclos a 92 °C por 1 min, 40 °C por 1 min, 72 °C por 2 min y un paso de extensión final a 72 °C por 5 min. Diez microlitros de cada muestra más dos microlitros de Blue/Orange Dye 6x (Promega, EUA) se cargaron en un gel de agarosa al 1 % y separados a 150 volts por 1 hora en 1X Tris-Borato-EDTA. El ADN se visualizó con SYBR® Green Dye (Sigma-Aldrich, EUA), de acuerdo con las especificaciones de los proveedores y la talla del fragmento, se estimó a partir de un marcador molecular de 1 kb (Applichem, Alemania). La talla esperada de la banda para el fragmento ligado al gen Php es de aproximadamente 490 pb 8.
RESULTADOS Y DISCUSIÓN
En todos los cultivares testados está ausente el gen Php, excepto en N. plumbaginifolia que es la fuente natural (Tabla 1 y Figura 1). Los resultados aportan nueva información que sugiere que estos cultivares, que se utilizaron como progenitores en los programas de mejora del tabaco en Cuba a lo largo de más de 40 años, no contienen el gen Php. Este tipo de resistencia puede introducirse y explotarse en los actuales y futuros programas de mejora en nuestro país. La evidencia científica sobre la ausencia de Php en el tabaco comercial cubano entra en contradicción con lo citado por Espino y citado por Valdés, que afirma que los cultivares cubanos de tabaco tipo Virginia poseen la fuente de resistencia a la enfermedad “pata prieta” que proviene de N. plumbaginifolia17,18. En ninguno de los 10 cultivares de tabaco Virginia que se analizaron se encuentra el gen Php.
Tabla 1 Cultivares utilizados para identificar la presencia/ausencia del gen Php, tipo de tabaco y país de origen
| Nombre | Tipo de tabaco | País de origen |
|---|---|---|
| Nicotiana plumbaginifolia | Especie silvestre género Nicotiana | Perú, Bolivia, Paraguay, Brasil |
| Habana-2000 | Negro | Cuba |
| Criollo-2010 | Negro | Cuba |
| Habana-92 | Negro | Cuba |
| Corojo-99 | Negro | Cuba |
| Corojo-2006 | Negro | Cuba |
| Corojo | Negro | Cuba |
| Burley Pinar 2004 | Burley | Cuba |
| Habana 2.1.1 | Negro | Cuba |
| Corojo-2012 | Negro | Cuba |
| Criollo | Negro | Cuba |
| Criollo-98 | Negro | Cuba |
| Corojo Especial | Negro | Cuba |
| KY 910 | Virginia | EUA |
| RxT | Negro | Polonia |
| Pelo de Oro | Negro | México |
| GA-955 | Virginia | Australia |
| Bel 61-10 | Negro | EUA |
| KY 17 | Burley | EUA |
| KY 14 | Burley | EUA |
| San Luis 20 | Virginia | Cuba |
| San Luis-21 | Virginia | Cuba |
| San Luis-22 | Virginia | Cuba |
| K 326 | Virginia | EUA |
| Coker 86 | Virginia | EUA |
| B-11 | Virginia | EUA |
| NC-1151 | Virginia | EUA |
| Virginia Isogénica | Virginia | Cuba |
| Habana Vuelta Arriba | Negro | Cuba |
| Florida 513 | Negro | EUA |
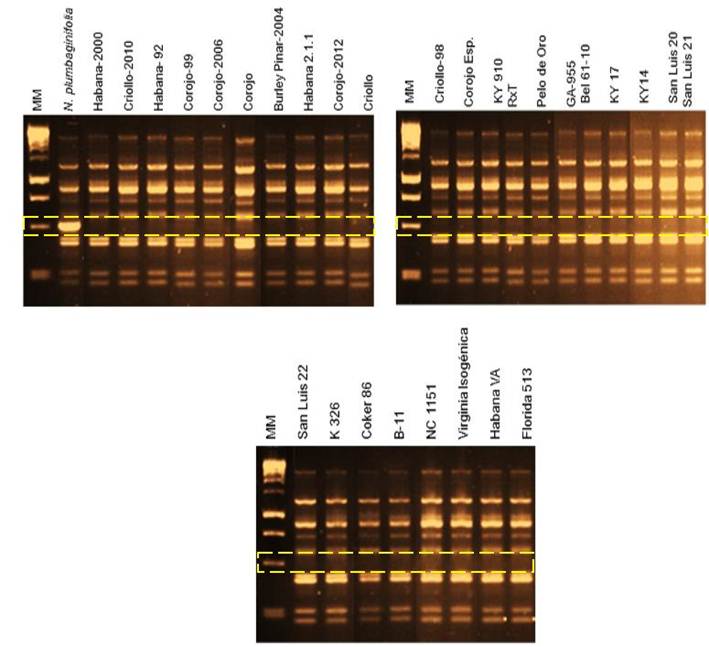
Figura 1 Identificación de la presencia/ausencia del marcador UBC30490 en los 29 cultivares analizados y en la especie silvestre N. plumbaginifolia mediante, electroforesis en agar al 1 %. Nótese que los rectángulos amarillos de líneas discontinuas señalan la presencia o ausencia de la banda de talla esperada de 490 pb para el gen Php y que solo aparece en N. plumbaginifolia
Sobre la base de esta nueva evidencia es posible desarrollar programas de mejora que utilicen como parentales un cultivar foráneo que tenga el gen Php y un cultivar cubano con buen desempeño agrícola y elevado rendimiento, para así obtener líneas y/o cultivares mejorados en cuanto a la resistencia a la “pata prieta” que posean el típico fenotipo comercial de tabaco cubano muy deseado por los consumidores de Europa. Debido a la baja durabilidad de los mecanismos de resistencia monogénica en tabaco 19, los programas deben estar enfocados a combinar la resistencia monogénica del gen Php con niveles medios o altos de resistencia poligénica que resulta más duradera en el tiempo.
Por esa razón es importante el diseño de esquemas de piramidación génica, que permitan obtener líneas élites de tabaco en cortos períodos de tiempo (tres a cinco años), que posean un amplio espectro de respuesta a las diferentes razas patogénicas de P. nicotianae, como resultado de la combinación de los tipos de resistencias monogénica y poligénica, sin afectar significativamente el rendimiento en la producción.
La existencia de marcadores AFLP, SSR y SCAR para la región genómica Wz, el componente de la resistencia en Beinhart-1000 y el gen Php, respectivamente 1,20, permiten aplicar métodos de mejora que permitan una selección más confiable, rápida y segura de las líneas genéticas resistentes. Uno de estos métodos es el retrocruce asistido por marcadores moleculares, que hace posible la combinación del gen Php en estado homocigótico o heterocigótico con otras fuentes de resistencia poligénica, como el fragmento genómico Wz en líneas isogénicas cercanas e híbridos isogénicos cercanos.
Se ha demostrado que Php y Wz se segregan de forma independiente y que la combinación de genotipos Wz/-Php/- exhiben niveles de resistencia a la “pata prieta”, que fueron significativamente mayores que los exhibidos por cultivares comerciales de EUA heterocigóticos para el gen Php, como NC 196 y NC 71 7. En tabaco, la introgresión de genes de resistencia, a partir de especies silvestres en estado heterocigótico, típicamente exhibe mayor desempeño agrícola y rendimiento en comparación con materiales en estado homocigótico 19.
En Cuba solo se informa la presencia de la Raza 0 de P. nicotianae y existe un debate sobre la presencia real de la Raza 1 21. El gen Php confiere inmunidad solo a la Raza 0, pero hay que tener cuidado con las líneas que se deriven de estos programas y que contengan este gen en estado homocigótico o heterocigótico. Es necesario cumplir los esquemas de rotación con cultivares que no posean el gen o que posean una fuente de resistencia diferente para evitar un cambio hacia la Raza 1 y la predominancia final de razas alternativas 11,22.
Todas las fuentes de resistencia ejercen presión de selección sobre el patógeno, lo que puede resultar en la selección y establecimiento de nuevas razas y/o poblaciones de patógenos con una mayor agresividad en genotipos de huéspedes resistentes 23.
En el tabaco, las poblaciones de P. nicotianae pueden exhibir mayor agresividad a las plantas con altos niveles de resistencia parcial, después de unas pocas generaciones de hospederos 22.
Cuando la resistencia completa se distribuye ampliamente en un área geográfica grande, conduce a una selección direccional en la población de patógenos. Esta selección da como resultado un aumento en los mutantes virulentos y la ruptura del gen de resistencia 22,23. Por lo tanto, la resistencia completa generalmente no es duradera y, a menudo, da como resultado ciclos de auge y caída en los que el huésped se ve favorecido durante un tiempo, seguido de un cambio a favor del patógeno 23.
En otro orden, es importante evaluar la calidad química de las nuevas líneas en términos de porcentaje de alcaloides totales y porcentaje de azúcares reductores y que estos valores estén dentro del margen comercial aceptable para el tabaco cubano en el mercado internacional. Las fuentes de resistencia a la “pata prieta” conocidas, se asocian regularmente con una reducción de los rendimientos y/o de la calidad de la hoja curada, lo que hace difícil el desarrollo de cultivares altamente resistentes, que a la vez produzcan altos rendimientos de hoja curada con características químicas de calidad adecuada 7.
Nota
Este artículo no cumple con el índice de Price porque que no hay más bibliografía actualizada disponible. Este gen fue descubierto hace más de 20 años y debido a que presenta problemas de ligamiento durante los cruces y en la segregación se ha hecho difícil su estudio y no se ha podido aislar, secuenciar y/clonar y los genetistas ante estas dificultades solo han investigado temas superficiales como su introgresión en cultivares de tabaco susceptibles a la “pata prieta” y han publicado artículos hace más de 10 años fundamentalmente sobre este tema en particular. Desde hace años se dejó de publicar en este tema y se perdió interés por las dificultades anteriormente expuestas y porque ya se tenían variedades con este gen y por el descubrimiento de nuevas fuentes de resistencia proveniente de especies silvestres del género Nicotiana que pueden incluirse en el genoma del tabaco comercial y son de más fácil estudio.
Pero para Cuba es un tema completamente nuevo que se está comenzando a explotar en las nuevas variedades de tabaco cubano como parte de un nuevo manejo integrado de plagas en el cual los esquemas de piramidación génica durante los programas de mejora se hacen necesarios para incluir nuevas fuentes de resistencia monogénica en combinación a otras fuentes de resistencia poligénica para desarrollar cultivares con un amplio espectro de resistencia.
Este artículo no cumple con el índice de Price porque que no hay más bibliografía actualizada disponible. Este gen fue descubierto hace más de 20 años y debido a que presenta problemas de ligamiento durante los cruces y en la segregación se ha hecho difícil su estudio y no se ha podido aislar, secuenciar y/clonar y los genetistas ante estas dificultades solo han investigado temas superficiales como su introgresión en cultivares de tabaco susceptibles a la “pata prieta” y han publicado artículos hace más de 10 años fundamentalmente sobre este tema en particular. Desde hace años se dejó de publicar en este tema y se perdió interés por las dificultades anteriormente expuestas y porque ya se tenían variedades con este gen y por el descubrimiento de nuevas fuentes de resistencia proveniente de especies silvestres del género Nicotiana que pueden incluirse en el genoma del tabaco comercial y son de más fácil estudio.
Pero para Cuba es un tema completamente nuevo que se está comenzando a explotar en las nuevas variedades de tabaco cubano como parte de un nuevo manejo integrado de plagas en el cual los esquemas de piramidación génica durante los programas de mejora se hacen necesarios para incluir nuevas fuentes de resistencia monogénica en combinación a otras fuentes de resistencia poligénica para desarrollar cultivares con un amplio espectro de resistencia.
CONCLUSIONES
En este artículo se demostró, que en los 29 cultivares utilizados, no se ha introgresado el gen Php, por lo que se clarifica que la fuente de resistencia a la “pata prieta” no proviene de Nicotiana plumbaginifolia.
Se hace necesario introducir este gen en los cultivares comerciales de tabaco, llevando a cabo una óptima estrategia varietal que los alterne con otros cultivares que presenten otro tipo de fuente de resistencia, evitando así la rápida adaptación del patógeno.
Esfuerzos futuros se deben encaminar en el desarrollo de programas de piramidación génica, para hacer coincidir más de un tipo diferente de resistencia a P. nicotianae en un mismo cultivar, siendo de vital importancia como línea base en los programas de mejoramiento genético.











 texto en
texto en 


