INTRODUCCIÓN
Los estudios fisiológicos relacionados con la simbiosis micorrízica arbuscular se dificultan considerablemente debido a la condición de simbiontes obligados que caracteriza a los hongos que intervienen en la asociación, lo cual, hasta el momento, hace imposible su crecimiento en condiciones axénicas 1. Sin embargo, el empleo del cultivo de raíces in vitro como un sistema simplificado para establecer dicha simbiosis, ha sido muy utilizado y particularmente útil en numerosos estudios fisiológicos que incluyen dos aspectos fundamentales: el intercambio de señales entre los simbiontes y el metabolismo fúngico 2,3.
A pesar de que existen en la actualidad diferentes especies o cepas de hongos micorrízicos arbusculares (HMA) que pueden sobrevivir en el ambiente que brinda este sistema de cultivo, reportándose en la literatura alrededor de 100 1, existen aún numerosos aislados que se resisten a colonizar las raíces transformadas e incluso, a germinar en esas condiciones. El perfeccionamiento metodológico continuo del sistema, teniendo en cuenta la composición de los medios de cultivo, las condiciones de crecimiento y los propágulos utilizados, hará que muchas de estas especies puedan ser cultivadas exitosamente en diferentes hospedantes y sistemas de cultivo 4.
En Cuba, el desarrollo de inoculantes amigables con el medio ambiente forma parte de la política del estado para lograr producciones limpias y aumentar la disponibilidad de alimentos para la población. En consecuencia, el Instituto Nacional de Ciencias Agrícolas (INCA) lidera la producción de inoculantes a base de hongos micorrízicos arbusculares (HMA). Por esta razón, contar con un cepario certificado de especies de HMA in vitro es una prioridad de las investigaciones que se llevan a cabo en la institución.
Por tanto, el presente estudio se planteó los objetivos de obtener esporas desinfectadas de Rhizoglomus sp. (INCAM-11) provenientes de suelo que expresen altos porcentajes de germinación y bajos niveles de contaminación, así como determinar el periodo de crecimiento de la hifa de germinación de propágulos de Rhizoglomus sp. (INCAM-11) en condiciones in vitro.
MATERIALES Y MÉTODOS
Material biológico
Se utilizó la cepa INCAM-11 de Rhizoglomus sp., procedente de la colección de HMA del Instituto Nacional de Ciencias Agrícolas (INCA) de Cuba. Los propágulos utilizados se aislaron del inoculante a través de la técnica de Tamizado húmedo y decantado y posterior extracción por centrifugación en gradiente de sacarosa + Tween 80 a 2000 rpm durante cinco minutos 5. Una vez obtenida la interfase agua - sacarosa + Tween 80, las esporas se extrajeron empleando una jeringa de 30 mL.
Se utilizó el medio SRM el cual estaba compuesto por (g L-1): Macroelementos (MgSO4.7H2O - 73,9; KNO3 - 7,6; KCl - 6,5; KH2PO4 - 0,41; Ca(NO3)2.4H2O - 35,9; NaFeEDTA - 0,16); Microelementos (MnSO4.4H2O - 1,225; CuSO4.5H2O - 1,1; ZnSO4.7H2O - 0,14; H3BO3 - 0,925; Na2MoO4.2H2O - 0,12; (NH4)6Mo7O24.4H2O - 1,7); Vitaminas (Pantotenato de calcio - 0,09; Biotina - 0,0001; Ácido nicotínico - 0,1; Piridoxina - 0,09; Tiamina - 0,1 y Cianocobalamina - 0,04); Sacarosa - 10). El pH se ajustó a 5,5 antes de adicionar 4 g L-1 de GellamGum y el medio se esterilizó a 121 ºC por 15 min.
Desinfección de esporas de Rhizoglomus sp. (INCAM-11)
Para desinfectar los propágulos de INCAM - 11 se utilizó la metodología propuesta por Cranenbrouck et al 6. Se emplearon 100 propágulos de la cepa, los cuales se colocaron sobre una membrana (0,44 μm de poro) y se lavaron tres veces con agua destilada estéril. Posteriormente, se pusieron en contacto con una solución de Cloramina T al 2 % y dos gotas de Tween 20 durante 10 minutos. Seguidamente se lavaron tres veces con agua destilada estéril y se trataron con una solución de antibióticos durante 10 minutos que contenía Sulfato de estreptomicina (0,02 %) y Sulfato de gentamicina (0,01 %), la cual se esterilizó con ayuda de un filtro miliporo (tipo HA, 4,0 cm de diámetro y 0,22 μm de poro). Pasado este tiempo la membrana con los propágulos fue transferida a la solución antibiótica, previamente filtrada en placa Petri estéril (90 mm diámetro).
Para el control de contaminantes se colocaron aleatoriamente cuatro placas Petri en el gabinete de bioseguridad con medios específicos para hongos (Agar Maltosa Sabouraud) y para bacterias (Agar Nutriente).
En todos los casos se utilizó un Diseño Completamente Aleatorizado para el montaje de los ensayos.
Experimento 1. Evaluación del porcentaje de germinación y contaminación de propágulos de Rhizoglomus sp. (INCAM-11) en condiciones in vitro
En este experimento se realizaron dos bioensayos con el propósito de evaluar la eficiencia de la metodología propuesta por Cranenbrouck et al 6 para garantizar la desinfección y posterior germinación de propágulos de INCAM-11. Cada uno de los bioensayos se repitió dos veces.
Bioensayo 1. En este estudio los propágulos se inocularon en medio SRM, inmediatamente después de concluido el tratamiento de desinfección 6. Se inocularon 20 placas Petri (90 mm diámetro), a razón de 5 propágulos por placa, para un total de 100 propágulos. Al finalizar el tratamiento se sellaron las placas con parafilm (Pechiney, Plastic Packaging, Chicago, IL 60631) y se incubaron (Incubadora Binder, Bégica) en oscuridad durante 60 días a 27 °C.
Bioensayo 2. En el segundo ensayo se compararon dos tiempos de exposición a la solución antibiótica con el objetivo de disminuir la contaminación de los propágulos e incrementar los porcentajes de germinación. Se realizaron dos tratamientos, uno en el cual los propágulos se inocularon en medio SRM justo después de la desinfección (DD) y otro en el que los propágulos se mantuvieron en la solución durante 24 horas posteriormente al tratamiento de desinfección (24 DD). Se inocularon igualmente cinco propágulos por placa y se emplearon 20 placas por tratamiento. Al finalizar la inoculación las placas se sellaron con parafilm e incubaron en iguales condiciones al bioensayo anterior.
Las placas se examinaron cada cuatro días para evaluar los porcentajes de germinación y contaminación de los propágulos hasta llegar al día 60 posterior a la desinfección.
Determinaciones realizadas. Se realizaron las determinaciones correspondientes a porcentaje de germinación y contaminación. Se consideró un propágulo germinado cuando este presentaba crecimiento del tubo germinativo con un largo superior al diámetro de la espora, ya fuese a partir del esporóforo o del extremo de la hifa de sostén 7.
En el caso de la contaminación, se consideró el número de propágulos contaminados en una placa con respecto al número total de propágulos que se sembraron en cada una.
En el ensayo de comparación del tiempo de exposición a la solución antibiótica se calcularon, además, los porcentajes de incremento y decremento de la germinación y la contaminación, respectivamente.
Experimento 2. Evaluación del crecimiento del tubo germinativo
Este experimento se diseñó con el propósito de realizar una dinámica de crecimiento del tubo germinativo de propágulos de INCAM-11. La variable comenzó a evaluarse a partir del momento en que se observó crecimiento del tubo germinativo a partir del esporóforo o de la hifa de sustentación. Las mediciones se realizaron cada cuatro días con un micrómetro acoplado al microscopio de disección (Novel, Aumento 40X), partiendo del comienzo de la nueva hifa formada y hasta el ápice de la misma. Este estudio se extendió hasta tanto se observara que las hifas detuvieran su crecimiento.
En este estudio también se comparó el largo del tubo germinativo de propágulos a los que se les aplicaron ambos tratamientos de desinfección descritos en el bioensayo 2 del experimento 1.
Análisis Estadístico
Después de comprobada la normalidad y la homogeneidad de varianza (Test de Brown-Forsythe), utilizando el paquete estadístico SPSS Statistics 19 (IBM), los datos fueron sometidos a Análisis de Varianza de clasificación simple y posterior Test de Tuckey, con el fin de identificar las diferencias significativas entre los tratamientos a p<0,05.
RESULTADOS Y DISCUSIÓN
Experimento 1. Evaluación del porcentaje de germinación y contaminación de propágulos de Rhizoglomus sp. (INCAM-11) en condiciones in vitro
La desinfección de esporas de hongos micorrízicos empleadas como inóculo es crucial para la formación y el desarrollo exitoso de la micorrización en condiciones in vitro, por ser la presencia de contaminantes uno de los mayores problemas que atenta contra el estudio de estos microorganismos bajo condiciones controladas; además, las metodologías de desinfección deben ser establecidas para cada especie de hongo en particular pues el efecto de los desinfectantes o sus combinaciones, varían en función de la especie utilizada 8.
Bioensayo 1. En este ensayo se encontró que los propágulos desinfectados de INCAM-11 comenzaron a germinar entre el sexto y octavo día posterior al tratamiento y continuaron germinando progresivamente hasta el día 28. Este comportamiento se corresponde con lo planteado por otros autores 9, quienes refirieron que los propágulos de HMA tardan en germinar de 2 a 30 días después de concluido el tratamiento de desinfección.
Los valores medios de germinación, a los 60 días, fueron inferiores a 50 %, como se puede apreciar en la Figura 1, mientras que el 60 % de las placas inoculadas mostraba algún crecimiento de contaminantes microbianos asociados a los propágulos (Figura 2).
Al parecer, los contaminantes que proliferaron en las placas estaban asociados a los propágulos antes de la desinfección (Figura 2), ya que en las placas controles que contenían medios específicos para hongos (Agar Maltosa Sabouraud) y bacterias (Agar Nutriente), no se observó crecimiento microbiano, lo cual evidencia que la contaminación de los propágulos procedió de las paredes de los mismos.
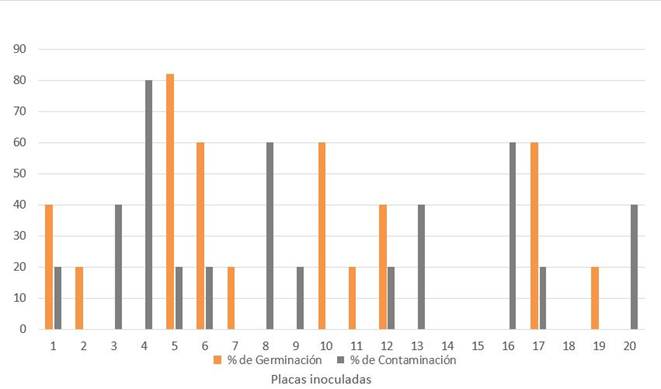 Las barras representan las medias de cinco propágulos
Las barras representan las medias de cinco propágulosFigura 1 Comportamiento de los porcentajes de Germinación y Contaminación estimados en cada una de las placas Petri inoculadas con propágulos de INCAM-11 en el Bioensayo 1
La eficiencia de la metodología de desinfección utilizada ha sido comprobada en numerosos estudios anteriores 2,8,10 y en un determinado número de cepas de HMA que hoy se encuentran formando parte de las dos colecciones de HMA in vitro del mundo (GINCO Bélgica y GINCO Canadá). Sin embargo, en el caso de esta cepa en particular las concentraciones de contaminantes que proliferaron después del tratamiento de desinfección son altas, con porcentajes que oscilan entre 20 y 80 en cada una de las placas (Figura 1).
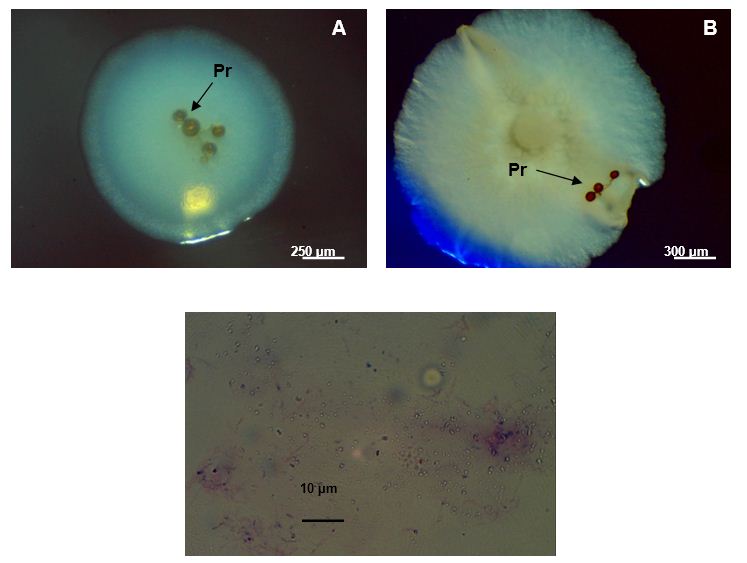 Fotos tomadas al microscopio de disección (A y B) (Novel, 40X). Foto C tomada al microscopio óptico (Novel, 1000X)
Fotos tomadas al microscopio de disección (A y B) (Novel, 40X). Foto C tomada al microscopio óptico (Novel, 1000X)Figura 2 Imágenes de contaminación bacteriana asociada a propágulos (Pr) desinfectados de INCAM - 11 (A y B). Tinción de Gram del contaminante más frecuente (C)
Los valores de germinación alcanzados son por lo general similares a los encontrados por otros autores 11, quienes reportaron, en esporas de Gigaspora margarita (Becker & Hall) y Scutellospora heterogama (Nicolson & Gerdemann - Walker & Sander) inoculadas en medio Agar Agua, valores cercanos a 60 % en presencia de Cloramina T (2 %) y tiempos de exposición a los desinfectantes + antibiótico entre 3 y 6 minutos. Sin embargo, Pérez et al 8, aplicando la misma metodología de desinfección que la utilizada en este estudio y utilizando igualmente el medio de cultivo SRM, informaron solo un 33 % de germinación en esporas de Rhizoglomus sp.
La germinación de propágulos de HMA puede ocurrir en ausencia de señales derivadas del hospedante, aunque no puedan completar su ciclo de vida bajo estas condiciones. No obstante, existen algunos factores que pueden estimular la germinación e incluso inhibirla como es la composición del medio de cultivo, el pH, algunos compuestos orgánicos, la humedad y los microorganismos asociados 12.
En el caso específico de los microorganismos, existen determinados grupos microbianos que pueden, no solo estimular la germinación de los propágulos, sino también inhibirla y viven, por lo general, asociados a las esporas e hifas de los HMA, ya sea en el lumen celular, o adheridos a sus paredes. Pueden, además, tener una participación en los beneficios que estos hongos le reportan a las plantas 13.
Las investigaciones, utilizando esporas totalmente desinfectadas de Funneliformis mosseae permitieron aislar un gran número de microorganismos que crecían en el interior de las esporas 14. Estos autores lograron subcultivar 11 aislados pertenecientes a varios grupos microbianos que no solo eran capaces de estimular la germinación de las esporas y la ramificación de las hifas, sino que además solubilizaban fosfato y fijaban nitrógeno atmosférico.
Por otro lado, los estudios de desinfección en esporas de Rhizoglomus clarus permitieron demostrar que algunos contaminantes que crecieron alrededor de las esporas obstaculizaron la emergencia y el crecimiento del tubo germinativo, por lo que la germinación de las mismas se vio limitada 15.
No obstante, es importante destacar que existen determinados grupos de microorganismos no considerados contaminantes que habitan las paredes de las esporas y que ejercen un papel benéfico sobre la germinación y la longitud del tubo de germinación 12, por lo que el empleo de metodologías de desinfección poco agresivas, que no eliminen totalmente los microorganismos que cohabitan con las esporas, es la clave para garantizar el éxito de la germinación 14.
Algunos microorganismos de los géneros Pseudomonas y Corynebacterium, pueden incrementar la germinación de esporas de Rhizoglomus versiforme e inciden directamente en los mecanismos de destrucción de la pared externa, intercambian material molecular y combinan algunos productos finales de la síntesis de cada uno de los microorganismos involucrados 15.
Al respecto, en otra investigación se informó una estimulación marcada de la germinación de esporas de Funneliformis mosseae cuando estas se inocularon en presencia de especies microbianas previamente aisladas de su interior 14.
Bioensayo 2. Con el objetivo de disminuir la contaminación de los propágulos e incrementar los porcentajes de germinación se realizó este ensayo, extendiendo el tiempo de exposición a la solución de antibióticos a 24 horas, después de concluido el tratamiento de desinfección.
La Figura 3 representa el efecto de esta variación sobre el comportamiento de ambas variables.
En cuanto a la germinación, se observó que los propágulos que estuvieron expuestos a la solución antibiótica durante 24 h previas a su inoculación comenzaron a germinar de dos a cuatro días antes que en el bioensayo anterior, o sea a los cuatro días, y los porcentajes de germinación aumentaron gradualmente con relación a los propágulos que no recibieron este tratamiento, alcanzando un 75 % de incremento. Así mismo, la exposición prolongada a la solución antibiótica contribuyó a reducir los niveles de contaminación en un 46 %.
Muchos estudios se han realizado con esporas de diferentes géneros de HMA bajo condiciones in vitro donde ha sido exitosa la implementación de agentes desinfectantes como Cloramina T, Tween 20 y soluciones de antibióticos (ej. Estreptomicina, Sulfato de gentamicina, Cefalexina, etc.) a diferentes concentraciones y tiempos de exposición 2,5,8; sin embargo, mantener los propágulos durante 24 h expuestos a la solución antibiótica no había sido informado hasta el momento.
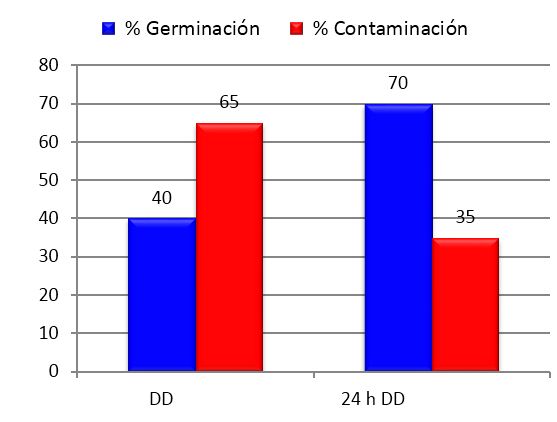 Barras del mismo color con letras distintas difieren entre sí. Las barras son las medias de 20 placas conteniendo cinco propágulos cada una. Diferencias significativas para p<0,05 según Test de Tukey. - DD después de la desinfección; 24 h DD-24 horas después de la desinfección
Barras del mismo color con letras distintas difieren entre sí. Las barras son las medias de 20 placas conteniendo cinco propágulos cada una. Diferencias significativas para p<0,05 según Test de Tukey. - DD después de la desinfección; 24 h DD-24 horas después de la desinfecciónFigura 3 Efecto del tiempo de permanencia en la solución antibiótica antes de la inoculación sobre los porcentajes de germinación y contaminación de propágulos de INCAM-11 en el bioensayo 2
Lo antes mencionado confirma que para obtener resultados satisfactorios en la desinfección de esporas, las concentraciones de los desinfectantes y antibióticos, así como la duración de los tratamientos deben ser adaptadas dependiendo de los niveles de contaminación y la sensibilidad de las esporas.
Aunque en este bioensayo se redujo considerablemente la contaminación con relación al bioensayo 1, los niveles que se obtuvieron son considerados altos si se comparan con los informados por Danesh et al 5, utilizando similar metodología. Estos autores obtuvieron porcentajes de contaminación menores a 5 % en esporas tratadas de Rhizoglomus intraradices.
Las concentraciones de microorganismos en los propágulos de HMA debe estar relacionada con la especie fúngica y el sustrato en el que se desarrollan antes de su esterilización. Durante el proceso de colonización, los HMA interactúan con numerosas bacterias y las esporas e hifas proporcionan sitios en los que ciertas poblaciones microbianas comúnmente habitan 12, por lo que ambos criterios son condicionantes para que en sus propágulos convivan con mayor o menor número de microorganismos.
Los resultados de este primer experimento demuestran que modificando las metodologías existentes se pueden obtener los efectos esperados. De tal manera que si las esporas de INCAM-11 se mantienen en solución antibiótica durante 24 horas, utilizando la metodología de Cranenbrouck et al 6, antes de su inoculación en medio de cultivo SRM, se incrementan sus porcentajes de germinación en un 75 %, se reducen los niveles de contaminación en un 46 % y la ocurrencia del proceso germinativo se adelanta de dos a cuatro días.
El crecimiento presimbiótico de los HMA es una fase decisiva para la sobrevivencia de estos hongos ya que de este depende que puedan encontrar un hospedante compatible para completar su ciclo de vida y el empleo de las técnicas de cultivo in vitro ha permitido estudiar cómo diferentes factores pueden, sinérgica o individualmente, afectar el crecimiento del hongo durante este temprano y sensible estadio de su desarrollo.
Experimento 2. Evaluación del crecimiento del tubo germinativo
En este experimento se realizó una evaluación de la dinámica de crecimiento de los tubos germinativos de INCAM-11, previamente desinfectados, utilizando ambos tratamientos de desinfección (Bioensayo 2) para determinar el momento en que detienen su crecimiento en condiciones axénicas.
Como puede apreciarse en las Figuras 4 y 5 los propágulos comienzan a germinar igualmente que en los ensayos anteriores, entre los días cuatro y ocho posteriores a la desinfección, dependiendo del tratamiento. A partir de este momento los tubos germinativos continúan creciendo exponencialmente hasta alcanzar valores constantes alrededor del día 56 (Figura 4).
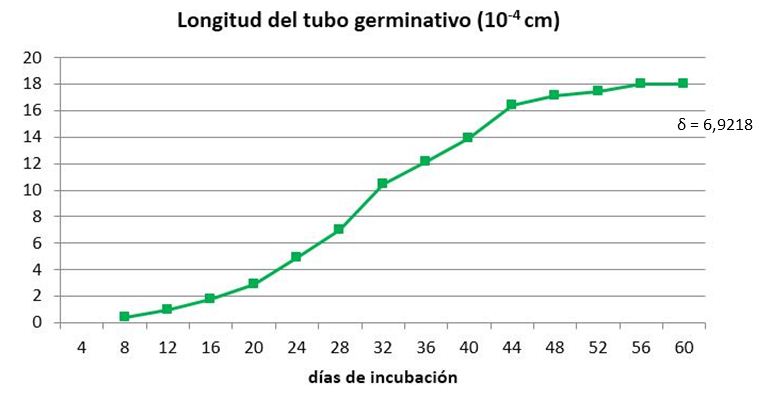 Los puntos corresponden a la media de 100 propágulos
Los puntos corresponden a la media de 100 propágulosFigura 4 Dinámica del crecimiento del tubo germinativo de propágulos de INCAM-11 inoculados para germinar en medio SRM durante 60 días
Cuando los propágulos se mantienen en la solución antibiótica durante 24 h comienzan a germinar antes y se alcanzan mayores valores de largo del tubo germinativo (LTG), mostrando, a partir del día 16, diferencias significativas entre los tratamientos (Figura 5) y porcentajes de incremento de 35 % como promedio.
La germinación de los propágulos no es homogénea, sino que varía en el día de inicio, en la longitud alcanzada y en el momento que detienen su crecimiento.
En este experimento las hifas germinantes que crecieron durante más días detuvieron su crecimiento el día 56 (Figuras 4 y 5), con independencia del momento en que habían comenzado a germinar, estimándose un promedio de 30 días durante los cuales las hifas continuaron creciendo en busca de señales provenientes de un hospedante potencial antes de detener su progresión, debido probablemente al agotamiento de las reservas de los propágulos.
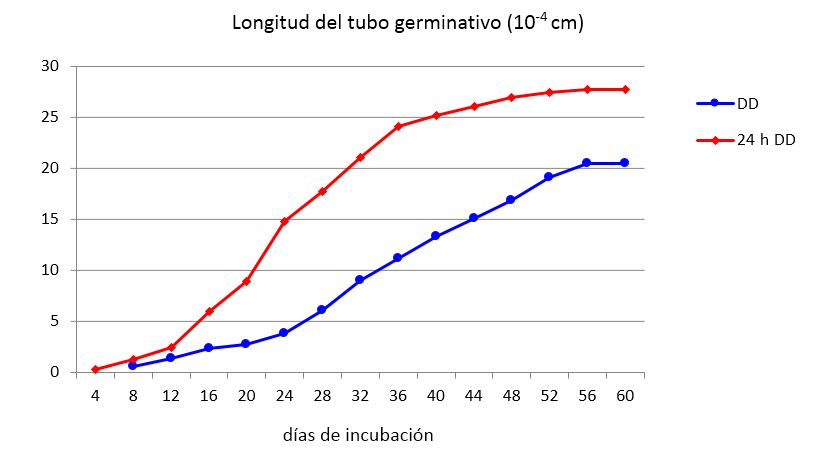 Los puntos corresponden a la media de 100 propágulos. Diferencias significativas para p<0,05 según Test de Tukey. DD - después de la desinfección; 24 h DD - 24 horas después de la desinfección
Los puntos corresponden a la media de 100 propágulos. Diferencias significativas para p<0,05 según Test de Tukey. DD - después de la desinfección; 24 h DD - 24 horas después de la desinfecciónFigura 5 Efecto del tiempo de exposición a la solución antibiótica sobre el crecimiento del tubo germinativo de propágulos de INCAM-11
Varios autores aseguran que el crecimiento del tubo germinativo es dependiente de la disponibilidad y cantidad de reservas de las esporas 16 y que el protoplasma contiene todos los organelos necesarios para asegurar su desarrollo posterior. Este consiste en el crecimiento recto de la hifa corredora en busca de un hospedante potencial y las sucesivas ramificaciones más finas que se producen para explorar el medio circundante. En el caso de no existir contacto con alguna raíz o que alguna señal proveniente de un hospedante no sea detectada, el tubo germinativo detiene su crecimiento, el protoplasma se retrae desde el ápice de la hifa y es secuestrado, vaciando la hifa, a través de la producción de sucesivos septos.
Otros autores han encontrado resultados similares con relación al tiempo que tardan los tubos germinativos de esporas de HMA en detener su crecimiento 17. Según estos autores, en un experimento de germinación de esporas de R. intraradices previamente desinfectadas, observaron la formación de septos en el extremo apical de la hifa, la retracción del citoplasma y el cese del crecimiento hifal, entre dos y cinco semanas después de su inoculación en medio de cultivo y en ausencia de raíces transformadas.
Al parecer no existe una alta relación entre el momento en que germinan los propágulos y el tiempo que transcurre hasta que detienen su crecimiento las hifas germinantes, lo cual pudo confirmarse con las correlaciones realizadas (r = 0,424 a p ≤ 0,05).
La longitud de los tubos germinativos y la germinación de las esporas son parámetros que no están relacionados, por tanto una mayor tasa de germinación no implica que los tubos germinativos sean mayores 18. La longitud que puedan alcanzar estas estructuras está más relacionada con el tamaño de las esporas y las reservas que puedan almacenar 18 y se manifiesta tanto en esporas de géneros diferentes 12, como en individuos de la misma especie 18.
CONCLUSIONES
El tiempo de permanencia de las esporas en solución antibiótica durante 24 horas antes de su inoculación en medio de cultivo SRM, incrementa los porcentajes de germinación, disminuye los porcentajes de contaminación y la germinación se adelanta de dos a cuatro días. Hasta el momento, ningún estudio anterior había tenido en cuenta esta modificación, por lo que el uso de la misma en las metodologías de desinfección favorecerá el éxito de los cultivos in vitro.
Las hifas de germinación de Rhizoglomus sp. (INCAM-11) se extienden en el medio de cultivo durante aproximadamente 30 días de forma independiente, antes de detener su crecimiento, lo que contribuye al posterior establecimiento de la asociación con raíces transformadas.
RECOMENDACIONES
Utilizar la metodología de desinfección de esporas de Cranenbrouck et al, extendiendo el tiempo de exposición a los antibióticos a 24 horas, para incrementar los porcentajes de germinación de esporas de Rhizoglomus sp. (INCAM - 11) provenientes de suelo y disminuir los niveles de contaminación.











 texto en
texto en 


