INTRODUCCIÓN
Los hongos micorrizógenos arbusculares (HMA, Phyllum Glomeromycota) son parte integral de numerosos ecosistemas y se consideran particularmente ventajosos debido a que se asocian a la mayoría de las plantas vasculares 1. Esta simbiosis mutualista facilita la captación de nutrientes minerales y agua a la vez que protege a las plantas contra distintas enfermedades 2,3. La mayoría de los HMA contribuyen a la estabilidad de los agregados del suelo 4 y se adaptan a un amplio espectro de condiciones edáficas que están relacionadas con su desarrollo y eficacia 5,6. El pH es considerado uno de los parámetros químicos más importantes del suelo 7, debido al efecto que ejerce tanto sobre las características físicas, químicas y biológicas de éste, como también sobre el rendimiento de los cultivos. A través del intercambio iónico el pH regula directamente la disponibilidad de los nutrientes, lo que determina la riqueza de especies y la composición de la comunidad de microrganismos entre los que se encuentran los HMA 7.
El pH determina en muchos casos la eficiencia del endófito, el porcentaje de germinación y el desarrollo de las esporas de los HMA 6,7. Por tanto, es muy importante en los estudios de selección de especies de HMA, con alta eficiencia simbiótica, tener en cuenta el efecto del pH, ya sea, sobre la productividad de la asociación o sobre los mecanismos de reproducción fúngicos, con el fin de poder seleccionar las especies o ecotipos de mayor eficiencia en un rango amplio de pH o en los rangos que resulten de interés 8,9. A pesar de la importancia de los hongos HMA en la fisiología y nutrición de las plantas, así como en la formación de comunidades de plantas, los factores que afectan la germinación, diversidad, densidad de esporas y colonización de raíces por HMA son poco conocidos 8.
Atendiendo a los aspectos anteriormente descritos el trabajo tuvo como objetivo evaluar el efecto del pH del medio de cultivo Strullu y Romand Modificado (SRM) en el crecimiento presimbiótico de Rhizoglomus irregulare (INCAM 11) en condiciones “in vitro”.
MATERIALES Y MÉTODOS
Para el presente estudio se evaluó el crecimiento del tubo germinativo de Rhizoglomus irregulare (INCAM 11), en diferentes condiciones de pH (4,5; 5,5; 6,5 y 7,5) del medio de cultivo Strullu y Romand Modificado (SRM).
Material biológico
Para la ejecución del experimento se extrajeron esporas de INCAM11 procedente de la colección de HMA del Instituto Nacional de Ciencias Agrícolas (INCA) de Cuba mediante la técnica de Tamizado húmedo y decantado y posterior extracción por centrifugación en gradiente de sacarosa + Tween 80 a 2000 rpm en centrifuga de mesa (KUBOTA) durante cinco minutos 10,11. Una vez obtenida la interfase agua - sacarosa + Tween 80, las esporas se extrajeron empleando una jeringa de 30 mL.
Desinfección de esporas de Rhizoglomus irregulare. (INCAM-11)
De los propágulos extraídos se seleccionaron ramilletes de esporas según la técnica de desinfección previamente propuesta por Cranenbrouck et al. 12, modificado por Perera 13, los cuales se colocaron sobre una membrana (0,44 μm de poro) y se lavaron tres veces con agua destilada estéril. Posteriormente, se pusieron en contacto con una solución de Cloramina T al 2 % y dos gotas de Tween 20 durante 10 minutos. Seguidamente se lavaron tres veces con agua destilada estéril y se trataron con una solución de antibióticos durante 10 minutos que contenía Sulfato de estreptomicina (0,02 %) y Sulfato de gentamicina (0,01 %), la cual se esterilizó con ayuda de filtro miliporo (tipo HA, 4,0 cm de diámetro y 0,22 μm de poro). Pasado este tiempo la membrana con los propágulos fue transferida a la solución antibiótica, previamente filtrada en placa Petri estéril (90 mm diámetro) durante 24 horas.
Posteriormente, los propágulos se inocularon en placas Petri de 90 mm diámetro, divididas en 4 compartimentos que contenían cada uno, medio de cultivo SRM con los diferentes pH en estudio 4,5; 5,5; 6,5 y 7,5 ajustados con HCL o NaOH según correspondiera.
Evaluación del crecimiento del tubo germinativo de propágulos de Rhizoglomus irregulare (INCAM - 11) en condiciones in vitro
Este experimento se diseñó con el propósito de realizar una dinámica de crecimiento del tubo germinativo de propágulos de INCAM-11. Esta variable se evaluó a partir del momento en que se observó crecimiento del tubo germinativo a partir del esporóforo o de la hifa de sustentación. Las mediciones del mismo se realizaron una vez por semana durante un mes, con un micrómetro acoplado al microscopio de disección (Novel, Aumento 40X), partiendo del comienzo de la nueva hifa formada y hasta el ápice de la misma.
Análisis estadístico
Una vez comprobada la normalidad, se calculó el intervalo de confianza de las medias al 95 % de probabilidad, atendiendo al número de repeticiones (10 réplicas por tratamiento) y la reproducibilidad de los datos. Los análisis de comparación de medias y la determinación de los intervalos de confianza fueron realizados por el programa STATISTIC versión 6.1.
RESULTADOS Y DISCUSIÓN
En la Figura 1 se muestra el efecto de los diferentes pH en el crecimiento del tubo germinativo de la cepa Rhizoglomus irregulare (INCAM 11). Se observó que los mayores valores de longitud del tubo germinativo los mostró la cepa en el pH 7,5, presentando diferencias estadísticamente significativas desde el inicio del experimento con el resto de los tratamientos.
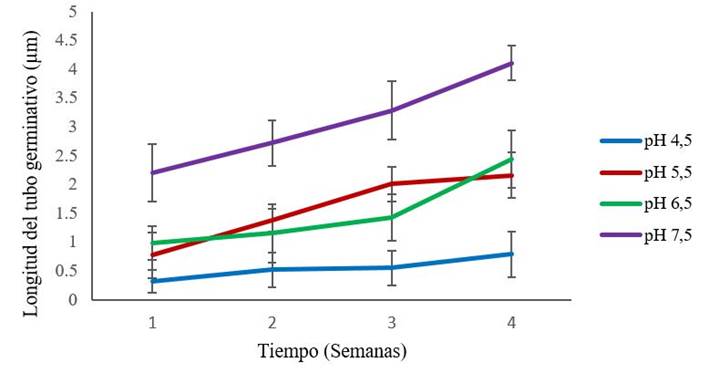 Las barras representan los intervalos de confianza de la media de tratamientos para p≤ 0,05 (n=4tratamientos)
Las barras representan los intervalos de confianza de la media de tratamientos para p≤ 0,05 (n=4tratamientos)Figura 1 Dinámica del crecimiento del tubo germinativo de propágulos de INCAM 11 inoculados en medio SRM durante cuatro semanas
Investigaciones dirigidas al estudio del efecto del pH en la colonización micorrízica, plantean que hay determinadas cepas de HMA insensibles al aumento del pH (valores de pH 7), aunque éstas, de manera general, tienen un mejor rendimiento en suelos alcalinos, o en condiciones de pH neutro 7. No obteniéndose los mismos resultados para suelos ácidos donde el número de hifas y arbúsculos presentes en las raíces examinadas eran escasas.
En el Instituto Nacional de Ciencias Agrícolas (INCA) se trabaja desde 1992 en la utilización y extensión de estos hongos en la nutrición vegetal en general y en la fosforada en particular, contando con un sistema de recomendación de cepas por tipo de suelo, en función de su pH, contenido de materia orgánica y nivel de fertilidad 14. De esta forma, estudios realizados en suelos Pardo Mullido Carbonatado con un pH-H2O ligeramente alcalino 2,7 se observó que la cepa INCAM 11 presentó siempre un efecto superior y significativo (p≤0,05), diferenciándose de los obtenidos por las cepas restantes Glomus cubense y Funneliformis mosseae15. En la presente investigación, este resultado permitió corroborar que la mencionada cepa presentó los mejores valores de germinación en un pH cercano al que se empleó para el estudio de extensión antes mencionado 15. Con lo cual se corrobora que el efecto del pH es determinante para la eficiencia de la cepa empleada por tipo de suelo, lo que evidencia que su potencialidad está relacionada con el pH del medio en que se desarrolla. Esto le permite acceder al sitio de infección con más facilidad lo que le posibilita establecerse en estas condiciones y ejercer su efecto.
Recientemente, algunos autores han planteado que la relación que se establece entre los rangos de pH del suelo y el efecto de la colonización micorrízica es verdaderamente complejo, dependiendo no sólo de la especie micótica, sino también del tipo de suelo, la forma en que se encuentran los nutrientes (fundamentalmente P y N y otros elementos como Cu, Zn, Mo, B, etc.) y en menor medida de la especie de planta sobre la que se desarrolla 8, en este sentido, es de destacar que estos efectos son importantes desde el inicio del ciclo de vida del simbionte, como se observó en este experimento, lo cual confirma la teoría de que el funcionamiento óptimo está determinado por el pH del sustrato en el cual se desarrolla el simbionte.











 texto en
texto en 


