INTRODUCCIÓN
Trichoderma sp. es empleado como bioplaguicida, por sus propiedades para inhibir fitopatógenos fúngicos. Este hongo se puede encontrar distribuido en diferentes zonas y hábitats, especialmente en sitios que contienen abundante materia orgánica 1. Su principal actividad antifúngica es el resultado de la competencia antagónica, mecanismo de vital importancia y definido como el comportamiento diferenciado de dos o más organismos frente a un mismo requerimiento, de manera que uno de los organismos reduce el espacio o los nutrientes disponibles del otro 2-3. Ciertas características como la velocidad específica de crecimiento o el desarrollo y factores externos: temperatura, humedad o pH, influyen en la competencia antagónica 4.
La producción global de tomate (Lycopersicum sculentum) para consumo, se estima en 108 000 000 t, con un rendimiento promedio de 36 t ha-1. China, es el mayor productor del mundo, seguido por EE.UU, Turquía, India, Egipto e Italia 5. La producción anual de tomate en Cuba representa más del 50 % del área total cultivada por las hortalizas, con más de 200 000 t comercializada 6. Para el año 2017 la FAO estimó que en Cuba se cultivaron 48713 ha de tomate; con una producción de 58 4072 t y un rendimiento superior a las 11 t ha-1 (7.
En los cultivos de tomate se ha observado una elevada incidencia de Stemphylium lycopersici en muchas regiones del mundo. Recientemente se ha informado un incremento de esta enfermedad en Sur América 8. Este patógeno se encuentra ampliamente distribuido en Cuba, incidiendo principalmente en el Occidente del país 9. Provoca la marchitez de las hojas y tallos en las plantas y en consecuencia acorta el ciclo biológico normal y reduce los rendimientos 10. En el Laboratorio Provincial de Sanidad Vegetal de Holguín se ha registrado, en los últimos 10 años, una afectación recurrente y masiva de este patógeno, lo que provoca grandes pérdidas de cosechas de tomate. Hasta el momento, no se conoce las causas que pudieran influir en el incremento de esta enfermedad.
Por lo antes expuesto se estableció como objetivo de este trabajo evaluar la efectividad antagónica in vitro de T. harzianum cepas A-34, A-53 y T. viride TS-3, frente a S. lycopersici.
MATERIALES Y MÉTODOS
Se utilizaron tres cepas: Trichoderma harzianum Rifai Cepa A-34, Trichoderma harzianum Rifai Cepa A-53 y Trichoderma viride Persoon Cepa TS-3, procedentes del Centro de Reproducción para el Control Biológico (CREE), de Ciudad Jardín, Empresa Agropecuaria de Holguín.
A partir de plantas de tomate Lycopersicon sculentum, Mill variedad HC-2580, con síntomas de Stemphylium lycopersici se colectaron las hojas que presentaron puntos oscuros o pequeñas manchas de unos 2 a 4 mm, de color pardo o negras y circulares con los contornos irregulares y rodeadas por un halo amarillento. En algunos casos las hojas colectadas presentaron manchas de color gris con un orificio en el centro de la hoja 10. Las hojas fueron obtenidas de cultivos de tomate de los municipios de Gibara, Holguín y Banes en la provincia de Holguín.
Los ensayos de antagonismo se realizaron en el Laboratorio Provincial de Sanidad Vegetal de Holguín, en el departamento de micología. Stemphylium lycopersici se aisló a partir de hojas infectadas de L. sculentum. El patógeno fue reproducido mediante inoculación de suspensión micelial en placa Petri, con medio de cultivo Agar Papa Dextrosa (APD) a 28 °C, durante 72 horas en una incubadora 11.
El enfrentamiento de S. lycopersici y Trichoderma sp. se realizó mediante el ensayo de antagonismo 12. Se utilizaron placas Petri de 90 mm de diámetro, con medio de cultivo APD. El micelio de S. lycopersici y de las cepas de Trichoderma sp. fue obtenido del centro de las colonias crecidas en placas Petri al sexto día. Se colocó en un extremo de la placa un disco de 7 mm de diámetro del micelio del patógeno y en el extremo opuesto otro disco de 5 mm con micelio de cada cepa de Trichoderma sp, según los diferentes tratamientos. Muestras del patógeno no inoculadas con Trichoderma sp. se utilizaron como control. Se utilizaron seis placas Petri por cada tratamiento para cada una de las cepas T. harzianum A-34, A-53 y T. viride TS-3. A partir del séptimo día de iniciar el enfrentamiento, se midió el porcentaje de inhibición micelial IM (%) 13,14. Para determinar el área de crecimiento micelial de Trichoderma sp. se empleó el software Image J de NHI 15.
Análisis estadístico
Para comparar el IM (%) entre las cepas, se realizó un PERMANOVA, con 10 000 permutaciones, empleando la distancia euclidiana, con un nivel de significación del 5 %, el valor de p sin corrección. Se utilizó el Software estadístico PAST 3.18 16.
RESULTADOS Y DISCUSIÓN
Se observó antagonismo in vitro de las tres cepas de Trichoderma sp. utilizadas frente a S. lycopersici. No se obtuvo diferencias estadísticas en el porcentaje de inhibición micelial de S. lycopersici por las distintas cepas de Trichoderma empleadas (Figura 1). Los valores obtenidos fueron en T. harzianum cepa A-53 IM (%)=87,2±4,53, seguido por T. viride cepa TS-3 IM (%)=81,13±13,80. El menor valor fue obtenido por T. harzianum cepa A-34 IM (%)=80,28±9,78.
La actividad antagónica mostrada por las cepas de Trichoderma sp. pudiera deberse a una mayor velocidad de crecimiento, a competencia por espacio y por los nutrientes u otros factores como la producción de enzimas, destacando las quitinasas, glucanasas y proteasas 17,18.
Se ha demostrado que Trichoderma sp. presenta enzimas extracelulares con actividad lítica sobre las hifas del patógeno. Algunos estudios han mostrado evidencias de la producción de quitinasas, que contribuyen a la degradación de las paredes celulares de los microorganismos patógenos 19.
La intensidad antagónica de Trichoderma sp. se considera elevada porque inhibió más de un 80 % el crecimiento de S. lycopersici. Una de las formas de antagonismo más común reportada por Trichoderma sp. es por hiperparasitismo, donde las hifas de Trichoderma recubren las del patógeno, entrelazando o entrecruzándose con este ocupando gran parte del espacio vital 20.
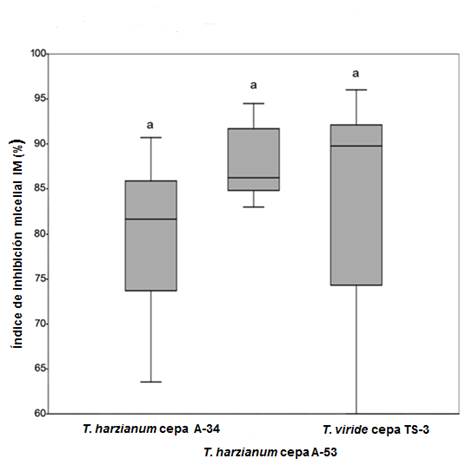
Figura 1 Porcentaje de inhibición micelial de Stemphylium lycopersici frente a las cepas de Trichoderma sp. A-34, A-53 y TS-3 a los siete días a partir de la prueba PERMANOVA (p=0.29 y F=1.31)
Otros trabajos muestran que Trichoderma sp. presenta una efectiva inhibición micelial de Fusarium sp., patógeno en semillas de cebolla. Este resultado se mantuvo en diferentes ciclos reproductivos de Trichoderma sp., fundamentalmente durante la esporulación 21. Cepas de T. harzianum y Trichoderma yunnanense presentaron también una inhibición del crecimiento de Phytophthora capsici de un 10,3 y 22,1 % al sexto día de iniciar el enfrentamiento 22.
Por otra parte, Trichoderma longibranchiatum mostró porcentajes de inhibición de 21,9 y 22,5 % contra Colletotrichum gloeosporioides y de 23,86 y 43,14 % frente a Fusarium verticillioides23,24. Estos valores son inferiores a los obtenidos en el presente estudio.
Ensayos similares de antagonismo realizados in vitro con T. harzianum cepa CCIBP-T4 demostraron una elevada actividad de hiperparasitismo a los seis días de inoculación frente a Mycosphaerella fijiensis, patógeno foliar en cultivos de plátano en Cuba. Trichoderma provocó la ruptura en la pared celular de las hifas del patógeno y la salida del contenido extracelular 25.
Otros autores evaluaron el efecto antagonista in vitro de 31 cepas de Trichoderma frente a Phytophthora capsici, mostrando las cepas un 97 % de inhibición micelial 26.
El moho foliar Cladosporium fulvum es una enfermedad que afecta los cultivos de tomate en Perú. Para controlar este patógeno se realizaron enfrentamientos in vitro con: Hansfordia pulvinata, T. harzianum, T. viride y Trichoderma virens. Se encontró que a 24 ºC y a las 72 h, T. harzianum presentó un porciento de inhibición micelial superior estadísticamente a las restantes tres especies, y a 28 ºC fue similar a T. viride27.
Se establece el micoparasitismo como el mecanismo de acción más común de Trichoderma sp. durante la inhibición micelial en diferentes patógenos. Y se aduce como una temperatura óptima de inhibición en el rango de 20 a 30 °C 27. En este sentido, es posible que la temperatura y el pH podrían ser los dos factores que más influyeron en no encontrar diferencias entre las cepas A-34, A-53 y TS-3, en la inhibición micelial de S. lycopersici en esta investigación. Ambos parámetros químicos-físicos se mantuvieron constantes durante los enfrentamientos y varios autores informan una fuerte relación de los mismos con la efectividad antagónica de Trichoderma sp. 21-27.
Los resultados demuestran, por primera vez, la actividad antagonista in vitro de Trichoderma harzianum (cepas A-53 y A-34) y Trichoderma viride (cepa TS-3) frente a Stemphylium lycopersici, patógeno foliar en los cultivos de tomate en la provincia de Holguín.











 text in
text in 


