INTRODUCCIÓN
El cultivo del tomate ocupa una superficie anual de 4 803 680 ha y un rendimiento a nivel mundial de 33,68 t ha-1 (1. En Cuba es el principal cultivo hortícola, con una superficie a campo abierto de 43 589 ha y un rendimiento promedio anual de 11,34 t ha-1 año-1 (2, mientras que, para su producción en el sistema de cultivo protegido, se dedican 167 ha, con rendimientos promedios entre 100 y 140 t ha-1 año-1 (3.
A nivel mundial el cultivo protegido se reconoce como una tecnología agrícola de avanzada que puede influir eficazmente en la producción de hortalizas frescas durante todo el año. En Cuba, constituye una tecnología promisoria para extender los calendarios de cosecha de las hortalizas y asegurar su suministro fresco al turismo, mercado de frontera y población.
El sistema de Cultivo Protegido, como modalidad de la horticultura cubana ha cobrado notable auge y difusión desde la década del noventa. A partir de ese momento, puede afirmarse, la preocupación existente acerca de los cultivos forzados (protegidos), debido a la utilización abundante de productos químicos que deterioran el ecosistema causando daños irreversibles al sistema suelo; por tanto, se proponen alternativas ecológicas para el manejo de los cultivos agrícolas bajo este sistema productivo; ya que, se conoce del alto consumo que se realiza de productos químicos, tanto para la nutrición como para la protección de las plantas, con vistas a lograr los altos rendimientos que se alcanzan por unidad de superficie 4-6.
Los gobiernos, hoy en día, promueven el uso de productos biológicos como los bioestimulantes, para reducir al mínimo el empleo de productos químicos que ocasionan toxicidad a la salud humana y al agroecosistema en general. Estos bioestimulantes son una gama de productos que contienen principios activos, los cuales actúan sobre la fisiología de las plantas, incrementando el crecimiento y desarrollo vegetal, así como los rendimientos y calidad de las cosechas 7.
En el marco actual de los bioestimulantes agrícolas, ha tenido un gran auge en la última década, el desarrollo de productos que tienen a las quitosanas como principales ingredientes activos. Estas son polímeros y oligómeros de glucosamina que se obtienen por desacetilación básica del polímero de quitina que, a su vez, se extrae del exoesqueleto de los crustáceos. Los polímeros y oligómeros de quitosana pueden tener una amplia aplicación agrícola a partir de las potencialidades biológicas que se le han demostrado a estos compuestos, como la promoción del crecimiento y mejora del rendimiento y frutos cosechados 8.
El Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias Agrícolas (INCA), ha desarrollado un producto a base de polímeros de quitosana obtenidos de quitina de exoesqueleto de langosta, cuyo nombre comercial es Quitomax®. Dicho producto ha sido evaluado y extendido en diversos cultivos de importancia económica como son tomate, tabaco, papa, pimiento, pepino, frijol, soya, maíz, arroz, entre otros, con resultados positivos y promisorios 9.
Teniendo en cuenta todo lo anterior, se puede plantear que existe la necesidad de emprender estudios donde se introduzcan nuevos productos bioestimulantes y biofertilizantes, como alternativas económicamente viables para incrementar las producciones en condiciones de cultivo protegido. Todo esto influirá en un beneficio económico, social y ambiental para la producción agrícola y por tanto contribuirá con la seguridad alimentaria del país. De acuerdo a estos antecedentes, el presente trabajo tuvo como objetivo general, evaluar la influencia de momentos de aplicación del Quitomax®, en el crecimiento, desarrollo, rendimiento agrícola y presencia de Alternaria solani en el cultivo de tomate bajo condiciones protegidas.
MATERIALES Y MÉTODOS
Para cumplir con el objetivo propuesto, se llevó a cabo el presente estudio en el período comprendido de junio a septiembre de 2017, en el Instituto Nacional de Ciencias Agrícolas (INCA), situado en el Municipio de San José de las Lajas, provincia Mayabeque.
El experimento se realizó en una casa de cultivo modelo Tropical A-12 con efecto “sombrilla”, de 540 m2. El suelo es un Ferralítico Rojo lixiviado agrogénico, según la nueva versión de clasificación genética de los suelos de Cuba 8. Se utilizó, como material vegetal, el híbrido CADDO caracterizado por ser una planta fuerte y compacta, con entrenudos cortos, una excelente cobertura foliar y amarres continuos, fruto con extraordinaria vida de anaquel y variedad de ciclo precoz a cosecha.
Se empleó el Quitomax®, cuyo ingrediente activo es un polímero de quitosana, obtenido por el Grupo de Productos Bioactivos del INCA, a partir de la desacetilación básica (NaOH) de la quitina presente en la cubierta de las langostas 10. Se preparó una disolución madre de Quitomax® al 1 %, la cual se diluyó en agua destilada estéril hasta obtener las concentraciones deseadas para los experimentos.
La producción de las plántulas se realizó en bandejas cubanas de poliestireno expandido con 247 alvéolos de 32,50 cm3 de volumen. Se utilizó como sustrato una mezcla de 90 % de humus de lombriz + 10 % de cascarilla de arroz. El riego se efectuó dos veces al día por cinco minutos, con un sistema de microaspersión aérea.
Bajo un diseño completamente aleatorizado con cuatro repeticiones, se estudiaron dos tratamientos: con Quitomax® y un tratamiento control. La imbibición de las semillas en Quitomax®, se realizó durante 1 hora antes de sembrar, utilizando la dosis de 1 g L-1. A los 15 y 30 días después de la germinación (DDG) en condiciones de semillero, se seleccionaron 15 plantas por cada tratamiento al azar, a las que se les realizaron las siguientes evaluaciones:
Altura de las plántulas (cm): se midió con regla graduada, desde el cuello de la raíz hasta la axila de la hoja más joven
Diámetro del tallo de las plántulas (cm): se determinó con un pie de rey, a partir de dos centímetros por encima del cuello de la raíz
Número de hojas por plántula: por conteo visual
El trasplante se realizó a los 30 días después de la siembra, en canteros planos de 180 cm de ancho y 15 cm de altura. El esquema de plantación empleado fue el de una hilera, con una distancia entre plantas de 40 cm, bajo un diseño completamente aleatorizado con cuatro repeticiones. Para la aspersión foliar se empleó la dosis de 300 mg ha-1, aplicándose en tres momentos después del trasplante, estas aspersiones se realizaron en horas temprana de la mañana (8:00-9:00 am), para aprovechar la apertura estomática de las hojas, y se hicieron manualmente utilizando una mochila de 16 L de capacidad, con boquilla de cono a presión constante. Se estudiaron los siguientes tratamientos (Tabla 1).
Tabla 1 Tratamientos estudiados
| No. | Tratamientos | |
|---|---|---|
| Semillero | Trasplante | |
| 1 | Imbibición de las semillas en Quitomax® | Imbibición |
| 2 | Imbibición + Aspersión Foliar a 7 DDT | |
| 3 | Imbibición + Aspersión Foliar a 7 y 15 DDT | |
| 4 | Imbibición + Aspersión Foliar a7, 15 y 30 DDT | |
| 5 | Aspersión Foliar a 7, 15 y 30 DDT | |
| 6 | Control (semillas embebidas en agua) | Control (sin Quitomax®) |
DDT: Días Después del Trasplante
A los 45 y 60 días después del trasplante (DDT) a 15 plantas por tratamiento, se les evaluaron las variables: altura de la planta (cm), diámetro del tallo (cm) y número de hojas por plántula, bajo la misma metodología descrita anteriormente.
En la etapa de floración - fructificación, se seleccionaron 15 plantas por cada tratamiento al azar, a las que se le realizaron las siguientes evaluaciones:
Número de racimos, flores y frutos por planta: por conteo visual
Masa promedio de los frutos (g): por división del peso total de los frutos entre la cantidad de frutos de la parcela. Se realizó en balanza analítica
Rendimiento agrícola (t ha-1): por pesada de la producción total del área de cálculo, extrapolada a una hectárea
Para evaluar la presencia de Alternaria solani, se realizaron las siguientes evaluaciones a los 7 (1ra evaluación) y 15 días (2da evaluación) posteriores al trasplante:
Para el porcentaje de infección se aplicó la siguiente fórmula 11
El valor resultante se multiplicará por 100. donde:
a- grado de la escala
b- # de órganos correspondientes a cada grado. n- tamaño de la muestra
k- mayor valor de escala
Se empleó la escala de 6 grados, a 15 plantas por tratamiento de Silva, 2009 11 donde:
0 - Sin síntomas (altamente tolerante)
1 - Daño en la pinta de la cofia de la raíz principal (tolerante)
2 - Daño de la cofia de la raíz principal, clorosis hojas viejas (tolerante)
3 - Daño a nivel del eje hipocotílico de la raíz y pobre desarrollo de las raíces secundarias, clorosis de las hojas (susceptibles)
4 - Daño a nivel del eje hipocotílico de la raíz, que se extiende hasta el tallo y pobre desarrollo de las raíces secundarias, clorosis de las hojas (susceptible)
5 - Afectaciones que condujeron a la muerte de las plantas (altamente susceptibles)
Para determinar el nivel de afectación se cuantificaron por tratamientos, las plantas afectadas y se calculó la incidencia por la siguiente fórmula:
Criterios para estimar el nivel infección según Silva, 2009 9:
Los datos obtenidos, se analizaron mediante un ANOVA de Clasificación Simple. Las medias resultantes se compararon con la Prueba de Rangos Múltiples de Duncan para p≤ 0,05 cuando existieron diferencias significativas entre los tratamientos, procesado con el programa Statgraphics Centurión (2013) bajo el sistema operativo Windows7.
RESULTADOS Y DISCUSIÓN
Efecto en el crecimiento de las plántulas
Los resultados obtenidos al evaluar la altura, el diámetro y el número de hojas por planta (Tabla 2) mostraron que en la primera evaluación realizada a los 15 días después de la siembra, no se obtienen diferencias significativas con respecto al tratamiento control. Sin embargo, en la evaluación realizada a los 30 días después de la siembra, los dos tratamientos se diferencian entre sí para cada una de las variables evaluadas.
Tabla 2 Efecto del Quitomax® en el crecimiento de plantas de tomate (híbrido CADDO)
| Tratamientos | Altura de la planta (cm) | Diámetro del tallo (cm) | Número de hojas/planta | |||
|---|---|---|---|---|---|---|
| 15 DDS | 30 DDS | 15 DDS | 30 DDS | 15 DDS | 30 DDS | |
| Con Quitomax® | 11,28 | 18,26 a | 0,23 | 0,35 a | 2,55 | 4,75 a |
| Control (sin Quitomax® | 10,09 | 16,14 b | 0,22 | 0,31 b | 2,40 | 3,18 b |
| ES x | 0,54 n.s | 0,61*** | 0,008 n.s | 0,05*** | 0,16 n.s | 0,04*** |
Letras distintas muestran diferencias significativas entre los tratamientos según la Prueba de Duncan para p≤0,05. (n=15)
En el caso de la altura, se superó al tratamiento control en un 13 %, el diámetro es superior en un 12 % y el número de hojas incrementa al control en un 49 %. No obstante, en ambos tratamientos se logró una postura de calidad para el trasplante donde una planta de tomate está apta para el trasplante cuando posee en un ciclo de 28 - 30 días, una altura de 15 - 18 cm, 5 hojas y un diámetro de tallo mayor de 3 mm 3.
Resultados similares fueron obtenidos en el cultivo de la papa (Solanum tuberosum L.) cuyo crecimiento es favorecido con la aplicación de dos oligosacarinas (Pectimorf® y Quitomax®), proporcionando efectos deseables en el contexto agrícola, como promover el crecimiento vegetativo, la producción de tubérculos y el rendimiento agrícola 12.
En el mismo cultivo del tomate (Solanum lycopersicum L), estudios de diferentes concentraciones de quitosana mediante imbibición de semillas (var. Amalia) durante cuatro y ocho horas, sólo la concentración de 1,0 g L-1 ejerció un efecto positivo en la masa seca de plántulas del cultivo, aunque no modificó el resto de los indicadores de crecimiento evaluados 13; sin embargo, en este trabajo la dosis utilizada estimuló las variables del crecimiento aun cuando el tiempo de imbibición fue considerablemente inferior al utilizado por estos autores.
En la Tabla 3 se observa que las variables de crecimiento evaluadas a los 45 días después del trasplante, mostraron diferencias significativas para cada una de ellas. Con respecto a la altura de las plantas, esta fue superior en el tratamiento donde se partió de semillas embebidas en Quitomax® y posteriormente se realizó la aspersión foliar a los siete y quince días después del trasplante; el resto de los tratamientos no difirieron de este, pero tampoco del control.
En el caso del diámetro del tallo, también el tratamiento de Quitomax® Imb. + A.F. (7,15 y 30 DDT), se diferenció estadísticamente de los restantes tratamientos. Para esta variable del crecimiento, todos los tratamientos con Quitomax® superaron al control. Un resultado similar al de la altura se obtuvo en el número de hojas por planta, donde se mantiene el mismo tratamiento como el de mejor resultado.
Tabla 3 Efecto del Quitomax® en el crecimiento de plantas de tomate híbrido CADDO) a los 45 días después del trasplante (DDT)
| Tratamientos | Altura de la planta (cm) | Diámetro del tallo (cm) | Número de Hojas/ planta |
|---|---|---|---|
| Control (sin Quitomax®) | 40,1 b | 0,403 c | 7,25 c |
| Quitomax® (Aspersión foliar a 7-15-30 DDT) | 42,1 ab | 0,584 b | 8,05 abc |
| Quitomax® (Imbibición1 hora) | 42,4 ab | 0,585 b | 7,35 c |
| Quitomax® (Imbición. + Aspersión foliar a 7DDT) | 43,75 ab | 0,542 b | 7,85 bc |
| Quitomax® (Imbición. + Aspersión foliar a 7 y 15 DDT) | 41,65 ab | 0,539 b | 8,60 ab |
| Quitomax® (Imbición. + Aspersión foliar a 7, 15 y 30 DDT) | 45,3 a | 0,656 a | 8,90 a |
| ESx | 1,41* | 1,64* | 0,33* |
Letras distintas muestran diferencias significativas entre los tratamientos según la Prueba de Duncan para p≤0,05. (n=15)
La respuesta mostrada por las distintas variable de crecimiento, pudiera ser explicada a partir de la capacidad de Quitomax® para estimular el crecimiento de las plántulas, lo que también mantiene una estrecha relación con la concentración empleada, el tamaño molecular y la forma de aplicación del producto al cultivo, que incluye el tiempo de contacto con el órgano que percibe la aplicación, en este caso la semilla, siendo estimulada la velocidad de germinación y acelerando el crecimiento. Se ha demostrado que las quitosanas estimulan los niveles de proteínas en las hojas, así como los niveles enzimáticos, incrementándose la resistencia basal de las plantas 14,15.
Con la aplicación del producto Quitomax®, se logró un incremento significativo en los componentes del rendimiento evaluados con respecto al control, lo que demuestra el efecto positivo de este producto en el desarrollo de las plantas de tomate.
En la Tabla 4 se observa que los mayores valores en el número de frutos por planta, así como en la masa fresca de los frutos, se alcanzaron con el tratamiento en el cual las semillas fueron embebidas en 1,0 g L-1 de Quitomax® combinada con la aspersión foliar de 300 mg ha-1 del producto asperjado a las plantas a los 7, 15 y 30 después del trasplante.
Es de destacar el incremento que se logró en la cantidad de frutos por plantas con respecto al tratamiento control donde solo se fertilizó el suelo, por lo que se puede inferir que el producto bioestimulante permite que las plantas absorban de manera más eficiente los nutrientes presentes en la solución del suelo y con ello una mayor producción.
Tabla 4 Efecto del Quitomax® en los componentes del rendimiento del tomate (híbrido CADDO) en condiciones de cultivo protegido
| Tratamientos | Número de frutos/ planta | Masa fresca de frutos/planta (kg) |
|---|---|---|
| Control (sin Quitomax®) | 20,9 d | 3,52 c |
| Quitomax® (Aspersión foliar a 7-15-30 DDT) | 25,2 bc | 4,25 bc |
| Quitomax® (Imbibición1 hora) | 21,7 cd | 3,66 c |
| Quitomax® (Imbición. + Aspersión foliar a 7DDT) | 26,3 ab | 4,43 b |
| Quitomax® (Imbición. + Aspersión foliar a 7 y 15 DDT) | 27,6 a | 4,60 b |
| Quitomax® (Imbición. + Aspersión foliar a 7, 15 y 30 DDT) | 27,3 a | 4,65 a |
| ESx | 0,64* | 7,41* |
Letras distintas muestran diferencias significativas entre los tratamientos según la Prueba de Duncan para p≤0,05. (n=15)
En cuanto al rendimiento agrícola, las aplicaciones del producto en sus diferentes formas (imbibición o aspersión foliar) influyeron positivamente en este indicador productivo (Figura 1). Todos los tratamientos con el Quitomax® superaron al control (excepto en el tratamiento donde solo se embebieron en el producto las semillas) y a su vez existieron diferencias significativas entre ellos, en dependencia de la cantidad de aspersiones foliares realizadas del producto después del trasplante.
En correspondencia con los componentes del rendimiento, este fue superior en el tratamiento de Quitomax® Imb. + A.F. (7, 15 y 30 DDT) con un rendimiento de 41,25 t ha-1, el cual superó en un 18 % al tratamiento control.
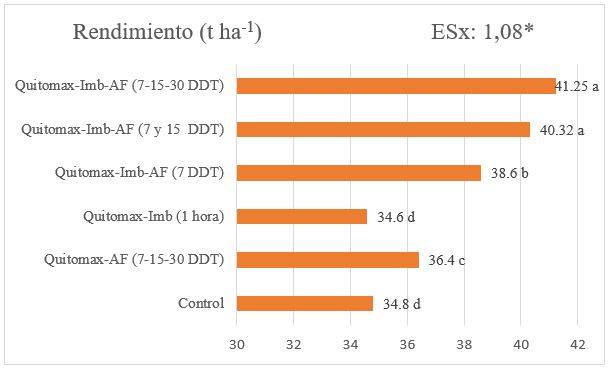
Figura 1 Efecto del Quitomax® en el rendimiento del tomate (CADDO) en condiciones de cultivo protegido. Medias con letras distintas muestran diferencias significativas entre los tratamientos según la Prueba de Duncan para p≤0,05. (n=15)
Los resultados antes señalados, están en correspondencia con los obtenidos en mini tubérculos de papa y en el cultivo del tomate al lograr el adelanto del período de floración y fructificación, el incremento del tamaño y masa de los frutos, así como, el número de flores y frutos con aplicaciones de quitosana 16. Similar resultado ha sido obtenido en la germinación de las semillas de estos cultivos 17.
Por otra parte, resultados similares a los encontrados en este trabajo han sido publicados a partir de estudios realizados en diferentes cultivos (tomate, cártamo y girasol), en aras de determinar las potencialidades de los polímeros de quitosanas, en los que lograron estimular el crecimiento mediante imbibición de semillas en estadios de semilleros, así como, los rendimientos por aspersión foliar en campo con resultados promisorios 17,18.
También, se señala que la aplicación de bioestimulantes, potencia las auxinas que intervienen en el proceso de reproducción vegetal, ocurriendo un sinergismo entre las sustancias aplicadas y las hormonas naturales de las plantas 19, lo cual hace pensar que similar comportamiento sucede cuando se aplica el Quitomax® al cultivo del tomate, logrando estimular desde el crecimiento hasta el rendimiento.
Estos resultados se relacionan con estudios que demuestran que la combinación de formas de aplicación tales como, el tratamiento a las semillas y la aplicación al suelo o sobre la planta de soluciones de quitosana, puede contribuir a aumentar el rendimiento de los cultivos 20.
La respuesta favorable de los indicadores productivos puede deberse a que la aspersión foliar del Quitomax® estimuló los procesos fisiológicos de las plantas, incrementando el tamaño de las células, lo cual hace más asimilable los nutrientes por las mismas y, por otra parte, este efecto también pudo estar relacionado con la capacidad del producto al actuar como antitranspirante y provocar un cierre parcial o total de los estomas, favoreciendo el estado hídrico de la planta y otros procesos fisiológicos que contribuyen a aumentar la producción de biomasa y el rendimiento agrícola, lo que a su vez reduce las pérdidas de agua en las plantas 21.
Efecto de Quitomax® en el grado de incidencia y porcentaje de infección por Alternaria solani
La utilización de antagonistas microbianos para el control de fitopatógenos, se ha catalogado como un importante complemento en el manejo integrado de plagas, considerándose este aspecto entre los diversos mecanismos propuestos que explican la promoción del crecimiento vegetal.
Por ello, al evaluarse la incidencia del Quitomax®, en su influencia sobre el hongo Alternaria solani, se obtuvieron diferencias estadísticas entre los tres tratamientos estudiados (Tabla 5), siendo mayor el grado de incidencia del hongo en el tratamiento control con un grado de susceptibilidad a la plaga, corroborándose la "Teoría de la Trofobiosis", cuyo argumento científico se fundamenta en que las plantas con inadecuado estado nutricional, serán más susceptibles al ataque de patógenos que las que han sido bien alimentadas, existiendo una respuesta proporcional al uso de alternativas ecológicas e inversamente proporcional al uso de agrotóxicos 22.
En el caso del tratamiento, donde el Quitomax® se aplicó vía imbibición de las semillas más dos aspersiones foliares, fueron menores las afectaciones foliares causadas por A. solani, obteniéndose en estas plantas, índices ligeros de afectación en la primera evaluación (15 días después del trasplante), con un 7 % de infección el cual se incrementa en la segunda evaluación con un índice de 13 % (45 días después del trasplante) con respecto al control.
Tabla 5. Influencia del Quitomax® en la presencia de Alternaria solani en el cultivo del tomate en condiciones protegidas
| Tratamientos | 1ra evaluación (7 DDT) | |
|---|---|---|
| G. incidencia | % infección | |
| Quitomax® (Aspersión foliar) | 2o | 9 b |
| Quitomax® (Imbición + Aspersión foliar) | 2o | 7 c |
| Control (sin Quitomax®) | 3o | 12 a |
| ESx | - | 0,16** |
| 2da evaluación (15 DDT) | ||
| Quitomax® (Aspersión foliar) | 3o | 20 b |
| Quitomax® (Imbición + Aspersión foliar) | 3o | 13 c |
| Control (sin Quitomax®) | 4o | 33 a |
| ES x | - | 0,21* |
Letras distintas muestran diferencias significativas entre los tratamientos según la Prueba de Duncan para p≤0,05. (n=15)
Para el tratamiento control, en la primera evaluación los niveles eran ligeros; sin embargo, en la evaluación siguiente se denotó un nivel intenso de infección; por tanto, este resultado permite corroborar el efecto del Quitomax® como producto biocontrol de patógenos ya que en los dos tratamientos con este bioproducto las plantas fueron menos afectadas. Este patógeno está presente en todo el país causando importantes daños en el cultivo, preferentemente cuando se presentan déficit nutricional e hídrico en las plantas por lo que aumenta la susceptibilidad a la plaga.
El manejo ecológico de los agroecosistemas favorece la diversidad de los enemigos naturales, disminuyendo los daños económicos causados por los insectos plagas. Los niveles de fenoles en las plantas pueden constituir una vía para el control parcial o total de patógenos fúngicos en algunas especies de plantas, de esta manera, estos fueron determinados para conocer en qué medida, los productos estimulaban los contenidos de fenoles en las plantas por ser una de las vías posibles para una mayor tolerancia al ataque de patógenos 9.
Una de las mayores necesidades agrícolas es la protección de las plántulas contra enfermedades causadas por patógenos. En este sentido tanto el polímero de la quitosana como sus oligómeros son potentes inductores de respuestas defensivas y de resistencia en la planta contra patógenos 9. Esta protección puede deberse a la actividad antimicrobiana que estos polímeros y oligómeros ejercen sobre los microorganismos o puede ser el resultado de la elevación de la resistencia basal de la planta, causada por la activación de resistencia inducida que ejercen estos compuestos en la planta 23,24.
CONCLUSIONES
Se demostró el efecto positivo del bioestimulante Quitomax® en el estímulo del crecimiento, desarrollo y rendimiento en las plantas provenientes de semillas embebidas, combinada con aspersiones foliares a los 7, 15 y 30 días después del trasplante, superior en un 18 % con respecto al control. Por otra parte, las plantas tratadas con Quitomax® tienen un bajo grado incidencia y porcentaje de infección por Alternaria solani demostrando el efecto del producto como biocontrol.











 texto en
texto en 


