INTRODUCCIÓN
Los bioestimulantes son microorganismos o sustancias que favorecen la nutrición de las plantas, confieren tolerancia ante el estrés abiótico e incrementan el rendimiento y la calidad de los cultivos 1,2. Los bioestimulantes microbianos, como los inoculantes a base de rizobios, se emplean con frecuencia para disminuir el uso de fertilizantes inorgánicos. Estos microorganismos tienen la capacidad de llevar a cabo la fijación biológica de nitrógeno (FBN) en simbiosis con las plantas leguminosas y a través de este proceso le suministran a la planta el nitrógeno atmosférico en una forma asimilable, favoreciendo así su crecimiento y desarrollo 3.
Las leguminosas son muy variables en cuanto a su eficiencia para fijar nitrógeno atmosférico en simbiosis, especialmente el frijol común (Phaseolus vulgaris L.), que es considerada dentro de las estudiadas la menos eficiente en este proceso 4. Por tal razón, se trabaja en la búsqueda de bioestimulantes no microbianos que, conjuntamente con estas bacterias, permitan activar la fisiología de estas plantas e incrementar los rendimientos y la calidad de los cultivos 5.
Entre los bioestimulantes no microbianos más empleados en la agricultura están las Oligosacarinas. Dentro de estas moléculas las más estudiadas por sus aplicaciones biológicas son los oligogalacturónidos, las quitinas y los quitosanos y los factores de nodulación de la familia Rhizobiaceae 6. Los oligogalacturónidos (OGAs) pueden regular la síntesis y acción de las hormonas y distintos procesos de organogénesis y de crecimiento en las plantas 7.
La mezcla de OGAs, denominada comercialmente Pectimorf®, estimula el enraizamiento, el crecimiento y la diferenciación celular de diferentes especies vegetales 6-8. Además, puede activar mecanismos de defensa y disminuir o atenuar el estrés ambiental en las plantas 6,9,10 Sin embargo, a pesar de emplearse el Pectimorf® en varias especies en diferentes concentraciones, formas de aplicación y condiciones de cultivo, aún no se ha realizado un estudio para determinar cuáles son las concentraciones que favorecen el crecimiento del frijol, por tal razón el objetivo de este trabajo fue determinar la concentración de Pectimorf® en combinación con Rhizobium más efectiva en la estimulación de la nodulación y el crecimiento de plantas de frijol (Phaseolus vulgaris L.), mediante el tratamiento a las semillas y aspersión foliar.
MATERIALES Y MÉTODOS
El estudio se realizó en el Instituto Nacional de Ciencias Agrícolas, provincia de Mayabeque, Cuba. Como bioestimulantes se emplearon el inoculante comercial Azofert-F® de Rhizobium leguminosarum (CF1, 1x109 UFC mL-1) a una dosis de 200 mL por 46,04 kg de semilla y una mezcla de oligosacáridos pécticos (oligogalacturónidos) conocido comercialmente como Pectimorf®.
Aplicación a las semillas
Semillas de frijol de la variedad Cuba C-25-9-N (40 semillas por tratamiento) se trataron con 170 µL de una mezcla que contenía Pectimorf® en diferentes concentraciones (1, 5, 10, 20, 40 y 100 mg L-1) y el inoculante Azofert-F®. Las semillas se sembraron en envases de 0,55 kg de capacidad, con suelo Ferralítico Rojo Lixiviado típico, éutrico 11. Se establecieron ocho tratamientos: dos controles (uno inoculado con Azofert-F® (control inoculado (CI)) y el otro no inoculado ni tratado con Pectimorf® (control absoluto (CA)) y el resto correspondieron a cada una de las concentraciones de Pectimorf® empleadas. Las plantas crecieron en un cuarto de luces con 16 horas luz, a una temperatura de 25-27 oC, con 60-70 % de humedad relativa y se regaron cada día con agua corriente. En la etapa de crecimiento R5, cuando el 50 % de las plantas presentaban los primeros botones, se evaluó el número y la masa seca de los nódulos totales (g), el número de trifoliolos, el diámetro y largo del tallo (cm), la longitud radical (cm), la biomasa aérea y de las raíces (g) y el contenido relativo de clorofilas totales en la tercera hoja trifoliada (unidades SPAD) con el medidor portátil MINOLTA SPAD 502 Plus.
Aplicación por aspersión foliar
Se establecieron ocho tratamientos: dos controles (uno inoculado con Azofert-F® (CI) y el otro no inoculado ni tratado con Pectimorf® (CA)) y el resto correspondieron a cada una de las concentraciones de Pectimorf® empleadas. Las semillas se inocularon con Azofert-F® y cuando el 50 % de las plantas tenían el segundo par de hojas trifoliadas desplegadas (etapa de crecimiento V3), se asperjaron con 1,5 mL de Pectimorf® por planta a las diferentes concentraciones. El experimento se realizó en las mismas condiciones que el anterior y se evaluaron las mismas variables en la etapa de crecimiento R5.
Diseño experimental y análisis estadístico
Los experimentos se realizaron bajo un Diseño Completamente Aleatorizado con dos repeticiones y se evaluaron 20 plantas por tratamiento. Todos los resultados fueron procesados a partir de un análisis de varianza de clasificación simple y comparación de medias por la Prueba de Tukey p<0,05 en el programa estadístico SPSS, Statistics v22. Para comprobar la normalidad de los datos se utilizó la prueba de Kolmogorov-Smirnov y para la homogeneidad de varianzas se empleó el estadístico de Levene.
RESULTADOS Y DISCUSIÓN
Aplicación a las semillas
El efecto de la aplicación conjunta de Pectimorf® y Azofert-F® a las semillas de frijol a las diferentes concentraciones se observa en las Tablas 1 y 2.
Tabla 1 Efecto de la aplicación a semillas de Pectimorf® (Pm) y Azofert-F®
| Tratamientos | N.T | MSNT (g) |
|---|---|---|
| CA | 49,00 ab | 0,06 a |
| CI | 51,40 ab | 0,06 a |
| 1 mg L-1 Pm + A | 46,50 ab | 0,05 ab |
| 5 mg L-1 Pm + A | 39,10 b | 0,040 b |
| 10 mg L-1 Pm + A | 59,70 a | 0,06 a |
| 20 mg L-1 Pm + A | 43,90 b | 0,06 a |
| 40 mg L-1 Pm + A | 53,40 ab | 0,05 a |
| 100 mg L-1 Pm + A | 60,30 a | 0,06 a |
| ESx | 3,55 | 0,004 |
(A) en la nodulación de plantas de frijol (Cuba Cueto-25-9-N) en etapa R5. N.T: nódulos totales, MSNT: masa seca de nódulos totales. CA: control absoluto, CI: control inoculado
Letras iguales no difieren significativamente para p< 0,05. ESx, error estándar de la media
Tabla 2 Efecto de la aplicación a semillas de Pectimorf® (Pm) y Azofert-F®
| Tratamientos | N. Hojas | L. Tallo (cm) | L. Raíz (cm) | D. Tallo (mm) | MSPA (g) | Clorofilas (unidades SPAD) |
|---|---|---|---|---|---|---|
| CA | 4,93 | 57,82 | 27,32 ab | 2,82 | 0,86 | 33,57 b |
| CI | 4,73 | 68,00 | 26,33 ab | 2,74 | 0,96 | 36,64 ab |
| 1 mg L-1 Pm + A | 5,00 | 62,64 | 25,59 ab | 2,81 | 0,94 | 34,23 b |
| 5 mg L-1 Pm + A | 4,47 | 57,58 | 26,87 ab | 2,71 | 1,00 | 36,64 ab |
| 10 mg L-1 Pm + A | 4,60 | 58,46 | 24,55 b | 2,68 | 0,93 | 39,28 a |
| 20 mg L-1 Pm + A | 4,93 | 66,03 | 27,67 a | 2,74 | 0,97 | 33,51 b |
| 40 mg L-1 Pm + A | 5,10 | 61,99 | 25,08 ab | 2,67 | 0,85 | 33,67 b |
| 100 mg L-1 Pm + A | 4,73 | 63,03 | 24,54 b | 2,74 | 0,94 | 33,01 b |
| ESx | 0,22 NS | 2,83 NS | 0,7 | 0,05 NS | 0.05 NS | 0,99 |
(A) en el crecimiento de plantas de frijol (Cuba Cueto-25-9-N) en etapa R5. N. Hojas: número de hojas, L. Tallo: largo del tallo, L.Raíz: largo de la raíz, D.Tallo: diámetro del tallo, MSPA: masa seca de la parte aérea, Clorofilas: contenido relativo de clorofilas en la tercera hoja trifoliada. CA: control absoluto, CI: control inoculado
Letras iguales no difieren significativamente para p< 0,05. ESx, error estándar de la media
En las variables de nodulación evaluadas no se evidenció la efectividad del inoculante Azofert-F® respecto a la población nativa de las bacterias del género Rhizobium presentes en el suelo empleado. A pesar de que las plantas tratadas con Pectimorf® no mostraron diferencias significativas con relación a los controles sí hubo diferencias entre tratamientos (Tabla 1). Las plantas tratadas con las concentraciones de 10 y 100 mg L-1 presentaron mayor número de nódulos que las plantas tratadas con las concentraciones de 5 y 20 mg L-1. En el caso de la masa seca de los nódulos fue menor para el tratamiento de 5 mg L-1 que, para el resto de los tratamientos, este resultado no es suficiente para plantear que la aplicación del producto a esta concentración afecta la fijación biológica del nitrógeno.
En cuanto a las variables de crecimiento, el mayor valor en el contenido relativo de clorofilas totales en la tercera hoja trifoliada correspondió a las plantas tratadas con la concentración de 10 mg L-1, aunque este efecto no fue significativo, en comparación con el control inoculado y con las plantas tratadas con la concentración de 5 mg L-1..
La combinación de ambos productos incrementó la masa seca de la raíz en las plantas tratadas con la concentración de 10 mg L-1, observándose diferencias significativas con el resto de los tratamientos, excepto con 5 mg L-1 (Figura 1). Aunque no hubo diferencias significativas en la longitud de la raíz, el menor valor correspondió a las plantas tratadas con 10 mg L-1 de Pectimorf®. Estos resultados indican que este incremento en la masa seca de la raíz se debe a un aumento en el número de raíces secundarias y adventicias y no a la longitud de la raíz.

CA: control absoluto, CI: control inoculado
Letras iguales no difieren significativamente para p<0,05. ESx, error estándar de la media
Figura 1 Efecto de la aplicación a semillas de Pectimorf® (Pm) y Azofert-F® en la masa seca de la raíz (MSRaíz) de plantas de frijol (Cuba Cueto-25-9-N), en etapa R5
Resultados similares se obtuvieron en experimentos con plantas de soya (Glycine max) var. INCAsoy-24 inoculadas con Bradyrhizobium y tratadas con 10 mg L-1 de Pectimorf® antes de la siembra. El desarrollo del sistema radical en la etapa de floración, a los 60 días después de la siembra, se favoreció con la aplicación de Pectimorf®, tanto en semillas inoculadas como no inoculadas 12. Ambos resultados manifiestan el poder enraizador que algunos autores le atribuyen a esta mezcla de OGAs 13-15.
En investigaciones realizadas en pecíolos de violeta africana (Saintpaulia ionantha) con Pectimorf® a la concentración de 10 mg L-1, se evidenció un incremento en la longitud de las raíces, pero no en la formación de raíces secundarias, efecto que fue más significativo que con la aplicación de ácido indol acético (AIA) (13). Este efecto del Pectimorf® también se ha obtenido a concentraciones menores de 10 mg L-1 (2 mg L-1) en plantas de plátano cultivar ‘FHIA-18’ en condiciones in vitro16. Asimismo, a concentraciones mayores (20 mg L-1) en esquejes de guayaba (Psidium guajava) var. Enana Roja Cubana, en el que el poder enraizador de este producto se manifestó en la formación de raíces adventicias 17.
Estos resultados corroboran lo informado por otros autores acerca de que los OGAs pueden actuar como sustituto de hormonas tradicionales, favoreciendo la diferenciación celular y la formación de órganos en las plantas 13.
Aplicación por aspersión foliar
El Pectimorf® aplicado por aspersión foliar a la concentración de 100 mg L-1 estimuló el número de hojas producidas, la masa seca de la parte aérea, la masa seca de la raíz y disminuyó la longitud radical. El efecto enraizador del producto también se observó a concentraciones de 1 y 5 mg L-1. No se observó efecto de los productos en la longitud del tallo; sin embargo, la concentración de 1 mg L-1 incrementó su diámetro (Tabla 3).
Tabla 3 Efecto de la aplicación foliar de Pectimorf® (Pm) en el crecimiento de plantas de frijol (Cuba Cueto-25-9-N) inoculadas con Azofert-F®
| Tratamientos | N. Hojas | L. Tallo (cm) | L. Raíz (cm) | D. Tallo (mm) | MSPA (g) | MSRaíz (g) | Clorofilas (unidades SPAD) |
|---|---|---|---|---|---|---|---|
| CA | 5,40 bc | 69,61 | 31,18 ab | 2,29 bc | 0,87 b | 0,26 c | 31,19 |
| CI | 5,47 bc | 75,50 | 31,62 ab | 2,21 cd | 0,82 b | 0,28 c | 33,94 |
| A+1 mg L-1 Pm | 5,20 c | 67,38 | 34,79 a | 2,53 a | 0,10 ab | 0,39 ab | 34,65 |
| A+5 mg L-1 Pm | 5,73 abc | 74,16 | 29,49 bc | 2,34 bc | 0,97 ab | 0,43 a | 32,36 |
| A+10 mg L-1 Pm | 5,53 bc | 74,68 | 26,52 cd | 2,32 bc | 0,90 b | 0,31 bc | 33,44 |
| A +20 mg L-1 Pm | 5,60 bc | 77,78 | 31,17 ab | 2,16 c | 0,91 b | 0,27 c | 32,61 |
| A +40 mg L-1 Pm | 6,07 ab | 80,13 | 25,08 d | 2,11 c | 0,93 b | 0,33 bc | 33,36 |
| A +100 mg L-1 Pm | 6,47 a | 81,11 | 24,06 d | 2,31 bc | 1,14 a | 0,42 a | 31,16 |
| ESx | 0,24 | 4,84 NS | 1,29 | 0,03 | 0,06 | 0,02 | 1,19 NS |
(A), en etapa R5. N. Hojas: número de hojas, L. Raíz: largo de la raíz, D. Tallo: diámetro del tallo, MSPA: masa seca de la parte aérea, MSRaíz: masa seca de la raíz, Clorofilas: contenido relativo de clorofilas en la tercera hoja trifoliada. CA: control absoluto, CI: control inoculado.
Letras iguales no difieren significativamente para p<0,05. ESx, error estándar de la media
El contenido relativo de clorofilas totales en la tercera hoja trifoliada no mostró diferencias significativas entre tratamientos. Hay autores que plantean que una posible vía por la cual los OGAs incrementan el crecimiento de las plantas, es porque estas moléculas estimulan la actividad fotosintética; lo que provoca una mayor ganancia de esqueletos carbonados que pueden ser utilizados para la síntesis de proteínas 18,19. Sin embargo, hay que tener en cuenta que la actividad fotosintética no está determinada únicamente por el contenido de clorofilas, sino que existen, además, otros elementos como la apertura y el cierre estomático y la actividad del resto de los componentes de los fotosistemas que influyen en el proceso de fotosíntesis.
En un estudio en plantas de frijol asperjadas con 10 mg L-1 de Pectimorf®, en la segunda etapa de la fase vegetativa de cultivo, el producto provocó modificaciones en los patrones de distribución y morfogénesis estomática con un incremento en el índice estomático. Estas modificaciones se evidenciaron, fundamentalmente, en la superficie abaxial, donde las células oclusivas se mostraron más estrechas y cortas. Asimismo, se observó que las hojas con mayor índice estomático presentaban estomas más pequeños. La menor localización de los estomas en la superficie adaxial provoca un incremento en la resistencia estomática de esta superficie, cuando está expuesta directamente a la radiación solar y así evita la pérdida de agua, lo que favorece la disponibilidad de esta sustancia para que ocurra la fotolisis, fenómeno que conjuntamente con la luz es necesario para que las plantas realicen la fotosíntesis 20.
En cuanto a las variables de nodulación, el número de nódulos totales fue mayor en las plantas asperjadas con 100 mg L-1 y la masa seca de los nódulos se incrementó con las concentraciones de 5 y 100 mg L-1 (Figura 2).
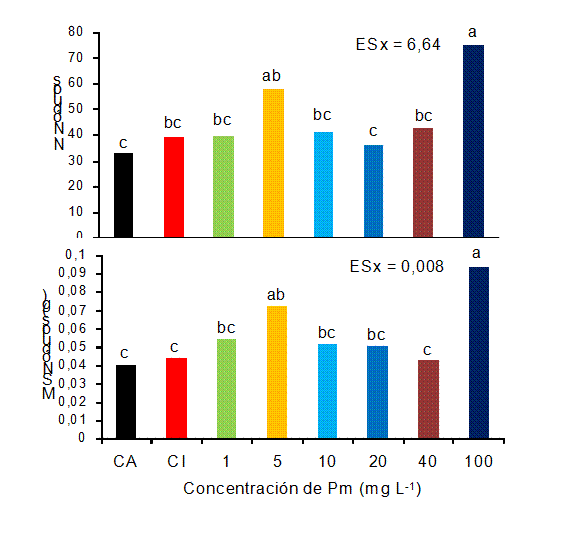
(A), en etapa R5. CA: control absoluto, CI: control inoculado
Letras iguales no difieren significativamente para p< 0,05. ESx, error estándar de la media
Figura 2 Efecto de la aplicación foliar de Pectimorf® (Pm) en el número de nódulos totales (No.Nódulos) y en la masa seca de los nódulos (MSNódulos) de plantas de frijol (Cuba Cueto-25-9-N) inoculadas con Azofert-F®
Antecedentes de la combinación de ambos bioestimulantes sólo se tienen en condiciones de campo, en el cultivo de la soya var. INCAsoy-24 e INCAsoy-27. En ambos estudios las plantas inoculadas con Bradyrihzobium se asperjaron al inicio de la floración con Pectimorf® a la concentración de 10 mg L-1. Las evaluaciones se realizaron a los 60 días después de la siembra para INCAsoy-24 y a los 45 días para INCAsoy-27. En el caso de INCAsoy-24, la aplicación de ambos productos incrementó la masa seca aérea y de la raíz, mientras que en la variedad INCAsoy-27, sólo la masa seca aérea. En dichos experimentos la aplicación de ambos productos no favoreció la nodulación (12-21) . Sin embargo, en nuestro caso las evaluaciones se realizaron a los 35 días después de la siembra, encontrándose que a concentraciones menores (1 y 5 mg L-1) y mayores (100 mg L-1) que las aplicadas en soya, el Pectimorf® favoreció, tanto la formación de raíces secundarias, como el desarrollo de los nódulos.
El incremento en la masa seca de la raíz provocado por Pectimorf® a 5 y 100 mg L-1 confirma lo planteado por otros autores, de que este producto, a base de OGAs tiene actividad auxínica 22-24, aunque también es posible que la función que realice sea la de activar señales que estimulen la síntesis de esta hormona. Para afirmar esto se requiere realizar estudios bioquímicos y moleculares.
Se plantea que el desarrollo del sistema radical le posibilita a la planta, tanto en condiciones normales de crecimiento como de estrés por sequía, una mayor absorción de agua y minerales que permite un incremento en el desarrollo foliar 25, tal como se muestra en los resultados con la concentración de 100 mg L-1, en los que el desarrollo de la raíz le permitió a la planta un incremento en el número de hojas y la masa seca de la parte aérea.
Los mejores resultados en la parte aérea se obtuvieron con la aplicación de 100 mg L-1 de Pectimorf®, concentración que también incrementó el número de nódulos. Este resultado pudiera ser una consecuencia del aumento en la fijación biológica de nitrógeno que propicia una mayor síntesis de ureidos, lo que permite que la planta disponga de nitrógeno para la síntesis de proteínas y otras moléculas necesarias para la formación y crecimiento del vástago.
Estos incrementos en las variables morfoagronómicas y en la nodulación a las concentraciones de 1, 5 y 100 mg L-1 de Pectimorf® pueden ser el resultado de un grupo de señales biológicas desencadenadas en las plantas por la combinación de estos productos. Para esto se recomienda realizar estudios bioquímicos y moleculares mediante el análisis de metabolitos y enzimas involucradas en el metabolismo del nitrógeno y el carbono que permitan explicar este efecto. Se propone además, evaluar estos bioproductos en el rendimiento y en la calidad del cultivo.
CONCLUSIONES
Los efectos positivos que ejerce el Pectimorf®, en combinación con el Azofert-F®, en la nodulación y en el crecimiento de plantas de frijol, depende de la forma de aplicación y de la concentración de esta oligosacarina.
Estas macromoléculas ejercen un efecto significativo en la formación de raíces a concentraciones de 10 mg L-1, cuando se aplica a semillas previo a la siembra y de 1, 5 y 100 mg L-1 cuando se aplica por aspersión foliar.
La aplicación de esta mezcla de OGAs a las semillas no afecta la nodulación. Sin embargo, por aplicación foliar a concentraciones de 5 y 100 mg L-1 este proceso se beneficia.
A pesar de conocer que los OGAs pueden actuar como sustitutos de hormonas tradicionales y estimular el crecimiento y el desarrollo de las plantas, es necesario realizar estudios que permitan identificar qué procesos relacionados con el crecimiento vegetativo se estimulan y cómo benefician la fijación biológica del nitrógeno.











 text in
text in 


