INTRODUCCIÓN
El uso de los bioproductos en la agricultura como alternativa al uso indiscriminado de fertilizantes y pesticidas ha ganado auge en los últimos años. Estos productos son biodegradables, no tóxicos y son capaces de actuar en la fisiología de las plantas promoviendo incrementos en el crecimiento y desarrollo vegetal 1. El quitosano forma parte de estos bioproductos y se obtiene a partir de la quitina que es el segundo polímero más abundante en la naturaleza después de la celulosa. Es un copolímero compuesto por unidades de 2-acetamido-2-desoxi-D-glucosa y 2-amino-2-desoxi-D-glucosa unidas entre sí por enlaces glicosídicos β (1→4), con un predominio de las últimas. Se obtiene a partir de subproductos de la industria marisquera aunque se puede encontrar en la naturaleza en la pared celular de algunos hongos 2. Desde el punto de vista biológico se ha demostrado que este polímero presenta gran actividad biológica independientemente de su masa molecular 3. A la concentración adecuada es capaz de adelantar la germinación, promover el crecimiento y el desarrollo de las plantas así como inducir mecanismos defensivos y de resistencia contra patógenos 1,4,5. Se ha probado su actividad antibacteriana contra el Pectobacterium carotovorum con el empleo de aceites esenciales de tomillo encapsulados en nanopartículas de quitosano 6. También en forma de películas para el recubrimiento de frutos con el objetivo de alargar la vida útil en postcosecha 7-9.
El quitosano se utiliza ampliamente en el manejo de residuos, el procesamiento de comidas, la nanotecnología, la medicina, la biotecnología y la agricultura. Es un material muy interesante en aplicaciones farmacéuticas por su baja toxicidad, biodegrababilidad y biocompatibilidad 7. Es un policatión natural con actividad antifúngica 10 con capacidad para inducir resistencia al ataque de patógenos 11. La caracterización de este polímero se basa en la determinación de su estructura por distintos métodos como la Microscopia Electrónica de Barrido (SEM), Espectroscopia de Energía Dispersa (EDS), Espectroscopia Infrarroja de Transformada de Fourier (FTIR) y Potencial Z entre otros 6. También por la determinación de su masa molecular por viscosimetría 12, cromatografía de filtración en gel, y el grado de desacetilación por potenciometría o métodos espectroscópicos 13, así como la cuantificación del contenido de cenizas y la humedad presente en el mismo 14.
Sin embargo, una vez conocidas estas características y realizada la dilución del mismo, la conductividad, el pH y la concentración son parámetros que pueden ser tenidos en cuenta pues brindan información del comportamiento de este polímero en solución. Esto se debe a que la determinación de la conductividad permite predecir cambios en la estructura de este polisacárido en disolución puesto que el quitosano en condiciones acídicas es un polielectrolito cuyo parámetro de carga λ es proporcional a la densidad de carga lineal que depende del pH y el grado de desacetilación 12. El control del pH es importante porque las propiedades del quitosano en disolución están dadas por el alto contenido de los grupos amino primarios (NH3) con un pKa de 6,3. La carga positiva del grupo NH3 a bajos valores de pH convierte al quitosano en un polielectrolito catiónico soluble en agua. Cuando el pH se incrementa por encima de 6,0 la carga positiva del grupo NH3 se pierde y el quitosano se vuelve insoluble. La transición del quitosano de soluble a insoluble ocurre en un rango de pH 6,0-6,5 en el pKa de los grupos aminos primarios que depende estrechamente del grado de desacetilación y del método de N-desacetilación 15,16. La masa de quitosano soluble puede brindar información sobre la concentración de quitosano soluble presente en el producto.
El Instituto Nacional de Ciencias Agrícolas cuenta con una tecnología para obtener un producto a base de quitosano nombrado QuitoMax®. Este producto ha sido evaluado y extendido en diversos cultivos de importancia económica como la papa (Solanum tuberosum L.), el pepino (Cucumis sativus L.), el pimiento (Capsicum annuum L.), el frijol (Phaseolus vulgaris L.), la soya (Glicine max L.), el maíz (Zea mays L.), el arroz (Oryza sativa L), tabaco (Nicotiana tabacum L.). Los incrementos productivos generados a partir de la aplicación del QuitoMax® han incrementado la demanda de este producto.
El tomate (Solanum lycopersicum L.), es una de las hortalizas que más se produce e industrializa en todo el mundo. En Cuba este cultivo representa el 50 % del área total dedicada a las hortalizas y su producción oscila alrededor de los 750 000 t 1. Los estudios de aplicación del QuitoMax® en tomate revelan un estímulo en las variables de crecimiento y rendimiento de este cultivo 1.
Teniendo en cuenta los antecedentes anteriormente expuestos, el objetivo de este trabajo fue evaluar las características químicas y la actividad biológica de este producto durante su almacenamiento. Dentro de las características químicas a determinar se encuentran la conductividad, el pH y la masa de quitosano soluble; mientras que la actividad biológica será evaluada mediante el efecto en la germinación de las semillas de tomate y la altura de sus posturas.
MATERIALES Y MÉTODOS
La investigación se desarrolló en el laboratorio de producción de Bioestimulantes y en el cuarto de luces perteneciente al departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas situado en el municipio de San José de las Lajas, provincia Mayabeque, Cuba.
Se prepararon tres lotes de QuitoMax® a una concentración de 4 g L-1 que contiene benzoato de sodio a 0,5 g L-1 a pH 4,5. El quitosano que se empleó en la producción tiene una masa molecular de 106 KDa y un grado de desacetilación (GD) del 73 % determinado por valoración potenciométrica, un 13 % de humedad y 2,2 % de cenizas. El QuitoMax® se almacenó en frascos de 240 ml a 30 ºC. El periodo de análisis fue de 30, 60, 90, 180 y 270 días.
La conductividad se le determinó a las diluciones de QuitoMax® a 0,5 g L-1 de concentración, con el empleo de un conductímetro CRISON ECMeter 30+ fabricado por Crison Instrumenst SA en los Estados Unidos previamente calibrado con soluciones patrones de 147 μS cm-1, 1413 μS cm-1 y 12,88 ms cm-1a 25 ºC.
El pH se determinó a una disolución de QuitoMax® de 4 g L-1 de concentración, con el empleo de un pHmetro Inolab pH 720 fabricado en Alemania, previamente calibrado con soluciones patrón de pH 4,01 y 7,00.
La masa de quitosano soluble se determinó filtrando previamente el QuitoMax® con una frita número 1, se tomaron 80 ml del producto y se le ajustó el pH a 10 para lograr la precipitación del quitosano presente en la disolución. Se separó el sólido del líquido por filtración con papel de filtro previamente pesado en balanza analítica Sartorius TE214S fabricada en Alemania. El sólido junto al papel de filtro se secó en una estufa Binder ED115 fabricada en Alemania, hasta peso constante. La masa de quitosano soluble se determinó a partir de la siguiente ecuación.
Donde pF es el peso en gramos del papel de filtro, m es el peso en gramos del quitosano precipitado y 0,265 es la masa de quitosano teórica determinada teniendo en cuenta la humedad del quitosano y el contenido de cenizas. La masa de quitosano soluble se expresó en porcentaje (%). Todas las determinaciones se realizaron por triplicado.
Adicionalmente se realizó la evaluación de la germinación a los 270 días de almacenado el producto. Las semillas se embebieron durante 1 hora en una disolución de QuitoMax® de 1 g L-1 de concentración, posteriormente se secaron y se dispersaron en placas petris a razón de 50 semillas por placa por cada tratamiento incluyendo el control. Como control se tomó el agua destilada, el tratamiento 1 correspondió a un QuitoMax® de reciente producción y el tratamiento 2 es el QuitoMax® conservado del lote 2. Las semillas de pusieron a germinar en una cámara de crecimiento WTW TS606/3-i a 28 ºC y se realizan evaluaciones a las 24, 48, 72 horas.
Posteriormente las semillas pre-germinadas se sembraron en recipientes de 6,6 cm de diámetro y 9,7 cm de altura sobre suelo Ferralítico Rojo Compactado Éutrico, según la Clasificación de los Suelos de Cuba 17. El crecimiento de las posturas transcurrió en el cuarto de luces a una temperatura de 27 °C y 36 % de humedad relativa, con un fotoperiodo de 16 horas luz y 8 de oscuridad. A los 25 días posteriores a la siembra se evalúo la altura de la planta a 15 posturas. La altura de las posturas (cm) se midió con regla graduada, desde el cuello de la raíz hasta la axila de la hoja más joven.
Los datos se procesaron mediante análisis de varianza de clasificación simple ANOVA y las medias se compararon por la Prueba de Tukey (p≤0,05). Para los análisis estadísticos se utilizó paquete estadístico STATGRAPHIC PLUS.
RESULTADOS Y DISCUSIÓN
La determinación del pH en los tres lotes mostró que este indicador se mantuvo estable a lo largo del periodo evaluado, entre 4,45-4,57 (Figura 1) consistentes con los valores reportados en el registro del producto de 4,5±0,1. La estabilidad del pH en este rango es necesaria puesto que un incremento elevado podría conllevar a la disminución de la acción del benzoato de sodio como antimicrobiano, teniendo en cuenta que solo es efectivo en condiciones ácidas. Las concentraciones de inhibición de los microorganismos son alrededor de 0,05-0,1 % del ácido no disociado, principalmente en alimentos ácidos (pH menor o igual 4-4,5) 18. Por lo que el pH en el cual se mantiene el producto, garantiza la solubilidad del quitosano y las propiedades antimicrobianas del benzoato de sodio.
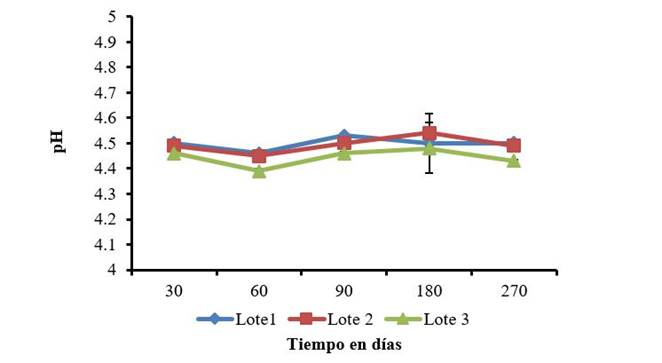
Las barras sobre los valores medios representan el intervalo de confianza de las medias α =0,5
Figura 1 Registros del pH en tres lotes de QuitoMax® durante 270 días de almacenamiento
Por otro lado, el estudio de la conductividad en los tres lotes mantuvo la estabilidad en el periodo de almacenamiento (Figura 2) y las diferencias entre los lotes 1, 2 y 3 son atribuibles al proceso de preparación del producto. La conductividad de este producto está dada por la contribución de todas las especies presentes en el, desde el quitosano, el benzoato de sodio y el hidróxido de sodio empleado para ajustar el pH. Por lo que las variaciones pueden provenir desde la heterogeneidad propia del quitosano hasta las cantidades de hidróxido de sodio empleadas en el ajuste de pH. La estabilidad observada en el transcurso del tiempo, indica que no hubo variación de la solubilidad del quitosano en el periodo de almacenamiento. Las mediciones de conductividad pueden mostrar la evolución de la protonación, con un incremento progresivo producto a la solubilización paulatina del quitosano. Una solubilización completa se obtiene cuando el grado de disociación α ≥ 0,5 y la relación estequiométrica entre el ácido acético y el quitosano [TeX:] <math> <mrow> <mrow><mo>[</mo> <mrow> <mi>A</mi><mi>c</mi><mi>O</mi><mi>H</mi></mrow> <mo>]</mo></mrow><mo>/</mo><mrow><mo>[</mo> <mrow> <mi>C</mi><mi>h</mi><mi>i</mi><mi>t</mi><mo>−</mo><mi>N</mi><msub> <mi>H</mi> <mn>2</mn> </msub> </mrow> <mo>]</mo></mrow></mrow> </math> es 0,6 19. La conductividad como herramienta de análisis, también se ha empleado en el estudio de la formación de complejos polielectrolitos entre el quitosano y la pectina, en los que se aprecia un incremento de esta a medida que se forma el complejo polielectrolito, lo que permite determinar la relación estequiométrica entre estos dos polisacáridos 20.
La poca variabilidad de la conductividad en el tiempo determinada en este estudio, coincide con los estudios de conductividad realizados por otros autores a diferentes concentraciones de quitosano y ácido acético. En estos se refiere que la conductividad en las disoluciones de quitosano no sufre cambios durante su almacenamiento y que las variaciones son consecuencias de errores en la medición 15.
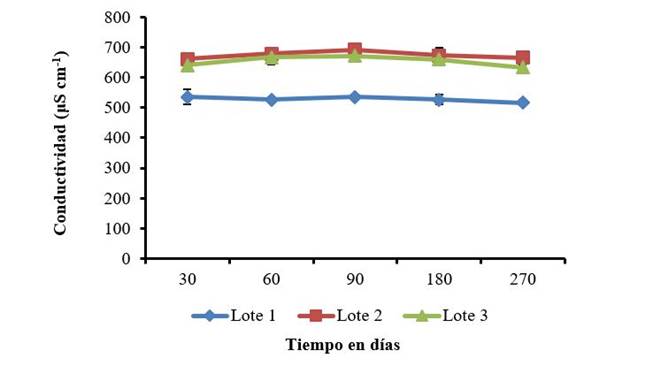
Las barras sobre los valores medios representan el intervalo de confianza de las medias α =0,5
Figura 2 Registros de la conductividad en tres lotes de QuitoMax® durante 270 días de almacenamiento
Por otro lado, al evaluar la solubilidad del quitosano de manera general se determina el material insoluble presente en disoluciones de ácido acético al 1 % a una temperatura de 25 °C 21. Sin embargo, en este trabajo se evaluó la masa de quitosano soluble presente en el QuitoMax® a 30 °C, como indicador de la concentración de quitosano disuelto en el producto (Figura 3). En general en los tres lotes la masa de quitosano disuelto se encontró por encima del 80 %, no existiendo diferencias entre el mismo lote en los periodos evaluados.
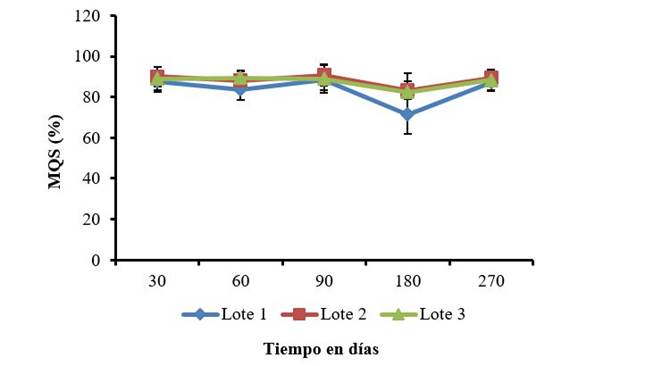
Las barras sobre los valores medios representan el intervalo de confianza de las medias α =0,5
Figura 3 Registros de la masa de quitosano soluble (MQS) en tres lotes de QuitoMax® durante 270 días de almacenamiento
En cuanto a la actividad biológica, al evaluar la germinación en semillas de tomate de cultivar “Amalia” tratadas con el producto se pudo observar que a los 270 días de conservación no hubo diferencias significativas p < 0,05 entre el producto conservado y el fresco y si con el control (Figura 4). Pasadas las 72 horas no se muestran diferencias significativas entre ninguno de los tratamientos. En general a los 270 días de conservación se observó un efecto positivo en la germinación a las 48 horas. Este incremento en la germinación puede deberse a que el quitosano tiene excelentes propiedades formadoras de películas, lo que facilita la formación de una película semipermeable en la superficie de la semilla y ayuda a mantener la humedad y promover la germinación 22. Aunque el mecanismo mediante el cual el quitosano ejerce un efecto en la germinación aún es desconocido, se ha reportado el efecto positivo en semillas de maíz (23) y trigo 22.
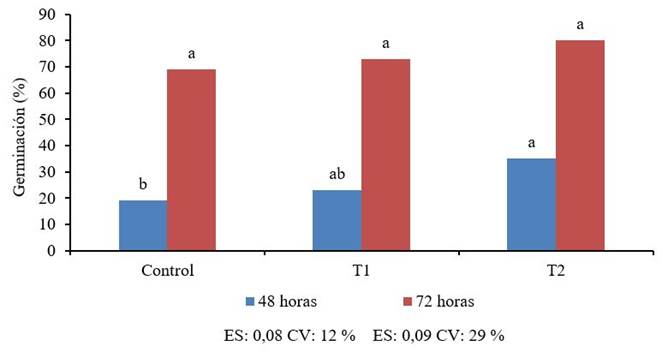
Letras iguales no difieren estadísticamente según la Prueba de Rangos Múltiples de Tukey HSD
Figura 4 Efecto del QuitoMax® fresco (T1) y conservado (T2) en la germinación de semillas de Tomate
La evaluación de la altura de la postura a los 25 días de germinadas no mostró diferencias significativas entre el producto conservado y el fresco, pero si con el control (Figura 5). Este comportamiento fue similar al observado en la germinación a las 48 horas. Si bien el mecanismo por el cual el quitosano promueve el crecimiento de las posturas tampoco ha sido publicado, los efectos positivos en el crecimiento y desarrollo de diversos cultivos ha sido ampliamente documentado en arroz 24, tomate 1, papa 5, soya 3 entre otros.
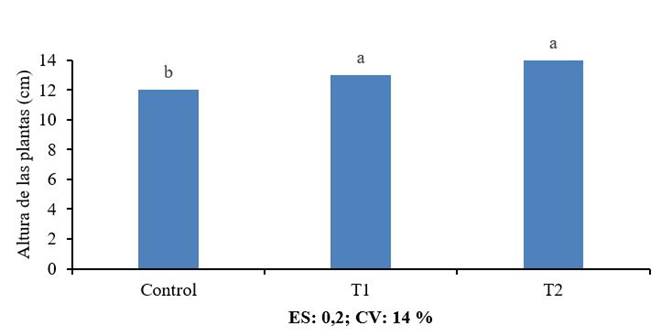
Letras iguales no difieren estadísticamente según la Prueba de Rangos Múltiples de Tukey HSD
Figura 5 Efecto del QuitoMax® fresco (T1) y conservado (T2) en la altura de las posturas
La estimulación del crecimiento y el desarrollo de las plantas por parte del quitosano ha sido asociado a procesos fisiológicos. Uno de estos procesos es evitar la pérdida de agua por vía de la transpiración mediante el cierre estomático de las plantas, lo que está relacionado con un efecto estimulante del crecimiento de estas, producto al efecto antitranspirante del quitosano 25. A su vez, resultados encontrados en el cultivo del frijol, han señalado que uno de los aspectos a través de los cuales el quitosano influye en la reducción de la transpiración, es mediante el incremento de los niveles de ácido abscísico (ABA) en las hojas tratadas, el cual activa el cierre parcial de los estomas 26
En este trabajo las posturas a los 25 días de germinadas no alcanzaron el tamaño óptimo requerido para el trasplante entre 15-18 cm 27. Sin embargo, estos resultados son similares a investigaciones realizadas utilizando la concentración de 1 g L-1 y la imbibición por 4 horas, puesto que las posturas a los 24 días de germinadas difieren del control, pero sus alturas no sobrepasan los 9 cm. De igual forma coincide con otros trabajos que al evaluar el efecto de este producto a esta misma concentración (1 g L-1) y por imbibición de semillas de tomate del cultivar “Mara” a cielo abierto sobre canteros, logran incrementos por encima del control desde los 10 días de germinadas las plantas. Sin embargo, difiere de la altura reportada por estos investigadores cuando informan que las posturas están listas para el trasplante a los 15 días de germinadas las plantas 1. Este trabajo también difiere con otros que emplean tiempos de imbibición de cuatro y ocho horas a diferentes concentraciones de quitosano (0,1-2000 mg L-1). En estas investigaciones las posturas a los 27 días de sembradas no evidenciaron cambios significativos en la altura de las plantas en ninguna de las concentraciones evaluadas respecto al control, pero si en la masa seca de la raíz a la menor concentración de 0,1 mg L-1 (28.
Teniendo en cuenta que estos son los primeros resultados de la estabilidad química del QuitoMax® en el tiempo y la actividad biológica de este, se sugiere extender la estabilidad química hasta el año de conservación y evaluar otras variables morfoagronómicas que puedan aportar información sobre la actividad biológica del QuitoMax® conservado en posturas de tomate u otros cultivos de interés económico.
El empleo de los bioestimulantes en la agricultura en contraposición al uso indiscriminado de fertilizantes químicos y pesticidas es de vital importancia porque contribuyen a disminuir la carga contaminante de los suelos al mismo tiempo que incrementan el rendimiento y el desarrollo de los cultivos. El QuitoMax® y los derivados de los quitosanos constituyen una vía eficaz y promisoria que debe ser tenida en cuenta en pos del desarrollo de la agricultura de nuestro país.
CONCLUSIONES
Los análisis químicos realizados a los tres lotes del producto QuitoMax® no demuestran cambios en la conductividad, el pH y la masa de quitosano soluble del producto durante la conservación.
El producto QuitoMax® presenta actividad biológica a los 270 días.
El producto conservado promueve adelantos en la germinación e incrementos en la altura de las plantas de tomate.
Teniendo en cuenta los resultados obtenidos en este trabajo el uso del QuitoMax puede ser extendido hasta los 270 días.











 texto em
texto em 


