INTRODUCCIÓN
Los pastos y forrajes constituyen las fuentes más baratas de alimentos para el ganado bovino, de modo que la obtención de altos volúmenes de biomasa con suficiente calidad para satisfacer los requerimientos nutricionales de los animales continúa siendo una necesidad de primer orden para el sector ganadero.
La fertilización de los pastos y cultivos forrajeros contribuye a incrementar la oferta de biomasa por unidad de superficie y tiempo y, consecuentemente, la producción animal. Por esta vía, no sólo se restituyen los nutrientes que se extraen del suelo a través del alimento que consume el ganado, sino también se mejora su valor nutritivo y persistencia 1,2.
Los estudios sobre la fertilización de los pastos, hasta hace pocos años se enfocaban, principalmente, en el incremento de la producción de biomasa por unidad de superficie; sin embargo, el aumento creciente de los precios de los fertilizantes, unido a la necesidad de disponer de tecnologías amigables con el medio ambiente, impone el diseño de estrategias de fertilización que garanticen una nutrición adecuada de estos cultivos, disminuyan el uso de insumos externos y, a la vez, aseguren la protección de los recursos naturales 3,4.
Dentro de tales estrategias se incluye la biofertilización, por sus potencialidades para incrementar los rendimientos de los cultivos agrícolas, mejorar las propiedades biológicas de los suelos y reducir el uso de fertilizantes minerales 5,6; por ello, la obtención y empleo de biofertilizantes para aumentar la eficiencia del uso de los nutrientes y promover el crecimiento de los plantas sigue siendo objeto de estudio.
El cultivo de especies forrajeras del género Brachiaria, específicamente B. híbrido cv. Mulato II, se ha ido extendiendo en las zonas tropicales, debido a su alto potencial de producción de biomasa y valor nutritivo para la alimentación del ganado; sin embargo, sus requerimientos de fertilizantes para alcanzar altos rendimientos suelen ser elevados 7.
Se ha demostrado que el uso de bacterias asociativas del género Azospirillum contribuye a mejorar el rendimiento de las poáceas forrajeras, no sólo por su capacidad para fijar nitrógeno atmosférico y su contribución a la reducción de las necesidades de un suministro de este nutriente vía fertilización, sino también por otros beneficios como la producción de fitohormonas, la solubilización de fosfatos, el biocontrol de patógenos y la protección de las plantas contra estreses abióticos 8-10.
Por otra parte, los hongos formadores de micorrizas arbusculares (HMA) son componentes integrales de la rizosfera de los pastos, cuyas plantas permanecen estrechamente asociadas mediante una red de hifas interconectadas que incrementan el volumen de suelo que exploran las raíces y facilitan la absorción de los nutrientes y el agua 11,12, además de otros servicios, como el incremento de su tolerancia al estrés hídrico, la protección contra patógenos y el restablecimiento de los tejidos fotosintéticos después de la defoliación 13. De hecho, el manejo de la biofertilización con estos microorganismos edáficos, también ha arrojado resultados positivos en el aumento de los rendimientos y la mejora en la absorción de nutrientes de los pastos 14,15.
Sin embargo, los estudios sobre el manejo conjunto de la biofertilización a base de bacterias asociativas y HMA en pastos y cultivos forrajeros no abundan, a pesar de las posibles ventajas de la introducción de ambos microorganismos en los esquemas de suministro de nutrientes de estos cultivos 16,17.
Basado en tales premisas se realizó el presente trabajo, con el objetivo de evaluar la respuesta de Brachiaria híbrido cv. 36087 (Mulato II) a la aplicación simple y combinada de biofertilizantes a base de la rizobacteria Azospirillum brasilense y la especie de HMA Rhizoglomus irregulare.
MATERIALES Y MÉTODOS
Se realizó un experimento en la Vaquería Típica 23 de la Unidad Básica de Producción Cooperativa “Juan Oramas”, ubicada en el municipio de Guanabacoa, provincia de La Habana, a los 23o08’ de latitud norte y a los 82º11’ de longitud oeste, sobre un suelo Pardo Mullido Carbonatado 18, cuyas principales características químicas se presentan en la Tabla 1.
Tabla 1 Características químicas del suelo (profundidad: 0-20 cm)
| pH H2O | MO (%) | P2O5 (mg 100 g-1) | Ca2+ | Mg2+ | Na+ | K+ | CIB |
|---|---|---|---|---|---|---|---|
| (cmolc kg-1) | |||||||
| 7,7 | 3,85 | 122 | 50,8 | 5,0 | 0,32 | 0,99 | 59,09 |
| (0,1) | (0,20) | (18) | (2,4) | (0,9) | (0,09) | (0,12) | (3,75) |
MO: materia orgánica. CIB: capacidad de intercambio de bases. Valores entre paréntesis indican intervalos de confianza (α=0,05)
El suelo poseía pH alcalino, contenidos medio y alto de materia orgánica (MO) y fósforo asimilable, respectivamente, así como alta capacidad de intercambio de bases (CIB), destacándose dentro de estas, los altos valores de Ca y K intercambiables 19.
El comportamiento de las precipitaciones y temperatura durante el período en que se condujo el experimento se muestran en la Figura 1.
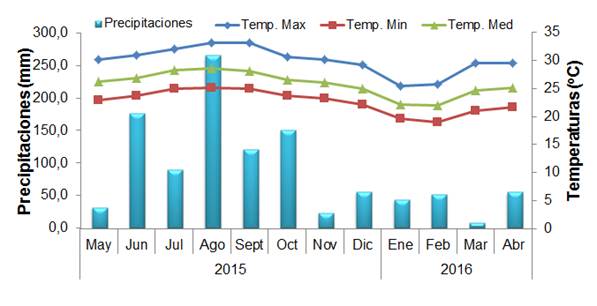
Figura 1 Comportamiento de las precipitaciones y la temperatura durante el período de ejecución del experimento
Durante el tiempo en que se condujo el experimento (mayo 2015-abril 2016), la precipitación total fue de 1187 mm, de la cual el 75 % ocurrió durante el período lluvioso (mayo y octubre de 2015) y el resto, entre noviembre de 2015 y abril de 2016 20.
Se evaluaron cuatro tratamientos, conformados por un testigo sin biofertilización, más las aplicaciones solas y combinadas de biofertilizantes a base de la rizobacteria A. brasilense y la especie de HMA R. irregulare, en un diseño cuadrado latino. Las parcelas constituyeron la unidad experimental y tenían una superficie total de 21 m2 y un área de cálculo de 14 m2.
El suelo se preparó mediante labores de roturación (arado), grada, cruce (arado) y grada, a intervalos aproximados de 25 días entre cada una. La siembra del pasto se realizó en mayo de 2015, en surcos separados a 50 cm y a chorrillo, con una dosis de 10 kg de semilla total ha-1 (1 kg de semilla pura germinable ha-1) y a una profundidad de 1.5 cm. Previo a la siembra, se tomaron con una barrena 10 muestras de suelo por el método del zigzag, a una profundidad de 0-20 cm, a las cuales se les determinó el pH en H2O (potenciometría, relación suelo-agua 1:2.5), y los contenidos de materia orgánica (Walkley y Black), P asimilable (extracción con H2SO4 0.05 mol L-1 y determinación colorimétrica), cationes intercambiables [extracción con NH4Ac 1 mol L-1 pH 7 y determinación por complejometría (Ca y Mg) y fotometría de llama (Na y K)] y la CIB (suma de bases intercambiables), según las técnicas analíticas establecidas en el laboratorio de suelo y plantas del Instituto Nacional de Ciencias Agrícolas (INCA) 21.
Para la biofertilización con A. brasilense se utilizó el producto comercial Nitrofix®, procedente del Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA), que contenía la cepa 8I, con una concentración de 109 UFC L-1. Se preparó una solución compuesta por una mezcla de biofertilizante y agua en una relación 1:10, en la cual se sumergieron las semillas durante 15 minutos; posteriormente se extrajeron y secaron a la sombra y se procedió a la siembra. A los 30 días después de la siembra, se preparó una mezcla del biofertilizante y agua en la proporción ya descrita y mediante una mochila manual se aplicó al suelo, muy próximo a los surcos, a razón de 20 L ha-1 de Nitrofix®.
Para la aplicación del biofertilizante micorrízico se utilizó la cepa INCAM-11 de la especie de HMA Rhizoglomus irregulare22 procedente de la colección del INCA. El inóculo se multiplicó en un sustrato arcilloso esterilizado en autoclave a 120 °C por una hora durante tres días, con el uso de Brachiaria decumbens cv. Basilisk como planta hospedera y contenía 30 esporas por gramo de sustrato, así como abundantes fragmentos de raicillas e hifas del hongo.
La inoculación se realizó por el método del recubrimiento de las semillas, para lo cual estas se sumergieron en una pasta fluida, elaborada mediante la mezcla de una cantidad de inóculo sólido equivalente al 10 % del peso de las mismas y agua, en una proporción de 60 mL de agua por cada 100 g de inóculo. Las semillas después de secadas a la sombra se sembraron. En el tratamiento donde se aplicaron conjuntamente ambos biofertilizantes, se adicionó el producto que contenía A. brasilense al agua utilizada para la preparación del inoculante micorrízico para la siembra, manteniendo la misma relación inóculo-agua. En el experimento no se aplicaron fertilizantes.
Se realizaron cuatro cortes a una altura de 10 cm de la superficie del suelo, los dos primeros a los 90 y 150 días después de la siembra, ambos en la época lluviosa y los otros a intervalos de 90 días, coincidiendo con el período menos lluvioso. En cada corte se pesó la masa fresca de la parte aérea del pasto que ocupaba el área de cálculo de las parcelas y se tomaron muestras de 200 g, las cuales se llevaron a una estufa de circulación de aire a 70 ºC durante 72 horas, para determinar el porcentaje de masa seca, estimar el rendimiento de masa seca y las concentraciones de N, P, K en la biomasa 21.
En el momento de cada corte, en cinco puntos del área de cálculo de cada parcela se midió la altura del dosel mediante una regla graduada y se consideró el punto de lectura, aquel donde la mayoría de las hojas perdían su posición vertical. En el segundo y cuarto corte, enmarcados en el período lluvioso y poco lluvioso, respectivamente, de cada parcela se tomaron tres sub-muestras de raíces y de suelo de la rizosfera a una profundidad de 0‒20 cm, mediante el empleo de un cilindro metálico de 5 cm de diámetro y 20 cm de altura. Los puntos de muestreo se distribuyeron equidistantes y separados a 10 cm de los surcos.
Las submuestras fueron homogenizadas para formar una muestra compuesta por parcela, de la cual se extrajo 1 g de raicillas para su tinción y clarificación 23. Se evaluaron la frecuencia de colonización micorrízica, mediante el método de los interceptos 24, la densidad visual o intensidad de la colonización 25 y el número de esporas en la rizosfera, a partir del tamizado y decantado por vía húmeda de dichas estructuras y su observación en microscopio 26.
La densidad de raíces se determinó momentos antes del segundo corte; para ello, en tres puntos equidistantes ubicados en el área de cálculo de cada parcela y a 10 cm del surco, se realizó un corte vertical del suelo hasta la profundidad 25 cm y se introdujo un cilindro metálico de 5 cm de diámetro y 20 cm de longitud. El suelo contenido en cada cilindro se depositó en un recipiente de vidrio, se agregó agua corriente y se agitó manualmente hasta deshacer los agregados gruesos y, seguidamente, se pasó por un tamiz de 0.5 mm. Las raíces recolectadas en el tamiz fueron lavadas nuevamente para eliminar los restos de suelo, secadas al aire e introducidas en una estufa a 70 ºC hasta obtener una masa constante.
El procesamiento estadístico de los datos se realizó mediante el análisis de varianza y la prueba de rangos múltiples de Duncan 27 a p<0,05. En las variables correspondientes a la caracterización química del suelo, así como en aquellas cuyos resultados se muestran en gráficos, se utilizó el intervalo de confianza de las medias (α=0,05) como estadígrafo de dispersión o como criterio para su comparación 28. En todos los casos se utilizó el programa estadístico SPSS 25 29.
RESULTADOS Y DISCUSIÓN
En la Figura 2 se presenta la influencia de los tratamientos en las variables fúngicas. Tanto en el período lluvioso como en el poco lluvioso, con la inoculación de R. irregulare se encontró un aumento significativo de la frecuencia e intensidad de la colonización micorrízica (densidad visual), así como del número de esporas en la rizosfera; sin embargo, los mayores efectos se observaron con la coinoculación de A. brasilense y R. irregulare, lo que puede atribuirse a un efecto positivo de las sustancias estimuladoras del crecimiento producidas por A. brasilense en el incremento de la longitud y ramificación de las raíces y en consecuencia, en el aumento de los sitios de colonización, así como al propio estímulo de estas sustancias en la formación y multiplicación de las estucturas micorrízicas 16,30.
Los valores de las variables fúngicas fueron mayores en el período lluvioso que en el poco lluvioso debido, probablemente, a la estacionalidad de la producción de biomasa del pasto. Durante la época de lluvias ocurre un rápido crecimiento de los pastos en virtud de los mayores niveles de precipitaciones y temperatura, tal como se muestra en la Figura 1 y ambos factores, unido al aumento de la luminosidad 31,32, conducen a la absorción de una mayor cantidad de nutrientes para la formación de biomasa y consecuentemente, a la formación de mayores cantidades de estructuras micorrízicas para garantizar el acceso de las plantas a los recursos del suelo 33,34.
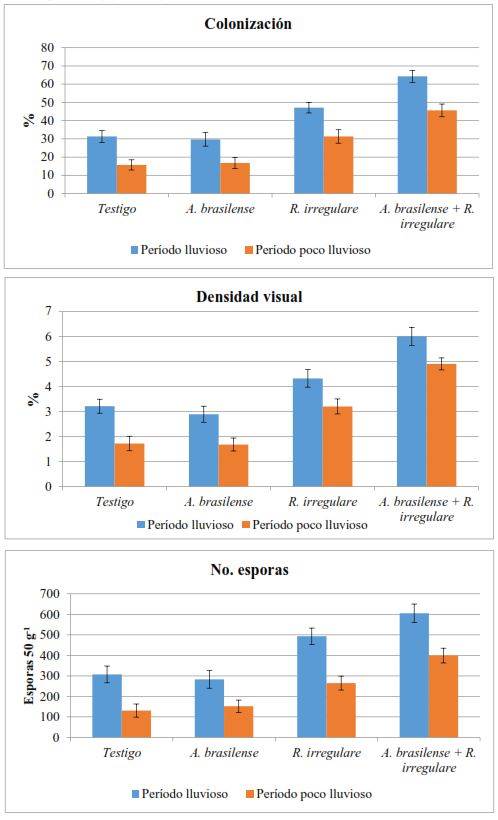 Medias con intervalos de confianza que se solapan entre si no difieren significativamente (α=0,05)
Medias con intervalos de confianza que se solapan entre si no difieren significativamente (α=0,05)Figura 2 Efecto de los tratamientos en las variables fúngicas. Las barras verticales muestran el intervalo de confianza
La Tabla 2 muestra el efecto de la biofertilización sobre las concentraciones de macronutrientes (N, P y K) en la biomasa aérea del pasto. Tanto en el período lluvioso como en el poco lluvioso, la aplicación por separado de ambos biofertilizantes incrementó las concentraciones de N, en relación con el tratamiento no inoculado (testigo), aunque entre ambos tratamientos, los valores más altos correspondieron a A. brasilense, pero los mayores efectos se encontraron con la aplicación conjunta de los biofertilizantes.
Tabla 2 Efecto de los tratamientos en las concentraciones (g kg-1MS) de K, P y K en la biomasa aérea
| Tratamientos | Período lluvioso | Período poco lluvioso | ||||
|---|---|---|---|---|---|---|
| N | P | K | N | P | K | |
| Testigo | 11,2 d | 2,3 | 17,3 | 12,1 d | 2,6 | 18,5 |
| 14,3 b | 2,4 | 18,5 | 15,5 b | 2,5 | 19,3 | |
| 12,7 c | 2,3 | 17,4 | 13,7 c | 2,4 | 18,7 | |
| 15,7 a | 2,5 | 18,2 | 16,9 a | 2,5 | 19,5 | |
| ES | 0,3** | 0,1 | 0,2 | 0,3** | 0,1 | 0,4 |
A. brasilense: inoculación con Azospirillum brasilense; R. irregulare: inoculación con Rhizoglomus irregulare. Promedios con letras distintas en la misma columna difieren significativamente a p<0,05 (Duncan, 1955)
Al evaluar la participación de los biofertilizantes en el aumento de las concentraciones de nitrógeno en la biomasa (Figura 3) se observó un resultado similar; es decir, la aplicación sola de uno u otro biofertilizante mejoró la nutrición del pasto con este nutriente durante ambos períodos, aunque los mayores valores correspondieron al tratamiento con A. brasilense. Sin embargo, la mayor participación se alcanzó con la aplicación conjunta de ambos biofertilizantes.
 Participación (%) = [(concentración de N (g kg-1) en la biomasa aérea del tratamiento biofertilizado-concentración de N (g kg-1) de la biomasa aérea del testigo) / Concentración de N (g kg-1) de la biomasa aérea del tratamiento inoculado] x 100Las barras verticales muestran el intervalo de confianza. Medias con intervalos de confianza que se solapan entre si no difieren significativamente (α=0,05)
Participación (%) = [(concentración de N (g kg-1) en la biomasa aérea del tratamiento biofertilizado-concentración de N (g kg-1) de la biomasa aérea del testigo) / Concentración de N (g kg-1) de la biomasa aérea del tratamiento inoculado] x 100Las barras verticales muestran el intervalo de confianza. Medias con intervalos de confianza que se solapan entre si no difieren significativamente (α=0,05)Figura 3 Participación de los biofertilizantes en el incremento de las concentraciones de N en la biomasa
Las poáceas forrajeras requieren cantidades importantes de N para mejorar su rendimiento y valor nutritivo 7,35 y a juzgar por el contenido de materia orgánica, las concentraciones de N del suelo donde se ejecutó el experimento no fueron suficientes para satisfacer la demanda del cultivo; además, en el experimento no se aplicó fertilizante nitrogenado. Por otra parte, se ha demostrado que los HMA participan activamente en la transferencia de N del suelo a la planta hospedera 36. A partir de estas premisas, se podía esperar un efecto positivo de la inoculación con R. irregulare en la absorción de N, en el incremento en las concentraciones de este elemento en la biomasa aérea, como se observó en la Figura 3 y, en consecuencia, una mejora de la nutrición nitrogenada del pasto.
Con respecto a la inoculación con A. brasilense, se conoce que este microorganismo puede fijar cantidades importantes de N en especies de pastos del género Brachiaria8,37, de modo que ello pudiera explicar su mayor efecto en el aumento de las concentraciones de N en la biomasa y su mayor contribución a la nutrición nitrogenada, en relación con R. irregulare. Sin embargo, el hecho de que ambas variables hayan alcanzado los mayores valores con el tratamiento donde se aplicaron los microorganismos de manera conjunta, refleja un efecto complementario de los mismos en la mejora de la nutrición nitrogenada del pasto.
Los tratamientos no tuvieron efectos en las concentraciones de P y K en la biomasa aérea, lo que estuvo en correspondencia con los altos contenidos de ambos elementos en el suelo (Tabla 1); de hecho, este fue un criterio para decidir la no aplicación de fertilizante fosfórico ni potásico en el experimento.
En la Tabla 3 se presenta el efecto de los tratamientos sobre algunos indicadores del crecimiento y el rendimiento de MS masa seca de la parte aérea del pasto. Al igual que en las variables analizadas anteriormente, se encontró un efecto significativo de la biofertilización sobre la altura del dosel y el rendimiento de MS, tanto en la época de lluvias como en la época menos lluviosa, así como sobre la densidad de raíces del pasto. Al comparar los resultados obtenidos con la aplicación de estos microorganismos por separado, la inoculación con A. brasilense mostró valores mayores que los alcanzados con R. irregulare en estas variables, aunque los mayores efectos se obtuvieron con la aplicación conjunta de ambos biofertilizantes.
El efecto de los tratamientos en el crecimiento y el rendimiento del pasto, parece estar relacionado con la influencia de los biofertilizantes en las concentraciones de N en la biomasa de la parte aérea de las plantas. Se conoce que, de todos los nutrientes minerales, este elemento es, cuantitativamente, el más importante para las poáceas forrajeras 7,38. De este modo, la mejora de la nutrición nitrogenada provocada por la aplicación de los biofertilizantes, tal como se observó en la tabla anterior, pudo haber repercutido favorablemente en la altura del dosel y el crecimiento de las raíces y, consecuentemente, en el rendimiento del pasto.
Tabla 3 Efecto de los tratamientos en la altura del dosel, la densidad de raíces y el rendimiento de masa seca (MS) del pasto
| Tratamientos | Período lluvioso | Período poco lluvioso | |||
|---|---|---|---|---|---|
| Altura (cm) | Densidad de raíces (g m-2) | MS (t ha-1) | Altura (cm) | MS (t ha-1) | |
| Testigo | 42,3 d | 522,7 d | 9,02 d | 19,9 d | 3,13 d |
| 89,7 b | 781,3 b | 11,58 b | 45,7 b | 5,52 b | |
| 64,5 c | 653,5 c | 10,23 c | 32,2 c | 4,34 c | |
|
|
110,5 a | 927,8 a | 12,74 a | 59,3 a | 6,33 a |
| ES | 4,9** | 27,1** | 0,39** | 2,0** | 0,25** |
A. brasilense: inoculación con Azospirillum brasilense; R. irregulare: inoculación con R. irregulare. ES: error estándar. Promedios con letras distintas en la misma columna difieren significativamente a p<0,05 (Duncan, 1955)
En el caso de A. brasilense, además de su contribución a la fijación biológica de N anteriormente citada, este microorganismo también ejerce diferentes mecanismos de estímulo del crecimiento a través de la producción de fitohormonas, principalmente ácido indolacético y giberelinas, lo cual modifica el metabolismo de las plantas y conduce a una mejor captación de agua y minerales 8,39. Ello también pudiera explicar su mayor influencia en el crecimiento del pasto, en relación con R. irregulare.
Con respecto a los HMA, varios autores han encontrado un efecto positivo en las concentraciones de N en la biomasa de la parte aérea de los pastos inoculados con cepas eficientes, a partir de un aumento del aprovechamiento de este elemento, dado, tanto por el aumento de la superficie radical de las plantas, como por la formación de estructuras micorrízicas que le permiten acceder a este y otros recursos del suelo 36, lo cual pudiera estar influyendo en los resultados obtenidos.
Resulta de interés destacar que la adición de R. irregulare haya sido efectiva para mejorar las concentraciones de N en la biomasa de la parte aérea, el crecimiento y el rendimiento del pasto, a pesar de las altas concentraciones de P del suelo, pues algunos trabajos refieren que el efecto de la inoculación micorrízica puede inhibirse en presencia de altos contenidos de este elemento 40. Sin embargo, otros han encontrado que las plantas inoculadas con cepas de HMA eficientes, pueden alcanzar un funcionamiento micorrízico efectivo, aun en suelos con altas concentraciones de P, siempre que otros nutrientes limiten su crecimiento y desarrollo 41.
CONCLUSIONES
La biofertilización con A. brasilense y R. irregulare constituye una alternativa efectiva para mejorar la nutrición nitrogenada y el rendimiento del pasto B. híbrido cv. Mulato II, al menos durante el primer año de su aplicación; los mejores beneficios se obtienen con la aplicación conjunta de ambos microorganismos.
Se sugiere realizar estudios para evaluar su contribución a la reducción de la aplicación de fertilizantes, fundamentalmente los nitrogenados.











 texto en
texto en 


