INTRODUCCIÓN
La teca (Tectona grandis) es una especie forestal originaria del Sudeste de Asia, cuya madera es una de las mejor valoradas y más conocidas en el mundo por sus cualidades intrínsecas, lo cual ha impulsado el desarrollo de programas de mejoramiento genético para potenciar sus atributos 1,2. En la primera etapa de dichos programas, se ha seleccionado material élite, con características comerciales de alto valor, sin embargo, es necesario avanzar hacia el desarrollo de cruzamientos controlados entre genotipos para lograr un mayor progreso en la calidad y rendimiento de esta especie. Tanto para el proceso reproductivo como para el mejoramiento genético a partir de cruces controlados, es necesario garantizar la disponibilidad de polen viable, para asegurar el éxito de las polinizaciones y la eficiencia del mejoramiento. Por ello, es indispensable conocer la capacidad de germinación del grano de polen y de esta manera, brindar un estimado de posibles progenitores femeninos y masculinos 3,4.
Las pruebas de germinación in vitro permiten determinar la cantidad de polen viable y el crecimiento del tubo polínico bajo condiciones controladas, ya que el medio de cultivo se asemeja a la composición del mucílago del estigma 4. Como parte de esta técnica, en los últimos años se han estudiado las aplicaciones de sustancias bioactivas que influyen en el crecimiento y la diferenciación celular de diversas especies vegetales, entre ellas los brasinoesteriodes (Br) y las oligosacarinas (OG) 5.
Los brasinoesteroides son hormonas esteroidales de las plantas, que se han encontrado principalmente en polen, hojas, yemas, flores y semillas, en proporciones y formas diferentes 6. Estos compuestos han demostrado tener un efecto positivo en la morfogénesis tanto in vitro como ex vitro, su respuesta depende del tipo y la concentración que se utilice, así como de su interacción con las hormonas de la planta. Dentro de estas sustancias el Biobras-16® ha sido ampliamente utilizado, y ha demostrado ser activo a concentraciones extremadamente bajas, generalmente soluciones de 10-2 y 10-4 mg L-1 (7,8.
Los oligogalacturónidos se generan por hidrólisis enzimática de la pared celular de plantas y a bajas concentraciones muestran actividad biológica. Estos compuestos forman parte de las oligosacarinas más estudiadas, son considerados bioestimulantes por ser moléculas bioactivas cuya función es mejorar las propiedades fisicoquímicas de las plantas, los rendimientos y la calidad de los cultivos 9. El principio activo de Pectimorf® es una mezcla de oligosacáridos pécticos, obtenido a partir de residuos de la industria citrícola, incluye moléculas señalizadoras importantes en los procesos fisiológicos de las plantas, relacionados con el crecimiento y la estimulación de los mecanismos de defensa. Las concentraciones óptimas del producto para obtener una respuesta biológica satisfactoria oscilan entre los 10 y 20 mg L-1 (10,11.
El empleo de sustancias bioactivas como las mencionadas, puede aumentar la eficiencia germinativa de los granos de polen y con ello, su fertilidad. El presente estudio se realizó con el objetivo de evaluar el efecto de dos productos cubanos, Biobras-16® y Pectimorf® sobre la germinación in vitro de polen crioconservado de teca.
MATERIALES Y MÉTODOS
Se seleccionaron árboles establecidos en ensayos clonales de la empresa Novelteak, Guanacaste, Costa Rica. De las inflorescencias se colectaron flores sin abrir y se colocaron en bolsas plásticas con cierre hermético durante una hora, para inducir la apertura de las mismas. Una vez abiertas las flores y con ayuda de pinzas de disección, se procedió a la extracción mecánica de las anteras, las cuales se colocaron en criotubos.
Para la crioconservación, las anteras con el polen fueron congeladas mediante inmersión directa de los criotubos en nitrógeno líquido a -196 ºC durante cuatro y ocho meses. Una vez transcurrido el tiempo de almacenamiento respectivo, las muestras fueron descongeladas a temperatura ambiente por cinco minutos y rehidratados en cámara de humedad durante una hora 12.
Los granos de polen contenidos en 0,1 g de anteras se desprendieron de las mismas mediante vibración, empleando un vortex y se colocaron en crioviales de 2,5 mL para la germinación. A cada vial se le añadieron 250 μL de medio de cultivo líquido compuesto por las sales de Brewbaker y Kwack (BK) diluidas al 10 %: Ca (NO3)2 300 mg L-1, MgSO4 200 mg L-1, H3BO3 100 mg L-1, KNO3 100 mg L-1 (13, así como 10 g L-1 de sacarosa y un pH final de 6,5. Cada tratamiento fue suplementado con las concentraciones de Biobras-16® y Pectimorf®, según se indica en la Tabla 1 y el medio sin suplementar se utilizó como control.
Tabla 1 Tratamientos empleados para la germinación de los granos de polen de teca a los 0, 4 y 8 meses de crioconservación
| Medios de germinación | Suplementos |
|---|---|
| M1 | Ninguno |
| M2 | 0,001 mg L-1 Biobras-16® |
| M3 | 0,050 mg L-1 Biobras-16® |
| M4 | 5 mg L-1 Pectimorf® |
| M5 | 10 mg L-1 Pectimorf® |
Todos los tratamientos se incubaron durante dos horas a temperatura ambiente y luego se les añadió 250 µL de acetocarmín (1 %) como colorante. El porcentaje de germinación se determinó mediante el cociente del número de granos germinados entre los totales encontrados en cada campo microscópico, considerando germinados únicamente los granos con un tubo polínico de longitud mayor o igual al diámetro del grano de polen. Dichos conteos se realizaron empleando muestras de 100 granos de polen por campo óptico, en un microscopio Nikon ALPHAPHOT-2 YS2 (10x).
Las mediciones correspondientes al área del grano de polen (mm2) y longitud del tubo polínico (µm) en muestras de polen frescas, se realizaron empleando un microscopio Nikon eclipse 80i con aumento 20x, acoplado a una cámara fotográfica con visualización en la computadora a través del programa Nikon Ds-Fi-L2.
En cuanto al diseño experimental para la variable germinación del polen, se realizó un diseño completamente aleatorizado, con un arreglo factorial: medio de cultivo (con cinco niveles) y tiempo de crioconservación (con tres niveles). Por su parte, para las variables área del grano de polen y longitud del tubo polínico, se realizó un diseño completo al azar. En todos los tratamientos se realizaron tres repeticiones y cinco lecturas por repetición.
Para el análisis estadístico, se comprobó el cumplimiento de los supuestos estadísticos para pruebas paramétricas y se evaluó la germinación mediante un Modelo Lineal General, con el fin de calcular el efecto de cada factor y la interacción de ambos. Los datos correspondientes al área del grano de polen y longitud de tubo polínico se sometieron a un análisis de varianza (ANOVA) con comparaciones múltiples de Tukey, y a un análisis de correlación lineal mediante el cálculo del coeficiente de Pearson. Todas las pruebas estadísticas se realizaron con 95 % de confianza y mediante el programa estadístico Minab 19®.
RESULTADOS Y DISCUSIÓN
Con el análisis de los datos mediante el Modelo Lineal General, se evidenció con un 95 % de confianza, que tanto el medio de cultivo como el tiempo de crioconservación y la interacción entre ambos factores, ejercieron un efecto significativo sobre la germinación del polen de teca, todos con un valor de p=0,000.
El tratamiento control (M1) evidenció disminución de la germinación del polen a los cuatro meses de crioconservación, la cual se mantuvo a los ocho meses. El tratamiento con Pectimorf® no mostró un efecto favorable para la germinación del polen crioconservado, de acuerdo con el comportamiento de los tratamientos M4 y M5 (Figura 1).
La disminución de germinación en polen crioconservado pudo deberse al genotipo, a la calidad del polen y a la cantidad de reservas de nutrientes del mismo, propiciadas por las condiciones ambientales donde se produjo el material genético utilizado en la investigación 14. Además, se conoce que la crioconservación puede provocar acumulación de especies reactivas de oxígeno y estrés por baja temperatura, éste último crea una desorganización del metabolismo de la planta, ocasionando alteraciones en la estabilidad de las proteínas, reacciones enzimáticas y actividad respiratoria de las células 15,16.
Por el contrario, el medio con brasinoesteroide a 0,001 mg L-1 (M2) favoreció la germinación de polen crioconservado durante cuatro y ocho meses, mientras que la concentración de 0,05 mg L-1 de este compuesto mostró un efecto positivo en la germinación a los cuatro meses. Estos resultados coinciden con publicaciones recientes que informan el uso de los brasinoesteroides como promotores de crecimiento, reductores del daño oxidativo causado por factores abióticos y promotores de la germinación de polen de diversas especies 7,10,15.

Letras diferentes indican diferencias estadísticas significativas (Tukey, P≤0,05). M1: Sin suplementos, M2: 0,001 mg L-1 Biobras-16®, M3: 0,050 mg L-1 Biobras-16®, M4: 5 mg L-1 Pectimorf®, M5: 10 mg L-1 Pectimorf®
Figura 1 Efecto de Biobras-16® y Pectimorf® sobre la germinación de polen de teca crioconservado durante 0, 4, 8 meses
Al evaluar la germinación de polen sin crioconservar (0 meses), existieron diferencias significativas entre los tratamientos; aquellos suplementados con Pectimorf® (M4 y M5) no difirieron del control (M1), mientras que los tratamientos con Biobras-16® (M2 y M3) disminuyeron la germinación en este momento con respecto al control, mostrando este último un porcentaje de germinación superior (33,5 %). Esto indica que, en polen fresco, los productos evaluados no lograron un efecto positivo en la germinación.
En el caso del polen conservado en nitrógeno líquido durante cuatro meses, se observó un efecto estimulador del brasinoesteroide en ambas concentraciones evaluadas, las cuales presentaron diferencias significativas con el resto de los tratamientos. Las muestras tratadas con Pectimorf® no se diferenciaron del control.
Al transcurrir los ocho meses de conservación, la menor concentración (0,001 mg L-1) de brasinoesteroide evidenció un mayor estímulo en la germinación de los granos de polen de teca, con resultados superiores al resto de los tratamientos, seguido por el tratamiento donde se aplicó 5 mg L-1 de Pectimorf (Figura 1).
Estos resultados demuestran el efecto promotor del Biobras-16® al ser aplicado exógenamente, lo cual coincide con otras investigaciones que señalan su actividad anti estrés a concentraciones entre 0,1 y 0,001 mg L -1 (7,8) . Dicho efecto pudo ser el responsable de mejorar el porcentaje de germinación con los tratamientos criocongelados (cuatro y ocho meses). Por otro lado, se menciona que los brasinoesteroides afectan positivamente la fertilización, modificando las propiedades del polen a través de la estimulación de su crecimiento y de los tubos polínicos. Lo anterior ha sido atribuido a su acción sobre la división y elongación celular 7. En estudios realizados en la germinación in vitro de polen de Oryza sativa L., 17 y en polen de Arabidopsis thaliana18, se demostró que al aplicar 24-epibrasinólida se mejoró la germinación in vitro de granos de polen cuando estos fueron sometidos a condiciones de estrés por calor.
Adicionalmente, se constató que ni el brasinoesteroide ni la concentración más alta de oligogalacturónidos tuvieron efecto significativo en el área del grano de polen, sin embargo, la concentración de 5 mg L-1 de Pectimorf® (M4) afectó negativamente esta variable (Tabla 2).
En cuanto a la longitud del tubo polínico de los granos de polen fresco, se evidenció que existen diferencias significativas entre algunos tratamientos (p=0,002). Para esta variable el medio suplementado con 5 mg L-1 Pectimorf® (M4); mostró una mayor elongación del tubo polínico (397±76), aunque no se diferenció de la menor concentración de Biobras-16®, ni de la mayor de Pectimorf®. Los tratamientos enriquecidos con brasinoesteroides (M2 y M3) y con 10mg L-1 de Pectimorf® (M5), no evidenciaron diferencias significativas para esta variable respecto al control (Tabla 2, Figura 2).
Tabla 2 Efecto de Biobras-16® y Pectimorf® en el área y longitud del tubo polínico de granos de polen de teca frescos
| Medio de germinación | Área del grano de polen (mm2) p=0,007 E.S.x=323,4 | Longitud del tubo polínico (µm) p=0,002 E.S.x=81,3 |
|---|---|---|
| M1 | 1551,0 a | 199,9 b |
| M2 | 1354,0 a | 310,6 ab |
| M3 | 1269,1 ab | 150,6 b |
| M4 | 629,0 b | 397,2 a |
| M5 | 1334,0 a | 302,1 ab |
Medias con una letra común no son significativamente diferentes según prueba Tukey (p > 0,05). M1: Sin suplementos, M2: 0,001 mg L-1 Biobras-16®, M3: 0,050 mg L-1 Biobras-16®, M4: 5 mg L-1 Pectimorf®, M5: 10 mg L-1 Pectimorf®

A: Sin suplementos, B: 0,001 mg L-1 Biobras-16®, C: 0,050 mg L-1 Biobras-16®, D: 5 mg L-1 Pectimorf®, E: 10 mg L-1 Pectimorf®
Figura 2 Imágenes que muestran el efecto de Biobras-16® y Pectimorf® en la longitud del tubo polínico de granos de polen de teca frescos. Se señalan los tubos polínicos en los tratamientos que alcanzaron mayor longitud
Los resultados obtenidos concuerdan con trabajos de germinación in vitro de granos de polen de Solanum tuberosum, en los cuales Pectimorf® favoreció notablemente el crecimiento de los tubos polínicos en concentración de 5 mg L-1, notándose una dependencia del genotipo y las concentraciones del producto en la respuesta del material vegetal. Cabe destacar que este compuesto es conocido por su efecto como sustituto de reguladores de crecimiento tradicionales como auxinas y citoquininas, en cultivo in vitro en diferentes etapas y especies 19.
Se conoce que el tubo polínico está compuesto por una célula de rápido crecimiento que requiere una deposición masiva de la pared celular para promover su alargamiento rápido. La pared interna del tubo de polen es abundante en calosa y contiene baja cantidad de celulosa, mientras que la capa externa está formada principalmente por pectinas, que al desesterificarse y entrecruzarse mediante Ca2+, aportan rigidez a la pared celular especialmente en la parte posterior del tubo 20.
Debido a esto, cabe mencionar que investigaciones realizadas en Arabidopsis thaliana han demostrado que los oligogalacturónidos incrementan la fosforilación de fosfoproteínas como la miosina 17 y la proteína de unión a cationes asociada a la membrana plasmática (PCaP1) 21. Esto podría explicar el efecto positivo del Pectimorf® en la elongación del tubo polínico de teca, ya que la miosina estimula el tráfico a través de la actina de vesículas portadoras de componentes para la síntesis de nueva membrana y pared celular no celulósica hacia la zona apical de crecimiento. Adicionalmente, la PcaP1 es capaz de unir actina y calcio, lo cual provoca la desestabilización de los filamentos de actina. El mantenimiento del gradiente de iones calcio en el citosol permite el crecimiento polarizado del tubo polínico, por lo cual es importante la regulación de la entrada de dichos iones a través de la membrana plasmática 21,22.
A pesar de múltiples informes que indican que los brasinoesteroides promueven el crecimiento del tubo polínico al favorecer la elongación y división celular; en polen de teca fresco no se evidenció este efecto positivo. Esto pudo deberse a que la respuesta de las especies vegetales depende del tipo y concentración del brasinoesteroide empleado, así como a la interacción de factores genéticos, químicos y ambientales, ya que el desarrollo del tubo polínico es muy sensible a factores de estrés 15.
Al realizar el análisis de correlación entre el tamaño del polen y la elongación del tubo polínico, se encontró que no existe correlación lineal entre las variables para el empleo de Biobras-16®, donde el análisis mostró aleatoriedad al evaluar su efecto, en el cual se obtuvo un coeficiente de Pearson de 0,097 (Figura 3A). Al analizar el efecto de Pectimorf®, se obtuvo un coeficiente de Pearson de -0,441, por lo que se pudo afirmar la existencia de correlación negativa entre las dos variables para este producto (Figura 3B).
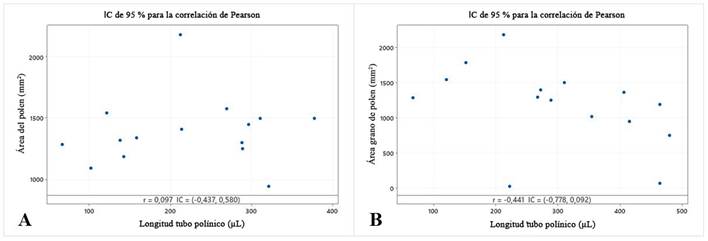
Figura 3 Análisis de correlación entre las variables área del grano de polen y longitud de tubo polínico
La existencia de una correlación negativa entre las variables área del grano de polen y longitud de tubo polínico en los tratamientos suplementados con Pectimorf®, sugiere una tendencia a que los granos de polen de menor tamaño tengan mayor habilidad de crecer sobre el pistilo y la posibilidad de ser más efectivos en la fecundación del estigma 19. Este comportamiento responde posiblemente a que los oligogalacturónidos son mensajeros químicos que realizan funciones similares a las auxinas, modulan las enzimas que intervienen en procesos específicos en planta, tales como morfogénesis, germinación y crecimiento 11. Al iniciarse la germinación del polen, se presenta un desplazamiento del citoplasma hacia la región apical de elongación y conforme el tubo polínico se elonga, se van depositando calosa y vesículas transportadoras en dicha región atendiendo al crecimiento polarizado que lo caracteriza 23,24. Estos resultados coinciden con las tendencias observadas en la germinación in vitro de polen de berenjena (Solanum melongena) sin suplementos bioactivos 25.
CONCLUSIONES
Las sustancias bioactivas evaluadas no favorecen la germinación de polen de teca fresco, pero Biobras-16®, en concentración de 0,001 mg L-1, estimula la germinación del polen de teca crioconservado durante cuatro y ocho meses.
Pectimorf® favorece el crecimiento del tubo polínico de muestras frescas de polen de teca, principalmente en la concentración de 5 mg L-1.
Se evidenció una correlación negativa para la longitud del tubo polínico y el área del polen al suplementar el medio de cultivo de germinación con este producto.
RECOMENDACIONES
Se recomienda evaluar la viabilidad del polen en períodos de tiempo mayores de crioconservación y utilizar concentraciones diferentes de estos compuestos bioactivos para realizar modelos predictivos.
Además, es recomendable analizar las variables longitud de tubo polínico y área de polen con mayor cantidad de muestras para determinar con mayor exactitud correlaciones entre estos factores, así como estudiar dichas variables en polen crioconservado.











 texto en
texto en 



