INTRODUCCIÓN
El garbanzo (Cicer arietinum L.), es una legumbre de interés que se cultiva en el mundo, constituyendo una rica fuente de proteínas, carbohidratos y minerales 1 y en Cuba, en los últimos años, ha adquirido importancia su producción 2,3.
En la actualidad, a nivel internacional, se está retomando el uso de extractos vegetales para aumentar los rendimientos agrícolas 4 y dentro de estos extractos, los productos formulados con algas, han sido muy utilizados como “bioestimuladores de las plantas”, logrando buenos resultados en el aumento de la producción 5.
Informes del uso de cianobacterias, han mostrado que estos microorganismos contribuyen a la fijación biológica del nitrógeno, mejoran la disponibilidad de nutrientes y ayudan a la estructura y función del suelo 1. Otros, han expresado los beneficios del uso de éstas para mejorar el crecimiento, el consumo de nutrientes y la bifortificación en cultivos como trigo (Triticum aestivum), algodón (Gossypium spp.), maíz (Zea mays), frijolito chino (Phaseolus aureus) 6 y garbanzo (Cicer arietinum L.) 7.
La Spirulina (Arthrospira platensis), es un alga del grupo de las cianobacterias, cuyo uso ha sido muy explotado en el campo de la biotecnología 8,9; sin embargo, el manejo sostenible de la producción agrícola ha posibilitado el incremento del uso de la misma en la agricultura 10.
Otro bioestimulante que posee gran interés en la agricultura es el Biobras-16®, formulación que tiene como ingrediente activo un análogo de brasinoesteroides sintetizado en Cuba. Este posee como principales efectos: incrementar los rendimientos, aumentar la calidad de las cosechas y estimular la tolerancia de las plantas ante condiciones de estrés ambiental (déficit hídrico, salinidad en el suelo y altas temperaturas), siendo ampliamente utilizado en cultivos como arroz, maíz, soya y tomate 11.
En Cuba, se han iniciado las investigaciones relacionadas con las respuestas de varios cultivos a la aplicación de extractos de Spirulina y otros productos en los cuales está presente; como el biofertilizante Spirufert.
El objetivo de esta investigación fue determinar la influencia del biofertilizante Spirufert sobre el rendimiento del garbanzo y las propiedades químicas del suelo, su momento de aplicación más adecuado y el efecto de su aplicación conjunta con Biobras-16® en dicho rendimiento.
MATERIALES Y MÉTODOS
Se realizaron dos experimentos en el área central del Instituto Nacional de Ciencias Agrícolas (INCA), ubicada en los 23o00'05,7” N 82o08'35,4” W, en el municipio San José de las Lajas, provincia Mayabeque.
El primer experimento se ejecutó entre noviembre del 2017 y marzo del 2018. Se utilizaron semillas del cultivar BS-70, las cuales, previo a la siembra, se inocularon con Azofert® (biofertilizante a base de la cepa Rhizobium leguminosarum, a una concentración celular 2,8 x 1010 UFC), a razón de 4,35 mL kg-1 de semilla. La siembra se realizó en un suelo Nitisol Ferrálico Líxico (eútrico alcíllico ródico), al cual se le determinaron sus propiedades químicas antes de la siembra (Tabla 1) y después de la cosecha (Tabla 2), siguiendo la metodología de Paneque et al., 2010 12.
Tabla 1 Principales propiedades químicas que caracterizan al suelo Nitisol Ferralíco Líxico (eútrico alcíllico ródico) antes de iniciar el primer experimento
| Muestras | Na | K | Ca | Mg | P | MO | pH |
|---|---|---|---|---|---|---|---|
| cmol kg-1 | mg kg-1 | g kg-1 | |||||
| M1 | 0,07 | 1,03 | 19,8 | 4,0 | 837 | 4,10 | 7,45 |
| M2 | 0,07 | 1,00 | 18 | 2,5 | 385 | 3,31 | 7,60 |
M1 (muestra tomada en zonas donde se aplicó el biofertilizante y se conformó con 20 submuestras) y M2 (muestra tomada en la zona donde se encontraba el control y fue conformada por 10 submuestras). Todas las submuestras fueron tomadas de 0 a 0.20 m de profundidad
Tabla 2 Principales propiedades químicas que caracterizan al suelo Nitisol Ferralíco Líxico (eútrico alcíllico ródico) al finalizar el primer experimento
| Muestras | Na | K | Ca | Mg | P | MO | pH |
|---|---|---|---|---|---|---|---|
| cmol kg-1 | mg kg-1 | g kg-1 | |||||
| M1 | 0,075 | 0,84 | 18,5 | 1,8 | 944,5 | 4,30 | 0,075 |
| M2 | 0,07 | 0,80 | 17 | 2,0 | 474,0 | 3,91 | 0,07 |
M1 (muestra tomada en zonas donde se aplicó el biofertilizante y se conformó con 20 submuestras) y M2 (muestra tomada en la zona donde se encontraba el control y fue conformada por 10 submuestras). Todas las submuestras fueron tomadas de 0 a 20 cm de profundidad
La distancia de siembra utilizada fue 0,75 x 0,20 m. Es importante señalar, que durante todo el ciclo del cultivo las plantas no recibieron fertilización mineral ni otro producto que no fuera el biofertilizante Spirufert. El control de las arvenses se realizó de forma manual y el riego se aplicó acorde a las necesidades del cultivo.
Durante el ciclo del cultivo, las temperaturas máximas y mínimas promedio fueron de 28,5 °C y 17,3 °C, respectivamente. La precipitación acumulada durante este ciclo fue de 192,7 mm, ocurriendo un 61,8 % durante la etapa vegetativa y el resto (38,2 %) en la etapa reproductiva, según datos de la Estación Meteorológica de Tapaste, ubicada a 500 m del área experimental.
Se utilizó el biofertilizante denominado Spirufert, el cual consiste en una suspensión acuosa de jalea de Spirulina (64 %) y vinaza (36 %) y que fue suministrado por la Unidad Empresarial de Base de Spirulina, Zaragoza, San José de las Lajas, provincia Mayabeque, perteneciente a la Empresa LABIOFAM S.A. Los tratamientos quedaron conformados de la siguiente forma:
T1- Azofert® (Control)
T2- Azofert® + Aspersión foliar de Spirufert (3,7 L ha-1) a los 30 días de la siembra
T3- Azofert® + Aspersión foliar de Spirufert (2,3 L ha-1) a los 13 días de la siembra + Aspersión foliar de Spirufert (3,7 L ha-1) a los 30 días de la siembra.
Las aspersiones se efectuaron en horas tempranas de la mañana con una mochila de 16 L de capacidad, comprobando que el volumen del producto a aplicar por parcela mojara bien el follaje de las plantas hasta punto de goteo y en la primera aspersión del tratamiento T3 se aseguró que quedara bien humedecido el suelo. Cada tratamiento fue aplicado en dos parcelas compuestas por cinco surcos de 20 m de largo cada uno, lo que equivale a un área de 75 m2 (3,75 x 20 m) por parcela.
Al final del experimento (120 días después de la siembra), se muestrearon aleatoriamente 30 plantas por tratamiento y se evaluaron los siguientes indicadores: número de vainas por planta, porcentaje de vainas con más de un grano, número y masa de granos por planta y masa de 100 granos. El rendimiento agrícola se estimó a partir de la producción obtenida en cada parcela y se expresó en t ha-1. Además, se determinó la concentración de N, P, K en los granos, siguiendo la metodología de Paneque et al., 2010 12.
El segundo experimento se realizó entre finales de noviembre del 2018 y febrero del 2019. Se utilizaron semillas de los cultivares cubanos N27 y N38, las cuales no fueron inoculadas y se sembraron en un suelo Nitisol Ferralíco Líxico (eútrico alcíllico ródico).
Se seleccionaron 30 m2 (1,5 x 20 m) por cada uno de los cultivares en estudio, a los que se le hicieron dos aspersiones foliares (46 y 61 días después de la siembra) de la mezcla de Biobras-16® y Spirufert (1:2 000 v/v) a razón de 1,5 L ha-1. Las aspersiones se realizaron de forma similar a la descrita en el primer experimento. Un área de igual tamaño (30 m2) de cada cultivar fue utilizada como tratamiento control sin aplicación.
Las plantas no recibieron fertilización mineral durante el ciclo del cultivo y el control de las arvenses y el riego se efectuó de manera similar a la descrita en el experimento anterior.
Durante el ciclo del cultivo, las temperaturas máximas y mínimas promedio fueron de 27,3 °C y 16,5 °C, respectivamente. La precipitación acumulada durante el ciclo del cultivo fue de 108,5 mm, ocurriendo un 54,7 % durante la etapa vegetativa y el resto (45,3 %) en la etapa reproductiva, según los datos recogidos en la misma Estación Meteorológica.
Al final del experimento (110 días posteriores a la siembra), se muestrearon al azar 30 plantas por tratamiento en cada cultivar en estudio y se realizaron las mismas evaluaciones del rendimiento y sus componentes descritas en el experimento anterior.
En ambos experimentos se realizó un muestreo aleatorio y los datos se procesaron mediante el cálculo de las medias, la desviación estándar y el intervalo de confianza a un 95 %, con el objetivo de discriminar diferencias entre las medias. Para ello se utilizó el programa estadístico SPSS y las figuras fueron confeccionadas con el programa Microsoft Excel 2010.
RESULTADOS Y DISCUSIÓN
De los indicadores del rendimiento evaluados, la aplicación de biofertilizante no modificó ni el porcentaje de vainas con más de un grano ni la masa de 100 granos. Sin embargo, el tratamiento donde se realizaron dos aspersiones con Spirufert (T3), resultó el mejor, al incrementar el resto de los componentes en comparación con el tratamiento control, aunque este tratamiento no difirió significativamente del tratamiento T2 donde solamente se efectuó una aspersión (Figura 1).
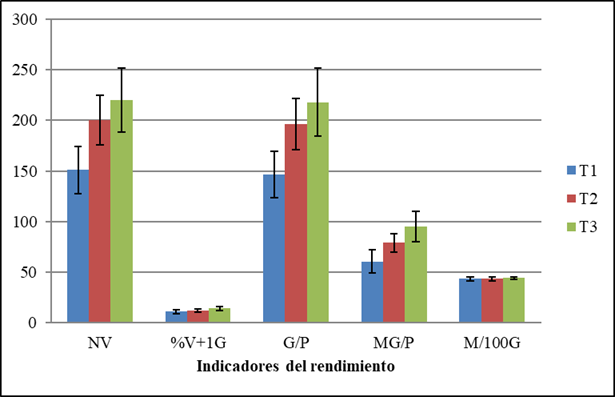 T1 (Tratamiento Control), T2 (Aspersión foliar con Spirufert a los 30 días), T3 (Aspersiones foliares con Spirufert a los 13 y 30 dias), NV (Número de vainas por planta), %V+1G (porciento de vainas con más de un grano por planta), G/P (Número de granos por planta), MG/P (Masa de granos por planta, g), M100G (Masa de 100 granos, g). Las barras representan el intervalo de confianza a α=0,05
T1 (Tratamiento Control), T2 (Aspersión foliar con Spirufert a los 30 días), T3 (Aspersiones foliares con Spirufert a los 13 y 30 dias), NV (Número de vainas por planta), %V+1G (porciento de vainas con más de un grano por planta), G/P (Número de granos por planta), MG/P (Masa de granos por planta, g), M100G (Masa de 100 granos, g). Las barras representan el intervalo de confianza a α=0,05Figura 1 Efecto de las aspersiones foliares con el biofertilizante Spirufert (Spirulina+Vinaza) en los indicadores del rendimiento de plantas de garbanzo cv. BS70
También se pudo comprobar que al realizar dos aspersiones foliares (T3), se incrementó el rendimiento de las plantas, superando en 57,7 % al rendimiento obtenido por las plantas del tratamiento control (T1) y en 20,6 % al obtenido por las plantas que recibieron una aplicación foliar solamente (T2), aunque sin diferencia significativa con este último tratamiento (Figura 2).
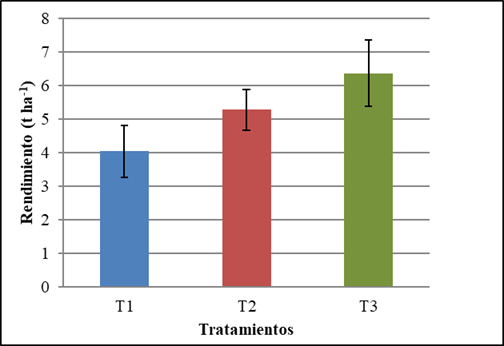 T1 (Tratamiento control), T2 (Aspersión foliar con Spirufert a los 30 días), T3 (Aspersiones foliares con Spirufert a los 13 y 30 días). Las barras representan el intervalo de confianza a α=0,05
T1 (Tratamiento control), T2 (Aspersión foliar con Spirufert a los 30 días), T3 (Aspersiones foliares con Spirufert a los 13 y 30 días). Las barras representan el intervalo de confianza a α=0,05Figura 2 Efecto del biofertilizante Spirufert (Spirulina+Vinaza) en el rendimiento de plantas de garbanzo cv. BS70
En el cultivo del garbanzo, el rendimiento varía en gran medida, dependiendo del cultivar y las condiciones edafoclimáticas del lugar donde se desarrolle el cultivo y el mismo puede oscilar; por ejemplo, desde 0,65 t ha-1 para el cv. Jamu-96 13, 1,54-1,90 t ha-1 para el cv. N-29 13,14 y hasta 3,26 t ha-1 para el cv. N-27 13.
Los resultados obtenidos en este trabajo confirman los informados anteriormente por otros autores en leguminosas, quienes han encontrado que la aplicación foliar de un extracto acuoso de Spirulina en habichuela incrementó la cantidad y la calidad de las semillas 15, mientras que la aplicación de extractos a base de algas en el frijol carita incrementó el número de vainas por planta, la masa de 100 granos y el rendimiento 16 y la aplicación de un extracto del alga parda Ecklonia máxima en plantas de soya estimuló el crecimiento, incrementó el rendimiento, aumentando el número de semillas, la masa de 1 000 semillas y mejoró la calidad de las semillas, incrementando el contenido de lípidos y proteínas de las mismas 17.
Además, en otros cultivos, se ha encontrado que el tratamiento de plantas de arroz con algas verde-azuladas incrementó la producción de granos 18 y que al aplicar extractos de Spirulina en plantas de berenjena, aumentó la producción de frutos 19.
El incremento en el rendimiento inducido por el tratamiento T3 en este trabajo, pudiera ser el resultado de la influencia positiva que el Spirufert provocó en la actividad microbiana del Azofert® y en el proceso de fotosíntesis, ya que se ha informado que la aplicación de una formulación a base de Mesorhizobium ciceri y cianobacterias de la familia Anabaena, influyó positivamente en la actividad microbiana y, por ende, en la fijación biológica del nitrógeno; en el contenido de clorofilas y en el nitrógeno disponible en el suelo, lo que se tradujo en un incremento del rendimiento agrícola 1. Por otra parte, también se ha informado; por ejemplo, en el cultivo de la vid, que la aplicación al suelo y al follaje de estos extractos de algas incrementó la tasa de asimilación de CO2 por las plantas, lo cual repercutió posteriormente en el rendimiento 20.
Paralelamente a esto, el Spirufert, dada su composición, puede aportar metabolitos y nutrientes que son esenciales para las plantas; pues se conoce que la Spirulina tiene aproximadamente del 60-70 % de su masa seca en proteínas 21 y se han identificado ácidos grasos poliinsaturados esenciales, vitaminas 8, xantinas, ficobiliproteínas 8,22, carbohidratos, nitrógeno, fósforo, potasio, calcio, hierro, manganeso, zinc 10, gran riqueza de α- y ß carotenos 8,23, ficocianina, considerables cantidades de ácido α-linolénico, una alta concentración de fitohormonas, oligoelementos, antioxidantes y polisacáridos, clorofila, xantofilas y lípidos 24. Además, en la vinaza se encuentran macro y micronutrientes como Ca, Mg, Na, K, Fe, Mn, Zn y Cu 25, cantidades moderadas de nitrógeno, fósforo 26 y materia orgánica 25,26.
No obstante a estos resultados, se debe continuar investigando en este sentido, para definir si las aplicaciones efectuadas en dos momentos en el tratamiento T3 (13 y 30 días después de la siembra) son las más efectivas para incrementar el rendimiento en este cultivo, o si es posible la utilización de otro modo de aplicación como es la peletización de las semillas, la aplicación directa al suelo o la combinación de aplicación al suelo y aspersión foliar como ha sido informado por otros autores 4,5,27-29.
Diferente a los resultados obtenidos en algunos componentes del rendimiento y el rendimiento, entre los tratamientos con el biofertilizante Spirufert y el tratamiento control no existieron diferencias en las concentraciones de N, P, K de los granos (Tabla 3).
Tabla 3 Efecto de las aplicaciones del biofertilizante Spirufert (Spirulina+Vinaza) en las concentraciones de N,P,K de los granos de plantas de garbanzo cv. BS70
| Tratamientos | N (%) | P (%) | K (%) |
|---|---|---|---|
| T1 | 2,69±0,10 | 0,59±0,03 | 0,68±0,09 |
| T2 | 2,78±0,11 | 0,64±0,06 | 0,71±0,05 |
| T3 | 2,73±0,06 | 0,62±0,04 | 0,72±0,11 |
T1 (Tratamiento control), T2 (Aspersión foliar con Spirufert a los 30 días), T3 (Aspersiones foliares con Spirufert a los 13 y 30 días)
Al observar los resultados mostrados en la tabla, se considera que debe estudiarse a profundidad, si el momento de aplicación y la concentración del Spirufert pudiera estar influyendo en que no haya respuesta en las concentraciones de N, P, K de los granos.
Algunos autores han encontrado que a pesar de que los extractos a base de algas poseen un contenido inferior de N-P-K en relación con los fertilizantes químicos, estos estimulan el crecimiento de los cultivos de manera similar al fertilizante químico, debido a que poseen cantidades superiores de otros elementos (calcio, hierro, manganeso, zinc y selenio) que ayudan a moderar las cantidades de nutrientes requeridos por las plantas 10, además, en diferentes publicaciones, se observa influencia en las concentraciones de diferentes minerales en hojas y frutos; sin embargo, esta respuesta no fue observada en este trabajo.
Por ejemplo, la aplicación foliar de un extracto acuoso de Spirulina en habichuela, estimuló las concentraciones de clorofila, nitrógeno, fósforo y potasio de las hojas 15. Por otra parte, al evaluar el efecto de extractos a base de algas con nombres comerciales Agrostemin, Phyllum, Fertimar y Ecoalga, sobre frijol (Phaseolus vulgaris L.) cv Jade, se observó que la concentración foliar de K en vainas mostró diferencias estadísticas 30.
Sin embargo, en un estudio donde se aplicaron extractos de Spirulina en plantas de berenjena, aunque se incrementó la producción de frutos, no se afectaron los niveles foliares de N, P, K y Na 19.
En la Tabla 4 se muestran las variaciones que mostraron las propiedades químicas del suelo utilizado en el primer experimento una vez finalizada la cosecha, en las zonas donde se aplicaron los tratamientos con biofertilizante y en la zona donde estaba el tratamiento control.
Tabla 4 Variaciones de las propiedades que caracterizan al suelo Nitisol Ferralíco Líxico (eútrico alcíllico ródico, FAO 2008) utilizado en el experimento
| Muestras | Na | K | Ca | Mg | P | MO | pH |
|---|---|---|---|---|---|---|---|
| cmol kg-1 | mg kg-1 | g kg-1 | |||||
| M1 | +0,005 | -0,19 | -1,3 | -2,2 | +107,5 | +0,2 | -0,25 |
| M2 | 0,00 | -0,2 | -1,0 | -0,5 | +89 | +0,6 | -0,4 |
M1 (muestra correspondiente a las zonas donde se aplicó el biofertilizante) y M2 (muestra correspondiente a la zona donde se encontraba el tratamiento control). (-disminución de las concentraciones, +aumento de las concentraciones)
Las mayores diferencias en la variación entre las zonas donde se aplicó biofertilizante y la zona donde estaba el tratamiento control, se observaron en las concentraciones de Mg y P, donde hubo una disminución y un aumento mayor de los niveles de magnesio y fósforo, respectivamente, en la zona del suelo donde se aplicó el biofertilizante.
Existen informes referidos a la influencia de las cianobacterias en la disponibilidad de nutrientes del suelo 1.
La disminución en los niveles de magnesio puede deberse a que con la aplicación del biofertilizante, aumente la activación de procesos fisiológicos en las plantas donde se requiere magnesio, como por ejemplo, el posible incremento de la concentración de clorofilas en las hojas, las cuales demandan de Mg pues forma parte de la molécula y esto, por supuesto, puede estar relacionado con una mayor actividad fotosintética, efectos que han sido descritos por otros autores al aplicar extractos de algas 1,20.
El mayor aumento en las concentraciones de fósforo en la zona donde se aplicó biofertilizante, puede deberse al aporte de fósforo por parte del biofertilizante y de los minerales que ayudan a moderar las cantidades de nutrientes requeridos por las plantas.
Una vez demostrada la eficacia del biofertilizante Spirufert en el cultivo del garbanzo, se decidió realizar un experimento donde se utilizara este pero en combinación con el Biobras-16® a una dosis ligeramente inferior (3 L ha-1) pero fraccionada en dos momentos de aplicación (46 y 61 días después de la siembra, o sea, en los momentos de prefloración y floración del cultivo).
Aunque en el primer experimento, los mejores resultados se obtuvieron cuando se realizaron aspersiones a los 13 días y 30 días después de la siembra; en este experimento se decidió utilizar otros dos cultivares (N-27 y N-38) de garbanzo y se realizaron también dos aspersiones foliares, pero en otros momentos del ciclo del cultivo, teniendo en cuenta que en el caso del Biobras-16 los mejores resultados se han obtenido cuando se realizan aplicaciones previo y durante la fase reproductiva 11.
Al analizar los resultados se puede observar, que la aplicación combinada de Spirufert y Biobras-16® incrementó significativamente la producción de granos de los dos cultivares en estudio, lo que repercutió en la masa de granos por planta (Figura 3) y por ende, en el rendimiento estimado del cultivo (Figura 4).
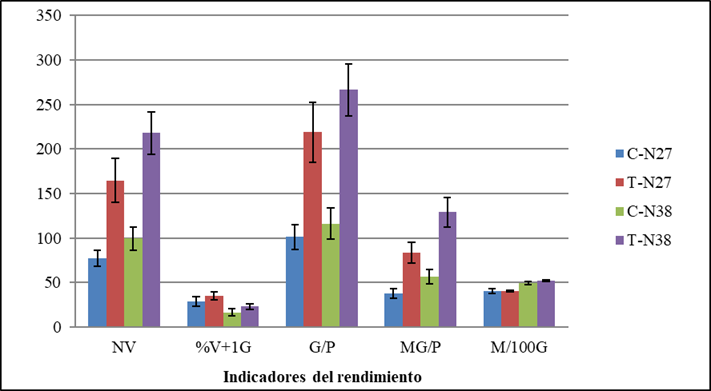 C-N27 (Tratamiento control cultivar N27), T-N27 (tratamiento con la mezcla cultivar N27), C-N38 (Tratamiento control cultivar N38), T-N38 (tratamiento con la mezcla cultivar N38), NV (Número de vainas por planta), %V+1G (porciento de vainas con más de un grano por planta), G/P (Número de granos por planta), MG/P (Masa de granos por planta, g), M100G (Masa de 100 granos, g). Las barras representan el intervalo de confianza a α=0,05
C-N27 (Tratamiento control cultivar N27), T-N27 (tratamiento con la mezcla cultivar N27), C-N38 (Tratamiento control cultivar N38), T-N38 (tratamiento con la mezcla cultivar N38), NV (Número de vainas por planta), %V+1G (porciento de vainas con más de un grano por planta), G/P (Número de granos por planta), MG/P (Masa de granos por planta, g), M100G (Masa de 100 granos, g). Las barras representan el intervalo de confianza a α=0,05Figura 3 Influencia de dos aspersiones foliares con una mezcla de Spirufert (Spirulina+Vinaza) y Biobras-16® en los indicadores del rendimiento de plantas de garbanzo, cultivares N27 y N38
 T-N27 (tratamiento con la mezcla cultivar N27), C-N38 (Tratamiento control cultivar N38), T-N38 (tratamiento con la mezcla cultivar N38). Las barras representan el intervalo de confianza a α=0,05
T-N27 (tratamiento con la mezcla cultivar N27), C-N38 (Tratamiento control cultivar N38), T-N38 (tratamiento con la mezcla cultivar N38). Las barras representan el intervalo de confianza a α=0,05Figura 4 Influencia de dos aspersiones foliares con una mezcla de Spirufert (Spirulina+Vinaza) y Biobras-16® en el rendimiento estimado de plantas de garbanzo, cultivares N-27 y N-38. C-N27 (Tratamiento control cultivar N27)
Los incrementos en el rendimiento alcanzaron valores de 21 y 28 %, para los cultivares N27 y N38, respectivamente; lo que demuestra la efectividad de las dos aspersiones foliares efectuadas con la mezcla de Spirufert y Biobras-16®.
Es conocido que el Biobras-16® tiene como ingrediente activo un análogo espirostánico de brasinoesteroides, que se ha demostrado actúa como un regulador de crecimiento en las plantas, por lo que se caracteriza por estimular diversos procesos fisiológicos 11. De esta forma, estudios realizados en frijoles, han demostrado que la aspersión foliar con Biobras-16® incrementó la longitud y el diámetro del tallo, así como el número de vainas y de granos por planta y, por ende, el rendimiento comercial 31. Resultados similares se obtuvieron con la aspersión foliar de Biobras-6 (formulación que tiene como ingrediente activo otro análogo espirostánico de brasinoesteroides) en tres variedades de soya inoculadas con Bradyrhizobium japonicum y Glomus clarum32. Esta respuesta puede estar relacionada con la estimulación en el crecimiento radical y en el número de nódulos inducidos por la aspersión foliar, en la fase de floración, de brasinoesteroides naturales como la homobrasinólida y la 24-epibrasinólida, informada por otros autores 33.
Por otra parte, la aspersión a semillas de frijoles con Biobras-16®, previo a la inoculación con Azofert®, incrementó significativamente el rendimiento del cultivo 34, lo que denotó la efectividad de este producto como bioestimulador del rendimiento en este cultivo.
De lo anterior se infiere, que el efecto encontrado era esperado, aunque queda aún por dilucidar si la aplicación combinada de Biobras-16® y Spirufert incrementó o no el efecto del Biobras-16® solo y si ese efecto fue aditivo o sinérgico; lo cual resulta de gran importancia en la actualidad; teniendo en cuenta que ambos productos son nacionales y se hace necesario incrementar la producción de este cultivo en el país con el uso de tecnologías de producción sostenibles y que sustituyan importaciones.
CONCLUSIONES
La aspersión foliar con el biofertilizante Spirufert en dos momentos de la fase vegetativa incrementó el rendimiento del cultivo del garbanzo; aunque no hubo influencia en los niveles de N, P, K en los granos. Además, el tratamiento modificó los niveles de P y Mg del suelo.
La aspersión foliar con la mezcla de Spirufert y Biobras-16® produjo un aumento significativo del rendimiento y sus componentes en dos cultivares de garbanzo; lo que sugiere que es posible lograr un efecto aditivo o sinérgico en el rendimiento de las plantas con la mezcla de estos dos productos nacionales.











 texto en
texto en 


