INTRODUCCIÓN
La arveja (Pisum sativum L.) es una leguminosa de grano, caracterizada por su alto valor nutricional y su uso en la nutrición humana y animal. Sus semillas contienen entre 18 y 20 % de materia seca, de las cuales, del 10 al 12 % son carbohidratos y entre cinco y ocho % son proteínas 1. Los granos de arveja pueden usarse para consumo inmediato o enlatados para almacenamiento a largo plazo 2. Este cultivo también se puede utilizar como forraje verde, heno, ensilaje o harina y como abono verde 3.
Como leguminosa, la arveja tiene otra característica importante, relacionada con la capacidad de fijar el nitrógeno atmosférico en simbiosis con bacterias de la familia de los rizobios 4, específicamente con la especie R. leguminosarum bv. viciae5. Esta simbiosis proporciona cantidades significativas de N al suelo para los cultivos sucesores y se plantea que la inoculación con estas bacterias puede producir rendimientos similares a la aplicación de 200 kg de N ha-1 (2.
La aplicación de grandes cantidades de fertilizantes inorgánicos en sistemas de producción intensiva 6,7 representa una carga contaminante para el medio ambiente y altos costos que muchos países no pueden pagar. Lograr rendimientos similares o más altos con bajos insumos y productos orgánicos, significa un desafío para la agricultura sostenible. La fijación simbiótica de N constituye una alternativa prometedora al respecto (8,9) .
Las tecnologías de inoculación de diversos microorganismos beneficiosos en las semillas constituyen una práctica agronómica económica, recomendada en la agricultura. La inoculación exitosa dependerá de varios factores, incluida la capacidad de la cepa introducida para competir con la población nativa existente y lograr una mayor infección, nodulación y contribución de N 10.
La simbiosis que se establece entre las plantas leguminosas y los rizobios responde a un intenso intercambio de señales desde el comienzo de la interacción, lo que permite la comunicación entre ambos simbiontes: el macro y el microorganismo 11. Las semillas liberan diversos compuestos, incluidos los flavonoides, que causan la expresión de genes nod en las bacterias, lo que induce la síntesis de factores Nod, moléculas esenciales en el éxito de la interacción 12. Estos compuestos también se han relacionado con la quimioatracción que ejercen las leguminosas sobre los rizobios y con la expresión de otros genes en estas bacterias que regulan la síntesis de exopolisacáridos y del sistema de secreción de tipo III, relacionados con las respuestas defensivas en el huésped y la exportación de proteínas en la nodulación, respectivamente 13.
Los ácidos grasos de alto peso molecular son componentes estructurales de los lipoquitooligosacáridos asociados con la nodulación. Los factores Nod consisten en un esqueleto de tres a cinco moléculas de N-acetil-glucosamina, que en el grupo amino del extremo no reducido se acila con un ácido graso de 16-20 átomos de C de largo (C16-C20) 14.
El uso de inoculantes inducidos en la síntesis de estas señales que gobiernan la comunicación, ha permitido obtener no solo una mejor nodulación y rendimiento de las plantas 15, sino también tolerancia a las condiciones de estrés en el medio ambiente 16. Por esta razón, el presente trabajo tuvo como objetivo evaluar el efecto de la inducción de una cepa de Rhizobium leguminosarum bv. viciae en la generación de señales en el inoculante y su actividad biológica en plantas de arveja.
MATERIALES Y MÉTODOS
Cultivo bacteriano. Inducción con daidzeína
Se utilizó una cepa de Rhizobium leguminosarum bv. viciae, conocida por su simbiosis con la arveja. Se produjo un preinóculo en 50 mL de medio extracto de levadura manitol 17 a pH 6,8; para inocular 600 mL del mismo medio sin y con daidzeína (Sigma), la que se añadió a una concentración final de 5 µM Los inóculos se obtuvieron después de mantener los frascos a 150 rpm durante 48 h, en un agitador orbital a 28 ± 2 ºC de temperatura. Para cada caso, el procedimiento se repitió tres veces e incluyó tres muestras de cada tratamiento (sin inducir e inducido con daidzeína).
Extracción de la fracción lipídica
Teniendo en cuenta que la mayoría de las señales reconocidas por su actividad biológica en la interacción rizobios-leguminosas son lípidos, se realizó una extracción selectiva de estas moléculas del inóculo tratado con daidzeína (Inducido) o no (Control), utilizando 180 mL de n-butanol en cada muestra. Se colocaron en un agitador orbital a 150 rpm durante 15 min y se mantuvieron en reposo durante la noche en condiciones de oscuridad a una temperatura ambiente de 25±2 °C. Luego se extrajo la fase orgánica en cada muestra, se centrifugó a 12000 g, 10 °C, durante 10 minutos. Todas las muestras se concentraron por rotoevaporación a 50-80 °C hasta que se obtuvieron 2 mL de cada una, que se utilizaron para la detección de señales producidas por la bacteria.
Detección de señales. Caracterización estructural de componentes principales en la fracción lipídica
Análisis de cromatografía líquida de alta resolución, fase inversa
Para evaluar la presencia de factores de nodulación entre los metabolitos, se analizaron 10 µL de todos los extractos lipídicos por HPLC, utilizando una columna de fase inversa Waters Symmetry C-18 (46 x 250 mm) de 5 µ de tamaño de partículas, instalada en un Sistema HPLC Waters Alliance. La velocidad de flujo fue de 1 mL min-1 y como solventes se usaron agua (A) y acetonitrilo (B), con un gradiente: 0-10 min 18 % B, 10-30 min 60 % B, 30-35 min 95 % B, 35-45 min 18 % B. Se usó un detector espectrofotométrico UV-Waters a una longitud de onda de 214 nm.
Cromatografía de gases acoplada a un espectrómetro de masas
Los derivados volátiles de ácidos grasos se prepararon por sililación, utilizando BSTFA (N, O-Bis (trimetilsilil) trifluoroacetamida) como reactivo en combinación con trimetilclorosilano (TMCS) (Kit BSTFA + TMCS, Supelco). Para el análisis por GC-MS, se utilizó un cromatógrafo de gases acoplado a un espectrómetro de masas Shimadzu GC-MS QP-2010; sistema equipado con autoinyector AOC-20i, inyector automático AOC-20s y un sistema de inserción directa controlado por el software "Solución GC-MS". Se utilizó una columna Optima 5 MS (30 m × 0,25 mm ID, 0.25 µm de espesor de película). Las condiciones de los análisis cromatográficos fueron: temperatura del inyector 310 °C, temperatura del horno 100 °C durante seis minutos. Posteriormente se aumentó a 320 °C a una velocidad de 20 °C min-1 y se mantuvo durante 5 minutos. El volumen de inyección fue de 1 µL y el flujo en la columna de 0,75 mL min-1, utilizando helio como gas de arrastre.
Efecto sobre la nodulación de plantas de arveja, en condiciones controladas
A partir de los biopreparados obtenidos, se inocularon dos mL por cada 500 g de semillas de la variedad Facon, que se sembraron en una mezcla de suelo/vermiculita estéril (1:1), sin aplicación de otros nutrientes. Las plantas se cultivaron en una cámara de crecimiento, con un fotoperíodo de 16/8 horas de luz/oscuridad a 28 °C y con un 60 % de humedad relativa, durante 35 días. El riego se realizó por capilaridad con agua desionizada, manteniendo el régimen de agua en aproximadamente el 90 % de la capacidad del campo. Se utilizaron nueve plantas por tratamiento para evaluar el número y la masa seca de nódulos (mg) por planta.
Efecto sobre el rendimiento de las plantas, en condiciones de campo
Este estudio se realizó en los campos experimentales de las localidades de Ferré (34º09´S, 61º09´W, altitud 93 m, suelo típico Mollisol negro, que corresponde a un suelo Feozem 18) y Pergamino (33 ° 53'S, 60 ° 34'W, altitud 56 m, suelo Argiudol típico, franco-limoso (Feozem árgico), provincia de Buenos Aires, Argentina), durante los meses julio-octubre de 2015. Dos de los ensayos se llevaron a cabo en parcelas (en ambas localidades) y uno extensivo en Ferré.
Los datos del análisis de suelo en Pergamino fueron: pH (1:2,5)= 5,6; N-NO3 (ppm)= 4; P Bray I (ppm)= 19,2; M. Org. (%)= 2,2; N total (%)= 0,111; Carbono (%)= 1,3. Las temperaturas (°C) entre julio-octubre: 16,4-20,1-20,4-25,0 y las precipitaciones (mm): 33,0-8,0-60,0-111,0.
Para la localidad de Ferré, los datos del análisis de suelo fueron: pH (1:2,5)= 5,6; N-NO3 (ppm)=13,7; P Bray I (ppm)= 23,6; M. Org. (%)= 2,7; N total (%)= 0,134; Carbono (%)=1,6. Las temperaturas entre julio-octubre: 16,3-21,0-20,7-24,8 °C y las precipitaciones: 3,0-4,0-68,0-105,0 mm, respectivamente.
Se inocularon semillas de la variedad Facon a una dosis de cuatro mL por 1000 g de semillas, con una densidad de siembra de 25 semillas m-1 y un sistema de siembra directa (sin laboreo) en Ferré y siembra convencional (laboreo previo del suelo) en Pergamino. Como cultivo antecesor en Ferré se cultivó soya, mientras que en Pergamino fue pastizales. En todos los experimentos se empleó como fertilización: 80 kg ha-1 de Mezcla (8-38-0-8 S). En el momento de la cosecha, se determinó el rendimiento (kg ha-1).
Diseño experimental y procesamiento estadístico
El experimento de la cámara de crecimiento se repitió tres veces. Se utilizó un diseño completamente aleatorizado y se comprobó la normalidad y la homogeneidad de la varianza en los datos, los cuales se analizaron de acuerdo con Tukey p<0,05.
En los experimentos de parcela se utilizó un análisis bifactorial, teniendo en cuenta los factores inoculantes y localidades, con tres y dos niveles, respectivamente. Para discriminar las diferencias entre las medias, los resultados se compararon utilizando el Test de Rangos Múltiples de Duncan p<0,05. Se utilizó el programa Statgraphics Plus, versión 5.1.
RESULTADOS Y DISCUSIÓN
Detección de señales. Caracterización estructural de componentes principales en la fracción lipídica
El análisis de la composición de los extractos en n-butanol, correspondiente a tres réplicas biológicas independientes para cada tratamiento, realizado por HPLC y GC-MS se presenta en las Figuras 1 y 2, respectivamente.
Se observan diferencias entre los tratamientos inducidos y no inducidos en los picos obtenidos y el área (concentración), que fue superior cuando el biopreparado se indujo con daidzeína (Figura 1 A y B), cuya área total fue de 372 567 175, con respecto al tratamiento no inducido que fue de 5 322 255.

Los datos representan el promedio de tres réplicas
Figura 1 Cromatogramas obtenidos por HPLC, tiempo de retención (tr) y área de los picos separados, al analizar las muestras del inoculante no inducido (A) y el inoculante inducido con daidzeína (B)
Cuando las muestras se analizaron por cromatografía de gases acoplada a un espectrómetro de masas (Figura 2), se identificaron varios picos, correspondientes a ácidos grasos de alto peso molecular como el ácido ecosenoico y esteárico y otras moléculas sintetizadas por el microorganismo.

Los datos representan el promedio de tres réplicas
Figura 2 Área de los picos correspondientes a los cromatogramas obtenidos por GC-MS en el inoculante no inducido e inducido con daidzeína y que representan ácidos grasos y otras moléculas
Los resultados muestran un aumento en el área de estos picos con el tratamiento inducido. Esto significa que la daidzeína promueve no solo la producción de factores de nodulación en las bacterias, sino también otros componentes de naturaleza lipídica, como los ácidos grasos y otros compuestos.
En trabajos anteriores, otros autores también encontraron un aumento de estos ácidos grasos de alto peso molecular en los factores Nod producidos por cepas simbiontes de frijol y garbanzo, en presencia de inductores de los genes nod15,19. La función biológica de los factores de nodulación está bien documentada. Sin embargo, se desconoce una posible función del resto de los compuestos detectados en el proceso de nodulación. De hecho, se ha descrito que los ácidos grasos de alto peso molecular exhiben actividad antimicrobiana y juegan un papel en el crecimiento de Rhizobium y la adaptación al estrés 20. Estas estructuras de ácidos grasos también son componentes de las membranas celulares de las plantas y se ha demostrado su acumulación en las raíces de plantas de soya colonizadas por Bradyrhizobium japonicum21. Algunos ácidos grasos de alto peso molecular son precursores de la síntesis del ácido jasmónico, que resulta esencial en las respuestas de la planta al estrés biótico y abiótico 22.
Mediante los métodos utilizados para caracterizar los compuestos lipídicos y detectar la presencia de factores Nod en las muestras de inoculantes, estas estructuras se identificaron en mayor medida en el inoculante inducido con daidzeína.
Efecto sobre la nodulación en condiciones controladas
Las plantas no inoculadas no formaron nódulos, pero con respecto al efecto de los tratamientos inducidos y no inducidos sobre la nodulación, se observó un efecto superior del tratamiento inoculado con el inoculante inducido sobre el número de nódulos formados en las raíces principales y totales y también en su masa (Tabla 1).
Tabla 1 Número de nódulos y masa seca de nódulos (mg) en plantas control no inoculadas (Control) y plantas inoculadas con el biopreparado inducido o no inducido, 35 días después de la siembra
| Tratamiento | Número nódulos Raíz Principal pl-1 | Masa seca nódulos Raíz Principal pl-1 | Número nódulos Total pl-1 | Masa seca nódulos Total pl-1 |
|---|---|---|---|---|
| Inducido | 3,56 a | 7,67 a | 14,89 a | 19,56 a |
| No Inducido | 0,36 b | 0,73 b | 8,79 b | 13,21 b |
| Control | 0,0 b | 0,0 b | 0,0 c | 0,0 c |
| SEx | 0,35 | 0,89 | 1,24 | 1,02 |
Los datos representan el promedio de tres repeticiones
Letras similares indican que no hay diferencias entre los tratamientos, según Tukey p<0,05; n=9
Estos resultados indican que la presencia de una mayor cantidad y diversidad de señales en el inoculante inducido (Figuras 1 y 2), estimuló la formación de nódulos en las plantas. Se ha planteado que la percepción de señales, tales como los factores Nod, activan las vías biosintéticas requeridas para la nodulación 23 y que un mayor número de estas estructuras significa una mayor fijación biológica, así como una mayor masa nodular podría indicar más tejido nodular, más bacteroides y más fijación; por lo tanto, mayor suministro de N a la planta 24.
Efecto de los inoculantes sobre el rendimiento de la arveja, en condiciones de campo
El análisis en parcelas mostró interacción entre los factores: inoculantes (control, no inducido e inducido) y localidades (Ferré y Pergamino). Se obtuvieron rendimientos superiores en los tratamientos biofertilizados (Figura 3), lo que demuestra el papel de estas bacterias en la nutrición nitrogenada del cultivo. Resultados similares fueron obtenidos por otros autores 25.

Medias con letras similares indican diferencias no significativas Duncan p<0.05. ES X= 54,67
Figura 3 Efecto de los tratamientos no-inoculado, inducido y no inducido sobre el rendimiento de arveja en dos localidades
Los rendimientos fueron superiores en Ferré, con alrededor de 1000 t ha-1 más, con respecto a Pergamino. Teniendo en cuenta que se utilizó en ambos experimentos la misma variedad, tratamientos y atenciones culturales y que las características del suelo y el clima no fueron significativamente diferentes, la diferencia en el rendimiento obtenida para ambas localidades, podría estar relacionada con el cultivo anterior y con el tipo de siembra utilizada. Es conocido el efecto positivo de las leguminosas en la rotación de cultivos 26,27, por las poblaciones de rizobios residuales con atributos positivos en la promoción del crecimiento vegetal y su capacidad de fijar nitrógeno atmosférico 28, por facilitar la circulación de los nutrientes en el suelo y la retención de agua 29 y por reducir la escorrentía de nutrientes y las emisiones de gases de efecto invernadero 30.
Con respecto a las ventajas de la siembra directa sobre los métodos convencionales de preparación del suelo se refieren incrementos en el número de plántulas establecidas 31, ahorro de agua 32 e incrementos en los rendimientos y calidad de los cultivos 33.
Cuando se compararon los tratamientos inoculados, se observó un rendimiento superior de la leguminosa en ambos lugares cuando se usó el inoculante inducido, con 468 y 125 kg ha-1 de semillas, por encima del tratamiento inoculado sin inducir, para Ferré y Pergamino, respectivamente. Sin embargo, diferencias significativas entre estos tratamientos inoculados solo se observaron en Ferré.
En el ensayo extensivo, se encontraron resultados similares a los experimentos en parcelas, con mayor rendimiento en el tratamiento inoculado con la bacteria inducida (2637 kg ha-1), seguido del tratamiento no inducido, pero inoculado (1891 kg ha-1). El control mostró el valor de rendimiento más bajo (1501 kg ha-1) (Figura 4).
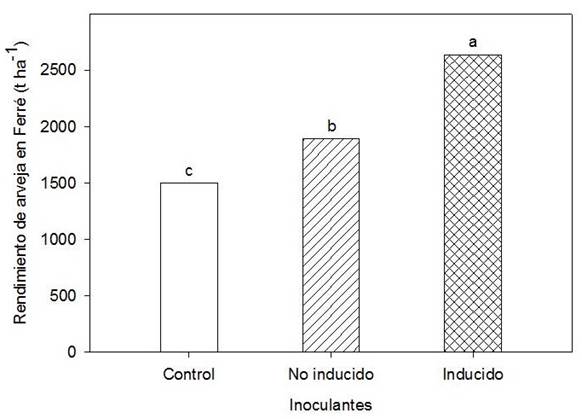
Medias con letras similares indican diferencias no significativas, según Duncan p <0.05. ES X = 22,16
Figura 4 Efecto de los tratamientos no inoculado (control), inducido y no inducido, sobre el rendimiento de arveja, bajo condiciones extensivas de campo en Ferré
El efecto positivo encontrado en las variables de nodulación (Tabla 1) se tradujo en mayores rendimientos del cultivo en diferentes condiciones. Resultados similares se obtuvieron por otros autores para la interacción Bradyrhizobium elkani-soya, Rhizobium leguminosarum-frijol y Mesorhizobium ciceri-garbanzo, cuando los inóculos también fueron inducidos. El análisis de los perfiles cromatográficos obtenidos en esas investigaciones, mostró también diferencias positivas en el número de picos y su área; resultados que se correspondieron con el número de nódulos y más tarde con el rendimiento de estos cultivos 15,19,34.
La importancia de los factores Nod en la interacción con las leguminosas no solo está relacionada con la nodulación y la eficiencia en la fijación biológica de N en condiciones normales y de estrés abiótico. La similitud de su estructura con los quitooligosacáridos derivados de la pared celular de hongos y activadores de defensa 35, así como evidencias directas de su papel en la reducción de enfermedades 36 y otras evidencias indirectas en la activación de enzimas de defensa 37, representan una participación de estas moléculas en ciertas respuestas de inmunidad a la invasión por patógenos 38.
CONCLUSIONES
La inducción de los genes de nodulación en Rhizobium leguminosarum bv. viciae, como parte de la mejora en los inoculantes y su diálogo con las plantas, provoca la síntesis y excreción de diferentes compuestos por la bacteria, lo que repercute en una mayor nodulación y rendimiento en el cultivo de arveja.
El desarrollo de inoculantes y formulaciones más complejas como los aquí tratados, permiten mejorar la simbiosis y garantizar niveles más altos de fijación de N.











 texto en
texto en 



