INTRODUCCIÓN
El suelo es un importante recurso natural con gran influencia sobre el medio ambiente y la economía. De él dependen, en gran medida, la supervivencia y el bienestar de la población actual y las generaciones futuras 1. La fertilidad de los suelos se considera un factor determinante en la disponibilidad de nutrientes para las plantas cultivadas. Es difícil comprender la fisiología de la nutrición de los cultivos económicos, sin un estudio adecuado de los indicadores que conforman la fertilidad y la naturaleza de los suelos, sobre todo, en las regiones tropicales 2.
Sin embargo, en los estudios de fertilidad del suelo se hace indispensable incluir los análisis relativos a la biología del suelo debido a que la mayoría de las transformaciones de los nutrientes en el suelo son realizadas por los microorganismos del suelo. Al respecto, varios estudios han establecido la importancia de la microbiota del suelo y sus interacciones para la mineralización de los nutrientes y la nutrición de las plantas 3.
Para cualquier estudio de suelos siempre es necesario una previa descripción del suelo como tal. Por una parte, es el primer contacto que se tiene con los suelos que puedan existir en la región de estudio y, por otra, el perfil de suelo se manifiesta a través de su morfología, en la cual se presentan una serie de propiedades que son el resultado de la formación del suelo y de la influencia antropogénica, si existe 4.
De manera general, los análisis iniciales de las propiedades físicas, químicas y biológicas de un suelo son un paso indispensable para proceder a un manejo agrícola sostenible, tomando en consideración sus factores limitantes y propiciar un manejo que conserve, mejore e incremente, tanto las propiedades del suelo como las producciones agrícolas sin afectar al medio ambiente.
Tomando en consideración la importancia de describir y caracterizar cualquier suelo con un uso agrícola, se efectuó la presente investigación con el objetivo de realizar la descripción del perfil de un suelo y determinar algunas de sus propiedades físicas, químicas y microbiológicas.
MATERIALES Y MÉTODOS
Para realizar la caracterización de algunas propiedades físicas, químicas y microbiológicas se seleccionó un suelo de la finca “El Mamey”, ubicada a 800 m al sur de la carretera Panamericana, en la localidad de Yaviza, distrito de Pinogama, provincia de Darién, República de Panamá. Este suelo estaba cubierto de pastos naturales, fue sometido a fuego y estaba bajo laboreo agrícola para con posterioridad realizar la siembra de cultivos anuales.
Se procedió al examen visual del terreno y con auxilio de palas, se procedió a la apertura de una calicata, aproximadamente al centro del terreno y en la parte media de la pendiente. Las dimensiones de la cala fueron de 1 m por 1 m de largo y ancho y 1,12 m de profundidad. Una vez realizada la apertura, se procedió a describir el suelo 4 y se establecieron los colores, según la Tabla Munsell 5. La clasificación del suelo se realizó siguiendo lo indicado en la Clasificación de Suelos de Cuba 2015 6, el World Reference Base 7 y la Soil Taxonomy 8.
Con posterioridad se tomaron muestras por triplicado en la profundidad del perfil para determinar la humedad natural, por el método gravimétrico y densidad aparente, por el método de los cilindros cortantes 9. También se tomaron muestras por triplicado de aproximadamente 500 g de cada horizonte que se trasladaron hasta el Instituto de Investigaciones Agropecuarias de Panamá (IDIAP), para realizarles análisis de algunas propiedades físicas y químicas. La evaluación de los resultados se realizó en función de los métodos analíticos empleados.
Las variables evaluadas y los métodos de determinación ejecutados en el IDIAP fueron: textura, por el método de Bouyoucos, pH en agua en una relación 1:2,5 por potenciometría. Los porcentajes de C y de la materia orgánica (MO) por Walkley-Black. El contenido de N se calculó a partir de multiplicar el porcentaje de la MO por 0,05. Las reservas de carbono orgánico del suelo se calcularon por la siguiente ecuación 10:
donde:
COS= carbono orgánico total en el suelo por superficie (Mg C ha-1)
CO= carbono orgánico total (%)
Da = densidad aparente (Mg m-1)
m = profundidad del suelo (cm)
La extracción de P, K, Mn, Fe, Zn y Cu se realizó por medio de la solución extractora de Mehlich-1 y determinados por medio de absorción atómica. Para la extracción de Ca, Mg y Al fue utilizado cloruro de potasio 1N, el Ca y Mg se determinaron por medio de absorción atómica y el Al mediante titulación con NaOH 0,01 N 11.
Las relaciones internutrientes se establecieron por cálculo a partir de los contenidos de los mismos en la solución del suelo. El porcentaje de saturación por bases se calculó a partir de la Capacidad de Intercambio de bases dividida por la Capacidad de Intercambio Catiónica y multiplicado por 100. La Capacidad de Intercambio Catiónico efectiva (CICe) se calculó a partir de la sumatoria de los cationes y de la acidez cambiable. El porcentaje de saturación por aluminio se calculó a partir del aluminio existente en el suelo dividido por la CICe 12.
Para realizar el análisis microbiológico del suelo se realizó un muestreo simple aleatorio en todo el terreno, tomando 14 muestras conformadas por cinco submuestras cada una, en la profundidad de 0-20 cm. Después de la correspondiente identificación, fueron congeladas a -18 ºC y con posterioridad fueron trasladadas en una nevera portátil para su procesamiento en el Instituto de Investigaciones Científicas y Servicios de Alta Tecnología (INDICASAT).
Se realizó la extracción de ADN genómico total (ADNg) de las muestras de suelo, utilizando el juego de reactivos DNeasy PowerSoil Pro (QIAGEN, Hilden, Germany), siguiendo el protocolo del fabricante. Para la construcción de bibliotecas de ADN, se realizaron dos tipos de amplificaciones diferentes para cada muestra usando dos combinaciones de cebadores, una para bacterias y arqueas y otra para hongos. En todos los casos las PCR (Reacción en Cadena de la Polimerasa) se hicieron por triplicado en termociclador.
Para el estudio de las bacterias y arqueas presentes en el suelo se utilizaron los cebadores 515F (GTGCCAGCMGCCGCGGTAA) y 806R (GGACTACHVGGGTWTCTAAT) que amplifican la región V4 del ADN ribosomal menor o 16S. Mientras que para el estudio de las comunidades de hongos se emplearon los cebadores ITS1F (CTTGGTCATTTAGAGGAAGTAA) e ITS4A (CGCCGTTACTGGGGCAATCCCTG) que amplifican la región del ADN ribosomal ITS (Espaciadores Internos de Transcripción). Los cebadores contenían adaptadores para la plataforma de secuenciación Illumina MiSeq 13.
Ambas PCR se ejecutaron bajo las siguientes condiciones: 3 min a 94 °C, 35 ciclos de 45 s a 94 °C, 1 min a 50 °C y 90 s a 72 °C, seguido por una elongación final de 10 min a 72 °C. En todos los casos las mezclas de reacción contenían 1x PCR Buffer, 700 μM de MgCl2, 400 μM de cada dNTP, 500 μM de los cebadores, 0,45x solución Q, 2U de taq ADN polimerasa (QIAGEN) y 10-30 ng de ADNg en 25μL. Los productos de las PCR fueron visualizados mediante electroforesis en geles de agarosa (1,5 %) utilizando como revelador el RedGel y se usó solución amortiguadora de corrida TAE 1x (Tris 40 mmol L-1 (pH 7,8), ácido acético y EDTA). Las corridas se realizaron a 80 voltios por 40 minutos en equipo de electroforesis horizontal. Para corroborar la presencia de los amplicones correctos se utilizó el marcador de peso molecular 1kb plus DNA Ladder (Invitrogen).
Posteriormente se realizó una segunda PCR en todos los casos para adicionar índices (SA5F y SA7R) a las secuencias 13. Las condiciones utilizadas fueron: 3 min a 94 °C, 6 ciclos de 45 s a 94 °C, 1 min a 50 °C y 90 s a 72 °C, seguido por una elongación final de 10 min a 72 °C. Las mezclas de reacción contenían 1x PCR Buffer, 1,5 mM de MgCl2, 800 μM de cada dNTP, 200 nM de los índices, 1,25 U de taq ADN polimerasa (QIAGEN) y 2 μL del pool de PCR1 en 25 μL. Una vez comprobada la presencia de los amplicones correctos realizando electroforesis según se describió previamente, se procedió a la purificación de la biblioteca de ADN con el juego de reactivos SequalPrep™ Normalization Plate, según instrucciones del fabricante. La concentración de ADN se cuantificó usando el juego de reactivos Qubit® dsDNA BR Assay (Life Technologies), obteniéndose una concentración aproximada de 10 ng/μl. Para determinar el tamaño, la pureza y la concentración de la biblioteca obtenida se utilizó un Bioanalizador (Agilent 2100 Bioanalyzer). Por último, las muestras fueron mezcladas en cantidades equimolares y secuenciadas en la plataforma Illumina MiSeq 13.
Las secuencias obtenidas se sometieron a análisis bioinformático de acuerdo a lo descrito previamente 13, para lo cual se definió una similitud entre las mismas del 97 % y se utilizó el paquete QIIME. A los OTU (unidades taxonómicas operacionales) se les asignó una identidad taxonómica al confrontar secuencias representativas de cada uno contra la base de datos del NCBI (Centro Nacional para la Información Biotecnológica de los Estados Unidos) mediante el BLAST. Las identidades obtenidas se utilizaron para determinar la distribución de las secuencias entre los principales filos de bacterias, arqueas y de hongos.
RESULTADOS Y DISCUSIÓN
Descripción del perfil de suelo (Tabla 1)
Clasificación
Cuba: Gleysol Vértico crómico sin carbonatos 6. WRB 2014: Gleysol vértico, éutrico 7. Soil Taxonomy: Vertic Endoaquept 8
Diagnósticos
Procesos de formación: Vertisolización y Gleyzación. Horizonte diagnóstico: Horizonte vértico. Características de diagnóstico: Propiedades gléyicas a menos de 50 cm de profundidad y propiedades vérticas
Localización
Ubicación: En Yaviza, al sur de la Carretera Panamericana. Municipio: Pinogana. Provincia: Darién. País: Panamá
Altura (m s.n.m.): 31 m. Coordenadas geográficas: Lat N 8,203 Long W -77,74
Factores de formación
1. Forma del terreno: alomado
1.1 Posición fisiográfica del lugar (posición dentro del relieve): mitad de la pendiente
1.2 Topografía del terreno circundante (a 1 km del lugar de la calicata): alomado
2. Pendiente donde se toma el perfil: ≈7°
3. Vegetación o uso de la tierra: en preparación (laboreo), antes pasto natural (Paspalum virgatum L.) que fue quemado con fuego.
4. Clima: Tropical subhúmedo (Aw)
5. Material de origen: sedimentario
6. Tiempo: Cuaternario
7. Drenaje interno: malo
8. Drenaje superficial: regular
Tabla 1 Descripción del perfil del suelo y horizontes identificados
| Horizonte | Profundidad (cm) | Descripción |
|---|---|---|
| A1(v) | 0-22 | Textura arcillosa de color 2,5Y5/1 gris amarillento, estructura de bloques prismáticos, buena, consistente, húmedo. Presencia de caras de deslizamiento. Raíces abundantes. No hay piedras u otras inclusiones. Presencia de hormigas y arañas pequeñas. Sin reacción al ácido. Transición gradual. Presencia de grietas que se extienden en la profundidad de los demás horizontes. |
| A2(v) | 22-36 | Textura arcillosa de color 2,5Y5/4 gris amarillento, estructura de bloques prismáticos, buena, consistente, húmedo. Presencia de caras de deslizamiento. Abundantes raíces y hormigas, sin reacción al ácido, transición brusca. |
| C1g | 36-59 | Textura arcillosa de color 2,5Y7/6 amarillento, estructura poliédrica media, masiva, húmeda, consistente. Presencia de caras de deslizamiento. Presencia de raíces finas, manchas de color 2,5Y7/1 gris claro, sin reacción al ácido. Transición gradual. |
| C2g | 59-112 | Textura arcillosa de color 5Y7/6 amarillo, estructura poliédrica grande, masiva, consistente, húmedo. Presencia de caras de deslizamiento. Presencia de algunas raíces muy finas, manchas de color N7/0 blanco grisáceo sin reacción al ácido. |
El tipo de arcilla predominante, identificada por observación visual, es el grupo 2:1, grupo de la montmorillonita. Las características que permitieron identificar la presencia de la arcilla fue la estructura de bloques 14, la alta retención de humedad, la elevada plasticidad, la presencia de caras de deslizamiento y la presencia de grietas en todo el terreno, producto de la contracción que de forma natural se presenta en estas arcillas en el período poco lluvioso 15. Este tipo de arcilla tiene una alta retención de humedad, que se manifiesta por las propiedades gléyicas detectadas a menos de 50 cm de profundidad, por lo que se puede considerar al mal drenaje interno y a la alta retención de humedad, como posibles factores limitantes de la producción.
Estudio de algunas propiedades físicas y químicas
En la Tabla 2 se presentan los principales resultados analíticos realizados al perfil de suelo. Al analizar la composición mecánica se observó un aumento del contenido de arcilla con la profundidad del perfil, transitando la clasificación textural de franco arcilloso a arcilloso.
Tabla 2 Algunas propiedades físicas, composición mecánica, materia orgánica y reservas de carbono orgánico del suelo de los cuatro horizontes identificados en el perfil
| Horizonte/Profundidad (cm) | Arena (%) | Limo | Arcilla | Clasificación textural | HN (%) | Da (Mg kg-3) | MO (%) | N | C | COS |
|---|---|---|---|---|---|---|---|---|---|---|
| (Mg C ha-1) | ||||||||||
| A1(v)/0-22 | 36 | 28 | 36 | Franco arcilloso | 34,35 | 0,90 | 1,14 | 0,06 | 0,66 | 13,14 |
| A2(v)/22-36 | 32 | 24 | 44 | Arcilloso | 37,22 | 1,12 | 0,21 | 0,01 | 0,12 | 1,92 |
| C1g/36-59 | 20 | 24 | 56 | Arcilloso | 43,69 | 0,98 | 0,04 | 0,00 | 0,02 | 0,52 |
| C2g/59-112 | 8 | 20 | 72 | Arcilloso | 38,35 | 1,01 | 0,00 | |||
HN: humedad natural. Da: densidad aparente. MO: materia orgánica. COS: reservas de carbono orgánico
Respecto a este resultado, durante el proceso de gleyzación se produce un cambio muy fuerte en la composición y en las propiedades de la parte mineral del suelo, pues es afectada por diferentes transformaciones complejas, se realiza la destrucción de los minerales primarios y secundarios y al mismo tiempo ocurre la síntesis de minerales secundarios de neoformación (arcillas); o sea, durante el proceso de gleyzación, hay formación de arcillas; por eso, en la mayoría de los casos, el horizonte gleyzado tiene una composición mecánica más arcillosa que los que no lo son 16.
La humedad natural osciló entre 34 y 43 %, lo que es un rango adecuado, si se toma en cuenta que los muestreos se realizaron al final del período poco lluvioso. Esta elevada humedad está en correspondencia con el tipo de suelo (Gleysol vértico), con presencia de arcillas del grupo de la montmorillonita, con una alta retención de humedad 14.
La densidad aparente fue baja a lo largo de todo el perfil, por lo que se puede plantear que el suelo no presentaba compactación. Este resultado se corresponde con la presencia de pastos naturales. La cantidad de raíces de plantas como Paspalum virgatum y la profundidad a la que llegan durante su crecimiento, provocan una buena agregación del suelo, porosidad y baja densidad aparente, lo cual crea excelentes condiciones físicas para el desarrollo de los cultivos 17. La densidad aparente y el crecimiento de las raíces tienen una correlación alta y positiva 18; o sea, con una densidad aparente baja no hay impedimento del crecimiento de raíces en el perfil, aspecto que fue observado en la descripción de este perfil de suelo, en el que se encontró presencia de raíces incluso en la mayor profundidad (59-112 cm). Además, los suelos con cobertura de vegetación o aquellos que no han sido sometidos a altas presiones de laboreo tienen bajos los valores de densidad de volumen o densidad aparente 19.
Los valores de materia orgánica y los porcentajes de C y N fueron bajos en todo el perfil. El porcentaje de C en el primer horizonte es inferior al reportado anteriormente 19, por debajo del cual se considera que el suelo está degradado. Es posible que estos bajos valores se deban a que antes de la toma de muestras, el lugar fue quemado con fuego y posteriormente se comenzaron las labores de aradura para efectuar el laboreo del suelo y se ha demostrado que las labores de quema y aradura convencional del suelo con inversión del prisma, tienden a disminuir los contenidos de materia orgánica y las reservas de carbono en el perfil 10.
El fuego cambia la dinámica del ciclo del C en el suelo, alterando propiedades físicas, químicas y biológicas, de esa manera, disminuyen los contenidos y la composición de la materia orgánica y la disponibilidad de N y P, al menos en los primeros meses posteriores al fuego 20.
En la Tabla 3 se observan las variables químicas evaluadas en el perfil de suelo. El pH se clasificó como ácido en todo el perfil, excepto en la profundidad de 22-36 cm que se clasificó como ligeramente ácido. Los contenidos de Ca y Mg fueron altos en toda la profundidad, mientras que el P fue bajo. Sin embargo, el K fue medio en las profundidades de 0-22 cm y 36-59 cm, mientras que en las otras fue bajo. El porcentaje de saturación por bases fue alto en todo el perfil y la capacidad de intercambio catiónica efectiva fue alta en las profundidades de 0-22 cm y 59-112 cm y medio en las restantes.
Tabla 3 Principales propiedades químicas de los cuatro horizontes identificados en el perfil
| Horizonte/Profundidad | pH | Ca | Mg | K | P | Saturación de bases | CICe |
|---|---|---|---|---|---|---|---|
| (cm) | (H2O) | (cmolc kg-1) | (mg L-1) | (%) | (cmolc kg-1) | ||
| A1(v)/0-22 | 5,90 | 34,00 | 6,50 | 61,30 | 1,00 | 99,75 | 40,76 |
| A2(v)/22-36 | 6,30 | 27,90 | 7,40 | 38,20 | 1,00 | 99,72 | 35,50 |
| C1g/36-59 | 5,40 | 22,40 | 9,50 | 46,60 | 0,00 | 92,49 | 34,62 |
| C2g/59-112 | 5,80 | 37,20 | 17,20 | 30,60 | 0,00 | 98,73 | 55,18 |
CICe: Capacidad de intercambio catiónico efectiva
Es de destacar que los valores de pH se encontraban en el rango aceptable para la mayoría de los cultivos (entre 5,6 y 8,4). En este contexto, la evaluación del pH del suelo suele ser crucial, pues se asocia a la disponibilidad de nutrientes para las plantas y a la toxicidad por aluminio en la solución del suelo 19. En otros estudios de caracterización de suelos se ha planteado que los suelos ácidos presentan contenidos de bases intercambiables medios a bajos, P aprovechable bajo, saturación de Al de media a alta y CIC media y, generalmente, suelen tener limitada la solubilidad del Ca, Mg y K 18; sin embargo, en la Finca “El Mamey” no ocurrió este comportamiento. Es posible que la elevada disponibilidad de Ca y Mg se deba a los procesos y factores de formación que han incidido en esta área. Es conocido que las arcillas 2:1, grupo de la montmorillonita producen capacidad de intercambio catiónico alta, lo cual está de acuerdo con los resultados del análisis químico hecho para este suelo, notándose un alto contenido de cationes intercambiables y, además, es elevado el porcentaje de saturación por bases 15,21,22.
En la Tabla 4 se observan las relaciones internutrientes calculadas para los diferentes horizontes identificados en el perfil de suelo. La relación Ca/Mg fue normal en todas las profundidades; sin embargo, las relaciones Ca/K; (Ca+Mg)/K; K/Mg y Mg/K estuvieron fuera de rango. Por su parte, la relación K/CICe fue baja, pero las relaciones Mg/CICe y Ca/CICe fueron altas. Esto quiere decir que, aunque la absorción de Ca y Mg por las plantas en este suelo debe ser adecuada, estos elementos deben estar bloqueando la absorción de K y, a su vez, este último elemento no debe ser predominante en la solución del suelo.
Tabla 4 Relaciones internutrientes de los cuatro horizontes identificados en el perfil
| Horizonte/Profundidad (cm) | Ca/Mg | Ca/K | (Ca+Mg)/K | K/Mg | Mg/K | K/CICe | Mg/CICe | Ca/CICe |
|---|---|---|---|---|---|---|---|---|
| A1(v)/0-22 | 5,23 | 216,56 | 257,96 | 0,02 | 41,40 | 0,39 | 15,95 | 83,42 |
| A2(v)/22-36 | 3,77 | 284,69 | 360,20 | 0,01 | 75,51 | 0,28 | 20,85 | 78,60 |
| C1g/36-59 | 2,36 | 188,24 | 268,07 | 0,01 | 79,83 | 0,34 | 27,44 | 64,70 |
| C2g/59-112 | 2,16 | 476,92 | 679,44 | 0,00 | 220,51 | 0,14 | 31,17 | 67,42 |
CICe: Capacidad de intercambio catiónico efectiva
Este comportamiento indica que no se está cumpliendo la ley del equilibrio internutrientes en el suelo y que se hace necesario corregir este desequilibrio si se quiere lograr una adecuada nutrición de las plantas. Además, se manifiesta el predominio de los cationes Ca2+ y Mg 2+ en el complejo de cambio, lo cual es común en suelos con arcilla montmorillonita 21,23.
En la Tabla 5 se presentan la concentración de microelementos y Al cambiables presentes en el perfil del suelo. Las concentraciones de Mn y Zn fueron medias en el primer horizonte y bajas en el resto. El Fe fue bajo en todo el horizonte y el Cu bajo en la primera profundidad y media en el resto. El contenido de Al cambiable fue bajo desde 0 a 36 cm de profundidad, alto de 36 a 59 cm y medio desde los 59 y hasta los 112 cm. La saturación al Al fue baja en todo el perfil.
Tabla 5 Concentración de micronutrientes y aluminio cambiable de los cuatro horizontes identificados en el perfil
| Horizonte/Profundidad | Mn | Fe | Zn | Cu | Al | Saturación al Al |
|---|---|---|---|---|---|---|
| (cm) | (mg L-1) | (cmolc kg-1) | (%) | |||
| A1(v)/0-22 | 37,20 | 14,20 | 7,00 | 1,90 | 0,10 | 0,25 |
| A2(v)/22-36 | 7,70 | 7,80 | 1,70 | 2,10 | 0,10 | 0,28 |
| C1g/36-59 | 7,50 | 11,40 | 1,20 | 3,20 | 2,60 | 7,51 |
| C2g/59-112 | 6,70 | 13,40 | 1,00 | 2,70 | 0,70 | 1,27 |
Es importante señalar que las concentraciones naturales de microelementos en el suelo dependen, fundamentalmente, del material de origen, los procesos de formación y la composición y proporción de los componentes en la fase sólida. Otros factores son el porcentaje y tipo de arcilla, contenido de materia orgánica y propiedades físico-químicas 24.
Coincidiendo con estos autores se ha planteado que en suelos con capacidad de intercambio catiónico elevada y con presencia de arcillas del grupo de la montmorillonita, es mayor la cantidad de los microelementos Fe, Zn y Cu, que pueden estar presentes en el suelo 14.
Además, el pH ha sido una de las propiedades del suelo más estudiadas, en relación con la disponibilidad de microelementos, encontrándose que las concentraciones aumentan, a medida que el pH se hace más ácido 23,25. Otro factor que pudo incidir en encontrar estos niveles de microelementos fue la quema del terreno antes de la toma de las muestras de suelo, pues se ha demostrado que el fuego aumenta la disponibilidad de micronutrientes en el suelo 20.
A pesar de lo anterior, se puede considerar que las concentraciones de los microelementos y el Al encontrados en el suelo no representan niveles de fitotoxicidad para los cultivos a establecerse; no obstante, es necesario mantener un monitoreo de los mismos, cuidando que no se incrementen sus concentraciones hasta niveles por encima de los permisibles a nivel internacional.
Propiedades microbiológicas
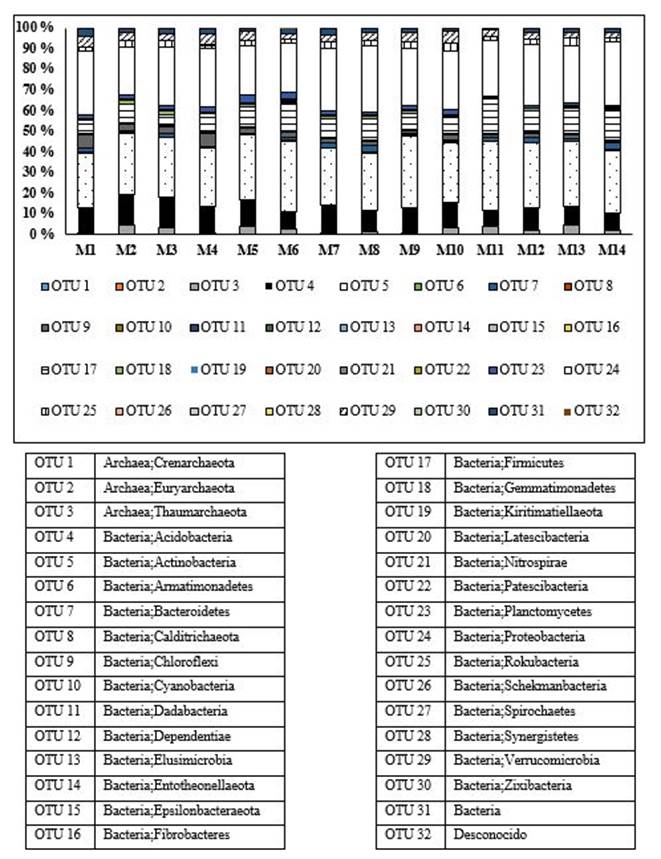
En la Figura 1 se observa la abundancia relativa de filos de Bacterias y Arqueas encontradas en el suelo de la finca “El Mamey”. Los más abundantes fueron los filos Actinobacteria, Proteobacteria, Firmicutes y Acidobacteria, todos del dominio Bacteria. Los demás filos encontrados de los dominios Bacteria y Arquea presentaron una abundancia relativa menor.
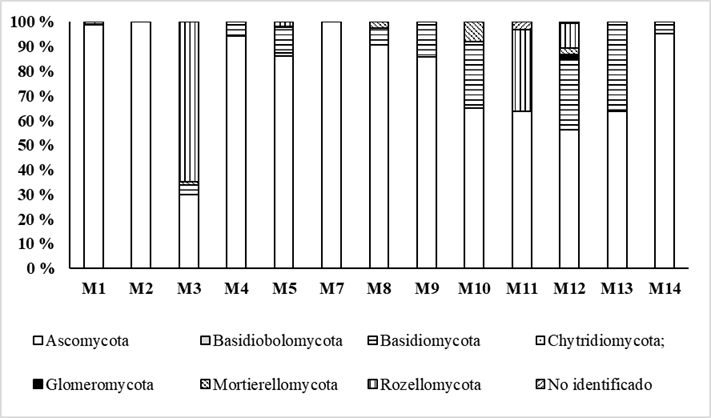
En la Figura 2 se observa la abundancia relativa de filos de hongos encontrados en los primeros 20 cm del suelo de la finca en estudio. En todas las muestras se observó el predominio del filo Ascomycota, seguido de Basidiomycota y Rozellomycota.
Respecto a este resultado, aunque los estudios de metagenómica revelan la enorme diversidad de microorganismos en el suelo y la heterogeneidad de su distribución, la mayoría de las secuencias encontradas pertenecen a unos pocos filos dominantes, encontrándose un gran número de filos con cantidades muy bajas de secuencias, ya fueran de los dominios Bacterias y Arqueas o el Reino Hongos. Es de destacar; además, la gran diversidad de filos de Bacterias encontrados respecto a la de los hongos y la baja abundancia relativa del filo Glomeromycota.
En particular, los cebadores utilizados para estudiar las bacterias y arqueas fueron diseñados y empleados satisfactoriamente para trabajos realizados con muestras de diferente procedencia, como heces, suelo, agua, sedimento marino, entre otros, en las que se constató la presencia de una elevada diversidad, tanto ( como ( de órdenes y géneros de los grupos pesquisados 13,26.
En cambio, el análisis de las poblaciones de hongos presentes en los suelos es más complicado. Varios estudios han reportado diferencias en los resultados en cuanto a la proporción de los distintos grupos fúngicos, a nivel de filo, orden, género y especie, dependientes del uso de diversas combinaciones de cebadores e incluso a la región secuenciada 27-30.
De hecho, se ha señalado que el cebador usado aquí para su estudio ITS4A amplifica preferencialmente los ascomicetos 31,32, lo cual concuerda con los resultados, siendo el grupo más abundante. Otro ejemplo lo constituye el estudio realizado en fincas de olivo (Olea europeae L.) con el uso de cebadores que amplifican hongos Glomeromycota, donde contradictoriamente se reportó un 89,8 % de secuencias pertenecientes a organismos de naturaleza no fúngica 33.
Respecto a las variaciones de las poblaciones de microorganismos entre las muestras, estas dependen directamente de la disponibilidad de nutrientes en el suelo, que emplean como sustrato y esta disponibilidad no suele ser uniforme en el espacio ni en el tiempo. La diversidad de plantas aumenta la diversidad taxonómica y funcional de la comunidad de microorganismos del suelo. Esto se debe a que diferentes plantas generan diferentes residuos orgánicos, lo que resulta en una base alimentaria diversificada 34. En este caso, aunque anteriormente el suelo estaba cubierto de una especie de pasto, esta no era la única planta presente en el sitio antes del fuego y la posterior preparación del terreno.
En relación a este tipo de manejo, fuego antes de la preparación del terreno, otros autores ya han señalado que el fuego tiene influencia directa e indirecta, a corto y largo plazo, sobre la biomasa de los microorganismos del suelo y sus servicios ecosistémicos. La afectación directa se debe a que las altas temperaturas causan mortalidad y las afectaciones indirectas están relacionadas en los cambios en las propiedades del suelo: calidad del sustrato, concentración de nutrientes y humedad del mismo. Respecto a las poblaciones fúngicas, el fuego estimula las poblaciones de hongos del filo Ascomycota y disminuye hasta en un 14 % la riqueza de especies de HMA 20.
No obstante, los resultados de este trabajo, es necesario señalar que la abundancia relativa es una categoría de la diversidad de especies y pretende incluir la riqueza de especies y la uniformidad de su distribución en una expresión sencilla y que la mayor abundancia de morfotipos y géneros corresponde a estudios realizados en ecosistemas naturales, lo cual indica mayor diversidad de microorganismos en comparación con los agroecosistemas 34,35.
Al respecto, las comunidades microbianas de bosques protegidos son diferentes de los parches de monte adyacentes a los campos productivos y estos microbiomas se van modificando a lo largo de los años de uso agrícola. Esta modificación no ocurre a nivel de una pérdida de diversidad, sino a través de la modificación de las abundancias relativas de varios grupos microbianos, especialmente los menos numerosos 3.
Sin embargo, a pesar de la cantidad de información que generan las metodologías de secuenciación masiva de ADN, para entender el funcionamiento y la dinámica de los sistemas microbianos, las técnicas nuevas se deben complementar con otras determinaciones físico-químicas más tradicionales y con técnicas microbiológicas que sirven para evaluar los cambios funcionales para entender el comportamiento de la comunidad microbiana en relación a los factores bióticos y abióticos de su ambiente 3.
CONCLUSIONES
Los resultados indican que es un suelo conservado, en el que las principales limitantes para su uso agrícola son la alta retención de humedad, el bajo contenido de materia orgánica y el desequilibrio en casi todas las relaciones internutrientes evaluadas.
Es posible proceder a realizar las labores agrícolas, siempre y cuando se realicen las correcciones necesarias para lograr la adecuada nutrición de las plantas.
Es necesario continuar el chequeo en el tiempo de las propiedades estudiadas, debido a que el mantenimiento de las propiedades físicas, químicas y biológicas de un suelo, son aspectos relevantes para evitar la degradación y la erosión del mismo, al ser transformado de un área bajo pastoreo a un área destinada a cultivos agrícolas.











 texto en
texto en