INTRODUCCIÓN
La zanahoria (Daucus carota L.) es la especie comercial más difundida de la familia Umbelliferae y uno de los cultivos hortícolas de raíz más extendidos a nivel mundial, con grandes valores económicos 1. En los últimos 30 años, la tasa de crecimiento de su consumo supera la tasa de crecimiento de la población a escala global. China es el principal país productor con alrededor de 16 800 000 toneladas, seguido por Rusia (1 565 032 t), Estados Unidos (1 346 080 t), Uzbekistán (1 300 000 t) y Ucrania (915 900 t), comercializada la mayor parte en forma fresca 2. El rendimiento promedio mundial es de 22,4 t ha-1, destacándose países como Holanda, España, Inglaterra y EEUU con valores entre 40 y 50 t ha-1 (3.
En Cuba se alcanzan de 30 a 40 t ha-1, dependiendo de la variedad y las condiciones de producción; siendo una de las hortalizas de mayor demanda en cualquier época del año, por sus excelentes cualidades gustativas, la posibilidad de consumirse en estado fresco o en conserva y a su relativo aporte en vitaminas y minerales 4.
Su cultivo en el país se extiende, fundamentalmente, a condiciones de organopónicos y huertos intensivos bajo tecnologías de producción sostenibles (mínimo uso de agroquímicos), dependientes de altos volúmenes de materia orgánica no siempre disponible, lo cual limita la fertilidad de los sustratos y la eficiencia biológica de las plantas. Por ello, se implementa el uso de bioestimulantes y biofertilizantes que permiten al cultivo superar las situaciones de estrés en las condiciones adversas del medio y maximizar sus potencialidades productivas intrínsecas para elevar los rendimientos (5).
En este sentido, los bioestimulantes QuitoMax® (mezcla de polímeros de quitosano) y PectiMorf® (mezcla de oligosacáridos pécticos u oligogalacturónidos), desarrollados por el Instituto Nacional de Ciencias Agrícolas (INCA), demuestran ser una alternativa promisoria para inducir positivamente el crecimiento y la productividad de varios cultivos, pues ejercen una influencia probada en el crecimiento vegetativo y radical, acortan y mejoran el período de floración y fructificación e incrementan los rendimientos mediante diversas formas de aplicación 6-10.
El presente trabajo tiene como objetivo evaluar el efecto de los bioestimulantes QuitoMax® y Pectimorf® en el crecimiento y la relación fuente-demanda del cultivo de la zanahoria.
MATERIALES Y MÉTODOS
La investigación se realizó en el Organopónico de la Universidad de Matanzas (23º 01ʹ 57ʺ N y -81º 30ʹ 31ʺ W, Proyección Cónica Conforme de Lambert con origen Cuba Norte), en condiciones de huerto intensivo, durante los meses de febrero a mayo de 2017. Se empleó la variedad de zanahoria “New Kuroda” con un ciclo biológico de 90 a 100 días.
Para el experimento se seleccionó un área de 180 m2, con suelo Ferralítico rojo típico 11. Se estableció un diseño de bloques al azar con tres tratamientos y tres réplicas, constituido por parcelas de 20 m2 (nueve parcelas experimentales). Se tuvo en cuenta un marco de siembra de 0,10 m entre plantas y 0,15 m entre hileras (cuatro hileras por cantero). Se evaluaron los siguientes tratamientos:
T1: control, sin aplicación de producto.
T2: aplicación foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS.
T3: aplicación foliar de 150 mg ha-1 de Pectimorf® a los 20 y 50 DDS.
Las dosis se seleccionaron teniendo en cuenta los resultados favorables obtenidos en otros cultivos con el empleo de estos bioestimulantes 12,13.
El producto QuitoMax® se caracterizó por presentar polímeros de quitosano con masa molecular promedio de 1,35 x 105 g mol-1, un grado de N-acetilación del 12 % y en concentración de 4 g L-1, mientras el PectiMorf® presentó una composición entre 55 y 61 % de ácido galacturónido y una concentración de ingrediente activo de 0,75 g L-1.
La aplicación se realizó con mochila Matabi de 16 litros de capacidad, humedeciendo todas las plantas de forma homogénea, a razón de 0,1 µL planta-1 para el QuitoMax® y 0,5 µL planta-1 para PectiMorf®.
El manejo agrotécnico se realizó teniendo en cuenta la Guía técnica para la producción del cultivo de la zanahoria 4 modificada en correspondencia con las posibilidades del área experimental y el desarrollo del cultivo, sin realizar aplicaciones de productos fertilizantes y fitosanitarios. Las necesidades hídricas del cultivo se cubrieron con el empleo de un sistema de riego microjet.
Las evaluaciones se realizaron en diferentes momentos del ciclo del cultivo (30, 50, 70 y 90 DDS) mediante muestreos destructivos, determinándose cada vez, en 10 plantas por parcelas (30 por tratamiento): altura (cm), área foliar (dm2) a partir del número de hojas activas con el empleo del software ImageJ ver. 1.51 14 y las metodologías propuestas 15,16; masa seca (g) total y por órganos (hojas y complejo tallo-raíz). Los índices de crecimiento se calcularon utilizando las expresiones que aparecen en la Tabla 1 17.
Tabla 1 Fórmulas y unidades para determinar índices de crecimiento en vegetales
| Índices de crecimiento | Símbolos | Fórmulas | Unidades |
|---|---|---|---|
| Índice de Área Foliar | IAF |
|
Adimensional |
| Tasa de Asimilación Neta | TAN |
|
g dm-2 día-1 |
| Tasa de Crecimiento del Cultivo | TCC |
|
g m-2 día-1 |
Símbolos Utilizados: W=Masa Seca Total; T=Tiempo; AF=Área Foliar; AS=Área de Suelo; LN=Logaritmo Natural
A partir de los valores de masa seca por órganos se determinó la curva de distribución de asimilados durante el ciclo del cultivo y la fuerza o potencia de fuente y demanda de la planta 18. Los datos fueron analizados en términos de planta:
Potencia de la fuente = Tamaño de la fuente (Área Foliar)*Actividad de la fuente (TAN)
Potencia de la demanda = Tamaño de la demanda (Materia Seca Raíz)*Actividad de la demanda (TRC Raíz)
En la cosecha se evaluó el largo y el diámetro de la raíz carnosa (cm), así como la masa fresca (g) y se estimó el rendimiento agrícola del cultivo (t ha-1).
Los datos se procesaron utilizando el programa Statgraphics Plus v.5.1 19, mediante un ANOVA de clasificación simple y las medias se compararon por la prueba de Rangos Múltiples de Duncan a una p≤0,05; en el análisis de las dinámicas, se estimó el error estándar de las medias.
RESULTADOS Y DISCUSIÓN
La altura de la planta no mostró diferencias significativas entre los tratamientos durante el desarrollo fenológico del cultivo (Tabla 2). Sin embargo, se apreció un incremento de esta variable en las plantas tratadas con los bioestimulantes respecto al control, a partir de los 50 DDS.
Tabla 2 Altura de la planta de zanahoria (cm) en los muestreos realizados
| Tratamientos* | Altura de la planta (cm) | |||
|---|---|---|---|---|
| 30 DDS | 50 DDS | 70 DDS | 90 DDS | |
| T1 | 23,5 ± 2,66 | 27,86 ± 2,68 | 38,89 ± 7,06 | 46,83 ± 5,36 |
| T2 | 24,27 ± 1,54 | 29,91 ± 3,71 | 42,06 ± 7,45 | 51,22 ± 5,09 |
| T3 | 25,33 ± 2,82 | 29,2 ± 4,97 | 45,06 ± 8,38 | 50,0 ± 8,02 |
* T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS ± Error estándar
Se valida por muchos autores el efecto estimulante del QuitoMax® y el PectiMorf® en el crecimiento de las plantas 20-24. Este efecto se atribuye a que las oligosacarinas funcionan como mensajeros químicos hormonales que regulan los mecanismos de crecimiento y la diferenciación en diferentes cultivos, acelerando el proceso de crecimiento de las plantas 25. Además, se refiere que pueden estimular la actividad fotosintética; por tanto, hay una mayor ganancia de esqueletos carbonados que son utilizados para la síntesis de nuevos compuestos, como las proteínas 26.
La Figura 1 muestra la eficiencia de los bioproductos en el desarrollo del área foliar del cultivo. Los mejores resultados se alcanzaron en las plantas tratadas como consecuencia de un incremento en el tamaño de las hojas, la mezcla de oligogalacturónidos causó el mayor aumento con 25 % por encima del control, pero sin diferencia con el quitosano, este último no se diferenció estadísticamente del control.
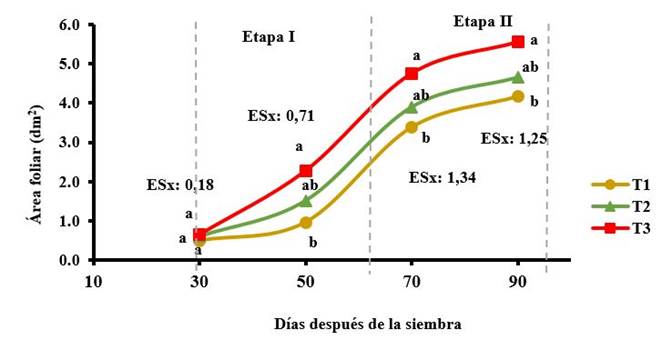 T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes en la vertical indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreo
T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes en la vertical indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreoFigura 1 Dinámica del área foliar (dm2) de la planta de zanahoria durante el ciclo de cultivo
Es característico en las plantas de zanahoria observar un crecimiento lento del follaje en la primera etapa del desarrollo vegetativo (30-60 DDS), que luego aumenta de forma constante en número de hojas entre los 61 y 97 DDS (Etapa II); después el crecimiento del follaje se desacelera (fase de desarrollo reproductivo) y hacia el final del ciclo biológico del cultivo el área foliar tiende a estabilizarse 27. Sin embargo, la aplicación de los bioestimulantes logró un incremento superior en el crecimiento del área foliar de la planta en la primera etapa, respecto a la segunda, de 26 y 13 % para la mezcla de oligogalacturónidos y el quitosano, respectivamente.
El desarrollo foliar que se aprecia con la aplicación del Pectimorf®, puede atribuirse a que este producto fue capaz de estimular el balance hormonal endógeno adecuado, para activar el incremento de la división celular en las yemas que originan las hojas y promover la síntesis de importantes sustancias que actúan en estos procesos. Aunque los mecanismos que pueden explicar con profundidad la influencia de los oligogalacturónidos en la división celular de las plantas superiores no han sido definidos 28, se ha observado que son capaces de desencadenar una serie de estímulos que aceleran el metabolismo y la actividad enzimática en las células, lo cual favorece el crecimiento y el desarrollo vegetal 29.
También puede relacionarse, al aumento de la eficiencia fotosintética de la planta, pues se ha observado que la aplicación de este bioestimulante incrementa el contenido de pigmentos fotosintéticos (clorofila a, b y totales) en las hojas 26,30,31, lo que permite una mayor captación de la radiación fotosintéticamente activa y, por tanto, un aumento en la actividad fotosintética. Otros estudios indican que el Pectimorf® puede favorecer la capacidad fotosintética en las plantas por el efecto que ejerce en la modificación de los patrones de desarrollo estomáticos 25.
Se refiere, que la incorporación de la mezcla de oligogalacturónidos en medios de cultivo in vitro y su aspersión foliar en la fase de aclimatización, aumentó el número de hojas en plántulas de banano (Musa spp., AAAB) cultivares FHIA 18 (8) y FHIA 21 32, así como el área foliar en plántulas de papaya (Carica papaya L.) cultivar Maradol Roja 33 y piña (Ananas comosus var. comosus) híbrido MD-2 34.
La segunda aplicación de los productos, aceleró el ritmo de crecimiento del follaje, lo cual tuvo una marcada influencia en la producción de asimilados en las plantas. El aumento de biomasa vegetal se realiza a partir del área foliar expandida como resultado de una mayor actividad fotosintética neta de esta, por lo que es una variable crítica para la productividad 34.
El incremento de masa seca resultó similar a los 30 DDS en todos los tratamientos (Figura 2). Se encontraron diferencias estadísticamente significativas a partir de los 50 DDS; al final del ciclo del cultivo los tratamientos con ambos bioestimulantes mostraron la mayor productividad (11,76 y 12,58 g planta-1, respectivamente) con incrementos de 45 y 55 % respecto al control (8,1 g planta-1) que en todos los momentos evaluados presentó los menores valores absolutos.
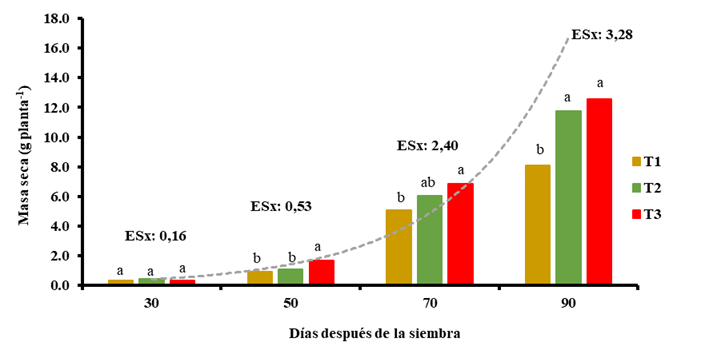 T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreo
T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreoFigura 2 Acumulación de masa seca total (hojas y complejo tallo-raíz) (g) en plantas de zanahoria en diferentes momentos del ciclo de cultivo
Las oligosacarinas favorecen la actividad fotosintética de las plantas, provocando mayor acumulación de biomasa, tanto en órganos aéreos como en las raíces. Autores previos demostraron que la aplicación foliar de PectiMorf® causa aumentos en la masa aérea y radical del rábano 35, así como una mayor productividad de biomasa acumulada en tubérculos de papa 36 y frutos de calabacita (Cucurbita pepo L.) var. ‘Grey Zucchini’ 37. También, diferentes formas de tratamiento con QuitoMax® han permitido incrementar la formación y el ensanchamiento de los estolones en papa 22, la producción de masa fresca y seca en frutos de pepino 38 y pimientos 39, así como de la parte aérea y las raíces en plantas de tabaco 24.
La determinación de los índices de crecimiento (Figura 3) permitió una mejor comprensión del proceso de crecimiento y la eficiencia fisiológica del cultivo de la zanahoria. No se encontraron diferencias significativas en los indicadores IAF y TAN en las plantas tratadas con los bioestimuladores, aunque sí evidenciaron un mejor comportamiento respecto al control no aplicado.
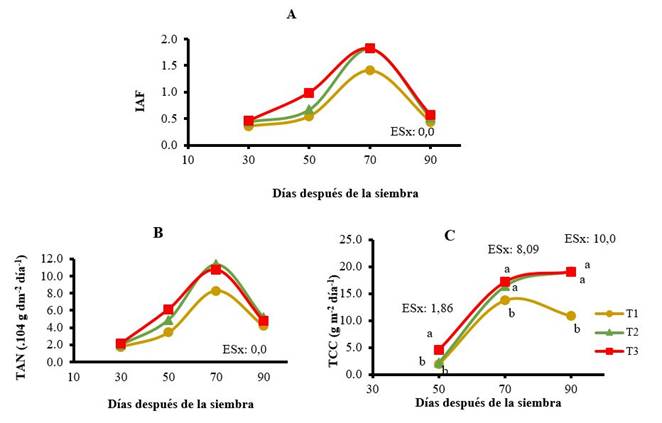 T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes en la vertical indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreo
T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes en la vertical indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreoFigura 3 Índices de crecimiento del cultivo de zanahoria: Índice de Área Foliar (A), Tasa de Asimilación Neta (B), Tasa de Crecimiento del Cultivo (C)
La tasa de crecimiento del cultivo aumentó en la medida que avanzó el ciclo del cultivo y comenzó la formación de la raíz carnosa; fue el único de los índices estudiados que presentó diferencias estadísticamente significativas. Los valores más altos coincidieron con el momento en que se presentó un aumento en el potencial de demanda (70 DDS para el control y entre 70-90 DDS con la aplicación de los bioestimulantes). La aplicación del PectiMorf® provocó los mayores valores, seguido del tratamiento con QuitoMax®, que en el primer muestreo no difiere del control. Al final del ciclo del cultivo, las plantas bioestimuladas registraron un valor máximo de 19,0 g m-2 día-1, mientras las plantas no tratadas solo alcanzaron incrementos de 10,85 g m-2 día-1 lo que demuestra un aumento del 75 % con el uso de los productos.
Los resultados apoyan la hipótesis de que los bioestimulantes favorecen la actividad fotosintética de la planta 40, aunque no se puede descartar que, además, estos productos facilitan la toma de nutrientes del suelo, algo que ha sido demostrado previamente 41. Así, el Pectimorf® por sus potencialidades como enraizador 33-42, puede favorecer la formación de raíces que posibilitan un suministro eficiente de agua y sales minerales 34 y, por tanto, un mayor desarrollo de la planta.
Se encontraron también, diferencias en los tratamientos evaluados en cuanto a los puntos máximos de acumulación de masa seca en los órganos de la planta (Figura 4).
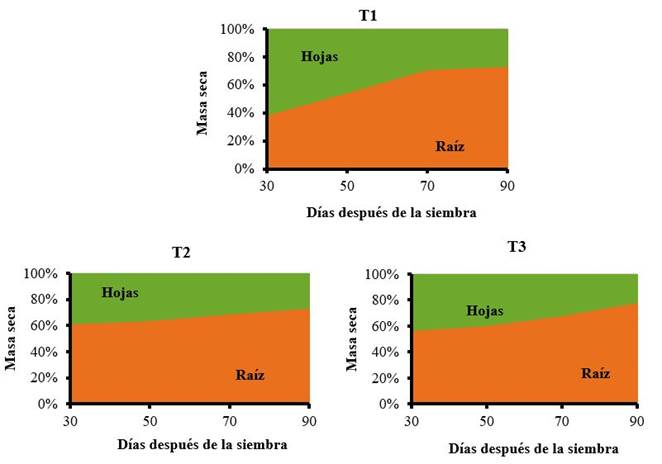 T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS
T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDSFigura 4 Dinámica del porcentaje de distribución de la masa seca por órganos (hojas y raíz) respecto al total en plantas de zanahoria
El tratamiento control presentó un comportamiento normal en la distribución de la biomasa seca. Se observó un mayor porcentaje de acumulación en las hojas, a los 30 DDS, con el 61,4 % del total. La acumulación de masa seca en la raíz resultó un proceso lento hasta ese momento, pero después comenzó a aumentar de forma constante hasta la cosecha, donde se alcanzó el 73,7 %.
Para lograr un rápido crecimiento inicial de las plantas jóvenes de zanahoria, es importante un incremento sustancial de la superficie foliar en la fase vegetativa, debido a que, por la morfología de las hojas que presentan peciolos largos y limbos segmentados, gran parte de la radiación solar incidente no es interceptada. Por lo tanto, en esta fase, una gran parte de los asimilados deben ser destinados a la formación de las hojas 43. Cuando el sistema foliar alcanza un desarrollo apropiado disminuye la partición de asimilados hacia el follaje, con el consiguiente incremento en su movilización hacia la raíz 44. Con el inicio del engrosamiento, las raíces se convierten en el principal sumidero.
Las plantas tratadas con los bioestimulantes mostraron una mayor acumulación de asimilados en la raíz (61,8 y 56,9 % para las aplicaciones de QuitoMax® y PectiMorf® respectivamente) que en las hojas (38,2 y 43,1 %) desde el primer muestreo.
La partición de asimilados entre la parte aérea y la raíz, durante el ciclo de cultivo de la zanahoria, es una expresión de la interacción entre los factores genéticos, los ambientales y los culturales 45. El comportamiento observado puede atribuirse a que la aplicación foliar de los bioproductos incrementó los niveles de hormonas tradicionales como giberelinas y ácido abscísico (ABA), sustancias que están muy relacionadas con el proceso de distribución de la masa seca en las plantas y la inducción de la tuberización 46.
La Figura 5 muestra las diferencias en el comportamiento de los potenciales fuente-demanda de las plantas en los tratamientos evaluados. En el control, el máximo potencial de las hojas como tejido fuente se obtuvo a los 70 DDS, con un valor de 0,35 g día-1; igual comportamiento presentó en este momento el potencial de demanda de la raíz con un valor de 0,38 g día-1. Este período correspondió al momento de mayor traslocación de asimilados desde las hojas hacia las raíces. Al final del ciclo para este tratamiento, disminuyeron ambos potenciales como resultado del descenso del IAF y la tasa de ganancia de peso de la raíz cerca de la cosecha.
Las plantas que recibieron aplicaciones del producto QuitoMax® alcanzaron valores superiores a los 70 DDS, con máximos potenciales de fuente y demanda para hojas y raíces, de 0,46 y 0,40 g día-1, respectivamente; hacia el final del ciclo de desarrollo del cultivo la potencia de fuente disminuyó de forma marcada, mientras la fuerza de demanda mantuvo valores altos (0,34 g día-1) lo cual indica que la raíz continuó acumulando reservas hasta el momento de la cosecha, aumentando la productividad del cultivo.
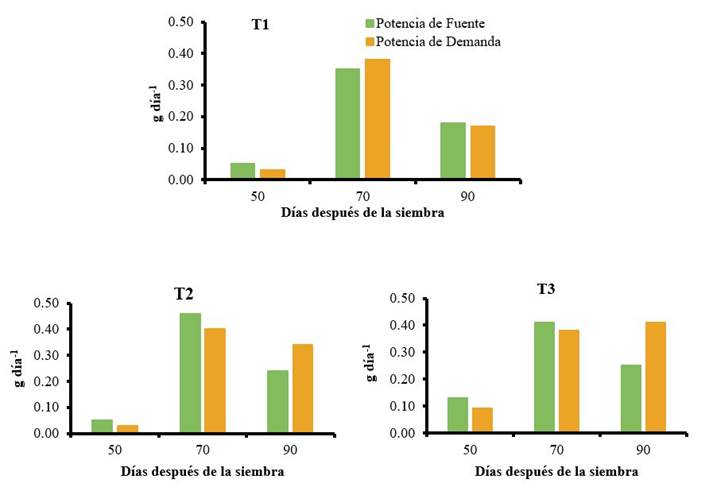 T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS
T1: control sin aplicación, T2: aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDSFigura 5 Potenciales fuente-demanda en plantas de zanahoria
Por su parte, la aplicación de PectiMorf® provocó una mayor potencia de fuente en las plantas a los 70 DDS (0,41 g día-1) y un mayor potencial de demanda de la raíz a los 90 DDS (0,41 g día-1). En este último muestreo se observó un incremento considerable de la potencia de demanda, lo cual representa, que la mayor traslocación y descarga de fotoasimilados en la raíz se llevó a cabo en este período.
La asimilación de masa seca y su distribución dentro de la planta, son procesos importantes que determinan la productividad de los cultivos 47. La producción de asimilados por las hojas y el punto hasta el cual pueden ser acumulados por el sumidero, representado en este caso por la raíz cosechada, define los rendimientos 48. Valores más elevados de los potenciales entre los órganos fuente y sumidero y en la tasa de asimilación neta (TAN), pueden traducirse en una mayor acumulación de biomasa en momentos próximos a la madurez fisiológica alcanzándose mayores rendimientos 49.
La Tabla 3 muestra los resultados obtenidos en el rendimiento y los componentes que lo determinan en el momento de la cosecha. El largo de la raíz carnosa no presentó diferencias entre los tratamientos; sí el diámetro, la masa de la raíz carnosa y, por tanto, el rendimiento que resultaron superiores en las plantas tratadas con PectiMorf® y difirieron significativamente del control y la aplicación de quitosano.
Tabla 3 Rendimiento y sus componentes en plantas de zanahoria
| Tratamientos* | Largo de raíz carnosa (cm) | Diámetro de raíz carnosa (cm) | Masa de raíz carnosa (g) | Rendimiento (t ha-1) |
|---|---|---|---|---|
| T1 | 10,14 ± 2,80 | 2,41 ± 0,36 b | 47,85 ± 8,05 b | 31,5 ± 2,10 b |
| T2 | 11,22 ± 2,53 | 2,56 ± 0,44 b | 58,60 ± 7,63 b | 38,70 ± 1,25 b |
| T3 | 11,39 ± 1,39 | 3,33 ± 0,25 a | 74,41 ± 17,46 a | 49,11 ± 3,26 a |
* T1: Control sin aplicación, T2: Aspersión foliar de 150 mg ha-1 de QuitoMax® a los 20 y 50 DDS, T3: Aspersión foliar de 150 mg ha-1 de PectiMorf® a los 20 y 50 DDS. Letras diferentes en la vertical indican diferencias significativas según prueba Duncan para p≤0,05 en análisis realizado a cada muestreo. ± Error estándar
Los bioestimulantes tuvieron un efecto positivo en el rendimiento agrícola de la zanahoria, demostrando ser efectivos en la productividad de las plantas tratadas, tomando en cuenta los incrementos respecto al control de 22 % con el QuitoMax® (aunque sin diferencias con el control) y de 56 % con el PectiMorf®. Los resultados alcanzados son superiores a los que se reportan para esta misma variedad con el empleo de biofertilizantes a base de microorganismos eficientes 50.
En la literatura no se refieren antecedentes del uso de oligosacarinas en el cultivo de la zanahoria, pero sí se ha demostrado que las aplicaciones de PectiMorf® aumentan el rendimiento en el rábano 35, el ajo 7 y la papa 9,21,36, así como la calidad de los tubérculos que se obtienen. También se ha corroborado el efecto positivo de la mezcla de oligogalacturónidos en el rendimiento de otras especies cultivables no tuberosas como frijol 13, calabaza 37 y papaya 51.
Las oligosacarinas (y productos que las contienen) han sido informadas como importantes macromoléculas bioestimuladoras de los rendimientos en diversos cultivos, con incrementos que oscilan entre 10 y 60 % por encima de los controles, en dependencia de las dosis de aplicación experimentadas, del cultivo y las localidades y suelos de que se traten 52-54.
CONCLUSIONES
El cultivo de la zanahoria responde, de forma favorable, a la aplicación foliar de los bioestimulantes, con un impacto significativo del producto PectiMorf® (T3), en el aumento del área foliar y la producción de masa seca. Las diferencias encontradas en la tasa se crecimiento del cultivo (TCC), los incrementos superiores en la tasa de asimilación neta (TAN) y las diferencias en el comportamiento de los potenciales fuente-demanda de las plantas, con la aplicación de los bioestimulantes, evidencian su efecto directo en la actividad fotosintética, la producción y distribución de fotoasimilados desde las hojas hacia las raíces en etapas tempranas del ciclo biológico.
La aplicación foliar de 150 mg ha-1 de PectiMorf® a los 30 y 50 días después de la siembra muestra una mejor respuesta productiva de las plantas y la calidad comercial de la raíz carnosa, expresado en un notable aumento de los rendimientos.











 texto en
texto en 


