My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.48 no.3 Ciudad de la Habana Setp.-Dec. 1996
Artículos Originales
Instituto de Medicina Tropical "Pedro Kourí"
Caracterización de los virus de influenza por el método de la inmunoperoxidasa utilizando anticuerpos monoclonales. Montaje y validación
RESUMEN
Se aplicó y validó por primera vez en Cuba el método de inmunoperoxidasa para la clasificación rápida en tipo y subtipo de los virus de influenza. El método está basado en un cultivo rápido en células MDCK-L y el empleo de anticuerpos monoclonales para la clasificación en tipo y subtipo. Se utiliza un pool de anticuerpos contra influenza A y otro contra la influenza B y los anticuerpos monoclonales HA1 - 71 y HA2 - 76 para el subtipaje en H1 y H3. La validación se realizó aplicándolo a 21 cepas de referencia internacional y 23 cepas de virus de influenza humana, aisladas y clasificadas previamente por inhibición de la hemaglutinación. Todas las cepas reaccionaron frente a los anticuerpos monoclonales en correspondencia con su tipo y subtipo de hemaglutinina. Fueron caracterizadas 6 cepas de referencia y 9 aislamientos dentro del subtipo H1N1; 9 cepas de referencia y 10 aislamientos en el subtipo H3N2 y 6 cepas de referencias y 4 aislamientos dentro del tipo B.No hubo reacciones inespecíficas ni cruzadas en los controles establecidos. La sensibilidad, especificidad y coincidencia fue del 100 %. La técnica resultó rápida y conveniente para la caracterización en tipo y subtipo de las cepas de virus de Influenza aisladas. Puede sustituir al método clásico de inhibición de la hemaglutinación cuando se requiere la caracterización rápida de brotes o epidemias de infecciones respiratorias agudas, lo que es de extrema importancia por ser éstas causantes de una alta morbilidad, fundamentalmente en grupos de riesgo, y por su repercusión económica.
Palabras clave: TÉCNICAS PARA INMUNOENZIMAS; ANTICUERPOS MONOCLONALES; CULTIVO DE VIRUS/métodos;PEROXIDASA; CUBA; ORTHOMYXOVIRUS HUMANO TIPO A/clasificación; ORTHOMYXOVIRUS TIPO B/clasificación.
INTRODUCCIÓN
El primer paso para la caracterización de los virus de influenza es la diferenciación en los tipos A y B y la determinación de los subtipos en el grupo A.
Este análisis se hace tradicionalmente por la técnica de inhibición de la hemaglutinación (IH), con antisueros específicos elaborados en diferentes animales.1-3 Después del aislamiento, generalmente son necesarios 1 o más pases del virus en huevos embrionados o en cultivos celulares4,5 para obtener títulos suficientemente altos, que permitan realizar la IH. Como este método es laborioso y consume bastante tiempo, muchos laboratorios posponen el subtipaje hasta después de la temporada de influenza, lo que causa una considerable demora en el reporte exacto y puntual de los datos epidemiológicos de cepas en circulación o el reconocimiento de cepas emergentes que puedan provocar nuevas epidemias.6
Para facilitar y perfeccionar el análisis de las cepas de influenza, los laboratorios necesitan métodos más rápidos y menos engorrosos en la identificación en tipo y subtipo de estos virus, aislados de muestras clínicas o después de un pase por algún sistema, de los anteriormente mencionados.
El método validado cumple los requisitos señalados. Se basa en la detección de antígenos virales en un cultivo celular rápido (24 horas) de MDCK-L infectados con virus de influenza tipo A (subtipos H1 y H3) y tipo B, por la técnica de la inmunoperoxidasa utilizando anticuerpos monoclonales. Se introduce por primera vez en nuestro país siguiendo las recomendaciones del CDC de Atlanta (Centro Colaborador de la OMS).
Los resultados obtenidos fueron satisfactorios y pueden servir de base para su empleo habitual, dada la importancia de identificar rápidamente los nuevos aislamientos o detectar cepas emergentes con características pandémicas.7,8
MÉTODOS
Células. Se utilizaron células MDCK-L5 con una concentración de 100 000 células/mL multiplicadas en medio Dulbecco´s modificado (DMEM), suplementado con 0,2 % de albúmina bovina, 5 % de suero bovino fetal (SBF), 25 mM Hepes y antibióticos (penicilina y estreptomicina).
Se prepararon placas de 96 pozos (Costar, Cambridge, Mass.) con 100 mg de la suspensión celular (10 000 células/pozo).
Virus (muestras). Cepas de referencia (tabla 1) que incluyen los tipos A y B y los subtipos H1 y H3 y 23 aislamientos previamente identificados por IH (tabla 2).
TABLA 1. Reacción de cepas patrones de influenza con diferentes tipos de hemaglutinina frente a los AcM específicos por la técnica de inmunoperoxidasa
| AcM | A(H1N1) Respuesta | A(H3N2) Respuesta | Tipo B Respuesta |
| Pool A | + | + | - |
| HA2-75 | + | + | - |
| HA1-71 | - | + | - |
| Pool B | - | - | + |
|
| A/Chile/l/83 | A/Aichit/2/86 | B/Ann Arbor/l/86 |
|
| A/Singapur/6/86 | A/Port Chalmor/1/73 | B/URSS/2/87 |
|
| A/Texas/l/86 | A/Texas/1/77 | B/Yamagata/16/88 |
|
| A/Taiwan/1/86 | A/Banghok/1/79 | B/Panarni/45/90 |
|
| A/Sinchuan/4/88 | A/Missisippi/1/85 | A/Guangdong/5/94 |
|
| A/Texas/36/91 | A/Filipinas/2/86 | B/Harbin/7/94 |
|
|
| A/Sichunn/2/87 |
|
|
|
| AABoijin/352/89 |
|
|
|
| A/Shangdong/9/93 |
|
TABLA 2. Tipificación de cepas aisladas mediante la técnica de inmunoperoxidasa e inhibición de la hemaglutinación
| Cepas aisladas caracterizadas por IH | Sueros hiperinmunes | Caracterizadas por inmunoperoxidasa | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | Pool | HA2 | HA1 | Pool | |
| A/Habana/821/92 |
|
|
|
| 80 | 320 |
|
|
| + | + | - | - |
| A/Habana/822/92 |
|
|
|
| 40 | 40 |
|
|
| + | + | - | - |
| A/Habana/823/92 |
|
|
|
|
| 80 |
|
|
| + | + | - | - |
| A/Habana/824/92 |
|
|
|
|
| 80 |
|
|
| + | + | - | - |
| A/Habana/867/92 |
|
|
|
| 160 | 80 |
|
|
| + | + | - | - |
| A/Habans/868/92 |
|
|
|
|
| 80 |
|
|
| + | + | - | - |
| A/Habana/869/92 |
|
|
|
| 160 | 80 |
|
|
| + | + | - | - |
| A/Habana/870/92 |
|
|
|
|
| 80 |
|
|
| + | + | - | - |
| A/Habana/1057/92 |
|
|
|
| 160 | 80 |
|
|
| + | + | - | - |
| A/Habana/987/92 | 80 | 160 | 160 |
|
|
|
|
|
| + | + | + | - |
| A/Habana/988/92 | 40 | 160 | 380 |
|
|
|
|
|
| + | + | + | - |
| A/Habana/989/92 | 40 | 80 | 80 | 80 |
|
|
|
|
| + | + | + | - |
| A/Habana/1056/92 |
| 80 |
| 160 |
|
|
|
|
| + | + | + | - |
| A/Habana/1058/92 | 80 | 320 | 320 |
|
|
|
|
|
| + | + | + | - |
| A/Habana/1059/92 | 40 | 160 | 80 | 160 |
|
|
|
|
| + | + | + | - |
| A/Habana/1060/92 | 80 | 320 | 160 | 80 |
|
|
|
|
| + | + | + | - |
| A/HabanA/1061/92 | 40 | 160 | 80 | 160 |
|
|
|
|
| + | + | + | - |
| A/Habana/1081/92 | 80 | 320 | 160 | 160 |
|
|
|
|
| + | + | + | - |
| A/Habana/1082/92 | 20 | 80 | 40 | 80 |
|
|
|
|
| + | + | + | - |
| B/Habana/12/94 |
|
|
|
|
|
| 640 | 40 | 20 | - | - | - | + |
| B/Habana/14/94 |
|
|
|
|
|
| 320 | 40 | 80 | - | - | - | + |
| B/Habana/40/94 |
|
|
|
|
|
| 640 | 40 | 40 | - | - | - | + |
| B/Habana/41/94 |
|
|
|
|
|
| 640 | 40 | 20 | - | - | - | + |
Sueros hiperinmunes utilizados: I. A/H3. 2. A/Habana/299/88 (H3N2). 3. A/Sichuan/2/88 (H3N2). 4. A/Beijing/353/89 (H3N2). 5. A/H1. 6. A/Taiwan/6/86 (HlNl). 7. B/Panamá/45/90. 8. B/Ann Arbor/l/86. 9. B/Victoria/2/88.
Se inocularon 4 pozuelos de cada muestra, con 20 mL cada uno y se reservaron 4 pozuelos no infectados como control negativo. Estas placas se incubaron a 37 oC en una atmósfera de CO2 al 5 %, toda la noche.
Al día siguiente se fijaron las células aspirando el medio y lavándolas 2 veces con PBS (200 mL/pozo). Consecutivamente se añadió en cada pozuelo 50 mL de PBS, 50 mL de metanol absoluto y 100 mL más de metanol absoluto. Una vez que se haya realizado la dosificación anterior en todos los pozuelos la mezcla se aspiró y se volvió a añadir 100 mL de metanol a cada pozo y se incubó la placa a temperatura ambiente durante 10 min. A continuación se lavaron las células 2 veces con PBS (200 mL/pozo).
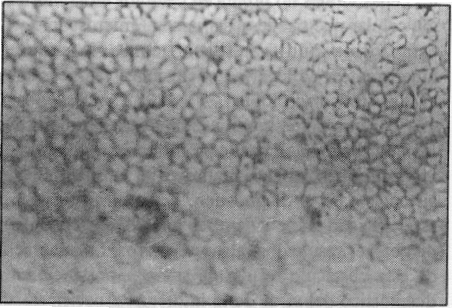
Control negativo. Cuatro pozuelos por placa no fueron infectados con virus de influenza (figura 1).
FIGURA 1. Control negativo: no se observa ninguna reacción de coloración en las células no infectadas.
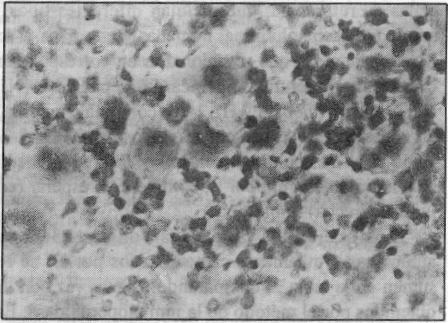
Controles positivos. Se utilizaron las cepas A/Texas/36/91 (H1N1), A/Beijin/352/89 (H3N2) y B/Panamá/45/90 (figura 2).
FIGURA 2. Control positivo (cepas de referencia y autóctonas previamente caracterizadas por IH): coloración roja intracitoplasmática en las células infectadas con virus de influenza.
Anticuerpos monoclonales (Acs M). Para la tipificación se utilizó un pool de anticuerpos contra influenza A en la dilución de 1:1 000 y otro para el B diluido 1:500. La tipificación de los subtipos H3 y H1, se realizó con los Acs M HA1-71 y HA2-76 diluidos 1:400.9,10
Las diluciones de trabajo se prepararon con una solución de leche en polvo descremada al 5 % en PBS.11,12 Estos anticuerpos fueron cedidos por el Laboratorio de Diagnóstico de Influenza del CDC de Atlanta y obtenidos por inmunización de ratones contra la nucleoproteína de virus de influenza tipo A (pool A), contra la nucleoproteína y hemaglutinina de virus del tipo B (pool B) y contra fragmentos desnaturalizados de la HA1 y HA2 del tipo A (Acs M HA1-71 y HA2-76).
Las diluciones de los Acs M se añadieron a razón de 75 mL/pozo a los pozuelos de cada muestra en el orden siguiente: pool A en el primer pozuelo,
HA1-71 en el segundo, HA2-76 en tercero y pool B en el cuarto. Igual tratamiento se le dio a los 4 pozuelos no inoculados (control negativo).
Las placas se incubaron a 37 oC en CO2 (5 %), durante 60 min. Las diluciones fueron aspiradas totalmente y se lavaron las placas 4 veces con PBS (200 mL/pozo), se incubaron con un anticuerpo antirratón conjugado con peroxidasa por 60 min en CO2 (5 %) y en una dilución de 1: 1 000 (75 mL/pozo).
El conjugado se eliminó totalmente, se lavaron las placas nuevamente con PBS (4 veces) y se añadió (60 mL/pozo) de una solución de sustrato preparado con 20 mg de 3-amino-9-ethylcarbazole (Sigma) en 5 mL de dimethylformamide y diluido en una concentración de 200 mg/mL en buffer de acetato de sodio, pH 5, la cual se conservó filtrada a -20 oC. Antes de su empleo se le adicionó 1 mL/mL de peróxido de hidrógeno (30 %). Una vez añadido el sustrato, se incubaron a temperatura ambiente por 30 a 60 min, tiempo en que se desarrolla el color de la reacción.
El sustrato fue eliminado totalmente y se lavaron 4 veces con PBS (200 mL/pozo), finalmente se añadieron 100 ìL de PBS en cada pozo y se observó al microscopio de luz invertida la coloración roja de las células donde se multiplicó el virus de influenza.
La coloración roja intracelular en los pozuelos inoculados con los aislamientos se interpreta como un resultado positivo de infección y su ausencia como negativo.
RESULTADOS
Se observó una intensa coloración citoplasmática en las células infectadas con influenza A y B frente al pool A y B, respectivamente, lo que indica la especificidad del método.
Los Acs M HA1-71 y HA2-76 toman una coloración menos intensa pero se mantiene como una clara coloración citoplasmática, viéndose a menudo una coloración perinuclear acumulada.
Los virus de influenza A que reaccionan coloreándose de forma similar frente a los Acs M HA1-71 y HA2-76, clasifican en el subtipo H3 y los que reaccionan solamente frente al HA2-76 en el subtipo H1.
El ensayo fue evaluado solamente con cepas de referencia de influenza humana. En la tabla 1 aparece la interpretación de los resultados obtenidos con las cepas de referencia, que incluían diferentes tipos y subtipos de hemaglutininas humanas, frente a los 4 Acs M utilizados, las que reaccionaron en correspondencia con su estructura antigénica: las cepas A (H1N1) con los Acs M pool A y HA2-76 (columna izquierda); las cepas A (H3N2) con el pool A; los Acs M HA2-76 y los HA1-71 (columna central) y las cepas B sólo respondieron con el pool B, como era de esperar (columna derecha) (tabla 1).
Los resultados obtenidos con las 23 cepas autóctonas previamente caracterizados por IH se resumen en la tabla 2, comparándolos a su vez con los obtenidos por el método de la inmunoperoxidasa. Estas cepas fueron tipificadas por IH frente a 9 sueros hiperinmunes. De las cepas del año 1992, 9 correspondieron al subtipo H1N1 con títulos que oscilaron entre 1/40 y 1/320, y 10 como subtipo H3N2 con títulos similares a las anteriores. Los 4 aislamientos restantes eran del año 1994, caracterizados del tipo B con títulos entre 1/20 y 1/640.
La caracterización por el método de la inmunoperoxidasa se corresponde con la clasificación anteriormente señalada, como puede observarse. Desde la cepa A/Habana/821/92 hasta la A/Habana/870/92, clasificadas anteriormente como A(H1N1) reaccionaron con los Acs M del pool A y HA2-76, al igual que la cepa A/Habana/1057/92, aislada posteriormente. Las clasificadas como A(H3N2) -desde la A/Habana/1058/92 hasta la A/Habana/1082/92- reaccionaron con los Acs M del pool A, HA2-76 y HA1-71 y las cepas del tipo B -aisladas en 1994 - reaccionaron solamente con el pool B utilizado en este trabajo.
Se obtuvo un 100 % de especificidad, sensibilidad y coincidencia, tanto con las cepas de referencia como con los aislamientos analizados.
No se detectó ninguna reacción de coloración en los cultivos no infectados (control negativo) (figura 1).
Los controles positivos y negativos establecidos en las placas funcionaron correctamente con sus correspondientes Acs M.
Todos los pozuelos fueron examinados microscópicamente. Sin embargo, la coloración con el pool A y el pool B fue tan intensa que más del 50 % podía ser identificado como positivo con la luz natural, sin necesidad del microscopio.
DISCUSIÓN
Una de las ventajas que aporta la utilización de las técnicas inmunoenzimáticas e inmunoquímicas es la posibilidad de lograr el diagnóstico causal de la entidad viral mediante la detección e identificación de antígenos virales directamente en cultivos de tejidos12,13 independientemente de la aparición o no del efecto citopatogénico (ECP). Se ha observado repetidamente que en muchas circunstancias los virus pueden ser detectados primeramente dada esta capacidad de desarrollar ECP,14 pero en otras ocasiones diferentes cepas virales no producen cambios en la morfología celular que puede observarse al microscopio y de esta forma pudieran pasar como infecciones "inaparentes" y llegar a conclusiones erróneas sobre el diagnóstico virológico.
Por otra parte, la utilización de Acs M debe evaluarse cabalmente cuando se introducen por primera vez como herramienta fundamental en determinados sistemas para el diagnóstico. Dado el alto grado de especificidad que ellos presentan existe la posibilidad de obtener resultados falsos negativos. La superación de este obstáculo resulta de suma importancia en el diagnóstico del virus de la influenza específicamente por el surgimiento de nuevas variantes antigénicas con comportamiento epidémico de estos virus.15,16
Teniendo en cuenta estos antecedentes, en este trabajo los ACS M utilizados fueron sometidos a un estudio detallado al ser enfrentados contra un número sustancial de diferentes cepas del virus de influenza humana pertenecientes a los subtipos A H1N1 A H3N2 y tipo B, de amplia circulación mundial.
De esta forma se comprobó que la especificidad de dichos Acs M fue válida para su utilización como reactivo biológico en el desarrollo de la técnica de la immunoperoxidasa con el objetivo de detectar estos virus, ya que se observó la reacción de las cepas patrones con los Acs M HA1-71 y HA2-76, lográndose la identificación de todas las cepas de origen humano pertenecientes a los subtipos H1 y H3, y quedó demostrado que estos anticuerpos son capaces de reconocer los epítopes bien conservados de la hemaglutinina de los virus de influenza A y B.17
Los resultados obtenidos en el presente estudio, al ser comparada la técnica de inmuno-peroxidasa con la técnica clásica de IH,18-21 tuvieron un comportamiento coincidente tanto para las cepas de referencia como para los aislamientos obtenidos durante el período de 1992 a 1994. La coincidencia fue válida con respecto a la sensibilidad así como para la especificidad, con la obtención de valores del 100 % entre ambas técnicas.
Existen diferentes referencias sobre la utilización de la técnica de inmunoperoxidasa para el diagnóstico de los myxovirus y paramyxovirus en cultivos de tejidos reportados por Dobardzic y otros, en 1973;22 posteriormente fue referida por Benjamin y otros, en 1976.14
Ziegler y otros,23 realizaron un extenso estudio utilizando la inmunoperoxidasa para el diagnóstico del virus de influenza en el cual incluyeron cepas de referencia aviares y porcinas además de las humanas, evaluadas todas ellas previamente por IH, se obtuvo entre ambas técnicas una coincidencia en la sensibilidad y especificidad con valores también del 100 %. Sin embargo, de las 263 muestras clínicas estudiadas por ellos, 154 contenían virus de influenza A, 84 virus de influenza B y 25 muestras fueron negativas (9,5 %), lo que atribuyeron a causas tales como: almacenamiento de las muestras por más de 5 años, se observó que a medida que los especímenes eran más recientes, la negatividad disminuía. En las muestras pertenecientes a los años 1988-1989, 12 resultaron negativas y en las correspondientes a 1992 sólo 1 fue negativa. También plantearon como posibles causas de disminución en la sensibilidad el poco volumen inoculado de cada muestra, un período corto de incubación y mala homogenización.
Investigadores como Espy y otros,24 Mills y otros25 y Wood y otros,26 empleando iguales Acs M (pool A y B) en cultivos celulares rápidos alcanzaron resultados que oscilaron entre 56 y 100 % de sensibilidad.
Además de su alta especificidad, la técnica no requiere del aislamiento viral para la caracterización y por ello reduce las múltiples operaciones asociadas a las técnicas clásicas y el gasto en recursos que éstas demandan. Es más fácil de aplicar y de interpretar dado el color rojo adquirido por las células infestadas. A estas ventajas se une la rapidez en el diagnóstico cuyo tiempo se disminuye a 24 horas, lo que no admite comparación respecto a las otras técnicas.
Las características señaladas satisfacen los requerimientos de los laboratorios de diagnóstico de los virus de influenza y elevan el control epidemiológico al permitir la caracterización inmediata durante los brotes, lo que es especialmente valioso para diferenciar los causados por cepas en circulación de los originados por cepas emergentes que puedan provocar nuevas epidemias.
Este trabajo abre la perspectiva de utilizar la técnica de inmunoperoxidasa como una herramienta importante y nueva en el Laboratorio de Referencia Nacional para el Diagnóstico de Influenza del Instituto de Medicina Tropical "Pedro Kourí" (IPK) y reforzar la capacidad de lucha contra esta enfermedad, que provoca una alta morbilidad-mortalidad, especialmente entre los grupos de riesgo, y tiene efectos económicos y sociales negativos de alta incidencia.
AGRADECIMIENTO
Los autores reconocen a la doctora Helen Regnery del CDC de Atlanta, EE.UU., el suministro de los reactivos empleados y el entrenamiento inicial para su realización. Al Laboratorio de Fotografía del IPK por la ayuda aportada.
SUMMARY
The immunoperoxidase method for the rapid classification of influenza viruses in type and subtype was applied and validated for the first time in Cuba. The method is based on a rapid culture in MDCK-L cells and on the use of monoclonal antibodies for the classification in type and subtype. A pool of antibodies against influenza A and another against influenza B and HA1-71 and HA2-76 monoclonal antibodies are used for the subtyping in H1 and H3. The validation was carried out by applying this method to 21 international reference strains and to 23 human influenza virus strains that were isolated and previously classified by hemagglutination inhibition. All the strains reacted to the monoclonal antibodies according to their hemagglutinin type and subtype. 6 reference strains and 9 isolations were characterized within the H1N1 subtype: 9 reference strains and 10 isolations in the H3N2 subtype; and 6 reference strains and 4 isolations in type B. There were neither unspecific nor crossed reactions among the controls established. There was 100 % of sensitivity, specificity and coincidence. The technique used proved to be fast and convenient for the characterization in type and subtype of the isolated influenza virus strains. It may substitute the classic hemagglutination inhibition method when it is required the rapid characterization of outbreaks or epidemics of acute respiratory infections, which is very important due to the high morbidity they cause mainly in risk groups and to their economic repercussion.
Key words: IMMUNOENZYME TECHNIQUES; ANTIBODIES, MONOCLONAL; VIRUS CULTIVATION/methods; PEROXIDASE; CUBA; ORTHOMYXOVIRUS TYPE A, HUMAN/classification; ORTHOMYXOVIRUSES TYPE B/classification.
REFERENCIAS BIBLIOGRÁFICAS
- Hierholzer JC, Suggs MT. Standaridized viral hemagglutination and hemagglutination-inhibition test: 1: standardization of erythrocyte suspension. Apppl Microbiol 1989;18:816-23.
- Palmer DF. Dowdle WR. Coleman MT, Schild GC. Advanced laboratory techniques for influenza diagnosis. Atlanta: Center for Disease Control, 1975:25-62.
- Swenson PD. Hemagglutination inhibition test for the identification of influenza viruses. En: Isenberg, HD ed. Clinical microbiology procedures handbook. Washington, Americam Society of Microbiology, DC:1992:8,11,12.
- Tobita K, Sugiura A, Enomoto C, Furuyama M. Plaque assay and primary isolation of influenza A viruses in a established line of canine kidney cells (MDCK) in the presence of trypsin. Med Microbiol Immunol 1975;162:9-14.
- Meguro H, Bryant JD, Torrence AE, Wright PF. Canine kidney cell line for isolation of respiratory viruses. J Clin Microbiol 1979;9:175-9.
- Webster RG, Laver WG. Studies on the origin of pandemic influenza: 1: antigenic analysis of A2 influenza virus isolated before and after the appearance of Hong Kong influenza using antisera to the isolated hemagglutinin subunits. Virology 1972;48:433-44.
- Walls HH, Hamon MW, Slagle JJ, Stocdsdale C, Kendal AP. Characterization and evaluation of monoclonal antibodies developed for typing influenza A and influenza B viruses. J Clin Microbiol 1986;23:240-45.
- Van Wyke KL, Yewdell JW, Reck LJ; Murphy BR. Antigenic characterization of influenza A virus matrix protein with monoclonal antibodies. J Virol 1984;49:248-52.
- St. Groth E, Scheideggers D. Production of monoclonal antibodies: strategy and tactics. J Immunol Meth 1980;35:1-21.
- Shalit I, Mac Kee PA. Beancharmp H, Wanes JL. Comparison of polyclonal antiserum versus monoclonal antibodies for rapid diagnosis of influenza A virus infections by immunofluorescence in clinical specimens. J Clin Microbiol 1985;22:877-79.
- Mills RD, Cain KJ, Woods GL. Detection of influenza virus by centrifugal inoculation of M D C K cellls and staining with monoclonal antibodies. J Clin Microbiol 1989;27:2503-8.
- Bosman FT, Nie wenhuifzen AC. Clinical application of the enzyme labeled antibody methods: immunoperoxidase methods in diagnostic histopathology. J Histochem Cytochem 1979;27:1140.
- Fink B, Loepfe E, Wyler R. Demonstration of viral antigen in cryostat sections by a new immunoperoxidase procedure eliminating endogenous peroxidase activity. J Histochem Cytochem 1979;27:686.
- Benjamin DR, Ray CG. Use of inmunoperoxidase for the rapid identification of human myxovirus and paramyxovirus in tissue culture. Appl Microbiol 1976;4:322-25.
- World Health Organization. Use of monoclonal antibodies for rapid diagnosis of respiratory viruses: memorandum from a WHO meeting. Bull WHO 1992;70:699-703.
- Ritz J, Pesando JM, Notis Mc, Conarty J, Clavell LA, Sallan SE et al. Use of monoclonal antibodies as diagnostic and therapeutic reagents in acute lymphoblastic leukemia. Cancer Res 1981;41:4771.
- Sánchez-Fauquier A, Guillen M, Martín J, Kendal AP, Melero JA. Conservation of epitopes recognized by monoclonal antibodies against the separated subunits of influenza hemagglutinin among type A viruses of the same and different subtypes. Arch Virol 1991;116:285-93.
- Waner JL, Tood SJ, Shalaby H, Murphy P, Wall L. Comparison of Directigen Flu-A with viral isolation and direct immunofluorescence for the rapid detection and identification of influenza A virus. J Clin Microbiol 1991;29:479-82.
- Spada B, Biehler K, Chegas P, Kaye J, Riepenhoff-Talty M. Comparison of rapid immunofluorescence assay to cell culture isolation for the detection of influenza A and B viruses in nasopharyngeal secretions from infants and children. J Virol Methods 1991;33:305-10.
- Buffington J, Chapman LE, Schmeltz LM, Kendal AP. Do family physicians make food sentinels for influenza. Arch Fam Med 1993;2:859-65.
- Webster RG, Kendal AP, Gerhard W. Analysis of antigenic drift in recently isolated influenza A (H1N1) viruses with monoclonal antibody preparations. Virology 1979;96:258-64.
- Dobardzic R, Boudreault A, Papilonis VL. Identification du virus de l´Influenza à l´aide de l´immunoperoxydase. Can J Microbiol 1973;19:146-9.
- Ziegler T, Hall H, Sánchez-Fauquier A, Gamble WC, Cox, NJ. Type and subtype-specific detection of influenza viruses in clinical specimens by rapid culture assay. J Clin Microbiol 1995;33(2):318-21.
- Espy MJ, Smith TE, Harmon M, Kendal AP. Rapid detection of influenza virus by shell vial assay with monoclonal antibodies. J Clin Microbiol 1986;24:677-9.
- Mills RD, Chain KJ Woods GL. Detection of influenza virus by centrifugal inoculation of M D C K cells and staining with monoclonal antibodies. J Clin Microbiol 1989;27:2505-8.
- Woods GL, Johnson AM. Rapid 24 wells plate centrifugation assay for detection of influenza A virus in clinical specimens. J Virol Methods 1989;24:35-42.
Recibido: 8 de febrero de 1996. Aprobado: 11 de junio de 1996.
Dra. Suset Oropesa Fernández. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Microbiología. Investigadora Agregada.
2 Licenciado en Bioquímica. Investigador Auxiliar.
3 Licenciada en Biología. Investigadora Auxiliar.
4 Especialista de II Grado. Investigador Titular. Responsable del Laboratorio de Virus Respiratorios.
5 Especialista de I Grado. Investigador Agregado.
6 Técnica.