Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.48 n.3 Ciudad de la Habana sep.-dic. 1996
Instituto de Medicina Tropical "Pedro Kourí"
Identificación rápida de los serotipos del virus del dengue mediante la reacción en cadena de la polimerasa
RESUMEN
Se emplearon 4 juegos de cebadores que permitieron la amplificación de una secuencia nucleotídica con talla única para cada uno de los serotipos del virus del dengue mediante la reacción en cadena de la polimerasa (RCP), con un método que consistió de extracción del ácido ribonucleico (ARN) de sobrenadante de cultivos celulares infectados, transcripción reversa - reacción en cadena de la polimerasa (TR-RCP), todo lo cual pudo ser completado en aproximadamente 7 horas, en un simple tubo. La talla de la secuencia amplificada se evidenció por electroforesis en un gel de agarosa, teñido con bromuro de etidio. El método demostró una sensibilidad de al menos 2,5 unidades formadoras de placa (ufp) por tubo de reacción, siendo útil para la detección e identificación simultánea de los 4 serotipos, a partir de sobrenadante de cultivos infectados de cepas provenientes de varios países del Caribe, América Central y del Sur.
Palabras clave: VIRUS DEL DENGUE/clasificación; SEROTIPIFICACIÓN; REACCIÓN EN CADENA POR POLIMERASA/métodos.
INTRODUCCIÓN
La fiebre del dengue (FD) y su forma severa, la fiebre hemorrágica del dengue/síndrome de choque del dengue (FHD/SCD), resultan de la infección por cualesquiera de los 4 serotipos del virus del dengue. La incidencia de la fiebre del dengue se ha incrementado en los últimos años, se estima que 80 millones de personas que viven en las regiones tropicales son afectadas anualmente; por otra parte, las formas severas se han convertido en el principal problema de salud en Asia en los últimos 20 años y emerge con un comportamiento similar en las Américas.1 La identificación y tipificación de los aislamientos virales realizados a partir de muestras clínicas o de mosquitos infectados son muy importantes para las investigaciones clínicas y epidemiológicas. El desarrollo de los anticuerpos monoclonales específicos de tipo ha perfeccionado ampliamente estas investigaciones, fundamentalmente empleando los ensayos inmunoenzimáticos.2 Aunque estos métodos son confiables y permiten obtener resultados reproducibles,3,4 el desarrollo de la reacción en cadena de la polimerasa (RCP), una técnica de amplificación del ADN in vitro, ha sido aplicado rápidamente al diagnóstico de las infecciones por los virus del dengue, esta técnicas poseen diversas ventajas sobre las técnicas inmunológicas convencionales.5,6 Nosotros aplicamos aquí la transcripción reversa-reacción en cadenade la polimerasa (TR-RCP) que resulta un método rápido y sencillo, para la detección y la identificación simultánea de los 4 serotipos de los virus del dengue.
MÉTODOS
Cepas de virus. Las cepas de los 4 serotipos de los virus del dengue utilizadas en la evaluación de la TR-RCP aparecen señaladas en la tabla 1, se indican su serotipo, país de procedencia y año del aislamiento. Cada cepa viral fue inoculada en tubos de cultivos celulares con monocapas confluentes del clon C6/36 de Aedes albopictus, crecidas en medio esencial mínimo Eagle, suplementado con 2 % de suero fetal bovino y 0,2 mM de aminoácidos no esenciales, y mantenida a 28 oC. Los sobrenadantes de los cultivos celulares infectados fueron cosechados 1 semana después de la inoculación y se conservaron a -70 oC hasta su uso. Además, se emplearon 3 cepas de otros Flavivirus (fiebre amarilla, Ilheus y San Luis) utilizados en el estudio, los que fueron procesados en forma similar a la anteriormente descrita.
TABIA 1. Cepas virales empleadas en el estudio
| Cepas | Serotipo | País | Año |
| Dl-77 | DEN1 | Cuba | 1977 |
| 28489 | DEN1 | Brasil | 1990 |
| DI-1636 JAM | DEN1 | Jamaica | 1977 |
| D1-NIC | DEN1 | Nicaragua | 1994 |
| 271 | DEN1 | Costa Rica | 1994 |
| A15 | DEN2 | Cuba | 1981 |
| 457951 | DEN2 | Panamá | 1993 |
| 818394 | DEN2 | T. Tobago | 1988 |
| 24 | DEN3 | Nicaragua | 1984 |
| NIC-30(169194) | DEN3 | Nicaragua | 1994 |
| D3 P RICO | DEN3 | Puerto Rico | 1993 |
| H241 | DEN4 | Hawaii | 1980 |
| TVP | DEN4 | Venezuela | 1975 |
| Dengue 4 Nic | DEN4 | Nicaragua | 1994 |
| ESL | ESL | Desconocido | - |
| 17D | FA | Cepa vacutial | - |
| Ilheus | HIL | Desconocido | - |
Cebadores. Los 4 juegos de cebadores fueron gentilmente donados por la doctora Eva Harris, de la Universidad de California, San Francisco; la secuencia nucleotídica así como su localización, aparecen en la tabla 2.
TABIA 2. Secuencia nucleotídica de los cebadores del virus dengue*
| Código | Secuencia | Posición |
| DIS | GGACTFGCGTATGGAGTTTG | 2229-2248 |
| DIC | ATGGGTTGTGGCCTAATCAT | 2718-2699 |
| D2S | GTTCCTCTGCAAACACTCCA | 1203-1222 |
| D2C | GTGTTATTTTGATTTCCTTG | 1432-1413 |
| D3S | GTGCTTACACAGCCCTATTT | 2253-2272 |
| D3C | TCCATTCTCCCAAGCGCCTG | 2572-2553 |
| D4S | CCATTATGGCTGTGTTGTTT | 3973-3992 |
| D4C | CTTCATCCTGCTTCACTTCT | 4370-4351 |
* Según Morita y otros.7
Extracción de ARN. La obtención del ARN viral para cada una de las cepas del virus del dengue empleadas, se realizó siguiendo el procedimiento usado por Lanciotti y otros 8 con algunas modificaciones. Se usaron 300 mL del sobrenadante de los cultivos celulares infectados y se les añadieron 300 mL de un tampón de lisis compuesto por isotiocianato de guanidina 8 M, citrato de sodio 50 mM, 2 mercaptoetanol 100 mM y Sarkosyl al 1 %. Secuencialmente fueron adicionados 60 mL de acetado de sodio 2 M (pH 4), 600 mL de fenol equilibrado con agua y 240 mL de cloroformo. Esta mezcla fue centrifugada a 12 000 rpm a 4 oC, durante 15 min, y la fase acuosa se transfirió a un nuevo tubo, se le agregó igual volumen de isopropanol y se mantuvo a 20 oC durante 3. Posteriormente se realizó una centrifugación a 12 000 rpm a 4 oC, por 20 min y el precipitado resultante fue lavado con etanol al 75 % y secado a temperatura ambiente. El material seco se resuspendió en 15 mL de agua libre de RNasas. De igual forma se procedió con los controles negativos: sobrenadante de cultivo celular no infectado y agua estéril para PCR.
Transcripción reversa y amplificación del ARN viral (TR-RCP). A 10 mL del ARN extraído se les adicionaron 90 mL de la mezcla siguiente (mezcla TR-RCP): 100 pmol de cada cebador; trifosfatos de desoxinucleótidos 0,2 mM; Tris 10 mM (pH 8,9); cloruro de magnesio 15 mM; cloruro de potasio 80 mM; 0,5 mg de albúmina sérica bovina (ASB) por mL; colato de sodio al 0,1 %; Tritón X-100 a l 0,1 %; 10 U de transcriptasa inversa AMV (Promega); ditiotreitol (DTT) 0,1 U mM; 0,1 U de inhibidor de la RNasa (Boehringer Mannheim) y 2,5 U de Taq ADN polimerasa (Boehringer Mannheim). Esta mezcla de reacción fue cubierta por 2 gotas de aceite mineral y sometida a una temperatura de 42 oC, durante 20 min, para la transcripción inversa, a lo que siguieron 30 ciclos con temperaturas de 92 oC por 60 s, 53 oC por 90 y 72 oC durante 120 s; finalmente la mezcla de reacción se dejódurante 5 min a 72 oC. Todas estas incubaciones secuenciales se efectuaron en un termociclador (Pharmacia LKB-Gene ATAQ Controler). Al finalizar la amplificación, 7 mL del producto amplificado fueron examinados por corrida electroforética en gel de agarosa (Sigma) al 2 %. La tinción de los geles de corrida se realizó con una solución de bromuro de etidio, para observar las bandas de los productos amplificados, utilizando un transilu-minador de luz ultravioleta (LKB). Este pro-cedimiento se practicó tanto sobre el ARN extraído de sobrenadantes de cultivos infectados por cepas virales, como sobre los controles negativos.
Hibridación dot blot del producto amplificado. La hibridación fue desarrollada según Towbin y otros, y Renart y otros.9,10 Como sondas fueron utilizadas las bandas oligonucleotídicas del serotipo 1 de la cepa D1 77 y del serotipo 3 de la cepa 24 de Nicaragua, obtenidas por RCP según Rico-Hesse y Deubel y otros, respectivamente;5,11 el clon pD1, con el gen de la envoltura del serotipo 2, de la cepa A15, 1981, incluido en el vector pSK(-), y el vector vaccinia recombinante con parte del genoma de la cepa de dengue 4, 814669, Dominicana, 1981, incorporado. Todas las sondas fueron marcadas con fósforo alfa (P32 -dATP), usando el protocolo que propone Amersham.9,10
Técnica de titulación mediante neutralización por reducción del número de placas. Se utilizó para determinar la sensibilidad de la TR-RCP y se realizó de acuerdo con lo descrito por Morens y otros.12
RESULTADOS
SIMPLIFICACIÓN DE LA TR-RCP
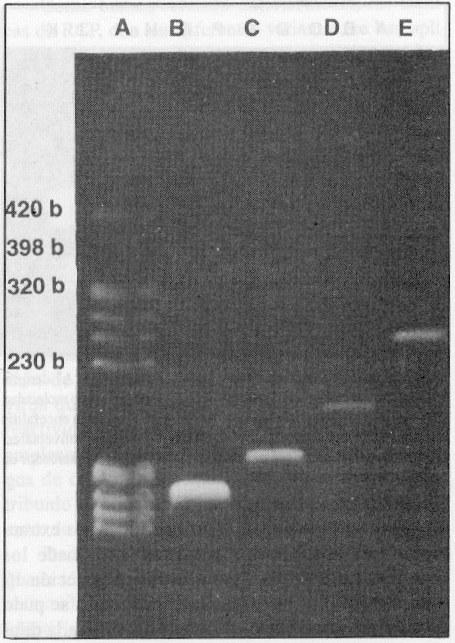
Para simplificar el procedimiento de detección y tipificación del virus del dengue, se empleó el método de extracción del ARN viral utilizado por Lanciotti y otros,8 y se combinó con la TR-RCP que usa juegos de cebadores semejantes a los recomendados por Morita y otros7, los cuales permiten amplificar secuencias determinadas de ácidos nucleicos, con tallas que se corresponden con 420, 230, 320 y 398 pares de bases, para los serotipos 1, 2, 3 y 4 del virus del dengue, respectivamente (figura 1).
FIGURA 1. Amplificación, por RT-PCR, de las cepas de los 4 serotipos del virus del dengue empleadas en la normalización, usando los 4 juegos de cebadores. A) dengue 2, B) dengue 3, C) dengue 4, D) dengue 1, E) marcador de peso molecular OBR 322 digerido con Hae III (Sigma).
ESPECIFICIDAD DE SEROTIPO DE CADA PAR DE CEBADORES
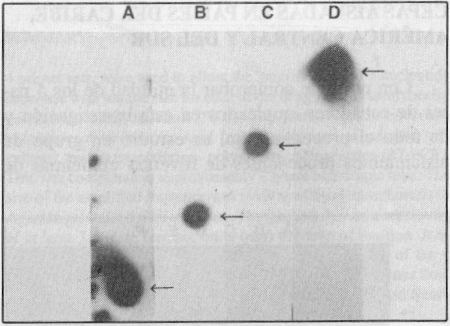
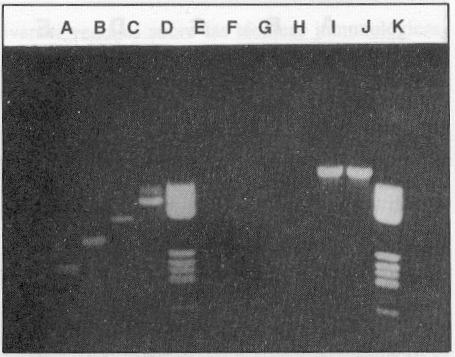
Empleando los 4 pares de cebadores en cada tubo de reacción se obtuvo la amplificación de un fragmento con una talla única según el serotipo. El resultado puede observarse en la figura 1, lo que también fue comprobado mediante el experimento de hibridación con sondas específicas de tipo, tal como muestra la figura 2. Se investigó, además, la reactividad cruzada de los 4 pares de cebadores con otros Flavivirus y no se observó banda alguna de ADN que demostrara reactividad después de 30 ciclos de amplificación. En cambio, los genomas de estos virus resultaron amplificados con el mismo procedimiento de TR-RCP pero empleando cebadores universales para todos los Flavivirus trasmitidos por mosquitos,7 como se observa en la figura 3, líneas I y J.
FIGURA 2. Hibridación dot blot de los productos amplificados por RT-PCR. A) dengue 2, B) dengue 3, C) dengue 4, D) dengue 1.
FIGURA 3. Especificidad de los pares de cebadores. A) dengue 2,B) dengue 3, C) dengue 4, D) dengue 1, E) marcador de peso molecular, F) virus Ilheus, G) virus de la fiebre amarilla,H) virus de la encefalitis de San Luis. Amplificación de F, G y H, con cebadores universales. I) virus Ilheus, J) virus de la fiebre amarilla, K) el mismo marcador de peso molecular.
SENSIBILIDAD DE LA TR-RCP
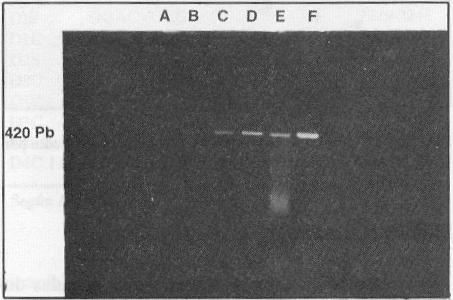
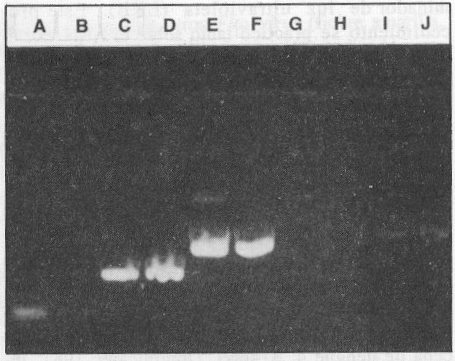
Se realizaron diluciones decimales seriadas de la cepa cubana del virus dengue 1 aislada en 1977, en el medio de mantenimiento de las células C6/36 (medio esencial mínimo enriquecido con glutamina y aminoácidos no esenciales) y se sometieron 300 mL de cada dilución al procedimiento de extracción de ARN y TR-RCP, en la utilización de los cebadores D1S y D1C, para evaluar la dilución límite. Después de 30 ciclos de amplificación se pudo detectar una banda de ADN amplificada hasta la dilución 1:10 000 que corresponde aproximadamente a 2,5 ufp de virus por tubo de reacción (figura 4). La sensibilidad de la TR-RCP para los restantes serotipos fue similar a la obtenida con la cepa del serotipo 1 (datos no mostrados)
FIGURA 4. Sensibilidad de la RT-PCR para la detección del serotipo 1 del dengue. A) dilución 10-5 , B) dilución 10-4, C ) dilución 10-3, D) dilución 10-2, E) dilución 10-1, F) sobrenadante de cultivo celular infectado con la cepa de dengue 1.
REACTIVIDAD DE LOS CEBADORES CON LAS CEPAS AISLADAS EN PAÍSES DEL CARIBE, AMÉRICA CENTRAL Y DEL SUR
Con el fin de comprobar la utilidad de los 4 pares de cebadores empleados en esta investigación y de todo el procedimiento, se estudió un grupo de aislamientos procedentes de diversas epidemias de dengue y dengue hemorrágico, que se han sucedido en algunos países de la región del Caribe, América Central y del Sur en fechas recientes (tabla 2). La figura 5 muestra la especificidad de tipo de los cebadores, para las cepas del virus del dengue aisladas en estas regiones.
Figura 5. Especificidad de los 4 pares de cebadores con cepas aisladas durante epidemias ocurridas recientemente en las regiones del Caribe, América Central y del Sur, las que aparecen listadas en la tabla 1. A) y B) dengue 2, C) y D) dengue 3, E) y F) dengue 4, G), H), I) y J) dengue 1.
DISCUSIÓN
En este trabajo describimos un ensayo de TR-RCP, rápido, específico y sensible, para la detección y tipificación del virus del dengue. El método empleado consta de sólo 2 pasos: (i) la extracción del ARN a partir de sobrenadantes de cultivos celulares infectados y (ii) la generación, por transcripción reversa (TR), de un ADN copia (ADNc), con amplificación subsecuente mediante la acción de la Taq ADN polimerasa. De esta forma, las 2 reacciones incluidas en el paso (ii), se combinan en un solo tubo de reacción y se produce una reducción importante del tiempo del ensayo. Paralelamente, disminuyen los riesgos de contaminación y es más factible la manipulación de un amplio número de muestras. El uso de cebadores específicos de tipo, que además determinan bandas de amplificación de diferentes tallas para cada uno de los serotipos, permite la detección y al mismo tiempo la tipificación, de acuerdo con la talla de la banda amplificada (figura 1).
Por tanto, la determinación correcta del tipo viral sólo requiere de la electroforesis del producto amplificado en gel de agarosa. Así se evitan otros procedimientos de biología molecular para la obtención del tipo viral, como es el caso de la hibridación con sondas radiomarcadas,5,6 o de la segunda amplificación conocida como RCP anidada que, según se reporta, aumenta la sensibilidad pero complica la manipulación y demora el resultado.8,13
Se pudo comprobar la especificidad de los juegos de cebadores utilizados. Los resultados se muestran en la figura 3. La especificidad de los cebadores se debe a que ellos reconocen exclusivamente la secuencia específica de ARN del serotipo viral, a partir de la cual fueron diseñados. Los resultados del experimento de hibridación así lo confirman (figura 2). Comprobamos, además, que no se produce reactividad cruzada con otros virus de la familia Flaviviridae que son transmitidos por mosquitos (figura 3).
El estudio de sensibilidad muestra resultados similares y para algunos serotipos, resultados superiores a los publicados por otros autores, quienes han trabajado con cebadores y diseños de ensayos semejantes a los nuestros. Esto puede deberse a que, a diferenciade dichos trabajos, empleamos un potente método de extracción de ARN, que contribuye significativamente a los resultados obtenidos. En estudios anteriores comprobamos que, al menos en nuestras condiciones, la extración simple empleada en sus trabajos por otros autores7,14 sólo permitió alcanzar una sensibilidad inferior a la que encontramos con la extracción de ARN aquí descrita. Autores como Lanciotti y otros8 muestran resultados de sensibilidad mejores que los nuestros, utilizando el mismo método de extracción de ARN, pero acoplado a una segunda amplificación de su TR-RCP para lograr tales resultados e identificar el serotipo.
En nuestro laboratorio contamos con un número de cepas pertenecientes a los 4 serotipos del virus del dengue, aisladas en epidemias ocurridas en países del Caribe, América Central y del Sur. Por otra parte, los cebadores empleados aquí sólo se habían utilizado antes para la identificación por TR-RCP de cepas circulantes en el sureste asiático. Los resultados que mostramos en la figura 5, obtenidos con las cepas que describimos en la tabla 2, demuestran la reactividad de estos cebadores y su especificidad con los serotipos del virus del dengue que circulan en estas regiones y, por tanto, queda abierta la posibilidad de emplearlos en estudios de diagnóstico, vigilancia y epidemiología molecular, realizados tradicionalmente por nuestro laboratorio en colaboración con países de tales regiones de América. Si tenemos en cuenta que los mismos juegos de cebadores que empleamos han dado excelentes resultados en el diagnóstico durante epidemias de dengue 1 y 2 en Tailandia15 y de epidemias por los serotipos que han circulado en países del sureste asiático, podemos inferir que estos cebadores ofrecen la posibilidad de realizar estudios de epidemias de dengue y dengue hemorrágico, causadas por los serotipos que actualmente circulan en las regiones más afectadas del mundo.
Como hemos referido anteriormente, las técnicas de RCP, con sus diferentes variantes, se han aplicado rápidamente y con propósitos diversos, fundamentalmente para el diagnóstico de enfermedades infecciosas. Sin embargo, son cada vez más frecuentes los reportes acerca de los problemas que la propia tecnología incorpora, entre ellos resaltan los de resultados falsos positivos y falsos negativos.16,17 Con el propósito de disminuir estos riesgos, asumimos un grupo de medidas en la práctica diaria, semejantes a los descritos por Sarkar y otros, y Kitchin y otros.16,17 Además del uso de al menos 2 controles negativos en cada ensayo: aquél que sustituye al material genético viral por el medio de crecimiento de las células y el agua de la utilizada en la preparación de las reacciones. Por las características del virus que estudiamos aquí y teniendo en cuenta la reactividad específica de tipo de los cebadores que empleamos, el uso de la combinación de los 4 juegos de cebadores en cada tubo de reacción ha contribuido al control de las contaminaciones cruzadas entre los serotipos.
Dado los resultados obtenidos consideramos que la técnica empleada aquí sería útil para emplearla en estudios de diagnóstico, a partir de aislados cuya identificación mediante anticuerpos monoclonales se haga difícil, bien por el bajo título viral o por pérdida de los epítopes específicos en las cepas estudiadas, para ciertos anticuerpos monoclonales tipo específicos, corrientemente empleados con estos fines. Este último fenómeno aunque no parece tener unafrecuencia significativa, ya ha sido reportado por otros autores en los serotipos 1 y 3.15,18
SUMMARY
4 primer sets, were used to allow the amplification of a nucleotide sequence with unique size for each of the dengue virus serotypes by polymerase chain reaction (PRC). The method consisted in the extraction of ribonucleic acid from supernatant of infected cell cultures, reverse transcription - polymerase chain reaction (RT-PCR). This was completed in approximately 7 hours in a simple tube. The size of the amplified sequence was evidenced by electrophoresis in Agarose gel stained with ethidium. The method showed a sensitivity of at least 2.5 plate forming units (pfu) per tube of reaction. It es useful for the detection and simultaneous identification of the 4 serotypes, starting from supernatants of infected strains cultures from different countries of the Caribbean, Central America, and South America.
Key words: DENGUE VIRUS/classification; SEROTYPING; POLYMERASE CHAIN REACTION/methods.
REFERENCIAS BIBLIOGRÁFICAS
- Monath TP. Yellow fever and dengue the interactions of virus, vector and host in the reemergency of epidemic disease. Virology 1994;5:133-45.
- Burke DS, Nisalak A, Gentry MK. Detection of flavivirus antibodies in human serum by epitope-blocking immunoassay. J Medical Virol 1987;23:165-73.
- Henchal EA, Gentry MK, McCown JM, Brandt WE. Dengue virus specific and flavivirus group determinants identified with monoclonal antibodies by indirect immunofluorescence. Am J Trop Med Hyg 1982;31:830-6.
- Henchal EA, McCown JM, Seguin MC, Gentry MK, Brandt WE. Rapid identification of dengue virus isolates by using monoclonal antibodies in an indirect immunofluorescence assay. Am J Trop Med Hyg 1983;32:164-9.
- Deubel V, Laille M, Hugnot JP. Identification of dengue sequences by genome amplification: rapid diagnosis of dengue virus serotypes in peripheral blood. J Virological Meth 1990;30:41-54.
- Henchal EA, Polo SL, Vorndam V, Yaemsiri C, Innis BL, Hoke CH. Sensitivity of a universal primer set for the rapid diagnosis of dengue virus infections by polymerase chain reaction and nucleic acid hybridization. Am J Trop Med Hyg 1991;45:418-28.
- Morita K, Tanaka M, Igarashi A. Rapid identification of dengue virus serotypes by using polymerase chain reaction. J Clin Microbiol 1991;29:2107-10.
- Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam V. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol 1992;30:545-51.
- Towbin H, Stahelen T, Gordon J. Protocols for nucleic acid bloting. Procedures of the National Academy of Sciences of the USA. 1979;76:4350-4.
- Renart J, Reeser JJ, Stark GR. Protocols for nucleic acidhybridization. Procedures of the National Academy of Sciences of the USA. 1979;76:3116-20.
- Rico-Hesse R. Molecular evolution and distribution of dengue viruses type 1 and 2 in nature. Virology 1990;174:479-93.
- Morens DM, Halstead SB, Larsen LK. Comparison of dengue virus plaque reduction neutralization by macro and "semi-micro" methods in LLC-MK2 cells. Microbiol Immunol 1985;29:1197-205.
- Bélak S, Ballagi-Pordány A. Experiences on the application of the polymerase chain reaction in a diagnostic laboratory. Molecular and Cellular Probes 1993;7:241-8.
- Tanaka M. Rapid identification of flavivirus using the polymerase chain reaction. J Virological Meth 1993;41:311-22.
- Maneekarn N, Morita K, Tanaka M, Igarashi A, Usawattanakul W, Sirisanthana V, et al. Applications of polymerase chain reaction for identification of dengue viruses isolated from patient sera. Microbiol and Immunol 1993;37:41-7.
- Sarkar G, Sommer SS. Shedding light on PCR contamination. Nature 1990;347:27.
- Kitchin PA, Bootman YS. Quality control of the polymerase chain reaction. Rev Med Virol 1993;3:107-14.
- Monath TP, Wands JK Hill LJ, Broom NV Marciniak RA, Wong MA, et al. Geographic classification of Dengue-2 virus strain by antigen signature analysis. Virology 1986;154:313-24.
Recibido: 10 de enero de 1996. Aprobado: 9 de julio de 1996.
Dra. Delfina Rosario Domínguez. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Microbiología. Investigadora Agregada.
2 Licenciado en Microbiología.
3 Licenciada en Radioquímica. Aspirante a Investigadora.
4 Licenciada en Biología. Investigadora Auxiliar.
5 Doctora en Ciencias Médicas. Especialista de II Grado en Microbiología. Investigadora y Profesora Titular. Jefa del departamento de Virología.