Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão impressa ISSN 0375-0760versão On-line ISSN 1561-3054
Rev Cubana Med Trop v.48 n.3 Ciudad de la Habana set.-dez. 1996
Instituto de Medicina Tropical "Pedro Kourí"
Toxoplasma gondii: caracterización de un anticuerpo monoclonal anti-P30
Lic. ALBERTO FACHADO,1 Dra. NEYDA FERNÁNDEZ,2 Dr. ERNESTO HERNÁNDEZ 3 y Lic. LISSET FONSECA4
RESUMEN
Se caracterizó un anticuerpo monoclonal específico a Toxoplasma gondii. El hibridoma produjo inmunoglobulinas IgG. El análisis por Western Blot demostró que el anticuerpo monoclonal fue específico para el antígeno de masa molecular aparente de 30 kd, presente en la superficie del parásito. El anticuerpo monoclonal se purificó a partir de fluido ascítico de ratón y se acopló a Sefarosa 4B. Este inmunoabsorbente fue utilizado con el fin de purificar el antígeno parasitario específico. El anticuerpo monoclonal estudiado puede ser de utilidad para las técnicas que contribuyan con el diagnóstico de la toxoplasmosis.
Palabras clave: TOXOPLASMA/inmunología; ANTÍGENOS DE PROTOZOARIOS/aislamiento y purificación; ANTICUERPOS MONOCLONALES/aislamiento y purificación; HIBRIDOMAS; WESTERN BLOTTING/métodos; ELISA/métodos; IGG; PROTEÍNAS DE LA MEMBRANA.
Toxoplasma gondii (T. gondii), coccidia que parasita intracelularmente, es el agente causal de la toxoplasmosis. Generalmente benigna o asintomática en individuos inmunocompetentes, puede convertirse en una seria infección en inmunodeficientes1 así como en niños infectados durante su vida intrauterina.2
Para el diagnóstico de una infección aguda han sido evaluados una variedad de métodos, éstos incluyen la detección del parásito en fluidos biológicos y métodos serológicos para la captura de inmunoglobulinas específicas IgM, IgG, IgA.3-5
La producción de anticuerpos monoclonales (AcM) ha sido útil en la purificación y caracterización de antígenos de Toxoplasma así como en el diagnóstico, por ejemplo, en los ensayos inmunoenzimáticos sobre fase sólida (ELISA), particularmente cuando se utilizan sistemas de inmunocaptura.6,7 Una importante aplicación en estas técnicas es el uso de AcM contra la proteína de masa molecular 30 x 103 (P30), presente en la membrana del parásito, muy útil como marcador de fase aguda.8
En este trabajo se describe la caracterización de un AcM producido por primera vez en el país, el que puede ser aplicado en el diagnóstico serológico, en la purificación de antígeno y en estudios sobre respuesta inmune del hospedero.
MÉTODOS
EXTRACTO ANTIGÉNICO
El extracto antigénico soluble fue preparado a partir de la cepa RH de T. gondii. Los trofozoítos se obtuvieron del exudado peritonial de ratones, 3 d después de ser infectados. Este fue mezclado con 2 mL de solución tampón fosfato salina 0,1 M (PBS) pH 7,2-7,4 y centrifugado a 650 kg por 10 min a 4 oC. El precipitado se re-suspendió en 2 mL de PBS y se realizaron varios pases mediante agujas No. 26. La solución resultante se centrifugó, esta vez a 160 xg durante 10 min a 4 oC y el sobrenadante obtenido fue centrifugado a 650 xg por 10 min a 4 oC. El precipitado se lavó 3 veces en 50 mL de PBS. La suspensión fue entonces sonicada a 4 oC para romper el parásito y centrifugada a 10 000 xg a 4 oC durante 1h. Se determinó la concentración de proteínas,9 y fue almacenado en fracciones de 1 mL a -70 oC.
PRODUCCIÓN DEL ANTISUERO
El antisuero de conejo anti-T. gondii fue preparado por dilución de 0,5 mL de antígeno de T. gondii (1mg/mL) en el mismo volumen de PBS. La solución antigénica fue mezclada en igual volumen de adyuvante completo de Freund para inocular subcutáneamente a conejos de aproximadamente 3 kg de peso corporal. Posteriormente fueron ejecutadas 4 inoculaciones a intervalos semanales con adyuvante incompleto de Freund. Siete días después de la última inoculación, los animales fueron desangrados por punción cardíaca. Luego de obtenido el suero, éste se almacenó a -70 oC. El título de anticuerpos en el suero hiperinmune fue determinado por contrainmunoelectroforesis (1:64) y 1:51 200 por ELISA. La fracción gamma- globulínica fue obtenida por precipitación con sulfato de amonio y centrifugación a 2 000 xg durante 30 min a 4 oC. El precipitado se resuspendió en solución salina 0,9 % y se trató con sulfato de amonio al 50 %, nuevamente centrifugado a 2 000 xg por 30 min a 4 oC. El precipitado se resuspendió en PBS y se aplicó a una columna preempacada (PD-10, Pharmacia) para una rápida desalinización. El producto final fue almacenado a -70 oC.
ANTICUERPO MONOCLONAL
El AcM murino fue obtenido en el Instituto Superior de Ciencias Médicas de Camagüey. El hibridoma positivo fue originalmente identificado por un ELISA anti-Toxoplasma.
REACTIVIDAD DEL ANTICUERPO MONOCLONAL
Para determinar la especificidad antigénica de este AcM se desarrolló la técnica de Western Blot. El extracto antigénico soluble de T. gondii fue solubilizado con tampón pH 6,8 compuesto por SDS, 2B-mercaptoetanol, glicerol, tris y posteriormente sometidos a electroforesis. Fue realizada la electroforesis en gel de poliacrilamida al 12,5 % con la presencia de SDS, la solución tampón empleada en la corrida fue tris, glicina, SDS pH 8,3, según lo descrito.10 Las condiciones de corrida fueron: corriente 35 mA constante y temperatura ambiente.
Una vez finalizada la corrida, el gel fue teñido en una solución de azul de coomasie R-250 al 0,05 %. Como patrones de masa molecular fue utilizado un kit de Sigma Chemical Co. compuesto por: seroalbúmina bovina 66 kd, ovoalbúmina 45 kd, tripsinogéno 24 kd y lisozima 14,3 kd.
Las proteínas separadas por la electroforesis en poliacrilamida fueron electrotransferidas1 a papel de nitrocelulosa Schleider & Schull de porosidad 0,45 mm, en la transferencia se utilizó una solución tampón compuesta por tris, glicina, metanol pH 8,3. El papel fue cortado en tiras y éstas incubadas en leche descrenada al 4 % en PBS que contenía Tween 20 al 0,5 % (PBS-T), para saturar los posibles sitios de unión inespecífica. Posteriormente se incubaron, durante toda la noche, en una solución de leche descremada-PBS-T que contenía al fluido ascítico de ratón en diferentes diluciones. Fueron ejecutados lavados sucesivos y durante 1 h se incubó con inmunoglobulinas de carnero, anti-ratón, marcados con peroxidasa de rábano (Sigma Chemical Co.) en dilución 1:1 000. Luego de repetidos lavados, la membrana fue revelada con diaminobenzidina (0,004 g) en 10 mL de PBS más 0,1 % de peróxido de hidrógeno.
Las inmunoglobulinas fueron aisladas del fluido ascítico por inmunoafinidad con Proteína A-Sefarosa (Pharmacia-LKB). La actividad biológica fue determinada por ELISA y la pureza por electroforesis en gel de poliacrilamida con duodecil sulfato de sodio (SDS).
ESPECIFICIDAD DEL ANTICUERPO MONOCLONAL
Para descartar reacciones cruzadas, se desarrolló un ELISA de 4 capas.12 Brevemente, una placa maxisorp fue recubierta con 10 mg de AcM e incubada a 4 oC durante toda la noche. Para el bloqueo se empleó seroalbúmina bovina al 4 % en PBS-T. Antígenos de T. gondii y de diferentes especies (Entamoeba histolytica, Giardia lamblia, Trypanosoma cruzi, Fasciola hepatica, Shistosoma haematobium) a concentraciones de 5 mg/mL fueron añadidos e incubados durante 2 h a 37 oC. Fue añadido durante 1h suero de conejo anti-T. gondii diluido 1:1 000, y la placa se incubó a 37 oC. Conjugado anti-conejo a la dilución de 1:4 000 fue añadido e incubado por 1h a 37 oC. Como último paso se diluyeron 20 mg de ortofenilendiamina en 50 mL de solución tampón citrato pH 7,9 que contenía
20 mg de peróxido de hidrógeno, esta solución fue dispensada y transcurridos 30 min el desarrollo de color fue medido en un lector de ELISA a 492 nm. Entre cada paso de incubación, los pocillos fueron cuidadosamente lavados con PBS-T.
CLASE Y SUBCLASE
Fue desarrollado un ELISA tipo indirecto. Una placa maxisorp se recubrió a una concentración de 10 mg/mL con antisueros comerciales de carnero anti-subclase: IgM, IgG1, IgG2A, IgG2B, IgG3. La incubación se llevó acabo durante 1h a 37 oC. Los pocillos fueron lavados con PBS-T, y bloqueados con seroalbúmina bovina al 3 % en PBS, nuevamente se incubaron a 37 oC por 1h. El AcM a una concentración de 5 mg/mL, así como los controles positivos (muestras comerciales de IgG1 e IgG2B) y negativos (PBS-T) fueron añadidos e incubados por 1h a 37 oC. Posterior a los lavados con PBS-T se añadieron inmunoglobulinas de carnero, anti-ratón, marcadas con peroxidasa de rábano (Sigma Chemical Co.) a una dilución de 1:1 000 en PBS-T, que contenía suero de ternera al 10 %. La placa se incubó a 37 oC por 60 min. Para el revelado de laplaca, se preparó una solución consistente en 20 mg de ortofenilendiamina, diluidos en 50 mL de solución tampón citrato pH 7,9 más 20 mL de peróxido de hidrógeno la cual fue dispensada a razón de 50 mL por pocillo. Seguidamente, la placa se mantuvo a temperatura ambiente en lugar oscuro por un período de 30 min. La reacción fue detenida por adición de ácido sulfúrico al 12,5 % y la absorbancia fue medida a 492 nm.
FOCALIZACIÓN ISOELÉCTRICA
La técnica fue ejecutada en el sistema Phast-System13 donde se aplicó la muestra a una concentración de 0,59 mg/mL, en un gradiente preformado por una mezcla de anfolinas en un rango 3,5-9,5 valores de pH.
INMUNOFLUORESCENCIA INDIRECTA (IFI)
La técnica fue realizada según la metodología descrita.14 Los trofozoítos fijados a una lámina portaobjeto fueron incubados durante 30 min en una solución de PBS que diluía al AcM 1:16 para posteriormente añadir inmunoglobulinas G, anti-ratón, marcadas con fluoresceína (BIOCEN) por 30 min. La lectura se realizó en microscopio de fluorescencia.
PURIFICACIÓN DE P30
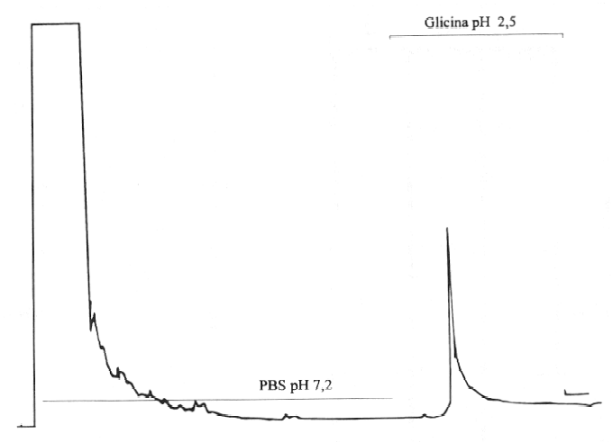
El antígeno de superficie P30 fue purificado por cromatografía de afinidad. El sobrenadante resultante de los parásitos sonicados fue aplicado a una columna cuyo inmunoabsorbente contenía al AcM como ligando. Secuencialmente se aplicaron PBS y solución al 0,1M de glicina pH 2,5. Inmediatamente, las fracciones fueron neutralizadas con 1M tris y analizadas por Western Blot, con objeto de detectar P30. Las condiciones anteriormente descritas para esta técnica, fueron seguidas con la particularidad de emplear AcM o anticuerpo policlonal (AcP) en las incubaciones.
RESULTADOS
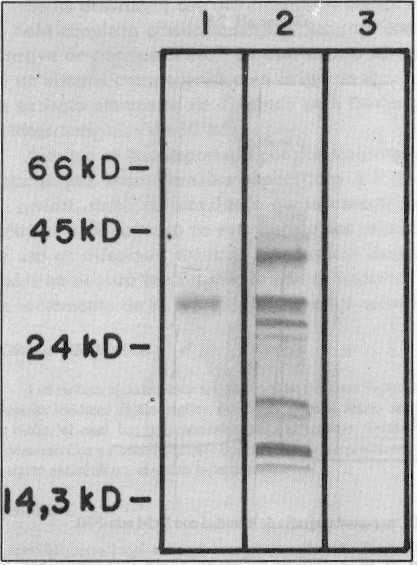
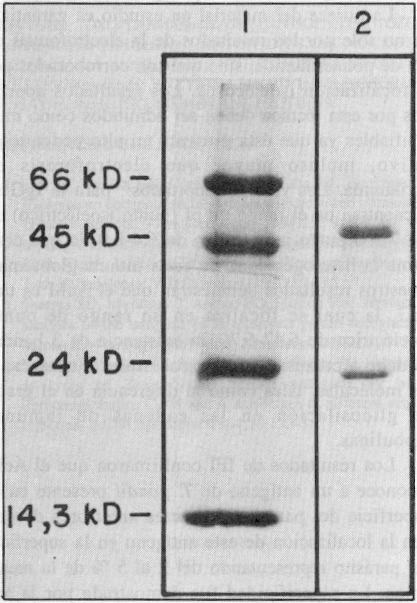
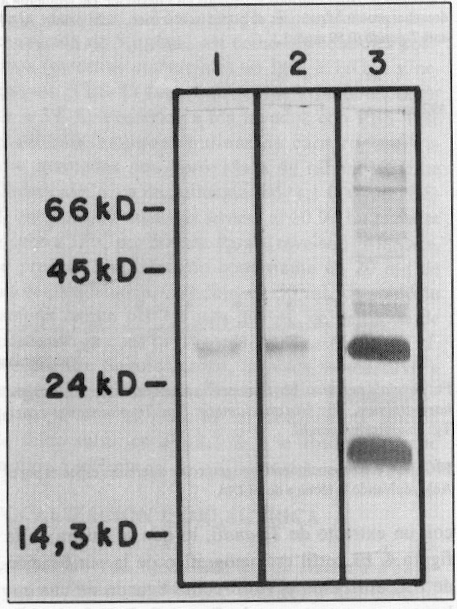
Por los resultados obtenidos en el Western Blot, al enfrentar el AcM a los antígenos solubles de T. gondii, se pudo encontrar que el hibridoma produce inmunoglobulinas específicas a un antígeno de masa molecular aparente de 30 kd (figura 1). Una vez purificado el AcM por una columna cromatográfica de proteína A-Sefarosa, se determinó la actividad biológica de las fracciones obtenidas por ELISA, se encontró mayor actividad al reconocimiento antigénico de T. gondii en la fracción II. Por el método de Lowry se detectó la presencia de 0,625 mg/mL y los resultados de la electroforesis en gel de poliacrilamida permiten asegurar la pureza de esta fracción, al visualizar 2 bandas de proteínas de masa molecular aproximada a los 50 y 25 kd, correspondientes a cadenas pesadas y ligeras, respectivamente (figura 2).
FIGURA 1. Reactividad del AcM. El extracto antigénico de T. gondii fue separado por electroforesis en gel de poliacrilamida y electrotransferido a membrana de nitrocelulosa. 1) La membrana fue incubada con AcM anti-T. gondii, 2) AcP anti-T. gondii, 3) AcM anti-Vibrio cholerae. En el extremo izquierdo aparece el patrón de pesos moleculares.
FIGURA 2. Electroforesis en gel de poliacrilamida al 12,5 % en condiciones reductoras: comprobación de la pureza del AcM. 1) Patrón de pesos moleculares. 2) Pico II eluido en la cromatografía de proteína A-Sefarosa.
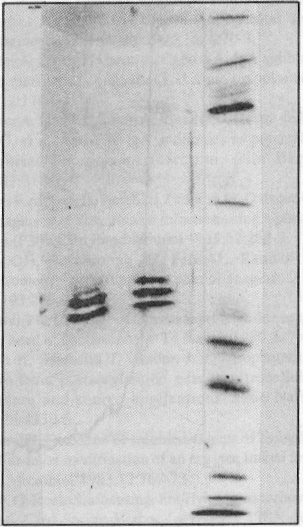
El análisis de los resultados obtenidos en la técnica de ELISA con antiinmunoglobulinas específicas de clase y subclases, demostró que el AcM pertenece a la subclase de las IgG1. Fueron obtenidas 3 bandas al realizar la focalización isoeléctrica, éstas se encontraron en un rango de pH de 6,47-6,70 (figura 3).
FIGURA 3. AcM murinos separados en Phast-Gel. De izquierda a derecha: proteínas patrones de punto isoeléctrico. AcM patrón, AcM anti-T-gondii (0,59 mg/mL).
La IFI reveló una reacción positiva por la fluorescencia de la periferia de la membrana celular del trofozoíto.
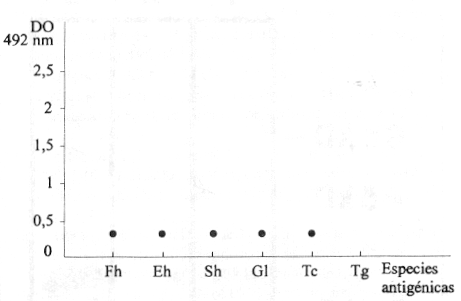
Al testar soluciones antigénicas de otros parásitos con el AcM en estudio, por ELISA, se obtuvieron valores de densidad óptica muy pequeños comparados con los obtenidos de la reacción de este AcM con un extracto de T.gondii, lo que se ilustra en la figura 4. El perfil cromatográfico de la purificación de P30 utilizando el AcM como ligando de una columna, se muestra en la figura 5. La técnica de Western Blot permitió comprobar el aislamiento de este antígeno al revelarse una única banda en los 30 kd (figura 6).
Fh: Fasciola hepatica. Eh: Entamoeba histolytica. Sh: Schistosoma haematobium. Gl: Giardia lambia. Tc: Trypanosoma cruzi. Tg: Toxoplasma gondii.
FIGURA 4. Reconocimiento antigénico de diferentes especies por el AcM, epleando la técnica de ELISA.
FIGURA 5. Análisis de antígenos de T. gondii en FPLC por cromatografía de afinidad con AcM anti-P30.
FIGURA 6. Análisis por Western Blot de antígenos de T. gondii purificados por cromatografía de afinidad.1-2) Fracción purificada. Se empleó AcM y AcP, respectivamente. 3) Extracto antigénico de T. gondii al reaccionar con AcP (control positivo).
DISCUSIÓN
La producción de AcM para la detección de antígenos es una importante herramienta en el inmunodiagnóstico de enfermedades infecciosas, con ellos se combina la sensibilidad y especificidad que caracteriza a esta clase de anticuerpos.
Estudios anteriores han revelado el uso de la principal proteína de membrana P30 en el ELISA de captura, para la detección de inmunoglobulinas específicas IgA, IgM e IgG,8,15 la cual ha sido muy útil en el diagnóstico diferencial de las toxoplasmosis aguda y crónica.
Los resultados de este trabajo demuestran que fue obtenido un AcM específico para el antígeno de 30 kd de T.gondii el que pertenece al isotipo IgG1. Anteriormente se han reportado anticuerpos específicos a T. gondii del isotipo IgG1.
La pureza del material en estudio es garantizada no sólo por los resultados de la electroforesis en gel de poliacrilamida, sino que son corroborados por la focalización isoeléctrica. Los resultados aportados por esta técnica deben ser admitidos como muy confiables ya que ésta presenta un alto poder resolutivo, incluso mayor que electroforesis en acrilamida. Los valores reportados17 para la IgG se encuentran en el rango de pI (punto isoeléctrico) de 5,8-7,3 o punto isoeléctrico de 6,4-8,9, lo que confirma la heterogeneidad de estas inmunoglobulinas. Nuestros resultados demuestran que el AcM es una IgG1 la cual se focaliza en un rango de punto isoeléctrico de 6,47-6,70, la existencia de 3 bandas se debe a características estructurales intrínsecas a las moléculas, tales como la diferencia en el grado de glicosilación en las cadenas de inmunoglobulinas.
Los resultados de IFI confirmaron que el AcM reconoce a un antígeno de T. gondii presente en la superficie del parásito. Reportes anteriores describen la localización de este antígeno en la superficie del parásito representando del 2 al 5 % de la membrana. La especificidad fue demostrada por la ausencia de reacción en el ELISA, donde fueron testados antígenos de otros parásitos, resultado muy útil ya que apunta hacia la factibilidad de emplear este AcM de forma específica.
Se ha descrito el uso del inmunoabsorbente con el AcM acoplado covalentemente a Sefarosa con el objetivo de purificar P30.18 En este trabajo se utilizó un sistema cromatográfico en el que se recirculó un extracto antigénico de T. gondii para finalmente obtener antígenos de 30 kd.
Aunque se han reportado por otros autores19,20 anticuerpos monoclonales específicos a P30 de T. gondii, debe ser resaltado quela caracterización del AcM descrito en este trabajo nos permitirá su uso en diferentes técnicas diagnósticas desarrolladas en nuestro laboratorio, lo que se traducirá en un incremento de la sensibilidad de estos métodos.
AGRADECIMIENTOS
Los autores agradecemos al colectivo del Instituto Superior de Ciencias Médicas de Camagüey, por facilitarnos el fluido ascítico de ratón, el cual fue indispensable para el trabajo. También a Raymundo Cox y Rodolfo Machín por brindarnos tan gentilmente el extracto antigénico y el suero hiperinmune.
SUMMARY
A specific monoclonal antibody was characterized to Toxoplasma gondii. The hybridoma produced IgG immunoglobulins. The Western Blot analysis showed that the monoclonal antibody was specific for the antigen of an apparent mollecular mass of 30 kd, which was present on the antigen surface. The monoclonal antibody was purified starting from mouse´s ascitic fluid and it was matched with Sepharose 4B. This immunoabsorbent was used to purify the specific parasitary antigen. The monoclonal antibody studied may be useful for those tecniques contributing to the toxoplasmosis diagnosis.
Key words: TOXOPLASMA/immunology; ANTIGENS, PROTOZOAN/isolation and purification; ANTIBODIES, MONOCLONAL/isolation and purification; HYBRIDOMAS BLOTTING, WESTERN/methods; ENZYME-LINKED IMMUNOSORBENT ASSAY/methods; IGG; MEMBRANE PROTEINS.
REFERENCIAS BIBLIOGRÁFICAS
- Luft BJ, Brooks RG, Conley FK, McCaba RE, Remington JS. Toxoplasma encephalitis in patients with acquired immunodeficiency syndrome. J Am Med Assoc 1984;252:913-7.
- Remington JS, Desmonts G. Toxoplasmosis. En: Remington JS, Klein JO, eds. Infectious Diseases of the Fetus and Newborn Infant 2 ed. Philadelphia: WB Saunders, 1990:89-195.
- Sharma SD, Mullenay J, Araújo FG, Ehrlich HA. Western blot analysis of the antigens of Toxoplasma gondii recognized by human IgM and IgG antibodies. J Immunol 1983;131:977-83.
- Partanen P, Turunen HJ, Paasivuo RTA, Leinikkt PO. Immunoblot analysis of Toxoplasma gondii antigens by human immunoglobulins G, M and A antibodies at different stages of infection. J Clin Microbiol 1984;20:133-5.
- Stepick-Biek P, Thulliez P, Araújo FG, Remington JS. IgA antibodies for diagnosis of acute congenital and acquired toxoplasmosis. J Infect Dis 1990;162:270-3.
- Decoster A, Darcy F, Caron A, Capron A. IgA antibodies against P30 as markers of congenital and acute toxoplasmosis. Lancet 1988;12:1104-6.
- Decoster A, Darcy F, Caron A, Vinatier D, Houze de L´Aulnoit D, Vittu G, et al. Anti-P30 IgA antibodies as prenatal markers of congenital Toxoplasma infection. Clin Exp Immunol 1992;87:310-5.
- Santoro F, Afchain D, Pierce RJ, Cesbron JY, Ovlaque G, CapronA. Serodiagnosis of Toxoplasma infection using a purified parasite protein (P30). Clin Exp Immunol 1985;62:262-9.
- Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the folin phenol reagent. J Biol Chem 1951;193:265-75.
- Laemmli VK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 Nature 1980;227:680-5.
- Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from poliacrylamide gels to nitrocellulose sheets: procedure and source applications. Proc Natn Acad Sci 1979;76:4350-6.
- Turunen HJ. Detection of soluble antigens of Toxoplasma gondii by a four-layer modification of an enzyme linked immunoassay. J Clin Microbiol 1983;17:768-73.
- Kohlez, G. Isoelectrofocusing. En: Hybridoma techniques. EMBO staff ed. Celd Spring Herbor Laboratory ISBN-o87969-143.3 Estados Unidos, 1980:52.
- Machin R, de la Cruz F de la Pividal J. Comparación de ELISA con las técnicas de IFI y fijación del complemento para el diagnóstico de la toxoplasmosis. Rev Cubana Med Trop 1985;37:269-77.
- Handman E, Remington JS. Serological and immunochemical characterization of monoclonal antibodies to Toxoplasma gondii. Immunology 1980;40:579-88.
- Rodríguez C, Afchain D, Capron A, Dissous C, Santoro F. Major surface protein of Toxoplasma gondii P30 contains an immunodominant region with repetitive epitopes. Eur J Immunol 1985;15:747-49.
- Williamson A.R. Isoelectric focusing of immunoglobulins. En: Weir DM, ed. Handbook of experimental Immunology. Oxford, London , Edinburg , Melbourne: Blackwell Scientif , 1978; cap. 9: 9,7.
- Kasper LH, Crabb JH, Pfefferkorn ER. Purification of a major membrane protein of Toxoplasma gondii by immunoabsorption with a monoclonal antibody. J Immunol 1983;130:2407-12.
- Kasper LH, Khan IA. Role of P30 in host immunity and pathogenesis of T. gondii infection. Res Immunol 1993;144:45-8.
- Bulow R, Boothroyd JC. Protection of mice from fatal Toxoplasma gondii infection by immunization with P30 antigen in liposomes. J Immunol 1991;147:3496-500.
Recibido: 12 de diciembre de 1994. Aprobado: 20 de febrero de 1995.
Lic. ALberto Fachado. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Licenciado en Bioquímica. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
2 Estomatóloga, Especialista de I Grado en Bioquímica Clínica. Instituto Superior de Ciencias Médicas de Camagüey.
3 Especialista de I Grado en Inmunología. Instituto Superior de Ciencias Médicas de Camagüey.
4 Licenciada en Bioquímica. Aspirante a Investigadora. IPK.