Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.49 n.1 Ciudad de la Habana ene.-abr. 1997
Caracterización de cepas de Haemophilus influenzae mediante fermentación de azúcares
Dr. RAFAEL LLANES CABALLERO, Dr. LUIS E. AZAHARES ROMERO, Dra. MIRIAM F. PÉREZ MONRAS y Dra. ALICIA MARTÍNEZ DÍAZ
RESUMEN
Se caracterizaron 64 cepas de Haemophilus influenzae circulantes en Ciudad de La Habana durante 1 a, por el método de fermentación de azúcares, por primera vez en Cuba. El patrón fermentativo D fue el más frecuentemente encontrado. Los patrones D y G en conjunto constituyeron el 72 % del total de cepas estudiadas. La combinación de la fermentación de azúcares con el serotipaje y el biotipaje permitió una mayor diferenciación de las cepas (14 grupos). Los patrones A, B, C y F aparecieron en niños mayores de 6 meses y el G en el grupo de 6 a 18 meses. En la meningoencefalitis bacteriana predominaron los patrones D y G, existió una mayor heterogeneidad en las cepas aisladas de infecciones respiratorias agudas. Se señalan algunas ventajas de este método de subtipificación de cepas de Haemophilus influenzae como son: la sencillez, facilidad de realizar e interpretar y no requerir de un personal calificado ni de un laboratorio especializado para su ejecución.
Descriptores DeCS: HAEMOPHILUS INFLUENZAE/clasificación; TECNICA DE TIPIFICACION BACTERIANA; INFECCIONES POR HAEMOPHILUS; ESTUDIOS PROSPECTIVOS.
INTRODUCCIÓN
Haemophilus influenzae constituye un patógeno importante de numerosas infecciones que se presentan fundamentalmente en edades pediátricas,1 el serotipo b (Hib) es uno de los causantes principales de meningitis purulenta y de infecciones severas del tracto respiratorio inferior.2,3
H. influenzae requiere para su crecimiento de medios complejos que contienen nicotinamida adenina dinucleótido (NAD o factor V) y hemina (factor X).4 Su metabolismo es aerobio5 o anaerobio facultativo4 y es capaz de utilizar los hidratos de carbono como fuente de energía a través de diferentes vías.6
El espectro de descomposición de los hidratos de carbono, que se determina por la producción de ácido de los sustratos, se emplea como método de tipificación de numerosas bacterias.7 Particularmente para H. influenzae, se establece la diferenciación en patrones fermentativos, sobre la base de la utilización de fructosa, maltosa y xilosa,8 este método es útil para distinguir cepas del mismo serotipo y biotipo.9
Se realizó el presente estudio con los objetivos siguientes: (I) caracterizar cepas de H. influenzae circulantes en Ciudad de La Habana durante 1 a con la utilización por primera vez en Cuba del método de fermentación de azúcares, (II) relacionar éste con otros métodos de tipificación de las cepas y con algunos aspectos clínico-epidemiológicos de presentación de la enfermedad.
MÉTODOS
Se realizó un estudio de tipo prospectivo en 64 cepas de H. influenzae, aisladas durante el período comprendido entre junio de 1992 y mayo de 1993 de 64 pacientes (0 - 5 a), procedentes de todos los hospitales pediátricos de Ciudad de La Habana y que presentaban diversas infecciones: meningoencefalitis bacteriana (MEB), 36; infecciones respiratorias agudas (IRA), 23 y otras infecciones, 5 (bac-teriemia primaria, 3; osteomielitis, 1; vaginitis, 1).
Identificación. Las cepas se identificaron como H. influenzae, en base a sus características morfológicas, de coloración y de agrupamiento por coloración de Gram y de requerimiento de los factores V y X (discos, Oxoid).4
Serotipificación. Se realizó aglutinación con partículas de látex (latéx Hib IPK). Como control se utilizó la cepa de referencia Eagan de Hib.
Biotipificación. Se evaluó la actividad ureasa, ornitina descarboxilasa y producción de indol, por el método de Kilian.4 Como controles se utilizaron las cepas de Proteus vulgaris ATCC 13315, Escherichia coli K99 y Salmonela cerro 18;74,723: SK 100158, donadas por el Laboratorio Nacional de Referencia de Enfermedades Diarreicas Agudas del Instituto de Medicina Tropical "Pedro Kourí" (IPK).
Fermentación de azúcares. Se emplearon los azúcares: D+ glucosa, D+ xilosa, fructosa, maltosa, lactosa y sacarosa (Merck) al 1 %, en medio líquido (Base Rojo Fenol, Difco), suplementada con NAD y hemina (10 mg/mL) (Merck), en tubos de 25 x 125 mm con tubo de Durham, según la metodología de Roberts.8 El inóculo se preparó como suspensión densa del microorganismo en solución salina fisiológica estéril 0,9 %; a partir de cultivo puro de 18 a 24 h de incubación. Como controles positivos se utilizaron las cepas de E. coli K99, P. vulgaris ATCC 13315, S. cerro 18;74,723: SK 10058 y Streptococcus pneumoniae serotipo 1. Como control negativo se empleó la base del medio de cultivo suplementada, sin añadir azúcares. Los caldos se incubaron a 35 °C, durante 24 h y hasta 7 d.
En una encuesta, se recogieron algunos datos del paciente, como la edad y el diagnóstico clínico. Los datos fueron procesados en una microcomputadoa IBM compatible, en una base de datos diseñada según el sistema Epi Info 5.01, del CDC de Atlanta.
RESULTADOS
El sistema de subtipificación de H. influenzae basado en la fermentación de azúcares, descrito por Tiller9 y modificado por Roberts y otros8 aparece en la tabla 1. Nosotros encontramos un patrón que no había sido reportado previamente (fructosa negativa, maltosa positiva y xilosa positiva) al que denominamos G.
TABLA 1. Patrones fermentativos de azúcares en Haemophilus influenzae
|
| Fermentación de fermentativo | ||
| Patrón | Fructosa | Maltosa | Xilosa |
| A* | + | - | + |
| B* | + | - | - |
| C* | - | - | + |
| D* | + | + | + |
| E* | - | - | - |
| F** | + | + | - |
* Tiller.9 ** Roberts y otros.8
Fuente: Laboratorio de Haemophilus, Instituto "Finlay", 1993.
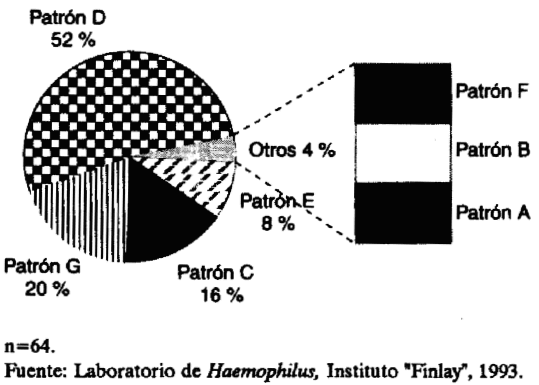
En nuestro estudio se observaron los 6 patrones descritos por Roberts y otros.8 La habilidad para fermentar fructuosa, maltosa y xilosa (D), constituyó el patrón más frecuente. Los patrones D y G en conjunto, representaron el 72 % del total de cepas estudiadas (figura).
FIGURA. Distribución de cepas según los patrones fermentativos de azúcares.
Todas las cepas utilizaron en su metabolismo la glucosa, sin producir gas, pero ninguna fermentó la lactosa ni la sacarosa.
El 92 % de las cepas fue Hib y el 8 % no b; por otra parte, el 80, 17 y 3 % pertenecían a los biotipos I, II y IV, respectivamente (datos no mostrados).
La combinación de los patrones fermentativos con los serotipos y biotipos, posibilitó subdividir este microorganismo en 14 grupos (tabla 2).
TABLA 2. Relación entre patrones fermentativos y serotipos/biotipos
|
| Serotipo/biotipo | |||||
| Patrón fermentativo | b/I | b/II | b/IV | no b/I | no b/II | no b/IV |
| A | 1 |
|
|
|
|
|
| B | 1 |
|
|
|
|
|
| C | 8 | 2 |
|
|
|
|
| D | 27 | 4 |
| 1 | 1 |
|
| E |
| 2 | 1 |
| 1 | 1 |
| F |
|
|
|
| 1 |
|
| G | 13 |
|
|
|
|
|
n=64. Fuente: Laboratorio Haemophilus, Instituto "Finlay", 1993.
La relación patrón fermentativo de azúcares-edad del paciente (tabla 3), mostró un predominio del patrón D en todos los grupos etarios, el C apareció en niños mayores de 6 meses, al igual que el A, B y F. El patrón G se manifestó en el grupo de 6 a 18 meses, con frecuencia relativa superior al resto (25,6 %).
TABLA 3. Distribución de cepas (No./%) según la edad del paciente y patrón fermentativo
|
| Edad (meses) | ||
| Patrón fermentativo | <6 | 6-18 | 18 |
| A | - | 1/2,3 | - |
| B | - | - | 1/7,1 |
| C | - | 8/18,6 | 2/14,3 |
| D | 4/57,1 | 23/53,5 | 6/42,9 |
| E | 2/28,6 | - | 3/21,5 |
| F | - | - | 1/7,1 |
| G | 1/14,3 | 11/25,6 | 1/7,1 |
| n=64 | n1=7 | n2=43 | n8=14 |
Fuente: Laboratorio de Haemophilus, Instituto "Finlay", 1993.
Al relacionar la tipificación de H. influenzae según patrones fermentativos de azúcares con el diagnóstico clínico (tabla 4), se evidenció una heterogenicidad en las cepas aisladas de IRA; en este grupo, el predominio del patrón D (39,1 %) fue relativamente inferior al grupo de MEB (55,6 %), los patrones E y F se asociaron sólo a IRA, mientras que el A y el B lo hicieron sólo a MEB. El patrón fermentativo G predominó en cepas aisladas de pacientes con MEB (27,9 %), respecto a aquéllas recuperadas de IRA (13 %); en otras infecciones no se identificó este patrón.
TABLA 4. Distribución de cepas (No./%) según diagnóstico clínico y patrón fermentativo
| Patrón fermentativo | Diagnóstico clínico | ||
| MEB | IRA | Otros | |
| A | 1/2,8 | - | - |
| B | 1/2,8 | - | - |
| C | 4/11,1 | 5/21,8 | 1/20 |
| D | 20/55,6 | 9/39,1 | 4/80 |
| E | - | 5/21,7 | - |
| F | - | 1/4,4 | - |
| G | 10/27,9 | 3/13 | - |
| n=64 | n1=36 | n2=23 | n8=5 |
Fuente: Laboratorio de Haemophilus, Instituto "Finlay", 1993.
DISCUSIÓN
El serotipaje ha sido utilizado en los últimos 50 a para diferenciar las cepas de H. influenzae.10 El biotipaje fue introducido posteriormente con este mismo fin.11 La utilidad de ambos métodos en el laboratorio de microbiología resulta limitada, dado el predominio estable de ciertos serotipos y biotipos en determinadas regiones geográficas.12 Existen otras técnicas más sensibles que el serotipaje y el biotipaje, que se emplean con fines epidemiológicos, como son el estudio de las proteínas de membrana externa y los lipopolisacáridos, el ribotipaje y el estudio isoenzimático;12,13 sin embargo, estas técnicas son complejas, caras y no todos los laboratorios poseen el equipamento necesario para desarrollarlas.4
El subtipaje según patrones fermentativos de azúcares ha sido propuesto como un método que se debe utilizar junto con el serotipaje y el biotipaje de H. influenzae.9 Esta combinación permitió ampliar la posibilidad de diferenciación de las cepas estudiadas en 14 grupos; sin embargo, de haberse relacionado exclusivamente los serotipos y biotipos se habrían podido subdividir las cepas en tan solo 6 grupos.
Roberts, al relacionar la fermentación de fructuosa, maltosa y xilosa con los biotipos, dividió esta especie en 14 grupos y al incorporar a su estudio la determinación de plásmidos, esta posibilidad se incrementó a 20 grupos diferentes.8
H. influenzae fermenta de forma inconstante la fructuosa, maltosa y xilosa.14
Nuestros resultados están en correspondencia con lo reportado en la literatura en relación con el predominio del patrón fermentativo D.8 Otros patrones han sido identificados con una frecuencia similar a la nuestra.8,9
Se conoce que todas las cepas de H. influenzae fermentan la glucosa sin producir gas4 y que no utilizan la lactosa ni la sacarosa;6 por otra parte, la fermentación de lactosa y sacarosa pudiera emplearse como una prueba presuntiva para diferenciar especies del género Haemophilus.4,15
Las edades tempranas constituyen el factor de riesgo más significativo de la enfermedad por H. influenzae16 y existe cierta asociación de algunos serotipos y biotipos con determinados grupos etarios.17
No hemos encontrado, hasta el momento, trabajos previos que relacionen los patrones fermentativos de azúcares y la edad del paciente.
Existe coincidencia entre nuestros resultados y el obtenido por Tiller, en cuanto a la asociación de los patrones A y B a MEB9 y el E y F a IRA.8 Roberts identificó el patrón D sólo a partir de IRA;8 nosotros, sin embargo, encontramos este último relacionado en mayor medida con MEB.
El estudio realizado permitió caracterizar cepas de H. influenzae circulantes en Ciudad de La Habana durante 1 a por el método de fermentación de azúcares; éste resultó sencillo, de fácil ejecución e interpretación y no requirió de un personal calificado, ni de un laboratorio especializado para su ejecución. Este método permitió una mayor capacidad discriminativa entre las cepas, al utilizarse junto al serotipaje y el biotipaje, por lo que pudiera constituir una herramienta útil en la caracterización de esta especie.
SUMMARY
64 Haemophilus influenzae strains circulating in Havana City during a year were characterized by the Carbohidrate fermentation method for the first time in Cuba. The fermentative pattern D was the most frequently found. Patterns D and G together were 72 % of the total of strains studied. The combination of the Carbohidrate fermentation with serotypping and biotyping allowed a greater differentiation of strains (14 groups). Patterns A, B, C and F appeared in children over 6 months of age, and pattern G in the group from 6 to 18. Patterns D and G predominated in the bacterial meningoencephalitis. A higher heterogeneity was observed among the strains isolated from acute respiratory infections. Some of the advantages of the Heaemophilus influenzae strains subtyping method are stressed, such as: simplicity, easiness to be applied and interpreted, and the fact that it is not necessary a qualified personnel or a specialized laboratory for its implementation.
Subject headings: HAEMOPHILUS INFLUENZE/classification; BACTERIAL TYPING TECHNIQUES; HAEMOPHILUS INFECTIONS; PROSPECTIVE STUDIES.
REFERENCIAS BIBLIOGRÁFICAS
- Jarosik GP, Hansen EJ. Identification of a new locus involved in expression of Haemophilus influenzae type b lipooligosaccharide. Infect Immun 1994;62:4861-7.
- Pasteur-Mérieux. Act-HIB. Vacuna contra el Haemophilus influenzae tipo b. Lyon;1993:1-51.
- Bishai WR, Howard NS, Winkelstein JA, Smith HO. Characterization and virulence analysis of catalase mutants of Haemophilus influenzae. Infect Immunol 1994;62:4855-60.
- Kilian M. Haemophilus. En: Ballows A, Hausler WJ, Shadomy HJ, eds. Manual of clinical microbiology. 5 ed. Washington DC: American Society for Microbiology, 1991:463-75.
- Joklik WC, Willett HP, Amos PB, Wilfert CN. Microbiology. 2 ed. Philadelphia: Appleton & Lange, 1993:461-72.
- Kilian M, Biberstein E. Haemophilus. En: Krieg N, Holts JG, eds. Bergey's Manual of systematic bacteriology. Chicago: Williams and Wilkins, 1984:558-70.
- O'Brien M, Colwell R. Characterization test appropiate for numerical taxonomy studies. En: Colwell R, Grigorova R, eds. Methods in microbiology. London: Academic, 1987:44-5.
- Roberts MC, Bell TA, Sandstrom KI, Smith AL, Holmes KK. Characterization of Haemophilus spp. isolated from infant conjunctivitis. J Med Microbiol 1986;21:219-24.
- Tiller FW. Biochemical differentiation of Haemophilus influenzae: additional characterization of biotypes by carbohidrate fermentation patterns. Zentral BL Mikrobiol Hyg Sect IA, 1982;253:236-46.
- MacPhernon CFC, Heidelberg M, Alexander HE, Leidy G. The specific polysaccharides of types a,b,c,d,e, and f of Haemophilus influenzae. J Immunol 1946;52:207-19.
- Kilian M. A taxonomic study of the genus Haemophilus with the proposal of a new species. J Gen Microbiol 1976;93:9-62.
- Alphen L van. Distinct geographic distribution of subtypes of Haemophilus influenzae type b in Western Europe. J Infect Dis 1987;156:216-8.
- Smith-Vaugham HC, Sriprakash KS, Mathews JD, Kemp DJ. Long PCR-Ribotyping of nontypeable Haemophilus influenzae. J Clin Microbiol 1995;33:1192-5.
- Piatkin K, Krivoshein Y. Microbiología. 2ed. Moscú: Editorial MIR, 1986:354-7.
- Mazloum HA, Kilian M, Mohamed ZM, Said MD. Differentiation of Haemophilus aegyptus and Haemophilus influenzae. Act Pathol Microbiol Immunol Scand Sect B, 1982;90:109-12.
- Liu VC, Smith AL. Molecular epidemiology of Haemophilus influenzae. Antibiot Agents Chemother 1992;45:30-45.
- De Groot R, Dzoljic-Danilovic G, Klingeren B van, Goessens WHF, Neijens HJ. Haemophilus influenzae: mechanisms, clinical importance and consequences for therapy. En: De Groot R, ed. Antibiotic resistance in Haemophilus influenzae. Rotterdam: Sophia's University, 1993;45-75.
Recibido: 19 de enero de 1996. Aprobado: 11 de abril de 1996.
Dr. Rafael Llanes Caballero. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.