My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.49 no.3 Ciudad de la Habana Sept.-Dec. 1997
Instituto de Medicina Tropical "Pedro Kourí"
UltramicroELISA indirecto para la detección de anticuerpos IgG en pacientes con fascioliasis
Dra. ANA MARGARITA ESPINO,1 Dra. LORENZA PADRÓN,2 Dra. BLANCA DUMÉNIGO3 y Lic. JOSÉ LAFERTÉ4
- Doctora en Ciencias Médicas. Investigadora Auxiliar. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
- Master en Infectología. Especialista de I Grado en Microbiología. Hospital Militar "Carlos J. Finlay".
- Médica Veterinaria. Investigadora Titular. IPK.
- Licenciado en Bioquímica. Investigador Auxiliar. IPK.
RESUMEN
Se describe la normalización de un ultramicroELISA para la detección de anticuerpos IgG anti-antígenos de excreción-secreción de Fasciola hepatica (UME-Fasciola). Se estudió un numeroso grupo de sueros entre los cuales 56 eran de pacientes con fascioliasis, 168 eran de pacientes con otras enfermedades parasitarias y 300 procedían de personas sanas, las cuales fueron utilizadas como controles negativos. Respecto al examen parasitológico considerado como "Regla de Oro", el UME-Fasciola mostró una sensibilidad del 100 %, especificidad de 98 % y valores predictivos para positivos y negativos de 90,3 y 100 %, respectivamente. Sólo se observó reacción cruzada con los sueros de pacientes infectados con Opistorchis felineus. Al comparar el UME-Fasciola con el ELISA convencional se obtuvo un índice de concordancia de 95,5 %.
Descriptores DeCS: IGG/análisis; ANTICUERPOS ANTI-IDIOTIPICOS/análisis; FASCIOLA HEPATICA/inmunología; ANTIGENOS HELMINTICOS/uso diagnóstico; ANTIGENOS HELMINTICOS/inmunología; FASCIOLIASIS/inmunología; FASCIOLIASIS/diagnóstico; TEST DE ELISA/normas; TEST DE ELISA/métodos.
La fascioliasis producida por Fasciola hepatica es una enfermedad zoonótica de gran importancia médico-veterinaria. Aunque en comparación con la infección animal la infección humana es poco común, en las últimas 2 décadas se han reportado más de 3 000 casos en más de 40 países de todos los continentes.1 Cuba es uno de los más afectados y donde la enfermedad se presenta cada vez más frecuente, no sólo de manera esporádica sino también de forma epidémica.2,3
El diagnóstico de la fascioliasis humana está basado en el hallazgo de los huevos del parásito en las heces o en el fluido duodenal, pero éste presenta serias dificultades: durante la fase prepatente no es posible el hallazgo de los huevos pues el parásito se encuentra migrando por el parénquima hepático sin llegar a la madurez sexual, y durante la fase patente cuando ya el parásito se encuentra maduro alojado en los conductos biliares, la excreción de huevos es intermitente. Es por esta razón que el inmunodiagnóstico ha constituido una alternativa necesaria e indispensable para lograr el diagnóstico de esta parasitosis.
De los métodos de inmunodiagnóstico más ampliamente utilizados para el diagnóstico de la fascioliasis, los ensayos inmunoenzimáticos han sido los más utilizados en cualquiera de sus 2 alternativas: la detección de anticuerpos4-6 y la detección de antígenos; 7-9 nuestro grupo de investigación ha desarrollado con éxito, en ambas direcciones, un conjunto de técnicas altamente sensibles y específicas, que emplean respectivamente para estos fines, antígenos de excreción-secreción10 y el AcM ES78 que reconoce estos antígenos.11
El sistema ultramicroanalítico (SUMA) y las técnicas de rango ultramicroanalítico (UME) han sido aplicados con éxito en diferentes programas de control en la vigilancia epidemiológica de muchas enfermedades de importancia médica en Cuba. Este sistema ha tenido entre otras aplicaciones la detección de anticuerpos contra citomegalovirus,12 herpes simple13, el antígeno de superficie de la hepatitis B14, el diagnóstico de malformaciones abiertas del sistema nervioso central en el feto, la determinación de hipertiroidismo congénito en el recién nacido y el diagnóstico de la amebiasis.15
En el presente trabajo nos propusimos estandarizar un UME indirecto para la detección de anticuerpos IgG anti-F. hepatica (UME-Fasciola), empleando como antígenos los productos de excreción-secreción del parásito adulto, y comparar sus resultados con los obtenidos con el ELISA indirecto que se realiza rutinariamente en nuestro laboratorio.
MÉTODOS
ANTÍGENOS DE EXCRECIÓN-SECRECIÓN
Los antígenos de excreción-secreción (ES) fueron obtenidos a partir del mantenimiento in vitro de adultos de F. hepatica según el procedimiento descrito en trabajos previos.16
MUESTRAS DE SUERO ESTUDIADAS
Se estudió un total de 524 muestras de suero de las cuales 56 eran de pacientes infectados con F. hepatica, cuyo diagnóstico pudo confirmarse por técnicas parasitológicas mediante el hallazgo de los huevos del parásito en las heces fecales o el fluido duodenal. Otras 168 muestras eran de pacientes infectados con otros parásitos (21 con Trichurus trichiura, 25 con Ascaris lumbricoides, 11 con Giardia lamblia, 9 con Necator americanus, 42 con Plasmodium falciparum, 10 con Toxocara canis, 14 con Schistosoma mansoni,3 con Opistorchis felineus y 22 con Entamoeba histolytica) cuyos diagnósticos también fueron confirmados por técnicas parasitológicas. Las 300 restantes fueron obtenidas de donantes de sangre que no presentaban antecedentes recientes de infección por F. hepatica y que al examen parasitológico resultaron negativos a éste y otros helmintos parásitos.
ENSAYO ULTRAMICROANALÍTICO (UME-FASCIOLA)
Se estandarizó un ultramicroELISA en fase sólida para la detección de anticuerpos anti-Fasciola mediante el sistema automatizado SUMA modelo 121B, espectrofluorímetro nefelómetro, acoplado a una microcomputadora y una multipipeta computadorizada de96 posiciones ERIZO 101 (Centro de Inmunoensayo, Ciudad de La Habana, Cuba).
Para la realización de esta técnica se utilizaron 2 tipos de controles, 1 control positivo preparado mediante la mezcla de 3 sueros de pacientes con Fasciola hepatica, seleccionado al azar entre aquéllos que por un ELISA indirecto presentaran valores de absorbancia de 1,0 a 1,5; y un control negativo preparado mediante la mezcla de 3 sueros de donantes de sangre que por el ELISA indirecto mostrara valores de absorbancia inferiores a 0,1.
Para determinar la concentración de antígeno para el recubrimiento, así como las diluciones de trabajo para sueros y conjugado, se realizó una titulación simultánea cruzada de varias concentraciones de antígeno (desde 10 a 80mg/mL) preparadas en tampón carbonato-bicarbonato 0,05 M pH 9,6; varias diluciones de los sueros controles (desde 1:20 a 1:320) preparadas en tampón Tris-HCL15 mM pH 7,8; que contenía 0,05 % de Tween 20 (Tris-T); y diluciones desde 1:500 a 1:2 000 de un conjugado anti-IgG humana/fosfatasa alcalina, preparadas en Tris-T que contenía 5 % de suero normal de carnero; se eligió como concentración óptima de antígeno un valor intermedio dentro de la zona de saturación de la placa y como dilución óptima para sueros y conjugado aquélla donde se obtuviera una diferencia entre controles positivos y negativos mayor que 10 veces.
El procedimiento seguido para el UME-Fasciola fue el siguiente: se utilizaron placas de ultramicroELISA de cloruro de polivinilo (PVC, SUMA, Centro de Inmunoensayo) con capacidad máxima de 30 mL, las cuales fueron sensibilizadas durante 16 h a 4 EC con 10 mL del antígeno a la concentración de trabajo previamente determinada. Posteriormente, las placas fueron lavadas 4 veces con tampón Tris-T y los espacios libres de antígeno fueron bloqueados durante 1 h a 37 EC con 15 mL de albúmina bovina al 0,1 % y sacarosa al 5 % disuelta en el tampón de lavado. Al finalizar la incubación se eliminó la solución bloqueadora al añadir en cada pocillo 10 mL de los sueros a la dilución de trabajo previamente establecida, los cuales fueron incubados durante 30 min a 37 EC. Posteriormente, las placas fueron nuevamente lavadas con Tris-T, después se añadieron 10 mL por pocillo de la dilución de conjugado, el cual se incubó durante 30 min a 37 EC. Finalmente las placas fueron lavadas 4 veces con Tris-T, posterior a lo cual se añadieron 10 mL de la solución de sustrato (4-metillumbelliferona phosphate ) (Koch Light Limited Haverhill Suffolk, Inglaterra), el cual fue incubado durante 30 min a temperatura ambiente. Al finalizar la incubación, el contenido fue transferido automáticamente a una placa de cuarzo en la cual se incluyó además, como blanco, 10 mL de 4-metillumbelliferona 1,4 mM diluida 1:10 en agua destilada y se procedió a la lectura en el fotómetro del equipo.
A cada valor de fluorescencia obtenido se le restó el valor del blanco y los resultados fueron expresados en tantos por cientos de fluorescencia, se tomó como 100 % la fluorescencia del control positivo.
ELISA INDIRECTO
De las 524 muestras de suero estudiadas se seleccionó al azar un total de 204 (30 de pacientes con F. hepatica, 74 de pacientes infectados con otros parásitos y 100 controles negativos) que se estudió en paralelo mediante un ELISA indirecto, se siguió exactamente el procedimiento descrito por nuestro grupo en trabajos previos.10
ANÁLISIS ESTADÍSTICO
Cada ensayo fue repetido 3 veces y los resultados para cada muestra estudiada fueron expresados como la F media para cada determinación. Teniendo en cuenta que las escalas de nuestros días son cuantitativas y conociendo que para las mediciones de las técnicas inmunoenzimáticas ha sido comprobada la suposición de normalidad,17,18 los resultados fueron considerados positivos cuando la F obtenida fuese mayor que la F media más 2 desviaciones estándar (DE) del grupo control negativo. Se aplicó la distribución t de Student de comparación de medias para investigar las diferencias entre los grupos positivos, negativos y de reacción cruzada.
Fueron utilizadas 6 muestras de sueros de pacientes con fasciolosis y 6 de los controles negativos para evaluar la reproductibilidad y la repetibilidad del ensayo, para lo cual, cada muestra fue colocada en diferentes posiciones de la placa y analizadas por 2 operaciones diferentes durante 4 d consecutivos.
Se calcularon la especificidad, la sensibilidad y los valores predictivos del UME-Fasciola, se tomó como referencia el examen coproparasitológico y se siguió el procedimiento recomendado por Haynes19 para estos fines. La concordancia entre los resultados obtenidos por el UME-Fasciola y el ELISA indirecto fue estudiada mediante la prueba de hipótesis de Kappa.
RESULTADOS
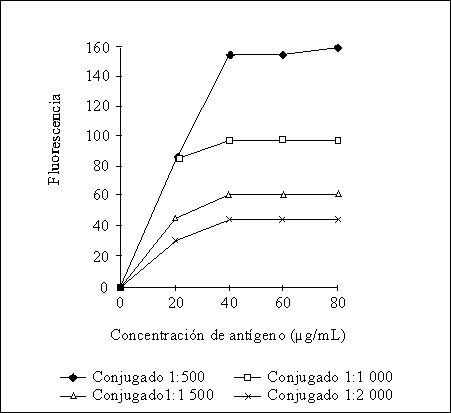
En el presente trabajo se logró normalizar un ultramicroELISA para la detección de anticuerpos IgG anti-F.hepatica. Las concentraciones óptimas de recubrimiento para el antígeno, así como las diluciones adecuadas de los sueros y el conjugado se establecieron al titular por separado cada uno de los componentes del sistema y seleccionar aquellas diluciones de reactantes que permitieran una adecuada discriminación entre los sueros controles positivos y negativos utilizados. Como se observa en la figura, el inicio de la zona de saturación de la placa comienza a la concentración de 40 mg/mL, consideramos como concentración óptima de antígeno para el recubrimiento 50 mg/mL por ser un valor intermedio dentro de la zona de saturación y evitar de esta manera variaciones innecesarias en los ensayos debidas a errores de manipulación. Como dilución óptima de suero conjugado se seleccionaron las diluciones 1:40 y 1:1 000, respectivamente, por ser aquéllas donde se obtuvo la mayor diferencia entre controles positivos y negativos por encima de 10.
FIGURA. Curva de saturación de la fase sólida con antígenos de ES de Fasciola hepatica a diferentes diluciones de conjugado. La dilución de suero empleada fue 1:40.
El valor de corte fue determinado mediante el estudio de los 300 sueros negativos. Los valores de F en este grupo oscilaron en el rango de 0,05-0,4 con un valor medio de 0,15 y una DE=0,095; por lo que se consideró positiva toda muestra de suero cuyo valor de F fuera mayorque0,34.Segúnestevalordecorte todos los pacientes infectados con F. hepatica resultaron positivos con valores que oscilaron en el rango de 0,35-1,5 con una media de 0,61 (DE=0,34).
Siguiendo este criterio, también 6 de los 300 sueros utilizados como controles negativos resultaron positivos aunque con valores de absorbancia muy próximos al valor de corte (0,36-0,38) para una media de 0,36 (DE=0,03).
Tomando como referencia el examen parasitológico como "Regla de Oro", el UME-Fasciola presentó una sensibilidad del 100 % y una especificidad del 98 %, con valores predictivos para positivos y negativos de 90,3y 100 %, respectivamente. Se obtuvieron diferencias altamente significativas entre el grupo control negativo y el grupo de pacientes con fascioliasis para una p<0,01. Los estudios de repetibilidad y reproductibilidad del UME-Fasciola mostraron resultado satisfactorios, ya que en todos los casos las variaciones intra e interensayos fueron inferiores al 5 %.
Al estudiar por el UME-Fasciola los sueros de pacientes infectados con otros parásitos se observó que los únicos que mostraron reacción positiva fueron los de pacientes infectados con O. felineus, con valores de F entre0,38-0,45 y valores medios de 0,38 (DE=0,08). Para el resto de los sueros no se observó reacción cruzada, se obtuvieron diferencias altamente significativas(p<0,01) para valores de Fen el rango de 0,05-0,19 (0,095 "0,08).
COMPARACIÓN DEL UME-FASCIOLA Y EL ELISA
Con el propósito de comparar el UME-Fasciola con el ELISA, se estudió en paralelo por ambas técnicas un total de 204 muestras de suero. Como se observa en la tabla, un total de 195 muestras resultó coincidente para un índice de concordancia del 95,5 %. De las muestras concordantes 30 pertenecían a pacientes con fascioliasis, 71 a pacientes infectados con otros parásitos y 94 a controles negativos. Dentro de las no concordantes se encontraban los 3 casos infectados con O. felineus y 6 controles negativos.
TABLA. Comparación entre el UME-Fasciola y el ELISA
|
| ELISA positivo | ELISA negativo | Total |
| UME positivo | 30 | 9 | 39 |
| UME negativo | 0 | 165 | 165 |
| Total | 30 | 174 | 204 |
DISCUSIÓN
Uno de los aspectos más importantes que se debe tener en cuenta en el montaje de cualquier método de diagnóstico que detecte anticuerpos es la calidad del material antigénico que se vaya a utilizar; de tal modo que la especificidad del antígeno y la sensibilidad del sistema de detección sean 2 propiedades que, una vez optimizadas, proporcionen un método eficaz para el diagnóstico de cualquier entidad infecciosa o parasitaria.
Desde que en 1987 nuestro grupo publicó la utilización de ensayos inmunoenzimáticos de rango microanalítico10 en el empleo de antígenos de excreción-secreción de parásitos adultos, el diagnóstico serológico de la fascioliasis humana alcanzó niveles elevados de especificidad, puesto que antes de este trabajo se reportaban con frecuencia inespecificidades y reacciones cruzadas en estos ensayos con el empleo de antígenos crudos, tegumentarios20-22 e incluso con antígenos metabólicos.23
Para llegar a este resultado hubo que realizar un minucioso estudio sobre las condiciones de sobrevivencia de F. hepatica en un medio libre de suplementos proteicos, se llegó a la conclusión de que los antígenos colectados durante las primeras 24 h de mantenimiento in vitro eran los más específicos10 y superaban en su uso diagnóstico a los antígenos somáticos y tegumentarios.20 Sin embargo, debido a que F. hepatica posee antígenos comunes a otros trematodes tales como Schistosoma mansoni, Opistorchis felineus, Chlonorchis sinensis y Paragonimus westermani,24 estaba entre las posibilidades que cuando se utilizara una técnica de mayor sensibilidad comenzaran a encontrarse algunas reacciones inespecíficas, ya que el procedimiento diseñado para la obtención de los antígenos de ES de 24 h minimiza, pero en modo alguno elimina, la posibilidad de reacciones cruzadas.
Los ensayos de rango ultramicroanalítico y, en especial, aquéllos que, como el UME, utilizan sustratos fluorogénicos, poseen una extraordinaria sensibilidad que supera varias veces a los de rango microanalítico; de modo que algunas reacciones antígeno-anticuerpo e incluso reacciones inespecíficas que con el ELISA no son observadas pueden hacerse evidentes con el UME, y ésta pudiera ser una de las causas que explique en el presente estudio la presencia de la reacción cruzada observada con los sueros de pacientes con opistorchiasis, y la no concordancia entre este resultado y el obtenido con el ELISA al emplear el mismo tipo de antígeno.
Además de las sensibilidad incrementada por el tipo de sustrato, otras diferencias de procedimiento entre el UME y el ELISA podrían también explicar los resultados discordantes observados. Éstas son, entre otras, los volúmenes utilizados para cada reactivo (10 mL para el UME, 100 mL para el ELISA), y las diferencias en la dilución de los sueros (1:40 para el UME, 1:800 para el ELISA). Tal como se estableció en el presente estudio, para la dilución 1:40 de los sueros existe una buena sensibilidad y una adecuada relación entre positivos y negativos; sin embargo, se observa muy baja especificidad para los sueros de pacientes con opistorchiasis. Para solucionar este problema sería apropiado estudiar las curvas de dosis-respuesta de estos sueros en comparación con la de los sueros de pacientes con fascioliasis, para de esta manera elegir una nueva dilución de trabajo con la que se logra eliminar la reacción cruzada; aunque teniendo en cuenta que este procedimiento pudiera resultar en una disminución de sensibilidad para detectar los casos de fascioliasis con más bajos valores de F, consideramos inconveniente realizarlo, ya que la opistorchiasis es una enfermedad propia del sudeste asiático que no es frecuente en nuestro medio, por lo que falsos positivos de este tipo pudieran ser despreciables.
Una solución semejante podría proponerse para eliminar los 6 falsos positivos encontrados con el UME entre los controles negativos, y de esta manera eliminar la discordancia entre esta técnica y el ELISA. Sin embargo, como se dijo anteriormente, los 300 sueros utilizados como controles procedían de personas sanas que asistieron como donantes a los bancos de sangre y que en el momento del estudio eran clínica y parasitológicamente negativos a F. hepatica y otros helmintos, condición que en modo alguno excluye la posibilidad de una exposición anterior a la infección por este parásito. Teniendo esto en consideración, la positividad encontrada por el UME-Fasciola en estos 6 casos pudiera también ser debida a la presencia de niveles muy bajos de anticuerpos de memoria, que sólo con una técnica de gran sensibilidad pudieron ser detectados. De cualquier modo, intentar eliminar este pequeño porcentaje de falsos positivos (2 %) con la variación del valor de corte o el cambio de la dilución de suero, podría resultar en una disminución de la sensibilidad del método, y traer, por consiguiente, la aparición de falsos negativos.
El UME-Fasciola al igual que el ELISA es una técnica que detecta anticuerpos, por lo que su positividad no puede ser en modo alguno considerada como un criterio de infección activa, ya que se ha demostrado que muchos pacientes ya curados mantienen elevados niveles de anticuerpos contra el parásito por períodos que pueden llegar hasta 2 ó 3 años;25 por tal razón, ante la duda de si estamos en presencia de una real infección por F. hepatica, de una infección pasada o simplemente de una reacción cruzada, lo más recomendable es acudir a las técnicas de detección de antígenos que emplean anticuerpos monoclonales,11 las cuales han sido reportadas por nuestro grupo para el diagnóstico con muy buenos resultados; sin embargo, teniendo en cuenta el elevado nivel de automatización del UME, los escasos volúmenes de reactivos que emplea y que hacen económico su uso, unido al hecho de que en varias provincias del país exista un equipo SUMA, recomendamos el empleo de esta técnica en estudios seroepidemiológicos en poblaciones de riesgo.
SUMMARY
The standardization of an ultramicroELISA for the detection of IgG antibodies anti excretory-secretory antigens of Fasciola hepatica (UME-Fasciola) is described. It was studied a considerable group of sera of which 56 were from patients with fascioliasis, 168 from patients with other parasitic diseases, and 300 from sound persons that were used as negative controls. As regards the parasitology testconsideredas"GoldS tandard",theUME-Fasciola showed a sensitivity of 100 %, an specificity of 98 %, and predictive values for positives and negatives of 90.3 % and 100 %, respectively. Cross-reaction was only observed with the sera from patients infected with Opistorchis felineus. On comparing the UME-Fasciola with the conventional ELISA, it was obtained a concordance index of 95.5 %.
Subject headings: IGG/analysis; ANTIBODIES, ANTI-IDIOTYPIC/analysis; FASCIOLA HEPATICA/immunology; ANTIGENS, HELMINTH/diagnostic use; ANTIGENS, HELMINTH/immunology; FASCIOLIASIS/immunology; FASCIOLIASIS/diagnosis; ENZYME-LINKED IMMUNOSORBENT ASSAY/standards; ENZYME-LINKED IMMUNOSORBENT ASSAY/ methods.
REFERENCIAS BIBLIOGRÁFICAS
- Chen MG, Mott KE. Progress in assessment of morbidity due to Fasciola hepatica infection: a review of a recent literature.Trop Dis Bull 1990;87:1-38.
- González JF, Pérez O, Rodríguez G, Aros E, Lastre M. Fascioliasis humana epidémica, Cuba 1983. VI. Estudio clínico de 44 adultos del Hospital General de Fomento. GEN 1985;39:276-81.
- Espino AM, Díaz A, Millan JC, Finlay CM. Detection of antigenemia and coproantigens during a human Fasciola hepatica outbreak. J Clin Microbiol 1997 (en prensa).
- Arriaga C. Comparison of a Dot-ELISA, passive haemagglutinationtest and thin layer immunoassay in the FAST-ELISA for the immunodiagnosis of nature or experimental Fasciola hepatica infection in sheep. Vet Parasitol 1988;30:197-203
- Hillyer GV, Soler de Galanes M. Initial feasibility studies of the FAST-ELISA for the immunodiagnosis of fascioliasis. J Parasitol 1991;77:362-5.
- Hillyer GV, Soler de Galanes M, Rodríguez-Pérez JB, Lagrava MS, Ramírez-Guzmán S, Bryan RT. Use of the Falcon assay screenig test enzyme-linked immunosorbent assay (FAST ELISA) and the enzyme-linked immunosotransferblot (EITB) to determine the prevalence of human fascioliasis in the Bolivian altiplano. Am J Trop Med Hyg 1992;46:603-9.
- Ambroise-Thomas P, Desgeorge PT, Bouttaz M. Diagnosis of human and bovine fascioliasis by means of enzyme-linked immunosorbent assay (ELISA): detection of circulating antibodies and/or antigens. Ann Soc Belge Med Trop 1980;60:47-60.
- Knobloch J. Human fascioliasis in Cajamarca/Perú. II. Humoralk antibody response and antigenemia. Trop Med Parasitol 1985;36:91-3.
- Youssef RG, Mansour NS, Azis AG. Early diagnosis of human fascioliasis by the detection of coproantigens using counterimmunoelectrophoresis. Trans R Soc Trop Med Hyg 1991;35:383-4.
- Espino AM, Duménigo BE, Fernández R, Finlay CM. Immunodiagnosis of human fascioliasis by enzime-linked immunosorbent assay usingexcretory secretory products. Am J Trop Med Hyg 1987;37:605-8.
- Espino Am, Finlay CM. Sandwich enzyme-linked immunosorbent assay for the detection of excretory secretory antigens in human with fascioliasis. J Clin Microbiol 1994;32:190-3.
- Laferté J, Marrero M, Álvarez M, Jomarrón L, García S, Vázquez S, et al. UltramicroELISA indirecto para la detección de anticuerpos totales a citomegalovirus en suero humano. Rev Inst Med Trop Sao Paulo 1992;34:43-7.
- Ribas MA, Vázquez S, Laferté J, Álvarez M. Normalización y aplicación de un ultramico ELISA para la detección de anticuerpos al virus herpes simple. Rev Cubana Med Trop 1992;44:104-8.
- Rodríguez L, Balmaseda A, Bravo J, Trujillo J, Martínez L, Ochoa R, et al. Validación de un ultramicroELISA de detección de anticuerpos contra el antígeno de superficie de la hepatitis B. Rev Cubana Med Trop 1996;48:45-9.
- Melchor A, Alberti E, Fonte L. Estandarización y validación de un inmunoensayo para la detección de Entamoeba histolytica en heces (SUMA). Av Biot Mod 1992;1:17-21.
- Espino AM, Duménigo BE, Huesca N, Finlay CM. Mantenimiento in vitro de adultos de Fasciola hepatica: obtención de antígenos de excreción-secreción. Rev Salud Animal 1988;10:287-93.
- Stone AA, Schwattz JE, Vladimarszttir H, Napoli A, Neale JM, Cox DS. An alternative statistical treatment for summarizing the central tendency of replicate assay date. J Immunol Method 1991;136:111-7.
- Karspinki KF. Optimality assessment in the enzyme-linked immunosorbent assay (ELISA). Biometrics 1990;46:38-46
- Haynes RB. Clinical Eidemiology Rounds. How to read clinical Journals:II.Tobarn about a diagnostic test. CMA 1981;124: 703.
- Mansour NS, Youssef FG, Mickhail EM, Boctor FN. Use of a partially purified Fasciola gigantica worm antigen in the serological diagnosis of human fascioliasis in Egypt. Am J Trop Med Hyg 1983;32:550-4.
- Espino AM, Seuret N, Morlote C, Duménigo BE. Antígenos de Fasciola hepatica, su utilidad en el diagnóstico de la fascioliasis. Rev Cubana Med Trop 1991;43:151-5.
- Hillyer GV, Serrano A. Fractionation of Fasciola hepatica tegument antigens and their application to the serodiagnosis of experimental fascioliasis by th enzyme-linked immunosorbent assay. J Helminthol 1986;60:173-8.
- Pfister CH, Daveau P, Ambroise-Thomas P. Partial purification of somatic and excretory products of adult Fasciola hepatica and their application for the serodiagnosis of experimental andnaturalfascioliasisusing an ELISA. Res Vet Sci 1984; 37:39-43.
- Hillyer GV, Serrano AE. The antigens of Paragonimus westermani, Schistosoma mansoni and Fasciola hepatica adult worm.Am J Trop Med Hyg 1983;32:350-8.
- Espino AM, Millan JC, Finlay CM. Detection of antibodies and circulating excretory - secretory antigens for assessing cure in patients with fasciolosis. Trans R Soc Trop Med Hyg 1992;86:649.
Recibido: 3 de marzo de 1996. Aprobado: 24 de diciembre de 1996.
Dra. Ana Margarita Espino. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.