Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.49 n.3 Ciudad de la Habana sep.-dic. 1997
Instituto de Medicina Tropical "Pedro Kourí"
Reacciones adversas y respuesta inmune de la vacuna Heberbiovac-HB aplicada a lactantes, simultáneamente con la DPT y la VA-MENGOC-BC
Dr. MANUEL DÍAZ GONZÁLEZ,1 Dra. LICEL RODRÍGUEZ LAY,2 Enf. AMELIA URBINO LÓPEZ-CHÁVEZ,3 Dr. JOSÉ R. BRAVO GONZÁLEZ4 y Dr. PLÁCIDO PEDROSO FLAQUET5
- Especialista de I Grado en Epidemiología. Investigador Agregado.
- Especialista de I Grado en Virología. Investigadora Agregada.
- Enfermera especializada.
- Especialista de I Grado en Bioestadísticas. Investigador Agregado.
- Especialista de II Grado en Epidemiología. Investigador Agregado.
RESUMEN
Se aplicó la vacuna recombinante cubana ( Heberbiovac-HB) derivada de células de levaduras, contra el virus de la hepatitis B, a la dosis de 10Fg, a 2 grupos de niños de edades de 3 meses y esquema de 0, 1 y 6, y 0, 1, 2 y 12 en coincidencia con las vacunas DPT y antimeningocócica, según se establece en el programa de inmunizaciones. Se estudió la reactogenicidad e inmunogenicidad en ambos grupos, las reacciones observadas fueron ligeras y similares a otros estudios, donde la febrícula, eritema e induración fueron los signos más frecuentes. Ambos grupos mostraron altos porcentajes de niños con títulos de anticuerpos anti-HBs superiores a 100 UI/L-1. Se demuestra la aceptable reactogenicidad de la vacuna y la no interferencia inmunológica por las otras vacunas aplicadas.
Descriptores DeCS: VACUNAS CONTRA HEPATITIS B/efectos adversos; VACUNAS CONTRA HEPATITIS B/ /administración & dosificación; REACCIONES ANTIGENO-ANTICUERPO/efectos de drogas; ESQUEMA DE INMUNIZACION; VACUNAS SINTETICAS; VACUNA DIFTERIA-TETANO-PERTUSSIS; NEISSERIA MENINGITIDIS/inmunología; VACUNAS BACTERIANAS.
La inmunización es el modo más efectivo y de bajo costo para combatir las enfermedades infecciosas. Desde principios de la década de los 70 se hicieron estudios para la búsqueda de una vacuna efectiva contra la hepatitis B, las primeras fuentes de antígeno lo constituyeron el plasma de pacientes asintomáticos.1 La primera generación de vacunas recombinantes sólo estuvo disponible a principios de la pasada década.2
Las vacunas producidas a partir de técnicas recombinantes de ADN se han impuesto por tener bajo costo, mejor tolerancia, estabilidad, posible uso con otros inmunógenos y alto poder inmunogénico.3 La recomendación más reiterada y común es la vacunación masiva en niños, que presenta varias ventajas: a) protección en edades tempranas, donde la posibilidad de convertirse en portador crónico es mayor, b) ser un grupo que recibe con mayor periodicidad la atención médica, abarata su costo, c) menor reactogenicidad, d) mayor inmunorrespuesta, e) posibilidad de ser utilizada en combinación con otras vacunas: DPT, PRS (parotiditis, rubéola y sarampión), Haemophilus influenzae tipo B, antipolio, sin interferencias y simultáneamente. Algunos de estos productos ya están disponibles y se espera que otros, combinados de éstos y otros inmunógenos, estén a nuestro alcance en el futuro.3-6 Heberbiovac-HB ha sido probada en dosis de 20 Fg en adultos y de 10 Fg en adultos y recién nacidos, esta última dosis también se ha empleado para niños preescolares y escolares de primaria y secundaria básica.
Dichos estudios señalan que la reactogenicidad en esta vacuna es ligera, no existe prácticamente hipersensibilidad, los síntomas disminuyen con las dosis. Los síntomas locales más frecuentes encontrados han sido el eritema, la induración y el dolor, y entre los generales la fatiga.7
El presente estudio persigue el objetivo de conocer el comportamiento reacto-inmunogénico en niños lactantes cuando hacemos coincidir la aplicación en diferentes sitios de inyección y al mismo tiempo de 3 vacunas incluidas en el esquema de vacunación del Programa Nacional de Inmunización tomando como base el esquema utilizado para DPT.
MÉTODOS
DISEÑO
Nuestro trabajo estudia la reactogenicidad en 2 grupos de lactantes al aplicárseles las vacunas DPT, antimeningocócica BC (VA-MENGOC-BC) y antihepatitis B (Heberbio-vac-HB), combinación no estudiada hasta ahora. Se respetan el número de dosis y la cantidad de inmunógeno que se debe administrar de cada una de los vacunas. Tiene la característica deser un ensayo de campo no experimental de vacuna, donde la comparación se hizo interna dentro de los grupos y entre los grupos constituidos por niños de 3 meses, fecha en que se inicia la aplicación de la vacuna DPT.
MUESTRA
El estudio se realizó en 2 áreas de salud del municipio La Lisa de Ciudad de La Habana. La muestra estuvo constituida por niños lactantes de 3 meses, con el consentimiento de padres o tutores; 34 residentes en el área de salud "Cristóbal Labra" y 38 pertenecientes al "Elpidio Berovides", agrupados en 2 cohortes en las que 34 niños recibieron el esquema 0, 1, 2 y 12 (grupo A) y a 38 les fue administrado el esquema 0, 1 y 6 (grupo B) de la vacuna Heberbiovac-HB, mientras que a todos se les aplicaron los esquemas establecidos para DPT y VA-MENGOC-BC. La muestra consistió en los nacidos de ambas áreas en un mismo mes para la variante de esquema A y a los nacidos en el mes siguiente se les asignó el esquema B.
METÓDICA
El estudio consistió en hacer coincidir en un mismo momento de vacunación la aplicación de las vacunas DPT, antimeningocócica BC (VA-MENGOC-BC) y antihepatitis B (Heberbio-vac-HB), todas incluidas en el esquema de vacunaciones del Programa Nacional de Inmunización de la República de Cuba (anexo).
La aplicación de las vacunas en el estudio correspondió con el esquema de administración que se muestra en la tabla 1.
TABLA 1. Aplicación de las vacunas
| Esquemas | Meses de edad | ||||
| Utilizados | 3 | 4 | 5 | 9 | 15 |
|
| DPT | DPT | DPT |
|
|
| A (0, 1, 2 y 12 meses) | VA-MENGOC-BC |
| VA-MENGOC-BC |
|
|
|
| Heberbiovac-HB | Heberbiovac-HB | Heberbiovac-HB | Heberbiovac-HB |
|
|
| DPT | DPT | DPT |
|
|
| B (0, 1 y 6 meses) | VA-MENGOC-BC | VA-MENGOC-BC |
|
|
|
|
| Heberbiovac-HB | Heberbiovac-HB |
| Heberbiovac-HB |
|
A los 2 grupos de niños se les aplicó la vacuna recombinante Heberbiovac-HB a la dosis de 0,5 mL (10 Fg) y vía intramuscular (i.m.). Se escogió la dosis de 0,5 mL de vacuna (10 Fg) debido a ser la recomendada por el productor y la aprobada en el actual esquema de vacunación del país. Las dosis y vías de las vacunas DPT (0,5 mL y vía i.m.) y VA-MENGOC-BC (0,5 mL y vía i.m.) son las establecidas en el Programa Nacional de Inmunizaciones. El sitio de la inyección utilizado para Heberbiovac-HB fue en la región anterolateral del muslo derecho, recomendada por el productor de la vacuna; la DPT, en el deltoides izquierdo y la VA-MENGOC-BC en el deltoides derecho. Todas las vacunas fueron administradas en el mismo momento, con jeringuillas desechables de 1 mL y aguja 23Gx1" individuales, 1 para cada vacuna. Los inmunógenos fueron aplicados por una misma enfermera, entrenada en estudios anteriores y con la presencia del pediatra dotado de todos los medios para la atención de urgencia en un local acondicionado al efecto en el policlínico. Los niños fueron sometidos en cada aplicación a vigilancia médica por espacio de 1 h en la referida unidad de salud y posteriormente seguidos en su residencia por el médico de la familia, que les dispensó una visita diaria durante los 3 d inmediatos posteriores a la vacunación. En cada consulta se midió la temperatura, se observó la posible presencia de signos locales o de otra ubicación, y se indagó con las madres o encargados inmediatos de los niños por la ocurrencia de otras manifestaciones clínicas observadas en las 24 h anteriores. Los médicos de la familia fueron previamente entrenados por el responsable de la investigación en el reconocimiento de los síntomas y signos que se debían observar. No se realizó observación a los 9 y 15 meses por aplicarse solamente la vacuna Heberbiovac-HB.
La inmunogenicidad fue medida mediante la obtención por vinipuntura de una muestra de 3 mL de sangre a los niños de 18 meses de edad, para ambos esquemas de aplicación. Se decide la extracción a los 18 meses por existir en dicha fecha garantía de inmunidad contra el tétanos al haberse aplicado completamente el esquema de DPT (4ta. dosis a los 17 meses). La muestra fue procesada por el Laboratorio de Referencia de Hepatitis del Instituto de Medicina Tropical "Pedro Kourí" (IPK). Los títulos de anticuerpos anti-HBs fueron medidos por la técnica ultramicroanalítica (SUMA) desarrollada por el Centro de Inmunoensayos (CIE).
ASPECTO ÉTICO
Para garantizar la voluntariedad de la participación en el estudio se realizó una consulta con los padres, donde se les explicó en que consistía éste y se solicitó la aprobación de la participación de sus hijos. A los padres que estuvieron de acuerdo se les entregó una carta donde se explicó por escrito el procedimiento del estudio, en la cual ellos firmaron la aprobación de participación de sus hijos.
ANÁLISIS ESTADÍSTICO
Se crearon bases de datos en Epi Info y Epistat. El estadístico utilizado fue la prueba de diferencias de proporciones para variables nominales (síntomas y signos), así como de la t de Student, y análisis de medias y de varianzas para variables cuantitativas continuas (títulos de anti-HBs).
RESULTADOS
REACCIONES ADVERSAS
Fue estudiada la reactogenicidad de 72 niños que completaron los respectivos esquemas, divididos en 34 correspondientes al grupo A y 38 pertenecientes al grupo B; en el primer grupo le correspondió al sexo masculino el 67,6 % y al femenino el 32,4 y en el segundo al masculino el 47,4 % y al femenino el 52,6. Los niños el grupo A no fueron observados después de la dosis de refuerzo. El total de observaciones por grupo fue de 102 y 114 en cada una de las 3 oportunidades, lo que hace un total de 306 y 342, respectivamente.
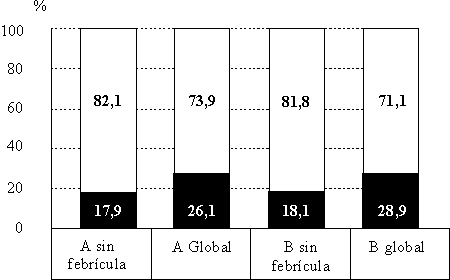
La reactogenicidad global fue de 26,1 % para el grupo A y de 28,9 % para el grupo B; si excluimos la febrícula (temperatura entre 37,0 y 37,9 EC) encontramos que la reactogenicidad desciende a 17,9 y 18,1 %, respectivamente (tabla 2, figura 1). Según la dosis administrada se aprecia que en el grupo A varía desde 44,1 % en la primera hasta 12,7 en la tercera, mientras que en el grupo B el comportamiento fue similar, con un rango desde 51,6 a 2,6 %. La diferencia más destacada (p<0,01) corresponde a la tercera dosis de ambos esquemas, lo cual tiene mucho sentido porque en dicha ocasión los niños del grupo A recibieron las 3 vacunas, mientras que los del B sólo recibieron la vacuna en estudio, la cual como se sabe es muy poco reactogénica (tabla 2). Esta diferencia es atribuible a la presencia de febrícula, ya que cuando excluimos ésta la diferencia se hace no significativa (p0,1). Es apreciable también el hecho que dentro de cada dosis la sintomatología en ambos grupos desciende notablemente a partir del primer día, e incluso el comportamiento ese primer día varía considerablemente cuando lo observamos en la primera dosis y en las dosis subsiguientes (tabla 2).
Fuente: Tabla 2.
FIGURA 1. Porcentaje de reactogenicidad general y sin considerar fabrívula, según el esquema de vacunación.
TABLA 2. Reactogenicidad general y sin febrícula, según los esquemas, las dosis y los días de observación
|
|
| Sintomatología con febrícula | Sintomatología sin febrícula | |||||||
|
|
| Esquema A (n = 34) | Esquema B (n = 38) | Esquema A (n = 34) | Esquema B (n = 38) | |||||
| Dosis | Día | No. | % | No. | % | No. | % | No. | % | |
| 1ra. | 1ro. | 30 | 88,2 | 36 | 94,7 | 19 | 55,9 | 24 | 63,2 | |
| 2do. | 11 | 32,3 | 17 | 44,7 | 7 | 20,9 | 11 | 28,9 |
| |
| 3ro. | 4 | 11,8 | 6 | 15,8 | 4 | 11,8 | 3 | 7,9 |
| |
| Total (1ra.) |
| 45 | 44,1 | 59 | 51,6 | 30 | 29,4 | 38 | 33,3 | |
| 2da. | 1ro. | 13 | 32,3 | 22 | 55,2 | 12 | 35,3 | 14 | 36,8 | |
| 2do. | 6 | 17,6 | 11 | 28,9 | 5 | 14,7 | 7 | 18,4 |
| |
| 3ro. | 3 | 8,8 | 4 | 10,5 | 3 | 8,8 | 2 | 5,3 |
| |
| Total (2da.) |
| 22 | 21,6 | 37 | 32,4 | 20 | 19,6 | 23 | 20,1 | |
| 3ra. | 1ro. | 8 | 23,5 | 2 | 5,3* | 4 | 11,8 | 1 | 2,6 | |
| 2do. | 4 | 11,8 | 1 | 2,6 | 1 | 2,9 | - | - |
| |
| 3ro. | 1 | 2,9 | - | - | - | - | - | - |
| |
| Total (3ra.) |
| 13 | 12,7 | 3 | 2,6 | 5 | 4,9 | 1 | 0,9 | |
| Total general | 80 | 26,1 | 99 | 28,9 | 55 | 17,9 | 62 | 18,1 |
| |
* p < 0,05. Fuente: Encuesta.
El signo más frecuentemente encontrado fue la febrícula, la cual representa 8,2 y 10,8 %, respectivamente de todas las observaciones realizadas; llama la atención su comportamiento en ambos grupos durante el primer día de la segunda dosis, en la que se produce diferencia significativa a favor del grupo B (p<0,01) a pesar de haber recibido en esa ocasión ambos grupos las mismas vacunas.
La fiebre (5,5 y 8,5 %), el eritema (4,2 y 3,8 %) y la induración (5,5 y 5,3 %) resultaron respectivamente los signos más relevantes y mostraron comportamientos semejantes con tendencias franca a la reducción según avanza el esquema de vacunación (tablas 3 y 4). Otros síntomas y signos como el decaimiento y el vómito tuvieron un comportamiento irrelevante al aparecer solamente en 11 y 1 ocasiones, respectivamente.
TABLA 3. Frecuencia de fiebre y febrícula de acuerdo con los esquemas, las dosis y los días de observación
|
|
| Síntomas y signos | |||||||
|
|
| Fiebre | Febrícula | ||||||
|
|
| Esquema A (n = 34) | Esquema B (n = 38) | Esquema A (n = 34) | Esquema B (n = 38) | ||||
| Dosis | Día | No. | % | No. | % | No. | % | No. | % |
| 1ra. | 1ro. | 6 | 17,6 | 13 | 34,2 | 11 | 32,4 | 12 | 31,6 |
| 2do. | 2 | 5,9 | 5 | 13,1 | 4 | 11,8 | 6 | 15,8 |
|
| 3ro. | - | - | 1 | 2,6 | - | - | 3 | 7,3 |
|
| Total (1ra.) |
| 8 | 7,8 | 19 | 16,6 | 15 | 14,7 | 21 | 18,4 |
| 2da. | 1ro. | 4 | 11,8 | 6 | 15,8 | 1 | 2,9 | 8 | 21,1 |
| 2do. | 1 | 2,9 | 3 | 7,9 | 1 | 2,9 | 4 | 10,5 |
|
| 3ro. | - | - | 1 | 2,6 | - | - | 2 | 5,3 |
|
| Total (2da.) |
| 5 | 4,9 | 10 | 8,7 | 2 | 1,9 | 14 | 12,2 |
| 3ra. | 1ro. | 3 | 8,8 | - | - | 4 | 11,8 | 1 | 2,6 |
| 2do. | 1 | 2,9 | - | - | 3 | 8,8 | 1 | 2,6 |
|
| 3ro. | - | - | - | - | 1 | 2,9 | - | - |
|
| Total (3ra.) |
| 4 | 3,9 | - | - | 8 | 7,8 | 2 | 1,7 |
| Total general | 17 | 5,5 | 29 | 8,5 | 25 | 8,2 | 37 | 10,8 |
|
Fuente: Encuesta.
TABLA 4. Frecuencia de eritema e induración de acuerdo con los esquemas, las dosis y los días de observación
|
|
| Síntomas y signos | |||||||
|
|
| Eritema | Induración | ||||||
|
|
| Esquema A (n = 34) | Esquema B (n = 38) | Esquema A (n = 34) | Esquema B (n = 38) | ||||
| Dosis | Día | No. | % | No. | % | No. | % | No. | % |
| 1ra. | 1ro. | 5 | 14,7 | 5 | 13,1 | 3 | 8,8 | 5 | 13,1 |
| 2do. | 1 | 2,9 | 2 | 5,3 | 3 | 8,8 | 4 | 10,5 |
|
| 3ro. | 1 | 2,9 | 1 | 2,6 | 3 | 8,8 | 1 | 2,6 |
|
| Total (1ra.) |
| 7 | 6,9 | 8 | 7,0 | 9 | 8,8 | 10 | 8,8 |
| 2da. | 1ro. | 3 | 8,8 | 3 | 7,9 | 3 | 8,8 | 4 | 10,5 |
| 2do. | 1 | 2,9 | 1 | 2,6 | 3 | 8,8 | 3 | 7,9 |
|
| 3ro. | 1 | 2,9 | - | - | 2 | 5,9 | 1 | 2,6 |
|
| Total (2da.) |
| 5 | 4,9 | 4 | 3,5 | 8 | 7,8 | 8 | 7,0 |
| 3ra. | 1ro. | 1 | 2,9 | 1 | 2,6 | - | - | - | - |
| 2do. | - | - | - | - | - | - | - | - |
|
| 3ro. | - | - | - | - | - | - | - | - |
|
| Total (3ra.) |
| 1 | 0,9 | 1 | 0,8 | - | - | - | - |
| Total general | 13 | 4,2 | 13 | 3,8 | 17 | 5,5 | 18 | 5,3 |
|
Fuente: Encuesta.
No se produjeron otras reacciones como eritemas, choque, convulsiones u otras manifestaciones graves. También analizamos el comportamiento individual, es decir, identificamos los niños que tuvieron 1 o más reacciones en cada dosis y día de observación, encontramos que el 55,9 % del grupo A y el 57,9 del grupo B manifestaron algún tipo de sintomatología el primer día de la primera dosis, 35,3 y 42,1 %, respectivamente, el primer día de la segunda dosis, y 29,4 y 2,6 % el primer día de la tercera dosis (tabla 5).
TABLA 5. Frecuencia de individuos sintomáticos de acuerdo con los esquemas, los dosis y los días de observación
|
|
| Esquema | |||
|
|
| Grupo A (n=34) | Grupo B (n=38) | ||
| Dosis | Día | No. | % | No. | % |
| 1ra. | 1ro. | 19 | 55,9 | 22 | 57,9 |
|
| 2do. | 8 | 23,5 | 11 | 28,9 |
|
| 3ro. | 4 | 11,8 | 5 | 13,2 |
| 2da. | 1ro. | 12 | 35,3 | 16 | 42,1 |
|
| 2do. | 5 | 14,7 | 10 | 26,3 |
|
| 3ro. | 2 | 5,9 | 4 | 10,5 |
| 3ra. | 1ro. | 10 | 29,4 | 1 | 2,6 |
|
| 2do. | 4 | 11,8 | 1 | 2,6 |
|
| 3ro. | 1 | 2,9 | - | - |
| Total general |
| 65 | 21,2 | 70 | 20,5 |
Fuente: Encuesta.
La sintomatología desciende en la medida que pasan los días y se avanza en el esquema de vacunación de modo que de forma general 1 de cada 5 niños en ambos grupos mantuvo o experimentó alguna sintomalogía durante el tiempo de observación.
INMUNOGENICIDAD
Obtuvimos muestras de sangre a los 18 meses de edad en 25 de 34 niños del grupo A (73,5 %) y 26 de 38 niños del grupo B (68,4 %).
La media geométrica de títulos de anticuerpos anti-HBs en el grupo A fue 20 570,2 UI/L-1 con intervalos de confianza (IC) al 95 % de 10 939,1 y 38 677,0; mientras en el grupo B fue 1 706,2 UI/L-1 (IC = 914,7 y 3 182,1) resultado estadísticamente significativo (p<0,01) lo cual era de esperar, pues el grupo A recibió una dosis de refuerzo a los 15 meses de edad. No se apreciaron diferencias significativas entre las medias geométricas de los varones y hembras dentro de los mismos grupos.
El 100 % de los niños del grupo A y el 96,2 del grupo B resultaron altamente respondedores (título $ 100 UI/L-1); con hiperrespuesta (títulos $ 1 000 UI/L-1) el 96,0 y 69,2 %, respectivamente; sólo 1 niño del grupo B alcanzó un título inferior a 100 UI/L-1. El 100 % de los niños resultaron inmunizados con títulos protectores (figura 2).
FIGURA 2. Grado de respuesta inmune según los esquemas.
DISCUSIÓN
La vacuna recombinante contra la hepatitis B, Heberbiovac-HB, aplicada a la dosis de 10 Fg conjuntamente con las vacunas DPT y antimeningocócica BC (VA-MENGOC-BC) previstas en el Programa Nacional de Inmunizaciones de Cuba, resultó segura, poco reactogénica y altamente inmunogénica.
Los resultados alcanzados en ambos grupos, donde 21,2 y 20,5 %, respectivamente, mostraron algún tipo de sintomatología, concuerda con estudios realizados por R. del Canho y otros,8 Dandolos,9 Milne,10 y André,11 en un resumen de estudios de Engerix B, que encuentran valores entre 15 y 20 % de reactogenicidad, y ligeramente superior a los alcanzados por nosotros7 en escolares de primaria con la administración de 10,5 y 2,5 Fg de Heberbiovac-HB. Lo habitualmente reportado se caracteriza por fiebre, febrícula, enrojecimiento e induración en el sitio de la inyección.
La respuesta inmunológica (título de anti-HBs) alcanzada por los infantes de nuestro estudio resultó excelente, con niveles de seroconversión (títulos $ 10 UI/L-1) del 100 %, y más del 95 % con títulos $ 100 UI/L-1; estos resultados coinciden con del Canho8 con 10 y 5 Fg de HB-Vax-DNA (Merck Sharp & Dohme) y el propio del Canho12 y Grosheide,13 ambos con 20 Fg de Engerix B, y por Poovorawan14 en lactantes sanos como en nuestro estudio. Las medias geométricas obtenidas, con el esquema 0, 1 y 6, de 1 706,2 UI/L-1 (IC = 914,7 y 3 182,1) coinciden con Lai,15 Milne10 y Goh,16 y superan los obtenidos por Stevens17 en 1987 y 1990, y son ligeramente inferiores a los observados por Milne10 con 10 y 5 Fg; todos realizados con HB-Vax-DNA (MSD). La media geométrica obtenida en nuestro estudio con el esquema de 4 dosis (0, 1, 2 y 12) de 20 570,2 UI/L-1 (IC= 10 939,1 y 38 677,0) supera ampliamente lo alcanzado por del Canho8 con 10 y 5 Fg de HB-Vax-DNA y Scholm18 con vacuna plasmática (MSD), ambos en niños hijos de madres positivas al AgsHB, y Grosheide13 con 20 Fg de Engerix B.
Se comprobó que no existió en nuestros grupos estudiados interferencia inmunológica respecto a la inmunogenicidad de la vacuna Heberbiovac-HB por parte de las vacunas DPT y VA-MENGOC-BC al aplicarse coincidentemente.
ANEXO. Calendario para los lactantes establecido por el Programa Nacional de Inmunizaciones
| Vacuna | 1ra. dosis | 2da. dosis | 3ra. dosis |
| BCG | Al nacimiento |
|
|
| Hepatitis B | Al nacimiento | 1 mes | 6 meses |
| DPT | 3 meses | 4 meses | 5 meses |
| VA-MENGOC-BC | 3,5 meses | 5,5 meses |
|
| Antipolio | A partir de 1 mes, 2 dosis en campañas anuales |
|
|
| PRS | 12 meses |
|
|
SUMMARY
The Cuban recombinant yeast-derived hepatitis B vaccine (Heberbiovac-HB) was administered to 2 groups of infants aged 3 months. A dosage of 10 mg was used through a scheme of 0, 1 and 6 and 0, 1, 2 and 12, coinciding with the DPT and antimeningococcical vaccines, according to the immunization schedule. Reactogenecity and immunogenecity were studied in both groups. The reactions observed were mild and similar to other studies, where febricula, erythema and induration were the most common signs. These 2 groups had high percentages of children with titres of antibodies anti HBs above 100 UI/L-1. It is demonstrated the acceptable reactogenecity of the vaccine and the non-immunological interference of other vaccines.
Subject headings: HEPATITIS B VACCINES/adverse effects; HEPATITIS B VACCINE/administration & dosage; ANTIGEN-ANTIBODY REACTIONS/drug effects; IMMUNIZATION SCHEDULE; VACCINES, SYNTHETIC; DIPHTHERIA -TETANUS-PERTUSSIS VACCINE; NEISSERIA MENINGITIDIS/immunology; BACTERIAL VACCINES.
REFERENCIAS BIBLIOGRÁFICAS
- OMS. Progresos en el estudio de la hepatitis. Informe del Comité de Expertos de la OMS en Hepatitis Vírica. Ginebra, 1977:57-63 (Serie de Informes Técnicos 562).
- ____. Vacunas de virus y medicamentos antivíricos. Informe de un grupo de científicos de la OMS. Ginebra, 1983:49-53 (Serie de Informes Técnicos 693).
- Zukerman AJ. The development novel Hepatitis B Vaccines. Bull Worl Health Organ 1987;65(3):265-75.
- Committee on Infectious Disease. Universal hepatitis B inmunization. Pediatrics 1992;89(4):795-801.
- Control Disease Center. Hepatitis B Virus: a comprehensive strategy for eliminating transmission in the United States through Universal Childhood Vaccination: Recommendations of the Immunization Practices Advisory Committee. Atlanta: Control Disease Center, 1993.
- Hollinger FB. Factors influencing the human response to B hepatitis vaccine. Booster, dose guidelines and vaccine protocol recommendations. Am J Med 1989;87(3A):1-24.
- Díaz M, Navia O, Bravo J, Pedroso P, Urbino A. Reactogenicidad de la vacuna Heberbiovac-HB a diferents dosis. Rev Cubana Med Trop 1995;47(1):65-70.
- Canho R del, Grosheide PM, Voodg M, Huisman WM, Heijtink RA, Schalm SW. Immunogenicity of two different dosages (10 and 5 Fg) of recombinant DNA hepatitis B vaccine in healthy neonates. Vaccine 1994;12(14):1324-26.
- Dandolos E. Safety and immunogenicity of a recombinant hepatitis B vaccine. J Med Virol 1985;17:57-62.
- Milne A. Antibody responses to recombinant yeast-derived hepatitis B vaccine in teenage New Zealand children. NZ Med J 1988;101:67-9.
- André FE, Safary A. Summary of clinical findings on Engerix-B a genetically engineered yeast-derived hepatitis B vaccine. Postgrad Med J 1987;63(S-2):169:78.
- Canho R del, Grosheide PM. Immunogenicity of a full dose (20Fg) of recombinant DNA hepatitis B vaccine in healthy neonates: a comparison of three different vaccination schemes. J Med Virol 1993;41:30-4.
- Grosheide PM, Canho R del, Voogd M. AntiHBs levels in infants of hepatitis B carrier mothers after delayed active immunization with recombinant vaccine concomitant with DPT-Polio vaccine: is there need for a second dose of HBIg? Vaccine 1994;12(12):1059-63.
- Poovorawan Y. Immunogenicity and protective efficacy of a yeast-derived hepatitis B vaccine in neonates. En: Coursaget P, Tong MJ, eds. Progress in Hepatitis B Immunization. London: John Libbery Eurotext, 1990:371-7.
- Lai CL. Use of hepatitis B recombinant DNA yeast vaccine (HB-VaxII) in children: two doses vs three doses of 5 Fg regime. J Infect 1986;13:19-25.
- Goh KT, Tan KL, Kong KH, Oon CJ, Chan SH. Comparison of the immune responses of four different dosages of a yeast-recombinant hepatitis B vaccine in Singapore children: a four-year follow up study. Bull World Health Organ 1992; 70(2):233-9.
- Stevens CE, Taylor PE, Tong MJ, Toy PT, Vyas GN, Nair PV. Yeast-recombinant hepatitis B vaccine: efficacy with hepatitis B immune globulin in prevention of perinatal hepatitis B virus transmission. JAMA 1987;257:2612-6.
- Schalm SW, Mazet JA, Gast GC del. Prevention of hepatitis B infection in newborns through mass screening and delayed vaccination of all infants of mothers with hepatitis B surface antigen. Pediatrics 1989;83:1041-8.
Recibido: 11 de noviembre de 1996. Aprobado: 27 de junio de 1997.
Dr. Manuel González Díaz. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.