Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão On-line ISSN 1561-3054
Rev Cubana Med Trop v.50 n.1 Ciudad de la Habana jan.-abr. 1998
Instituto de Medicina Tropical "Pedro Kourí"
Proteasa dependiente de cisteína en Trypanosoma cruzi útil en el diagnóstico de la enfermedad de Chagas
RESUMEN
Se normalizó un sistema inmunoenzimático en fase sólida para la detección de anticuerpos IgG en suero de pacientes chagásicos crónicos, se utilizó como antígeno una proteasa de Trypanosoma cruzi (GP57/51kDa). Para el cálculo de sensibilidad, especificidad y valores predictivos del procedimiento, se tomaron como referencias los resultados obtenidos por serología convencional (SC), inmunofluorescencia indirecta (IFI), hemaglutinación indirecta (HAI) y lisis mediada por complemento (LMC) para la detección de anticuerpos anti-Trypanosoma cruzi en el suero. Excepto 1, las muestras positivas por estas técnicas también lo resultaron por nuestro método. Estos resultados apoyan la utilización de GP 57/51 en el serodiagnóstico de la enfermedad de Chagas.
Descriptores DeCS: ENFERMEDAD DE CHAGAS/diagnóstico; PROTEINASAS DE CISTEINA/uso diagnóstico; TRYPANOSOMA CRUZI/inmunología; ANTIGENOS DE PROTOZOARIOS/sangre; TEST DE ELISA/métodos; SERODIAGNOSTICO/métodos; TECNICA DEL ANTICUERPO FLUORESCENTE INDIRECTA/métodos; TESTS DE HEMAGLUTINACION/métodos.
Alrededor de 90 000 000 de personas en América Latina, ¼ de la población total de nuestra región, está en riesgo de infectarse con Trypanosoma cruzi(T. cruzi),1,2 agente causal de la enfermedad de Chagas. De estos, un estimado de 16 000 000 están actualmente infectados y en riesgo de convertirse en pacientes crónicos de esta parasitosis.3
La enfermedad es transmitida por 2 vías fundamentales: por intermedio de vectores (triatomas) y por transfusiones de sangre infectadas.4,5 El incremento de la población urbana ha provocado que la transmisión de la infección a consecuencia de la hemoterapia sea un hecho cada vez más frecuente en hospitales y bancos de sangre de Centro y Sudamérica.4,5
Para enfrentar este problema, la prueba diagnóstica más comúnmente utilizada ha sido la hemaglutinación,6 procedimiento al que se le asocian 3 tipos de limitaciones, la amplia diferencia de resultados entre laboratorios debido a que los reactivos por lo general son preparados en cada uno de ellos; falsos positivos a consecuencia de la utilización del parásito completo como antígeno, lo que ha llevado a descartar un número importante de donaciones sanguíneas; y una sensibilidad no siempre adecuada, lo que conduce a la transmisión de la enfermedad.6 Existe, por lo tanto, necesidad de definir moléculas antigénicas de T. cruzi que pudieran ser mejores reactivos para la detección de la infección por este protozoo. En este sentido, han sido obtenidos numerosos antígenos procedentes de este parásito por medio de ingeniería genética.7 Sin embargo, pese a las modificaciones técnicas introducidas, estos siguen siendo muy caros para usos masivos.
En fecha reciente fue descrita una cisteíno proteinasa de T. cruzi (GP57/51) kDa), que participa en los procesos de destrucción de tejidos asociados con fenómenos autoinmunes.8,9 Evidencias de que epimastigotes y trypomastigotes de T. cruzi liberan proteasas durante la metaciclogénesis10 y que éstas a su vez son reconocidas por anticuerpos protectores que circulan durante la infección chagásica crónica, nos han hecho suponer que la utilización de esta molécula en un ensayo inmunoenzimático nos ayudaría a la detección de anticuerpos contra T. cruzi de manera muy específica y a relativo bajo costo, lo que es el objetivo fundamental del presente trabajo.
MÉTODOS
Sueros humanos. Se procesaron 191 muestras de sueros, 100 fueron obtenidas de individuos sanos no chagásicos, comprobados mediante serología convencional (HAI e IFI) y además por LMC. Estos sueros fueron obtenidos de un área endémica de Chile y se utilizaron como grupo control negativo de anticuerpos a T. cruzi, por tanto, fueron la base para el establecimiento del criterio de positividad del ensayo; 45 muestras correspondieron a un grupo de sueros provenientes de individuos considerados como chagásicos crónicos, que además de las manifestaciones clínicas propias de esta parasitosis presentaban SC positiva o LMC positiva, o ambas. Las muestras restantes (46) corresponden a un grupo de sueros obtenidos de pacientes con otras parasitosis y fueron utilizadas para el estudio de reacciones cruzadas.
El suero control negativo se obtuvo a partir de una mezcla de sueros de personas sanas, que resultaron no reactivos por las técnicas de HAI, IFI (con títulos menores que 1/40) y LMC, porcentaje de lisis inferior al 20 %.
El suero control positivo fue elaborado con diferentes sueros reactivos a T. cruzi, sus títulos de anticuerpos variaron de 1/80 a 1/1 024, medidos por la técnica de HAI, IFI y LMC, porcentaje de lisis superior al 20 %.
Con la finalidad de evaluar la reactividad cruzada con la glicoproteína estudiada, fueron investigadas muestras séricas de individuos que padecían otras enfermedades parasitarias: leishmaniasis (20), malaria (10), toxoplasmosis (10), toxocariasis (3) y cisticercosis (3).
Inmunofluorescencia indirecta. Se utilizaron epimastigotes de la cepa Y(IOC-106, Río de Janeiro, Brasil) de T. cruzi proveniente de cultivo, éstos fueron lavados y fijados con formalina según Camargo.11 Se utilizó un conjugado anti-IgG humana marcada con fluoresceína (Instituto "Pasteur", París, Francia). Todas las preparaciones se examinaron con un microscopio de luz ultravioleta (Leitz, Heer-brujgg, Switzerland). Las muestras con títulos mayores que 1/40 fueron consideradas positivas.
Hemaglutinación indirecta. Esta técnica se realizó mediante la metodología descrita por Camargo y otros.12 De forma breve, se sensibilizaron eritrocitos humanos O negativos preservados con formaldehído al 1 %, con un extracto antigénico de T. cruzi. Todas las muestras se analizaron por duplicado mediante placas de poliestireno de fondo en U (Microtiter) y los títulos mayores que 1/40 fueron considerados como positivos.
Lisis mediada por complemento. El ensayo de LMC fue realizado según la metodología descrita por Gazzinelli y otros.13 De forma breve, trypomastigotes de T. cruzi fueron mantenidos en cultivos de células Vero que contenían RPMI 1640 y suero fetal de ternera (SFT) al 5 %, éstos fueron concentrados por centrifugación a 400 gravedades por 10 min y suspendidos a una concentración de 107 parásitos por mL con medio TC-199 suplementado con SFT al 5 %. Después, 50 mL de la suspensión fueron incubados con anticuerpos por 1h a 37 oC, se siguió con un lavado a 1 300 gravedades por 10 min a 4 oC, a continuación se realizó una nueva incubación a 37 oC por 1h, pero esta vez con complemento diluido 1/10. Los tubos controles incluyeron parásitos incubados con anticuerpos positivos, complemento inactivado a 56 oC durante 30 min y parásitos incubados con anticuerpos preinmunes y complemento.
El conteo de parásitos se realizó por duplicado en un hemocitómetro y el porcentaje de lisis fue determinado como sigue: porcentaje de lisis = 100-(100 x 3 número de trypomastigotes móviles en suero humano normal /número de trypomastigotes móviles en suero humano inactivado). Fueron considerados positivos los ensayos que mostraron un porcentaje de lisis superior al 20 %.
Preparación del extracto crudo de epimastigotes. El extracto crudo antigénico fue preparado a partir de epimastigotes de la cepa Y de T. cruzi cultivados en medio líquido de tryptosa infusión de hígado (LIT),14 suplementado con 10 % de suero fetal bovino y 100 m/mL de penicilina G, después se realizó el conteo parasitario en cámara de Neubawer y se obtuvo una concentración de 20 x 106 parásitos por mL. A continuación los epimastigotes fueron lavados 3 veces por centrifugación en tampón fosfato-salino (PBS) 0,1 M pH 7,2. El volumen total de la suspensión, 10 mL, fue colocado en un sonicador (Soniprep 150) y sometido a 3 ciclos de 1 min con intensidad de 18 khrz e intervalos de reposo de 30 s. El producto final se centrifugó a 12 000 gravedades durante 1 h a 4oC, el precipitado fue desechado y el contenido proteico del sobrenadante fue estimado mediante el método de Lowry.15 Se prepararon alícuotas de 1 mL que fueron conservadas a -20 oC hasta su uso.
Purificación de GP 57/51. La GP 57/51 kDa fue purificada a partir de un extracto crudo de epimastigotes de T. cruzi mediante la cromatografía líquida de alta resolución9 (FPLC) (Pharmacia, LKB), con algunas modificaciones. De forma breve, para el fraccionamiento se utilizó una columna de filtración en gel Superdex -200. Las alícuotas recolectadas durante la cromatografía fueron utilizadas en los estudios de actividad enzimática sobre el sustrato sintético benzyloxycarbonil-arginyl-arginine 2(4-methoxy) naphthylamide (Z-Arg-Arg-Mna) (Bachem, Switzerland). La pureza de la fracción con actividad enzimática fue determinada por electroforesis en gel de poliacrilamida (SDS-Page)16 al 12,5 %, en condiciones reductoras. Las bandas fueron visualizadas al teñir uno de los geles con Azul de Coomassie R-250.
Actividad enzimática. Se siguió la metodología descrita por Barret,17 con las modificaciones siguientes: se incubó el sustrato en una solución de incubación de 0,5 mL, que contenía buffer glicina- HCl 100 mM pH 9,5; EDTA 2 mM; L-cisteína 2 mM y sustrato 1 mM, durante 10 min a 37 oC. La reacción fue detenida con 0,5 mL de solución detenedora (fast garnet 2,25 %, NaNO2 0,2 mM, EDTA 25 mM, P-cloromercuribenzoato 50 mM, T-20 1 % pH 6). La lectura se realizó en un espectrofotómetro a 520 nm.
Inmunoensayo enzimático (ELISA). Las condiciones de reacción y las concentraciones de los reactivos biológicos se evaluaron mediante titulación cruzada de los reactivos empleados en el sistema, finalmente se seleccionaron aquéllos que ofrecieran una mejor relación entre controles positivos y negativos (P/N < 10).
El ensayo consistió en un método indirecto que utilizó como fase sólida placas de poliestireno de fondo plano (Polysorp, Nunc), que fueron recubiertas, durante 16 h a 4 oC, con 100 mL por pocillo de diferentes concentraciones de la enzima (0,5 - 8 mg) en tampón carbonato de sodio 0,1 M pH 9,6. Los espacios libres fueron bloqueados con PBS 0,015 M, que contenía Twen-20 al 0,05 % (PBS-T) y seroalbúmina bovina (BSA) al 1 %, las placas fueron de nuevo incubadas durante 1 h a 37 oC, seguido a la incubación éstas fueron lavadas 4 veces con PBS-T, a continuación se añadieron 100 mL por pocillo de las muestras de sueros ya diluidas en PBS-T más BSA al 1 % (1/50, 1/100, 1/200, 1/400) y el tampón de dilución utilizado como blanco, todas fueron incubadas por 1 h a 37 oC. Más tarde, las placas se lavaron igual a la vez anterior, se añadieron 100 mL por pocillo de la solución de IgG de conejo anti-IgG humana acoplada con peroxidasa previamente diluida en PBS-T más BSA al 1 % (1/1 000, 1/2 000, 1/4 000, 1/6 000, 1/8 000) y se incubaron 1 h a 37 oC; seguido a este paso, las placas fueron lavadas 4 veces con PBS-T. Por último, se añadieron 150 mL del sustrato (10 mL H2O2 al 30 % p/v + 25 mL del tampón 0,1 M de citrato de sodio pH 5 + 10 mg O-Phenylenediamine hidrochtoride), y se procedió a incubar a temperatura ambiente durante 30 min en condiciones de oscuridad. La reacción enzimática fue detenida mediante la adición de 50 mL por pocillo de ácido sulfúrico al 12,5 % en agua destilada.
La lectura de las densidades ópticas (DO) fue realizada en un espectrofotómetro para placas de ELISA (Titertek, Multiskan Plus) a 492 nm.
Análisis estadístico. Las muestras de suero de 100 individuos como grupo control negativo fueron estudiadas por duplicado. El valor de corte fue determinado según la fórmula DO ± 3 DE, todos los valores de densidad óptica mayores que éste fueron considerados positivos. Para comprobar si los valores de absorbancia obtenidos para los sueros seguían una distribución normal se utilizó la prueba de bondad de ajuste de Kolmogorov Smirnov, además se empleó una prueba de hipótesis de comparación de medias y el estadígrafo de la t de Student para comprobar la existencia o no de diferencias estadísticamente significativas entre los grupos.
Para el cálculo de la sensibilidad, especificidad y valores predictivos18 de nuestro ELISA, se tomaron como referencia la SC y LMC, ya utilizados en la clasificación de las muestras, para ello se confeccionó la tabla de contingencia de doble entrada correspondiente.
RESULTADOS
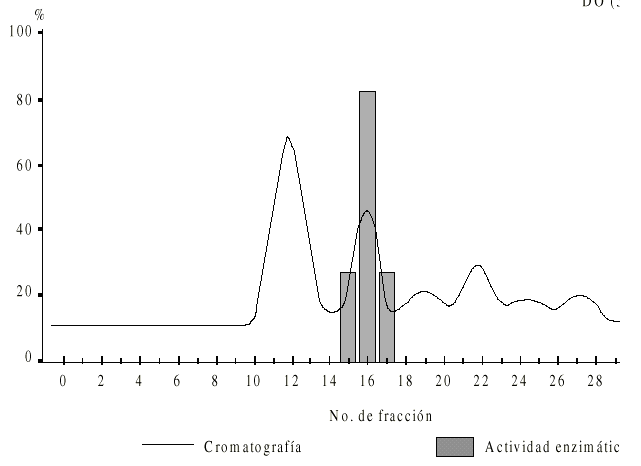
La figura 1 muestra el perfil cromatográfico obtenido por filtración en Superdex-200 del extracto crudo de epimastigotes. Se obtuvieron 6 picos (P1 a P6) y sólo la fracción correspondiente al P2 mostró actividad enzimática.
Fig. 1. Perfil de elución del fraccionamiento en Superdex- 200 de un extracto de Trypanosoma cruzi. La muestra (1 mL) fue aplicada con Tris-HCL 100 mM pH 8,2 a un flujo de corrida de 0,8 mL/min. Las fracciones 16 y 18 con actividad proteolítica eluyeron a un volumen de 48 a 54 mL.
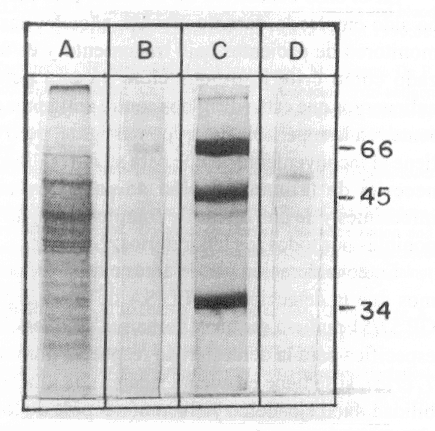
La fracción con actividad enzimática (P2), fue corrida en SDS-Page y luego de coloreado el gel, observamos una banda cuyo peso molecular (Pm) y su movilidad relativa (Mr) la ubican en un rango de 57/51 kDa, esto nos sugiere que se trata de la GP 57/51 kDa (fig. 2).
Fig 2. SDS- Page (12,5 % en condiciones reductoras). Extracto crudo de epimastigotes de Trypanosoma cruzi (línea a). Muestra de proteína utilizada como control (línea b). Patrones de pesos moleculares expresados en kDa (línea c). Fracción purificada GP 57/51 kDa (línea d). Para teñir el gel, se utilizó Azul de Coomasie R-250.
Seleccionamos 4 mg como concentración óptima de la enzima para el recubrimiento porque éste es un valor intermedio en la meseta de la curva de titulación, donde se evitan errores en los resultados a consecuencia de imprecisiones de dilución. Siguiendo el mismo análisis se seleccionaron la dilución del suero 1/100 y del conjugado 1/4 000, porque éstas ofrecieron una mejor discriminación entre controles positivos y negativos (datos no mostrados).
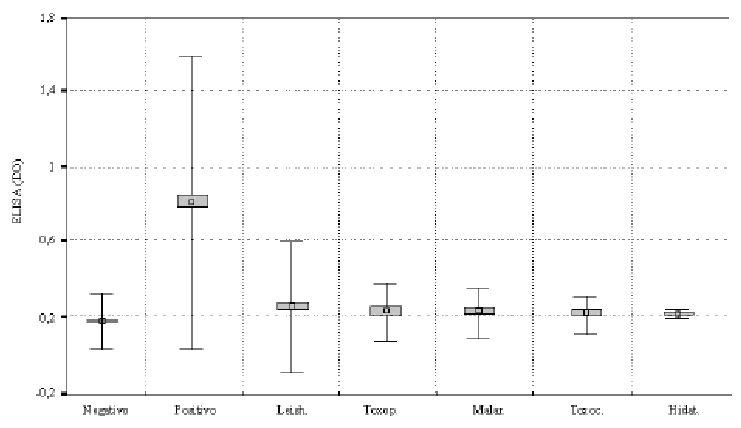
La especificidad del ELISA con la GP 57/51 fue evaluada con un grupo de sueros controles negativos, un grupo de sueros de pacientes con evidencias clínicas y serológicas de trypanosomiasis y varios grupos de sueros con otras enfermedades parasitarias (fig. 3). La media de las DO del grupo control negativo fue de 0,173 ± 3 (0,052) con un rango de 0,055-0,031. Los sueros de pacientes con trypanosomiasis mostraron un rango de 0,322-1,4 y una DO media de 0,812 ± 3 (0,266), mientras que los valores de DO de los sueros de pacientes con otras infecciones parasitarias mostraron rangos medios entre 0,166=0,342 y valores de DO media de 0,228 ± 3 (0,051). En correspondencia con ello se observó una diferencia significativa entre los grupos estudiados (p < 0,01).
Fig. 3. Especificidad del ELISA con la GP 57/51 y sueros de pacientes con: Pos.= trypanosomiasis, Leish.= leishmaniasis, Toxop.= toxoplasmosis, Malar.= malaria, Toxoc.= toxocariasis, Hidat.= hidatidosis y Neg.= grupo control negativo. La t de Student mostró una diferencia significativa entre los grupos estudiados (p < 0,01). La antena superior de los controles negativos marca el valor de corte. El cuadro sombreado del centro de la figura representa la mediana y el espacio entre la antena superior y la inferior la DE ± 3.
Mediante el uso de la prueba de Kolmogorov Smirnov se determinó que no se rechazaba la hipótesis de normalidad, d=0,0730.
Cuando se evaluaron los 46 sueros de pacientes que incluían otras parasitosis, se observó reactividad cruzada en 2 muestras de sueros con leishmaniasis para 96,66 % de especificidad del total de muestras relacionadas (fig. 3), ninguno de los pacientes infectados con otro protozoo o helminto resultó positivo.
La figura 4 muestra los resultados de sensibilidad (97,7 %) y especificidad (100 %) del ELISA, tomando como referencia la SC y LMC. Los valores predictivos para sueros positivos y negativos fueron de 100 % y 99 %, respectivamente.
Fig. 4. Comparación del ELISA GP 57/51 con la SC y LMC.
DISCUSIÓN
La importancia de hacer una adecuada selección de las diferentes variables que intervienen en la buena realización de cualquier ensayo inmunoenzimático está bien establecida.19 En nuestro trabajo al valorar la concentración óptima de la enzima para el recubrimiento de la placa, encontramos que ésta se logra a 4 mg/mL, concentración más baja que la reportada por Gazzinelli y otros13 con el empleo, como en nuestro estudio, de placas de poliestireno (Immunolon, I Dynatech) y un proceder similar al nuestro en la obtención de la enzima, pero con la combinación de 2 métodos cromatográficos. No tenemos explicación absoluta para esto, pero pensamos que en ello pudo influir la calidad del material antigénico purificado por esos autores o, quizás, algunas diferencias en las condiciones del ensayo enzimático.
El valor de corte escogido en nuestro ensayo fue de una densidad óptica 0,329 del grupo control negativo, pues con éste, todos los sueros negativos confirmados por los métodos de referencia fueron negativos y sólo 1 caso de los sueros positivos confirmado por SC y LMC fue negativo por el método que se compara. Quizás esto se debió a que éste era un suero con densidad óptica muy cercano al valor de corte y al tratar de ganar en especificidad se obtuvo un resultado falso negativo. Evidencias acumuladas después de un largo seguimiento de pacientes con trypanosomiasis indican que los anticuerpos detectados por SC pueden existir en total ausencia de infección activa.18 De cualquier modo, nuestro método tiene, en relación con un grupo control negativo-constituido por sueros de un área endémica sin historia de trypanosomiasis- índices de sensibilidad y especificidad de 97,7 % y 100 %, respectivamente.
La reactividad cruzada de GP 57/51 con un número pequeño de sueros de individuos con leishmaniasis no fue sorprendente (4 %) pues T. cruzi y Leishmania sp. poseen epitopes semejantes, glicoproteínas que contienen galactosil (Gal) terminal20 y proteínas derivadas del citoesqueleto, como la tubulina, que son semejantes en muchos trypanosomátides.
En el caso específico de la LMC, este método ha sido empleado durante muchos años18,21 para el monitoreo de pacientes bajo tratamiento y es utilizado como criterio de curación, ya que detecta anticuerpos que están dirigidos contra antígenos presentes en la superficie del trypomastigote, pero éste tiene el inconveniente de que para su normalización necesita de la manipulación de parásitos vivos infectantes y de una fuente de complemento, no disponibles por todos los laboratorios.18
En consideración con lo antes expuesto, pensamos que la detección por ELISA de anticuerpos a GP 57/51 pudiera ser una alternativa más sencilla y específica para la detección de respuesta humoral a T. cruzi, si se tiene en cuenta, además, la alta sensibilidad, fácil ejecución y obtención rápida de los resultados que nos brindan los sistemas inmuno-enzimáticos.
SUMMARY
An immunoenzymatic system on solid phase for the detection of IgG antibodies in serum from choronic Chagasic patients was standardized. A protease from Trypanosoma cruzi (GP57/51KDa) was used as an antigen. The sensitivity, specificity and predictive values of the procedure were calculated taking into account the results obtained from conventional serology (CS), indirect immunofluorescence (IIF), indirect hemagglutination (IHA) and complement-mediated lysis test (CML) for the detection of anti-Trypanosoma cruzi antibodies in serum. Except one, the positive samples obtained by those techniques were also positive by our method. These resultas show that GP 57/51 is useful in the serodiagnosis of Chagas disease.
Subject headings: CHAGAS DISEASE/diagnosis; CYSTEINE PROTEINASES/diagnostic use; TRYPANOSOMA CRUZI/immunology; ANTIGENS, PROTOZOAN/blood; ENZYME-LINKED IMMUNOSORBENT ASSAY/methods; SERODIAGNOSIS/methods; FLUORESCENT ANTIBODY TECHNIQUE, INDIRECT/methods; HEMAGGLUTINATION TESTS/methods.
REFERENCIAS BIBLIOGRÁFICAS
- Brener Z. Immunity to Trypanosoma cruzi. Adv Parasitol 1980;18:247-92.
- Hudson L. Immunobiology of Trypanosoma cruzi infection and Chagas disease. Trans R Soc Trop Med Hyg 1981;75:493-8.
- Hernández-Munain C, Fernández AM, Alcina A, Fresno M. Characterization of aglycosul-phosphatedylinositol-anchored membrane protein from Trypanosoma cruzi. Infect Immunol 1991;59:1409-15.
- Teixera ARL, Pereira LM. Discrepancias entre resultados de tres reacoes serológicas para diagnóstico da doenca de Chagas. Rev Bras Biol 1981;41:789.
- Deas JCP. Control of Chagas'disease in Brazil. Parasitol Today 1987;3:336-41.
- Zicker F, Smth PG, Luquetti AO, Oliveira OS. Mass screening for Trypanosoma cruzi infections using the immunofluorescence, ELISA and haemagglutination tests on serum samples and blood eluates from filter paper. Bull World Health Organ 1990;68: 465-71.
- Carbonetto CH, Malchiodi EL, Chiaramonte M, Durante De E, Fossati CA, Margni RA. Isolation of Trypanosoma cruzi antigen by affinity chromatography with a monoclonal antibody preliminary evolution of its possible applications in serological test. Clin Immunol 1990;82:93-6.
- McKerrow JH. New Insights into the structure of a Trypanosoma cruzi protease. Parasitol Today 1991;7:132-3.
- Scharfstein JM, Schechter M, Senna M, Peralta JM, Mendoca-Previato, Miles M. Trypanosoma cruzi: characterization and isolation of 57/51 M.W surface glycoprotein (GP 57/51) expressed by cpimastigotes and blood stream trypomastigote. J Immunol 1986;137:1336-41.
- Bonaldo MC, D'Escoffier LN, Salles JM, Goldenberg S. Characterization and expression of proteases during Trypanosoma cruzi metaciclogenesis. Exp Parasitol 1991;73:44-51.
- Camargo ME. Fluorescent antibody test for serodiagnosis technical modification employing preserved cultured forms of T. cruzi in slide test. Rev Inst Med Trop Sao Paulo 1966;8:227-34.
- Camargo ME, Hshino S, Sequeira GRV. Hemagglutination with preserved, sensitized cells, a practical test for routine serological diagnosis of American Trypanosomiasis. Rev Inst Med Trop Sao Paulo. 1973;15:81-5.
- Gazzinelli RT, Galvao MC, Krautz G, Lima APCA, Romeu-Concado J, Scharfstein J, et al. Use of Trypanosoma cruzi purified glycoprotein (Gp 57/51) or trypomastigote-shed antigen to assess cure for human Chagas'disease. Am J Trop Med Hyg 1993;49: 625-35.
- Camargo EP. Growth and diferentiation in Trypanosoma cruzi. I. Origen of metacyclical Trypanosoma in liquid media. Rev Inst Med Trop Sao Paulo 1964;6:93-101.
- Lowry DH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the folin phenol reagent. Biol Chem 1951;193:265-75.
- Laemmli UK. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature 1970;227:680-5.
- Barret AJ. The classification of proteinases. Ciba Found Symp 1980;75:1-13.
- Haynes B. Clinical epidemiological rounds. How to red clini-cal. Journal: II to learn about a diagnostic test. CMA J 1981;124: 703-10.
- Bullock SL, Walls TD. Evolution of some of the parameters of the enzyme linked immunoespecific assay. J Infect Dis 1977;136:276-85.
- Ávila JL, Roja MA. Galactosyl (1-3 mannose) epitope on phospholipids of Leismania mexicana and L. braziliensis recognized by Trypanosomatide infected human sera. J Clin Microbiol 1990;28:1530-7.
- Gazzinelli RT, Leme UMC, Romeu-Concado J, Gazzinelli G, Scharfstein J. Identification and partial characterization of Trypanosoma cruzi antigens recognized by T cells and immune sera from patients with Chagas' disease. Infect Immunol 1990;58:1437-44.
Recibido: 3 de marzo de 1997. Aprobado: 28 de diciembre de 1997.
Dr. Esteban Alberti Amador. Instituto de Medicina Tropical "Pedro Kourí." Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Microbiología. Investigador Agregado. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
2 Licenciado en Bioquímica. Investigador Auxiliar. IPK.
3 Licenciada en Biología. Investigadora Agregada. IPK.
4 Licenciado en Matemáticas. Investigador Agregado. Instituto "Finlay".
5 Especialista de I Grado en Inmunología. Investigador Auxiliar. IPK.