My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.51 n.1 Ciudad de la Habana Jan.-Apr. 1999
Instituto de Medicina Tropical "Pedro Kourí"
Respuesta humoral específica en ratones Balb/c inoculados con una librería genómica de expresión de Trypanosoma cruzi
Resumen
Se construyó una librería genómica de expresión de Trypanosoma cruzi (T. cruzi) utilizando como vector el plásmido pcDNA3, con la cual se inmunizaron ratones machos de la línea isogénica Balb/c por la vía intramuscular. Se empleó un grupo control positivo al que se le administró antígenos solubles de T. cruzi y otros 2 grupos que recibieron ADN genómico y plásmido, respectivamente; un grupo no recibió inmunización. A todos los animales se les extrajo sangre semanalmente hasta la cuarta semana y 2 semanas después de la reinmunización, para estudiar la respuesta de anticuerpos específicos contra los antígenos del microorganismo mediante un ensayo inmunoenzimático indirecto (ELISA). Se evidenció un aumento significativo de anticuerpos específicos en los animales reinmunizados con 50 mg de la librería y en el grupo inmunizado con los antígenos solubles de T. cruzi.
Descriptores DeCS: ADN PROTOZOARIO/inmunología; GENOMA DE PROTOZOOS; VACUNAS ANTIPROTOZOOS/farmacología; TRYPANOSOMA CRUZI/genética; TRYPANOSOMA CRUZI/inmunología; VACUNAS DE ADN/farmacología; RATONES CONSANGUINEOS BALBC.
La búsqueda de nuevas vacunas o el perfeccionamiento de las ya existentes continúa estando dentro de las máximas prioridades de las investigaciones biomédicas.1,2
Entre las nuevas tendencias en el desarrollo de vacunas se encuentran las vacunas de péptidos sintéticos, las de proteínas recombinantes, las atenuadas por métodos de ingeniería genética y las vivas recombinantes, basadas en la expresión de antígenos de interés vacunal en vectores vacunales vivos atenuados ya autorizados para su uso.2-4. En este contexto surgen en años recientes los primeros reportes de inmunización con ácidos nucleicos, o como más comúnmente se conoce, ADN desnudo.2
La demostración de la capacidad inmunizante del material genético proveniente de distintos microorganismos después de su administración por distintas vías, constituye el hallazgo más fascinante y prometedor en el campo de la inmunoprotección.5
La posibilidad de estimular con este nuevo tipo de inmunización de forma simultánea y duradera la inmunidad celular y humoral, incluyendo las células T citotóxicas,6 lo cual sólo ha sido posible con las vacunas vivas atenuadas, podría permitir el abordaje de la prevención de las enfermedades virales y parasitarias sin los riesgos de las vacunas vivas, como la reversión a la virulencia y la posibilidad de infecciones mortales en huéspedes inmunosuprimidos.4-6
Como desventajas potenciales de este nuevo método se encuentran básicamente la posibilidad de integración al genoma, con la consiguiente posibilidad de producir transformación neoplásica, y la inducción de estados de autoinmunidad7 por el desencadenamiento de respuestas dirigidas contra el ADN. Por fortuna, después de profundos estudios experimentales, no se ha reportado la presencia de estas complicaciones, ya que ha sido imposible la demostración de la integración al genoma del material genético inyectado, así como la inducción de autoinmunidad.7
En este contexto es que nuestro grupo se propuso la introducción de esta tecnología en nuestro medio, incorporando elementos novedosos, mediante la investigación de la capacidad inmunizante de la administración a animales de experimentación de ácidos nucleicos de Trypanosoma cruzi, en forma de una librería genómica de expresión, para profundizar en el estudio de la respuesta inmune contra T. cruzi, así como dar los pasos iniciales en el desarrollo de vacunas experimentales de nuevas generaciones para la prevención de la tripanosomiasis.
Métodos
Cepas. Se utilizaron epimastigotes de la cepa Y (CT-IOC 106) de Trypanosoma cruzi, donada gentilmente por la doctora María Auxiliadora de Sousa del Instituto "Oswaldo Cruz" de Río de Janeiro, Brasil.
Para la construcción de la librería genómica de expresión se usó la cepa de Escherichia coli (E.coli) HB 101 suministrada por la firma Boehringer Mannheim Biochemica, RFA.
Plásmido. Se empleó el vector comercial pcDNA3 suministrado por la firma Invitrogen, EE.UU. (fig 1).
Fig. 1. Plásmido pcDNA3.
Enzimas de restricción y modificación. Se emplearon las enzimas de restricción Sau3A y BamH1, así como las enzimas T4 ligasa y fosfatasa alcalina, suministradas por la firma Boehringer Mannheim Biochemica (RFA), y utilizadas según las instruccciones del fabricante.
Antibióticos. Se usó estreptomicina con una concentración de 30 mg/mg; ampicilina a razón de 50 m g/mL y gentamicina a 50 mg/mL (Boehringer Mannheim Biochemica, RFA).
Animales. Se empleo un total de 40 ratones machos, de la línea isogénica Balb/c con un peso entre 16 y 18 g y 6 semanas de edad, suministrados por el Centro Nacional de Producción de Animales de Laboratorio (CENPALAB, Cuba).
Preparación de las células competentes. Se inoculó una colonia de E. coli HB 101 en un precultivo de 5 mL de medio Luria Bertaini8 (LB) (triptona 10g/L, NaCl 5g/L y extracto de levadura 5g/l, pH 7,5) más estreptomicina (LBs) y se incubó a 37 °C con agitación durante 16 h en zaranda (Incubator Shaken,Co., EE.UU.) a 200 rpm. A partir del precultivo crecido se sembró 1mL/mL en un elermeyer con 200 mL de medio LBs recién preparado, y se incubó a 37 °C con agitación en zaranda (200 rpm) hasta que alcanzó una densidad óptica de 0,6 leída a una longitud de onda de 600 nm en un espectrofotómetro (Utrospec 111, Pharmacia LKB). El cultivo crecido se dejó reposar en un baño de agua helada durante 30 min y se centrifugó a 600 gravedades durante 30 min a 4 °C en una centrífuga refrigerada (MLW K23D VEB MLW MEDIZINTECHNIK, Alemania). Después de eliminar el sobrenadante, el precipitado celular fue lavado 2 veces con agua destilada estéril, fría (4 °C) y 2 con glicerol al 10 % (Pharmacia). Todas las centrifugaciones se realizaron en iguales condiciones que la primera. Por último, el precipitado celular se resuspendió en la solución de glicerol al 10 % y se distribuyó en alíquotas de 80 mL en viales (Eppendorf) de 1,5 mL, los cuales fueron almacenados a -70 °C hasta el momento de realizar la transformación genética.
Construcción de la librería genómica de T. cruzi. El ADN genómico de T. cruzi fue obtenido de las formas epimastigóticas del parásito según el método de Hookey.9 Se tomaron 2 x 109 epimastigotes que fueron resuspen-didos en tampón de lisis (Tris HCL 100mM, pH 8; EDTA 100 mM,pH 8; SDS 2 %; NaCl 150 mM y proteinasa K 200mg/mL) e incubados 2h a 56 °C; seguidamente se procedió a hacer la extracción del ADN con fenol cloroformo (1:1), el cual a continuación fue precipitado con etanol absoluto. El sedimento obtenido fue resuspendido en tampón Tris-EDTA (TE) (Tris 10 mM, EDTA 1 mM, pH 8) y la integridad del ADN obtenido fue chequeada por electroforesis en gel de agarosa al 0,8 % en Tris-Borato-EDTA (TBE) (Tris base 0,004 M, ácido bórico 0,001 M; EDTA 0,5 M; pH 8) con bromuro de etidio (0,5 mg/mL), prefijando el voltaje de la fuente (modelo EPS 400/500, Pharmacia) entre 1 y 5 V/cm y utilizando una cámara modelo GNA-200 (Pharmacia). Después de ser observado en un transiluminador ultravioleta (modelo Ultra Linker, Kodak) la concentración de ADN fue estimada con un cuantificador automático de ADN y ARN, Gene Quant (Pharmacia Biotech, Inglaterra).
Veinte microgramos de ADN genómico de T.cruzi fueron digeridos por la enzima Sau3A, y se obtuvieron fragmentos de aproximadamente 2 kb, lo cual fue comprobado por electroforesis en gel de agarosa al 0,8 % mediante el patrón de peso molecular IV (Boehringer Mannheim Biochemica,RFA). Más tarde 3,6 mg de dichos fragmentos y 5 µg del plásmido pcDNA3 previamente digerido con la enzima BamH1 y desfosforilado con la enzima fosfatasa alcalina, se ligaron empleando la enzima T4 ligasa. A continuación las células competentes de la cepa HB101 de E.coli fueron transformadas por electroporación con la librería usando un electroporador (Gene Zapper 450/2500. IBI.Kodak Company) y una cubeta de 2 mm (Kartell) y siguiendo la metodología del fabricante. Se fijó el voltaje en 2 500 V, la resistencia en 400 É y la capacitancia en 21 mF. De inmediato se añadió 1 mL de medio LB estéril a la cubeta, se resuspendió suavemente y se depositó el contenido en un tubo de precultivo vacío y estéril que fue incubado a 37°C por 1 h a 150 rpm en una zaranda (Incubator Shaken, Co, EE.UU.). De este precultivo se tomaron 100 mL que fueron sembrados en una placa con LB agar técnico #1 al 1 % (Oxoid) con ampicilina, durante 16 h a 37 °C. De las colonias obtenidas se seleccionaron al azar 10, a las que se les realizó la purificación de plásmidos por el método de lisis alcalina.8 Los plásmidos obtenidos fueron digeridos con la enzimaBamH1 y posteriormente se realizó una electroforesis en gel de agarosa al 0,8 % con bromuro de etidio; se utilizó como control el plásmido pcDNA3 digerido con la misma enzima. El resto del precultivo (900 mL) se sembró en 500 mL de LB con ampicillina, para llevar a cabo la amplificación de la libreria genómica. Después de incubar por 16 h a 37 °C con agitación (150 rpm) el cultivo fue centrifugado a 600 gravedades durante 15 min a 4 °C. Con las células obtenida se llevó a cabo la purificación de plásmidos por el método antes referido. El material purificado fue diluido en solución salina 0,9 % estéril hasta obtener una concentración final de 250 m/mL, después de lo cual fue conservado a -20 °C hasta el momento de su uso.
Obtención del sonido de Trypanosoma cruzi. Fueron recolectados por centrifugación 5 x 10 epimastigotes de la cepa Y (CT-10C 106), obtenidos después de 7 d de cultivo en medio LIT10 (Liver Infusion Triptose) suplementado con 10 % de suero fetal de ternera (Gibco) y 50 m g/mL de gentamicina, y el sedimento fue lavado 4 veces con solución salina tamponada con fosfato (SSTF) (NaCl 8g/L; KC1 0,2 g/L; Na2HPO4 1,15 g/L; KH2PO 0,24 g/L, pH 7,2) a 400 gravedades durante 10 min a 4 °C. Después el botón célular ontenido fue resuspendido en 5 mL de SSTF y sonicado con una intensidad de 18 Hz (Soniprep) 120, Inglaterra por 3 veces durante 60 s intervalos de reposo de 60 s en hielo; finalmente el homogeneizado fue centrifugado a 1 200 gravedades durante 1h a 4 °C y el sobrenadante fue distribuido en viales (Eppendorf) de 1 mL y conservado a -70 °C, Más tarde se determinó la concentración de proteínas por el método de Lowry.11
Esquema de inmunización. Los animales se dividieron en 5 grupos y fueron inoculados de la siguiente forma: 25 mg de la librería genómica (n = 15) (Grupo L), 25 mg de antígenos solubles de T. cruzi (n = 5) (Grupo T), 25 mg de plásmido pc DNA3 (n = 5) (Grupo P), 25 mg de ADN genómico de T. cruzi (n = 5) (Grupo G), y un grupo adicional de 5 animales que no fueron inmunizados (Grupo C). Cuatro semanas despupes de la primera inoculación. 10 animales del grupo L fueron reinmunizados con la librería genómica de expresión; 5 de ellos con 25 mg (Grupo L1) y el resto con 50 mg (Grupo L2). Los grupos P y G también fueron reinmunizados con 50 mg.
Dosis y vía de administración. Se administraron 25 y 50 mg de inóculo en cada caso de 0,1 mL de solución salina al 0,9 %, por la vía intramuscular en la región anetrior de la pata trasera derecha, con excepción del grupo C, que no recibió ningún tipo de inmunización.
Ensayo inmunoenzimático para determinar la respuesta de anticuerpos específicos del isotipo IgG contra Trypanosoma cruzi. A 4 animales de cada grupo se les extrajo sangre del seno retrorbital semanalmente con capilares de vidrio heparinizados, durante las 4 primeras semanas posinmunización; se realizó una extracción adicional en la sexta semana. A los grupos L1 y L2 sólo se les extrajo sangre en la sexta semana, que corresponde a los 15 d de realizada la reinmunización. El suero se obtuvo por centrifugación a 400 gravedades durante 10 min a temperatura ambiente.
El ensayo inmunoenzimático se realizó por un método indirecto cualitativo. Se recubrieron placas de poliestireno de 96 pozos con fondo plano (Marxi-Sorp. Nunc) con 100 mL/pozo de antígenos solubles de T. cruzi a una concentración de 5 mg/mL disueltos en solución carbonato-bicarbonato 0,1 M; pH 9,6 y se mantuvo durante 16 h a 4 °C en cámara húmeda. Después se bloqueó con leche descremada al 3 % (Oxoid) disuelta en SSTF (100 mL/pozo) durante 1 h a 37 °C en cámara húmeda, se lavó 3 veces con SSTF-Tween 20 (0,05 %) en un lavador de placas (Denley Well Wash 4), se añadió por duplicado el suero de los ratones diluido 1/200 con SSTF-Tween 20, (100 mL/pozo) y se incubó durante 2 h a temperatura ambiente; seguidamente se lavó 8 veces en iguales condiciones y se depositaron 100 mL/pozo de un conjugado anti-inmunoglobulina G anti-IgG) de ratón obtenido en conejo marcado con peroxidasa (Sigma) a una dilución de trabajo de 1/1 200 y se incubó por 1 h en cámara húmeda a la temperatura ambiente. Se lavó nuevamente y se añadieron 100 mL/pozo de sustrato ortofenilendiamina (Sigma) diluido en tampón fosfato citrato 0,15 M; pH 5. Se incubó durante 30 min en cámara húmeda a temperatura ambiente, más tarde se detuvo la reacción con ácido sulfúrico al 12,5 % y se leyó en un espectrofotómetro (Flow. Laboratories. INC. MC Lcon, Va.) a una longitud de onda de 492 nm. Se calculó la media de las densidades ópticas obtenidas para cada grupo.
Procesamiento estadístico. Para el procesamiento de los resultados obtenidos con el método de ELISA se realizó un análisis de la varianza de clasificación simple (ANOVA) y la prueba de comparaciones múltiples de Tukey para determinar los pares significativos.
Resultados
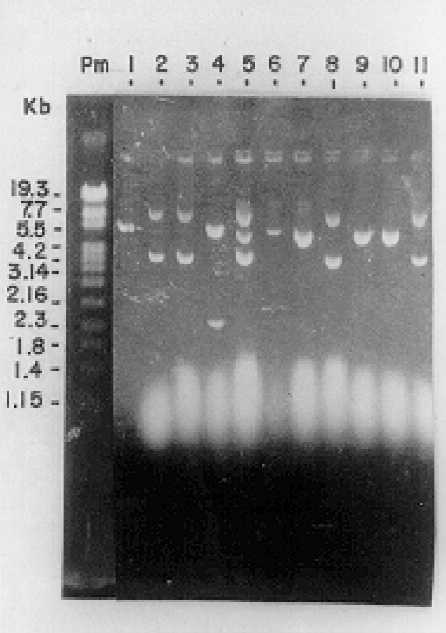
Obtención de la librería genómica de expresión de T. cruzi. En la figura 2, se observa el resultado del análisis de restricción realizado con la enzima BamH1 a los plásmidos purificados de los transformantes obtenidos después de la transformación genética de E. coli con la librería genómica. Como resultado de este experimento se observaron 6 plásmidos (60 %) con insertos de ADN de T. cruzi (líneas 2, 3, 4, 5, 8 y 11). Estos clones recombinantes muestran bandas con tallas mayores y menores que el vector (línea 1) utilizado como control. El resto de las digestiones se mantienen al nivel del vector y parecen corresponder con vectores no recombinantes (líneas 6, 7, 9 y 10).
Fig. 2. Análisis de restricción con la enzima BamH1 de los plásmidos purificados
a partir de los transformantes obtenidos.
Línea 1: plásmido pcDNA3 digerido con la enzima BamH1.
Líneas 2, 3, 4, 5, 8 y 11: plásmidos con insertos de ADN de T.cruzi. Líneas 6, 7, 9 y 10: vectores no recombinantes.
Ensayo inmunoenzimático para determinar la respuesta de anticuerpos específicos del isotipo IgG contra Trypanosoma cruzi. En las determinaciones realizadas hasta la cuarta semana posinmunización no se obtuvieron diferencias significativas en la producción de anticuerpos específicos en los animales inmunizados con la librería genómica al compararlo con los demás grupos. Sólo se obtuvo un aumento significativo de anticuerpos específicos en relación con todos los grupos en el grupo inmunizado con antígenos de T. cruzi (p < 0,05).
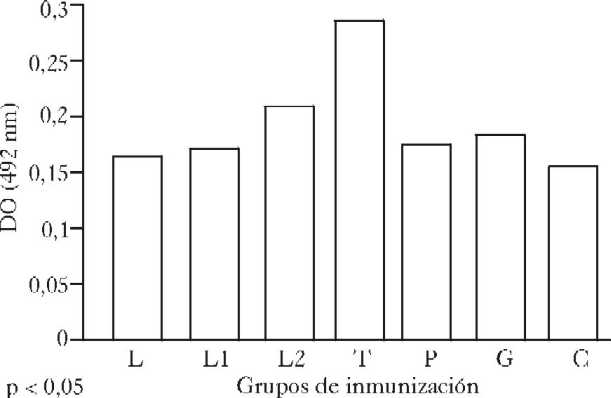
Los resultados obtenidos en la sexta semana posinmunización ponen de manifiesto un aumento significativo ( p < 0,05) en la producción de anticuerpos específicos en el grupo reinmunizado con 50 mg de la librería con respecto al grupo que recibió una dosis de la librería genómica de expresión, el inmunizado con el plásmido y al no inmunizado.
El grupo inmunizado con antígenos solubles de T. cruzi mostró un aumento significativo (p < 0,05), de anticuerpos específicos con respecto a los demás grupos con excepción del grupo reinmunizado con 50 mg de la librería (p < 0,05) ( fig. 3).
Fig. 3. Respuesta de anticuerpos IgG específicos contra antígenos solubles de Trypanosoma cruzi (ELISA). Sexta semana posinmunización. L: grupo inmunizado con una dosis de librería genómica de expresión de T. cruzi. L1: grupo reinmunizado con 25 mg de librería genómica de expresión de T. cruzi. L2: grupo reinmunizado con 50 mg de librería de expresión de T. cruzi. T: grupo inmunizado con antígenos solubles de T. cruzi. P: grupo inmunizado con plásmido (pcDNA3). G: grupo inmunizado con genóma de T. cruzi. C: grupo no inmunizado.
Pares significativos: (T-L), (T-L1), (T-P), (T-G), (T-C), (L2-L1), (L2-P), (L2-C).
Discusión
Los resultados obtenidos de la digestión con enzimas de restricción de los plásmidos purificados después de la transformación genética de E. coli con la librería genómica (fig. 2), permitieron demostrar que en el inóculo que se administró había una elevada cantidad de material genético de T.cruzi, se aseguraba por lo tanto, una elevada representatividad del genoma del microorganismo en el inóculo administrado.
Con respecto a los resultados obtenidos al estudiar el suero de los animales inmunizados por el método de ELISA, se puso de manifiesto la ausencia de respuesta humoral hasta 4 semanas después de administrada la librería, lo que coincide con los resultados obtenidos por Barry y otros después de la inmunización de ratones con una librería genómica de expresión de Mycoplasma pulmonis, quienes encontraron una pobre respuesta de anticuerpos específicos en los animales inmunizados.12 Otros autores que llevaron a cabo la inmunización con genes individuales obtuvieron resultados similares.13-15
En el estudio de la sexta semana posinmunización se evidenció un efecto estimulador específico de la respuesta inmune humoral después de la reinmunización con 50 mg de la librería, es de señalar que entre este grupo y el inmunizado con antígenos de T.cruzi (T), que mostró la mayor respuesta de anticuerpos, no se encontraron diferencias significativas.
El hecho de no haberse encontrado diferencias significativas entre el grupo reinmunizado con 50 mg de la librería (L2) y los grupos reinmunizados con 25 mg de ésta (L1) y con ADN genómico de T. cruzi (G), hace necesario el estudio de este aspecto en el futuro con la utilización de un mayor número de animales y de otros esquemas de inmunización.
Los avances en la inmunización con ácidos nucleicos han cobrado gran interés en otros parásitos debido a su gran simplicidad y capacidad para generar una buena respuesta inmune.16 Múltiples han sido los trabajos donde se muestran los altos niveles de anticuerpos y linfocitos T citotóxicos específicos alcanzados en la inmunización con ADN.17-20 En nuestro caso pensamos que pudiera inducirse una respuesta humoral específica más potente con otros esquemas de inmunización, lo cual debe demostrarse en trabajos futuros con la utilización de un mayor número de animales.
El uso de esta metodología permitirá la caracterización de los productos génicos reconocidos por los animales inmunizados, con la consiguiente identificación de antígenos con una posible utilidad como inmunógenos para el desarrollo de vacunas contra la tripanosomiasis.
En trabajos previos nuestro grupo ha demostrado la expresión de antígenos de T. cruzi en el músculo,21 así como una estimulación específica de la inmunidad celular en ratones inmunizados con una librería genómica de T. cruzi.22
Muchos son los argumentos emitidos por la comunidad científica, tanto a favor como en contra de una posible vacuna con ADN en seres humanos.23 Hasta el momento basta con saber que la inmunización con ácidos nucleicos nos permite de forma práctica la manipulación del sistema inmune y la búsqueda de nuevos antígenos potencialmente útiles para el desarrollo de vacunas de nueva generación.
Summary
A genomic expresion library of Trypanosoma cruzi (T. cruzi) was made using plasmid pcDNA3 as a vector, with wich male mice from the Balb/c isogenic line were intramuscullary inoculated. It was used a positive control group that was administered soluble antigens of T. cruzi. Other 2 groups received genomic and plasmid DNA, respectively. One group was not immunized. Weeckly blood samples were obtained from all the animals until the fourth week and 2 weeks after reinmunization to study the response of specific antibodies against the microorganism antigens by an indirect immunoenzimatic assay (ELISA). It was observed a significant increase of specific antibodies in the animals reinmunized with 50 mg of the library, as well as in the group immunized with soluble antigens of T. cruzi.
Subject headings: DNA, PROTOZOAN/immunology; GENOME, PROTOZOAN; PROTOZOAN VACCINES/pharmacology; TRYPANOSOMA CRUZI/genetics; TRYPANOSOMA CRUZI/ /immunology; VACCINES, DNA/pharmacology; MICE, INBRED BALBC.
Referencias Bibliográficas
- Danko I, Wolff JA. Direct gene transfer into muscle. Vaccine 1994;12:1499-502.
- Spier RE. Meeting on vaccine strategies for tomorrow. Vaccine 1993;11:1450-2.
- Meloen RH, Casal JI, Dalsgaard K, Langeveld JP. Synthetic peptides vaccines: succes at last. Vaccine 1995;13:885-6.
- Sarmiento ME, Acosta A, Estevez P, Martínez M, Reyes A, Hidalgo C, et al. Expresión de la subunidad B de la toxina del cólera en Escherichia coli y Mycobacterium smegmatis. Vaccimonitor 1996;2:2-5.
- Waine GJ, Mc Manus DP. Nucleic acids: vaccine of the future. Parasitol Today 1995;11:113-6.
- Rhodes GH, Dwarki VJ, Abai A, Felgner J, Felgner PL, Gromkowski SH, et al. Injection of expression vectors containing viral genes induces cellular, humoral, and protective immunity. En: Ginsberg HS, Brown F, Chanock RM, Lerner RA, eds. Vaccines 93. New York: Cold Spring Harbor Laboratory Press, 1993:137-41.
- Coney L, Wang B, Ugen EK, Boyer J, Mc Callus D, Srikantan V, et al. Facilitated DNA inoculation induces anti HIV-1 immunity in vivo. Vaccine 1994;12:1545-50.
- Sambrook J, Frisch EF, Maniatis T. Molecular Cloning: a laboratory Manual. 2 ed. New York: Cold Spring Harbor Laboratory Press, 1989:1.2-6.34.
- Hookey JV, Palmer MF. A comparative investigation and identification of Leptospira interrogans serogroup icterohaemorrhagiae strains by monoclonal antibody and fingprint analysis. Zbl Bakteriol 1991;275:185-99.
- Camargo EP. Growth and differentiation in Trypanosoma cruzi. 1 Origin of metacyclic tripanosomes in liquid medio. Rev Inst Med Trop Sao Paulo 1964;6:93-100.
- Lowry DH, Rosebrough NJ, Farr AL, Randall LJ. Protein Measurement with the folin phenol reagent. J Biolg Chem 1951;193:265-75.
- Barry AM, Lai WC, Johnston AS. Protection against mycoplasma infection using expression library immunization. Nature 1995;377:632-5.
- Lowrie DB, Tascon RE, Colston MJ, Silva CL. Towards a DNA vaccine against tuberculosis. Vaccine 1994;12:1537-40.
- Hoffman SL, Sedegah M, Hedstrom RC. Protection against malaria by immunization with a Plasmodium yoelii circumsporozoite protein nucleic acid vaccine Vaccine 1994;12:1529-33.
- Webster RG, Fynan EF, Santoro JC, Robinson H. Protection of ferrets against influenza challenge with a DNA vaccine to the haemaglutinin. Vaccine 1994;12:1495-8.
- Milei J, Storino RA, Beigelman R, Grana D, Basombrio MA. Morphometry of skeletal muscle involvement in mice infected or preimmunized with live attenuated Trypanosoma cruzi. Medicina (B Aires) 1991;51:529-32.17. Xu D, Liew FY. Genetic vaccination against leishmaniasis. Vaccine 1994;12:1534-6.
- Montgomeny DL, Shiver JW, Leander KR, Perry HC, Friedman A, Martinez D, et al. Heterologous and homologous protection against influeza A by DNA vaccination: optimization of vectors. DNA Cell Biol 1993;12:1545-50.
- Webster RG, Fynan EF, Santoro JC, Robinson H. Protection of ferrets against influenza challenge with a DNA vaccine to the haemaglutinin. Vaccine 1994;12:1495-8.
- Davis HL, Michael LM, Mancini M, Schleef M, Whalen RG. Direct gene transfer in skeletal muscle: plasmid DNA-based immunization against the hepatitis B virus surface antigen. Vaccine 1994;12:1503-9.
- Alberti E, Sarmiento ME, Hidalgo CJ, Leyva JL, Vidal T, Acosta A. Expresión de antígenos de Trypanosoma cruzi en músculo de ratones Balb/c inmunizados con una librería genómica de expresión. Vaccimonitor 1997;1:2-4.
- Vidal T, Alberti E, Padilla M, López R, Sarmiento ME, Hidalgo C, et al. Respuesta linfoproliferativa a antígenos solubles de T. cruzi en ratones Balb/c inoculados con una librería genómica de expresión. Vaccimonitor 1996;9:2-4.
- Pardo OL. La inmunización con ADN. ¿Una nueva generación de vacunas? Biotecnol Aplic 1996;13:81-8.
Recibido: 27 de febrero de 1997. Aprobado: 8 de octubre de 1997.
Dr. Esteban Alberti Amador. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
E.mail: ciipk@infomed.sld.cu
1 Especialista de II Grado en Microbiología. Investigador Agregado. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
2 Especialista de II Grado en Inmunología. Investigador Titular. Profesor Titular. Instituto "Finlay".
3 Especialista de II Grado en Fisiología Normal y Patológica. Investigadora Auxiliar. Instituto "Finlay".
4 Máster en Genética Clínica. Médico general. Investigador Agregado. Instituto "Finlay".
5 Licenciado en Bioquímica. Investigador Auxiliar. IPK.
6 Especialista de I Grado en Inmunología. Instituto "Finlay".
7 Técnico en Química. Instituto Nacional de Higiene, Epidemiología y Microbiología.
8 Especialista de II Grado en Inmunología. Investigador Auxiliar. IPK.